修回日期: 2010-08-19
接受日期: 2010-08-24
在线出版日期: 2010-11-08
目的: 探讨线粒体解偶联蛋白2(uncoupling protein 2, UCP2)对胰高血糖素样肽-1(glucagon-like peptide 1, GLP-1)分泌的影响.
方法: 定量PCR及Western blot检测小鼠不同肠段内UCP2的表达情况, 免疫组织化学检测UCP2在肠道中的分布情况, ELISA法测定给予高糖后UCP2基因缺失鼠和野生小鼠血GLP-1的含量变化.
结果: UCP2 mRNA在小肠中表达高于结肠, 而近端结肠中的表达高于远端结肠. Western blot结果显示UCP2蛋白在末端回肠和近端结肠的表达高于远端结肠, UCP2蛋白表达与mRNA变化趋势一致. UCP2主要分布在黏膜上皮层, 平滑肌细胞内也有少量表达. 荧光免疫标记显示UCP2和GLP-1在肠黏膜层有共表达现象. 葡萄糖可提高肠道组织中UCP2 mRNA表达水平. 给予葡萄糖后15和30 min, 无论是野生型鼠还是UCP2-/-鼠, 血GLP-1水平明显升高, UCP2-/-鼠升高更明显(6.9000±0.25, 5.5600±0.42 vs 3.5408±0.18, 均P<0.01; 9.3500±0.95, 7.8600±0.25 vs 3.7322±0.13, 均P<0.01), 60 min对照组的血GLP-1水平基本降至初始值, 而UCP2-/-鼠血中GLP-1的水平下降缓慢.
结论: 葡萄糖可以诱导肠道内UCP2的表达, 肠黏膜细胞内UCP2升高对肠源性GLP-1的分泌可能具有负调控作用.
引文著录: 李正阳, 陈燕, 林琳, 蒯筱漪, 于鹏丽, 张红杰. 线粒体解偶联蛋白2在肠道的分布模式及其对GLP-1分泌的影响. 世界华人消化杂志 2010; 18(31): 3306-3312
Revised: August 19, 2010
Accepted: August 24, 2010
Published online: November 8, 2010
AIM: To detect the expression of mitochondrial uncoupling protein 2 (UCP2) in the intestinal tissue and to assess the possible effects of UCP2 on GLP-1 secretion in the gastrointestinal tract.
METHODS: The expression of UCP2 mRNA and protein in the gastrointestinal tract was detected by quantitative reverse transcription-polymerase chain reaction (qRT-PCR) and Western blot, respectively. Co-localization of UCP2 with GLP-1 was detected by immunohistochemistry. The level of serum GLP-1 was measured by enzyme-linked immunosorbent assay.
RESULTS: UCP2 was primarily expressed in mucosal epithelial cells and co-localized with GLP-1 in the gastrointestinal mucosa. Glucose administration induced strong expression of UCP2 in the colon of C57BL/6J mice. UCP2-deficient mice showed an increased glucose-induced GLP-1 secretion compared with wild-type littermates (6.9000 ± 0.25, 5.5600 ± 0.42 vs 3.5408 ± 0.18, both P < 0.01; 9.3500 ± 0.95, 7.8600 ± 0.25 vs 3.7322 ± 0.13, both P < 0.01). Taken together, these results suggest an inhibitory effect of UCP2 on glucose-induced GLP-1 secretion.
CONCLUSION: The expression of UCP2 in the mouse gastrointestinal tract can be strongly induced by glucose administration.UCP2 serves as a negative regulator of glucose-induced GLP-1 secretion.
- Citation: Li ZY, Chen Y, Lin L, Kuai XY, Yu PL, Zhang HJ. Distribution of mitochondrial uncoupling protein 2 in the intestinal tract and its effect on GLP-1 secretion. Shijie Huaren Xiaohua Zazhi 2010; 18(31): 3306-3312
- URL: https://www.wjgnet.com/1009-3079/full/v18/i31/3306.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i31.3306
线粒体解偶联蛋白2(uncoupling protein 2, UCP2)是线粒体解偶联蛋白(uncoupling proteins, UCPs)家族成员之一[1,2], UCP2 mRNA体内分布较广泛, 在消化系内也有较高的表达[3], 然而目前其病理生理功能尚不完全明确. 已有的研究表明, 在胰岛β细胞中, UCP2介导的线粒体内膜质子渗漏, 减低了通过葡萄糖供能产生的ATP, 负性调节葡萄糖刺激的胰岛素分泌[4,5]. 高糖、高脂可升高胰岛内UCP2的表达水平[6-8]. 近来研究显示, 胰岛素的分泌和机体血糖的稳态, 除与胰岛β细胞功能状况有关外, 尚与某些胃肠道产生的胰岛素刺激激素的调节有关, 其中胰高血糖素样肽-1(glucagon-like peptide 1, GLP-1)是来源于肠道的重要的胰岛素分泌调节因子. GLP-1由肠道L细胞产生, 葡萄糖、氨基酸和脂肪酸均可刺激GLP-1的分泌[9-11]. GLP-1可呈葡萄糖依赖性地促进胰岛素分泌、降低胰高血糖素的分泌、保护胰岛β细胞的功能, 并有抑制胃排空和抑制食欲的作用, 减低体质量, 而且GLP-1具有心脏保护作用, GLP-1的多重机制针对了2型糖尿病的病理生理特点, 使2型糖尿病患者通过基于GLP-1的治疗(如GLP-1类似物)全面获益成为可能[12-15]. 已知胰岛β细胞是葡萄糖敏感细胞, 具有ATP-sensitive K+离子通道(KATP channel), 这种离子通道由SUR1和Kir6.2两个亚单位组成[16]. UCP2对葡萄糖刺激的胰岛素分泌具有负性调节作用, 且此作用是通过介导线粒体内膜质子渗漏, 抑制了ATP的合成, 影响KATP离子通道的功能状态而实现[4,5]. 肠道分泌GLP-1的L细胞也是葡萄糖敏感细胞, 并且有研究显示GLP-1与KATP离子通道的SUR1和Kir6.2亚单位存在共表达[17]. 提示L细胞分泌GLP-1可能也通过影响KATP离子通道的功能状态实现. 鉴于此, 深入探讨GLP-1的分泌调控机制, 探讨UCP2与GLP-1间的关系, 为寻找糖尿病治疗的新的靶点有着重要意义. 由此我们提出了这样假说, 肠道内L细胞分泌GLP-1可能同样也受到肠道内UCP2的影响, 其可能的作用方式像UCP2对胰岛β细胞分泌胰岛素的调控一样, 即UCP2升高, 质子渗透增加, ATP合成减少, GLP-1分泌减低. 本研究通过对UCP2基因缺失鼠及野生鼠在高糖刺激下GLP-1分泌测定以及UCP2的表达与GLP-1分泌之间关系的研究, 探讨UCP2对GLP-1分泌的影响.
C57BL/6J鼠44只, C57BL/6J背景基础上的UCP2基因缺失鼠20只均购自南京大学动物模式中心. 所有鼠龄为8-10 wk. 鼠饲养在SPF级环境, 温度23 ℃, 有着常规的光线与黑暗循环. 动物的饲养和动物实验操作严格按实验动物饲养及操作规程进行. TRIzol试剂(TRIzol Reagent, Invitrogen, USA), 反转录酶(AMV reverse transcriptase, GIBCO Invitrogen, Carlsbad, CA, USA), TaqMan探针及引物(Shanghai Shinegene Molecular Biotechnology Co., LTD., Shanghai), 引物及探针的序列如下: UCP2 gene: Sense primer: 5'-CCAATGTTGCCCGWAATG-3', Anti-sense primer: 5'-TGAGGTTGGCTTTCAGGAG-3', Probe1: 5'-FAM+CTGGTGACCTATGACCTCATCA AAG-3', β-actin: Sense primer: 5'-GGCACCACACYTTCTACAATG-3', Anti-sense primer: 5'-GGGGGTGTTGAAGGTCTCAAAC-3', Probe2: 5'-FAM+TGTGGCCCCTGAGGAGCAC CC-3'. 定量PCR仪(ABI Prism 7000, Applied Biosystems, Foster City, CA, USA), 线粒体蛋白提取试剂盒, BCA蛋白分析试剂盒(Pierce, Rockford, USA), 酶联免疫测定GLP-1试剂盒(Glucagon Like Peptide-1 active, ELISA kit, Linco Research, Inc).
1.2.1 组织标本的准备: 为了观察葡萄糖对肠道UCP2表达的影响, 将C57BL/6J鼠分成3组, 每组8只: 第1组给予25%葡萄糖溶液灌胃(2 g/kg体质量); 第2组: 给予腹腔注射葡萄糖溶液(2 g/kg体质量); 第3组(对照组): 给予相应体积的生理盐水处理. 给予葡萄糖的各组鼠在给予葡萄糖后60 min处死, 采集肠道标本. 为了观察UCP2对葡萄糖刺激的GLP-1分泌有何影响, 给予UCP2基因缺失鼠(每个时间点的小鼠数量, n = 5)以葡萄糖(2 g/kg)灌胃处理, 对照组(n = 20)给予生理盐水. 在给予葡萄糖干预处理前所有鼠禁食12 h, 禁食期间可自由饮水, UCP2基因缺失鼠及野生鼠给予葡萄糖后分别于0, 15, 30, 60 min收集血标本并测定血糖变化. 血标本的采集过程中应加入Dipeptidyl peptidase IV抑制剂, 离心3 000 r/min, 收集上清放于-70 ℃以备GLP-1的测定. 采集末端回肠及结肠标本后即刻放入液氮中以备提取RNA及蛋白, 同时选取上述部位肠道组织放入40 g/L多聚甲醛中以备做组织的免疫组织化学.
1.2.2 RNA的分离: 将前期液氮中留取的末端回肠, 近端及远端结肠标本取出, 放入研钵中, 反复加入少量液氮, 反复研磨后, 按50-100 mg组织/1 mL TRIzol加入TRIzol, 转入离心管. 将加TRIzol后的组织, 室温放置5 min, 使其充分裂解. 12 000 r/min离心5 min, 弃沉淀. 按200 µL氯仿/1 mL TRIzol加入氯仿, 振荡混匀后室温放置15 min. 4 ℃, 12 000 g离心15 min. 吸取上层水相, 至另一离心管中. 按0.5 mL异丙醇/1 mL TRIzol加入异丙醇混匀, 室温放置5-10 min. 4 ℃, 12 000 g离心10 min, 弃上清, RNA沉于管底. 按1 mL 750 mL/L乙醇/mL TRIzol加入750 mL/L乙醇, 温和振荡离心管, 悬浮沉淀. 4 ℃, 8 000 g离心5 min, 尽量弃上清. 室温晾干或真空干燥5-10 min. 根据RNA量多少加入DEPC水, 20-50 μL, RNA溶解后放入-70 ℃待用. 测A值定量RNA浓度, 以A260/280测定RNA的纯度. A260/280>1.7, RNA纯度好.
1.2.3 定量RT-PCR测定UCP2 mRNA: (1)cDNA的逆转录: Oligo(dT)18 primers 1 µL, 15×Buffer 2 µL, dNTP 0.5 µL, AMV逆转录酶1 µL, 模板RNA 1 µL, DEPC水4.5 µL, 稍离心, 100 ℃沸水浴1 min, 42 ℃水浴1 h, 100 ℃沸水浴3 min灭活AMV, 立即PCR或-20 ℃保存. (2)定量RT-PCR测定UCP2 mRNA: 选用ABI Prism 7000序列探测系统(Applied Biosystems, Foster City, CA, USA)进行定量PCR检测, 选用TaqMan标记探针(Shanghai Shinegene Molecular Biotechnology Co., LTD., Shanghai, China). 用ABI Prism 7000 SDS software version 1.0. 获得曲线循环数量. UCP2 gene: 每一反应体系20 μL, 10×Buffer 2 μL, Mg2+ 1.6 μL, dNTPs 0.6 μL, Primer UCP2 0.8 μL, Taq酶0.2 μL, Probe1 0.07 μL, dH2O 13.73 μL. β-actin: 每一反应体系20 μL, 10×Buffer 2 μL, Mg2+ 1.6 μL, dNTPs 0.6 μL, Primer UCP2 0.8 μL, Taq酶0.2 μL, Probe1 0.07 μL, dH2O 13.73 μL. 引物和探针序列见前(材料部分). 每一标本3个复孔, 每一反应体系加cDNA 1 μL. 扩增条件为95 ℃ 5 min, 40循环95 ℃ 30 s, 60 ℃ 1 min, 最后1循环为72 ℃ 3 min.
1.2.4 Western blot检测肠道中UCP2的表达: (1) 线粒体蛋白提取及蛋白定量(选取BCA-100蛋白定量测定试剂盒), 按说明书进行操作; (2)电泳: 制胶浓度选择为12.5%, 电泳, 按每块胶20 mA恒流电泳; (3)转膜: 取出完成的电泳的SDS胶, 浸入转膜Buffer中15 min, 取滤纸浸入缓冲液中, 剪取合适大小的PVDF膜, 转膜时间90 min; (4)免疫标记及显影: 将膜浸入Blocking Buffer(5%脱脂牛奶-PBST)中, 摇床上Blocking 1 h. 吸去Blocking Buffer, 将一抗在1% BSA-1×PBST中按一定比例稀释(UCP2 1∶1 000), 加入装有PVDF膜的小袋中, 确保含有一抗的液体覆盖膜, 4 ℃孵育过夜. 取出PVDF膜, 在脱色摇床上用Washing Buffer洗3遍, 每次15 min. 在1% BSA-1×PBST中按比例稀释HRP标记的二抗(1∶2 000), 与膜共同孵育1 h. 取出PVDF膜, 在脱色摇床上用Washing Buffer洗3遍, 每次15 min. 将ECL底物以1∶20的比例稀释, 与膜共同孵育60 s, 吸水纸吸干残余底物, 夹入塑料膜中, 并在膜上放一张X光片. 将膜在显影液中浸泡40 s, 清水洗后放入定影液中, 待胶片变透明后清水洗后, 晾干, 排片.
1.2.5 ELISA法测定不同实验组小鼠血GLP-1的含量: ELISA试剂盒购自Linco Research, Inc. 每一样品分析时做复孔测定, 取均值. 按试剂盒说明书操作步骤进行. 第1天: 测定板孔内加冲洗缓冲液, 室温下孵育5 min后倒掉液体; 加分析缓冲液200 μL到非特异结合孔A1, A2和100 μL到剩余孔; 加100 μL的标准品按升序到孔A3, A4, 接着的一系列孔中加100 μL QC1(孔B3和B4)及QC2(孔B5和B6); 加100 μL待测样品到剩余孔, 轻轻摇动反应板, 封膜封闭反应板, 4 ℃过夜. 第2天: 倒掉反应板中液体, 冲洗缓冲液洗反应板5次, 完成后吸干液体, 立即在每个反应孔中加200 μL的共价结合检测液, 室温下孵育2 h后倒掉液体, 加冲洗缓冲液洗3次, 吸净缓冲液; 每孔中加200 μL稀释底物, 避光暗处室温下孵育至少20 min. 调整反应时间以保证在标准曲线的最低点也有明显的反应信号, 在最高标准点(100 pmol/L)对应有最大荧光反应值可以读出, 有充足的荧光物产生后加50 μL的反应终止液, 孵育5 min; 在荧光免疫酶标仪上选择激发/发射波长为355 nm/460 nm进行测定.
1.2.6 免疫组织化学检测UCP2在肠道中分布: 免疫组织化学法检测UCP2在肠道中分布, 常规脱蜡和水化后PBS洗片; 滴加3% H2O2在TMA上, 室温静置10 min后PBS洗; 抗原修复10 min; PBS洗片后滴加UCP2抗体50 μL, (按1∶70 V/V, 在稀释液中加入0.05% Tween)4 ℃过夜; 第2天室温平衡, PBS洗片后滴加二抗(1∶1 500, V/V)50 μL, 37 ℃ 1 h; PBS洗片, DAB显色, 自来水冲洗10 min, 苏木素复染40 s; 常规洗片、脱水、透明、封片, 进行镜检. 每次染色同时设置阴性对照的片子.
统计学处理 结果以mean±SD表示, 显著性统计比较, 采用单因素方差分析及t检验. P<0.05为有统计学意义.
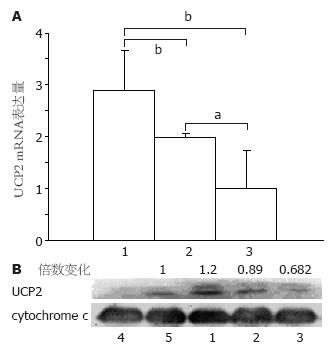
应用定量RT-PCR技术对8只C57BL/6J小鼠不同肠段组织UCP2 mRNA表达进行检测, 发现小鼠末端回肠、近端结肠及远端结肠UCP2 mRNA的表达呈逐渐下降趋势(图1A). UCP2 mRNA在小肠中表达高于结肠, 而近端结肠中的表达高于远端结肠, 小鼠不同肠段UCP2 mRNA表达存在差异, 且差异有显著性. 关于UCP2蛋白的表达, Western blot的结果显示其在末端回肠和近端结肠的表达高于远端结肠(图1B). 这种蛋白表达的变化趋势与UCP2 mRNA表达变化趋势一致.
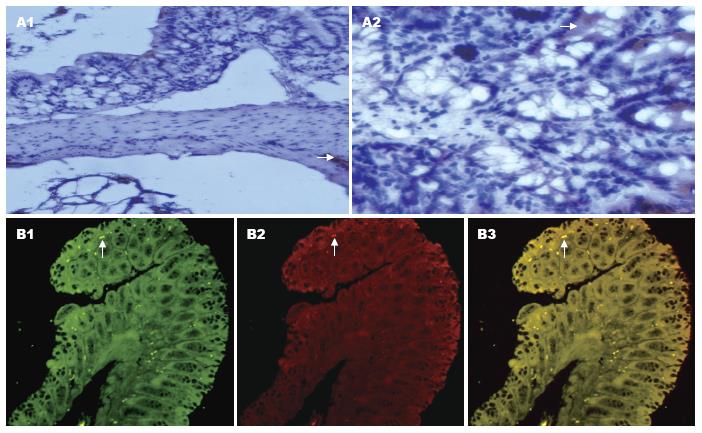
UCP2主要表达在黏膜上皮层的细胞质内, 在平滑肌细胞内也有少量表达. 用抗GLP-1和UCP2的抗体进行荧光免疫标记分析, 发现UCP2和GLP-1在肠黏膜层有共同表达现象存在, 提示具有分泌GLP-1功能的黏膜上皮细胞有UCP2的表达, 而L细胞是肠内分泌GLP-1的特异性细胞, 提示分泌GLP-1的肠道L细胞可能有UCP2的表达(图2).
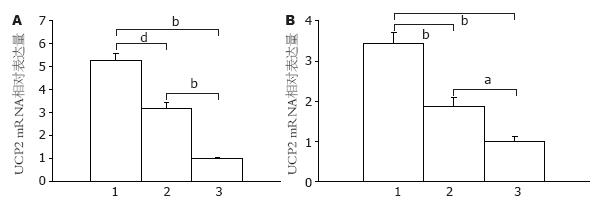
在禁食12 h后, 分别给予小鼠灌胃和腹腔注射葡萄糖液的处理, 给予葡萄糖量按2.0 g/kg, 对照组给予相应体积的生理盐水灌胃. 经上述处理1 h后处死动物, 取组织做定量RT-PCR检测UCP2 mRNA的表达水平. 与对照组比较, 给予葡萄糖可提高肠道组织中UCP2 mRNA表达水平, 尤其给予葡萄糖灌胃的小鼠, 其UCP2 mRNA的表达高于腹腔内注射葡萄糖小鼠肠道组织中UCP2 mRNA的表达(图3). 在远端结肠: 腹腔给予葡萄糖后肠黏膜组织UCP2 mRNA表达高于对照组(P<0.05); 葡萄糖灌胃后肠黏膜组织中UCP2 mRNA表达高于对照组(P<0.01); 近端结肠组织中葡萄糖灌胃与腹腔给予葡萄糖后UCP2 mRNA表达比较, 差异显著(P<0.001).
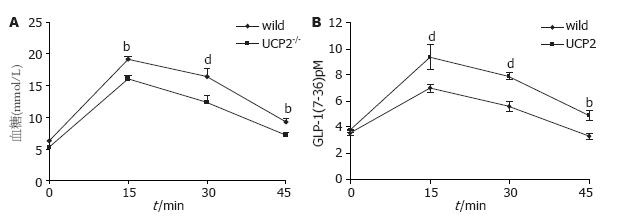
为了评估UCP2对GLP-1分泌的影响, 分别采集UCP2基因缺失鼠和野生鼠在禁食状况和给予葡萄糖后15, 30, 60 min的血标本, 测定GLP-1分泌情况同时测定血清葡萄糖, 结果显示: GLP-1表现为给予葡萄糖后15和30 min无论是野生型鼠还是UCP2-/-鼠, 血GLP-1水平明显升高, UCP2-/-鼠升高更明显(15 min时UCP2-/-鼠GLP-1为9.35±0.95, 野生鼠6.9±0.25; 30 min时UCP2-/-鼠GLP-1为7.86±0.25, 野生鼠5.56±0.42), 60 min对照组的血GLP-1水平基本降至初始值, 而UCP2-/-鼠血中GLP-1的水平下降缓慢(每个时间点小鼠数量, n = 5)(图4).
UCP2 mRNA在体内分布广泛, 在脾, 胸腺, 胰岛的β-细胞, 心脏, 肺, 白色和棕色脂肪组织, 巨噬细胞内以及消化系有大量的UCP2 mRNA. UCP2在mRNA水平广泛分布, 但其蛋白水平在某些组织中呈低表达, 甚至含量不易测出, 如在心肌细胞内有大量的UCP2 mRNA, 而UCP2蛋白未能检出[18-20]. UCP2在胰岛特异性表达且葡萄糖可提高UCP2的表达, 而升高的UCP2抑制胰岛素的分泌[7,18], UCP2在表达上分布的差异似乎也暗示着其在生理功能上的组织特异性.
我们应用定量RT-PCR技术对小鼠不同肠段的UCP2 mRNA表达情况进行了检测, 发现从小肠到近端结肠到远端结肠, UCP2 mRNA的表达呈逐渐减低趋势, 即UCP2 mRNA表达量在小肠高于结肠, 而近端结肠中的表达量高于远端结肠且这种表达有显著性差异. 我们同时用Western blot方法检测了UCP2蛋白的表达水平, 发现其蛋白表达水平与mRNA表达水平是一致的, 即UCP2的mRNA和蛋白表达在小肠均高于结肠, 在结肠的表达是近端结肠表达高于远端结肠, 有显著性差异. 提示在小鼠肠道不同部分UCP2的表达存在差异. 我们采用免疫组织化学技术对UCP2在肠道中的组织分布进行观察, 发现UCP2主要表达在黏膜层, 在平滑肌细胞也有少量的表达, 且UCP2在细胞内分布主要在细胞质内. UCP2在人类肠道组织中的分布与Horimoto等[21]报道的结肠癌及其癌旁组织中的分布是一致的. Murase等[22]报道大鼠小肠中有较丰富的UCP2 mRNA, 食物中的脂肪酸可通过激活PPARα上调大鼠小肠内UCP2 mRNA的表达.
高血糖对UCP2 mRNA表达的影响研究结果不一致, 但多数研究表明[7,8]高血糖能上调胰岛β细胞线粒体的UCP2表达, 抑制胰岛素的分泌, 葡萄糖对肠道组织内UCP2表达有着怎样的影响? 我们将C57BL/6J小鼠分为3个组, 分别给予口服葡萄糖, 腹腔注射葡萄糖和口服生理盐水的处理发现, 给予葡萄糖后小鼠肠道组织中UCP2 mRNA的表达上调, 且口服葡萄糖组高于腹腔给予组, 提示葡萄糖可诱导肠道内UCP2的表达, 且口服葡萄糖后诱导肠内UCP2 mRNA的表达上调更明显. 造成口服葡萄糖和腹腔注射葡萄糖后肠内UCP2的表达差异可能与腔内葡萄糖的直接作用和腹腔注射葡萄糖后引起血糖的升高继而引起UCP2的mRNA表达升高的系统作用有关.
UCP2在消化系的病理生理功能尚不清楚, UCP2在消化系内的这种分布与其功能有着怎样的联系?
众所周知, 消化系除执行食物的消化、吸收和排泄外, 其还是体内最大的一个内分泌组织, 在消化系的胃和肠道黏膜组织内含有具有分泌功能的内分泌细胞, 肠道内的UCP2是否像其介导胰岛素分泌一样, 也介导肠源性激素的分泌呢?
我们利用UCP2基因缺失鼠为研究载体发现, UCP2基因缺失鼠血GLP-1基础水平较野生鼠稍高, 但无显著性差异(0 min, 3.7322±0.13 vs 3.5408±0.18, P>0.05). 给予葡萄糖后15及30 min, 无论是UCP2基因缺失鼠还是野生鼠血GLP-1均明显升高, UCP2基因缺失鼠升高更明显, 以后随时间延长GLP-1下降, 但UCP2基因缺失鼠血GLP-1水平下降缓慢, 60 min UCP2基因缺失鼠血GLP-1水平明显高于野生鼠(60 min, 4.87±0.16 vs 3.40±0.18, P<0.01)而血糖低于野生鼠. 提示UCP2对GLP-1的分泌似乎具有负调控作用.
口服葡萄糖可提高GLP-1的分泌, 然而目前其机制尚不完全清楚. 来自佛罗里达大学的Jang等[23]通过对人和小鼠的肠道L细胞的研究发现, L细胞表达味蛋白和味觉受体以及其他几种味觉信号, 他们调控了GLP-1的分泌. Lim等[24]通过对MKR鼠和L细胞的模型: 鼠源性的GLUTag和人源性的NCI-H716细胞的研究发现, 肠道L细胞对胰岛素有反应, 胰岛素的抵抗可损害GLP-1的分泌. 我们的结果提示肠黏膜细胞内UCP2升高对肠源性GLP-1的分泌可能具有负调控作用, 但肠黏膜细胞内升高的UCP2对肠源性GLP-1的分泌的调控通路有待进一步研究. 深入研究UCP2对肠源性激素-GLP-1分泌的调控机制以及其对糖稳态的影响, 为寻找糖尿病治疗的新的靶点提供有益的理论依据.
线粒体解偶联蛋白2(UCP2)是线粒体内膜蛋白, 具有负性调节胰岛β细胞的胰岛素分泌作用. UCP2 mRNA在体内分布广泛, 消化系内也有较高的表达, 然而目前其病理生理功能尚不完全明确.
宋军, 副教授, 武汉协和医院消化科
胰高血糖素样肽-1(GLP-1)是来源于肠道的重要胰岛素分泌调节因子, GLP-1由肠道L细胞产生, 具有葡萄糖依赖性地促进胰岛素分泌、降低胰高血糖素的分泌、保护胰岛β细胞的功能, 抑制胃排空, 降低食欲从而降低体质量, GLP-1的多重机制针对了2型糖尿病的病理生理特点, 使得GLP-1成为关注焦点.
Murase等报道大鼠小肠中有较丰富的UCP2 mRNA, 食物中的脂肪酸可通过激活PPARα上调大鼠小肠内UCP2 mRNA的表达.
UCP2可负性调节胰岛β细胞的胰岛素分泌, UCP2也参与了肠源性激素GLP-1的分泌, GLP-1进而影响胰岛β细胞的胰岛素分泌, 参与了机体糖稳态的调节, 因而进一步开展有关UCP2在肠源性激素分泌的调节作用的研究, 为寻找新的治疗靶点提供了理论基础.
本文有较好的科学性和一定的创新性, 可读性较强, 能较好地反映我国胃肠病学基础研究的先进水平.
编辑 李军亮 电编 何基才
| 1. | Borecký J, Maia IG, Arruda P. Mitochondrial uncoupling proteins in mammals and plants. Biosci Rep. 2001;21:201-212. [PubMed] [DOI] |
| 2. | Fleury C, Neverova M, Collins S, Raimbault S, Champigny O, Levi-Meyrueis C, Bouillaud F, Seldin MF, Surwit RS, Ricquier D. Uncoupling protein-2: a novel gene linked to obesity and hyperinsulinemia. Nat Genet. 1997;15:269-272. [PubMed] [DOI] |
| 3. | Saleh MC, Wheeler MB, Chan CB. Uncoupling protein-2: evidence for its function as a metabolic regulator. Diabetologia. 2002;45:174-187. [PubMed] [DOI] |
| 4. | Chan CB, MacDonald PE, Saleh MC, Johns DC, Marbàn E, Wheeler MB. Overexpression of uncoupling protein 2 inhibits glucose-stimulated insulin secretion from rat islets. Diabetes. 1999;48:1482-1486. [PubMed] [DOI] |
| 5. | Zhang CY, Baffy G, Perret P, Krauss S, Peroni O, Grujic D, Hagen T, Vidal-Puig AJ, Boss O, Kim YB. Uncoupling protein-2 negatively regulates insulin secretion and is a major link between obesity, beta cell dysfunction, and type 2 diabetes. Cell. 2001;105:745-755. [PubMed] |
| 6. | Krauss S, Zhang CY, Scorrano L, Dalgaard LT, St-Pierre J, Grey ST, Lowell BB. Superoxide-mediated activation of uncoupling protein 2 causes pancreatic beta cell dysfunction. J Clin Invest. 2003;112:1831-1842. [PubMed] |
| 7. | Langin D. Diabetes, insulin secretion, and the pancreatic beta-cell mitochondrion. N Engl J Med. 2001;345:1772-1774. [PubMed] [DOI] |
| 8. | Yamashita T, Eto K, Okazaki Y, Yamashita S, Yamauchi T, Sekine N, Nagai R, Noda M, Kadowaki T. Role of uncoupling protein-2 up-regulation and triglyceride accumulation in impaired glucose-stimulated insulin secretion in a beta-cell lipotoxicity model overexpressing sterol regulatory element-binding protein-1c. Endocrinology. 2004;145:3566-3577. [PubMed] [DOI] |
| 9. | Holst JJ. Enteroglucagon. Annu Rev Physiol. 1997;59:257-271. [PubMed] [DOI] |
| 10. | Eissele R, Göke R, Willemer S, Harthus HP, Vermeer H, Arnold R, Göke B. Glucagon-like peptide-1 cells in the gastrointestinal tract and pancreas of rat, pig and man. Eur J Clin Invest. 1992;22:283-291. [PubMed] [DOI] |
| 11. | Mortensen K, Christensen LL, Holst JJ, Orskov C. GLP-1 and GIP are colocalized in a subset of endocrine cells in the small intestine. Regul Pept. 2003;114:189-196. [PubMed] [DOI] |
| 12. | Toft-Nielsen MB, Madsbad S, Holst JJ. Determinants of the effectiveness of glucagon-like peptide-1 in type 2 diabetes. J Clin Endocrinol Metab. 2001;86:3853-3860. [PubMed] [DOI] |
| 13. | Nagell CF, Wettergren A, Ørskov C, Holst JJ. Inhibitory effect of GLP-1 on gastric motility persists after vagal deafferentation in pigs. Scand J Gastroenterol. 2006;41:667-672. [PubMed] [DOI] |
| 14. | Nyström T, Gutniak MK, Zhang Q, Zhang F, Holst JJ, Ahrén B, Sjöholm A. Effects of glucagon-like peptide-1 on endothelial function in type 2 diabetes patients with stable coronary artery disease. Am J Physiol Endocrinol Metab. 2004;287:E1209-E1215. [PubMed] [DOI] |
| 15. | Asmar M, Holst JJ. Glucagon-like peptide 1 and glucose-dependent insulinotropic polypeptide: new advances. Curr Opin Endocrinol Diabetes Obes. 2010;17:57-62. [PubMed] |
| 16. | Donley VR, Hiskett EK, Kidder AC, Schermerhorn T. ATP-sensitive potassium channel (KATP channel) expression in the normal canine pancreas and in canine insulinomas. BMC Vet Res. 2005;1:8. [PubMed] [DOI] |
| 17. | Nielsen LB, Ploug KB, Swift P, Ørskov C, Jansen-Olesen I, Chiarelli F, Holst JJ, Hougaard P, Pörksen S, Holl R. Co-localisation of the Kir6.2/SUR1 channel complex with glucagon-like peptide-1 and glucose-dependent insulinotrophic polypeptide expression in human ileal cells and implications for glycaemic control in new onset type 1 diabetes. Eur J Endocrinol. 2007;156:663-671. [PubMed] [DOI] |
| 18. | Nedergaard J, Cannon B. The 'novel' 'uncoupling' proteins UCP2 and UCP3: what do they really do? Pros and cons for suggested functions. Exp Physiol. 2003;88:65-84. [PubMed] [DOI] |
| 19. | Mattiasson G, Sullivan PG. The emerging functions of UCP2 in health, disease, and therapeutics. Antioxid Redox Signal. 2006;8:1-38. [PubMed] [DOI] |
| 20. | Pecqueur C, Alves-Guerra MC, Gelly C, Levi-Meyrueis C, Couplan E, Collins S, Ricquier D, Bouillaud F, Miroux B. Uncoupling protein 2, in vivo distribution, induction upon oxidative stress, and evidence for translational regulation. J Biol Chem. 2001;276:8705-8712. [PubMed] [DOI] |
| 21. | Horimoto M, Resnick MB, Konkin TA, Routhier J, Wands JR, Baffy G. Expression of uncoupling protein-2 in human colon cancer. Clin Cancer Res. 2004;10:6203-6207. [PubMed] [DOI] |
| 22. | Murase T, Kondo H, Hase T, Tokimitsu I, Saito M. Abundant expression of uncoupling protein-2 in the small intestine: up-regulation by dietary fish oil and fibrates. Biochim Biophys Acta. 2001;1530:15-22. [PubMed] |
| 23. | Jang HJ, Kokrashvili Z, Theodorakis MJ, Carlson OD, Kim BJ, Zhou J, Kim HH, Xu X, Chan SL, Juhaszova M. Gut-expressed gustducin and taste receptors regulate secretion of glucagon-like peptide-1. Proc Natl Acad Sci U S A. 2007;104:15069-15074. [PubMed] [DOI] |
| 24. | Lim GE, Xu M, Sun J, Jin T, Brubaker PL. The rho guanosine 5'-triphosphatase, cell division cycle 42, is required for insulin-induced actin remodeling and glucagon-like peptide-1 secretion in the intestinal endocrine L cell. Endocrinology. 2009;150:5249-5261. [PubMed] [DOI] |