修回日期: 2010-08-26
接受日期: 2010-08-31
在线出版日期: 2010-10-08
目的: 探讨H.pylori感染对人胃癌MKN45细胞环氧合酶2(COX-2)启动子荧光素酶报告基因重组质粒(pGL3-Basic-COX-2-promoter)活性的影响及p38MAPK信号通路对其的调控作用.
方法: 将构建的COX-2启动子pGL3-Basic-COX-2-promoter和内参质粒pRL-SV40共转染人胃癌MKN45细胞, 加入100倍细胞数量的H.pylori共培养一段时间后, 检测双荧光素酶的活性. Western blot检测H.pylori感染对人胃癌MKN45细胞p38MAPK信号通路的激活作用. 运用p38MAPK特异性抑制剂SB203580阻断p38MAPK信号通路, 观察H.pylori对MKN45细胞COX-2启动子活性的影响.
结果: 瞬时转染实验显示, COX-2启动子在MKN45细胞中的转录表达随时间的变化而升高, 转染后40 h的双报告基因活性是转染后8 h的3.5倍(P<0.01); 加入H.pylori共培养后, 同时间点的荧光素酶活性明显升高(P<0.05或P<0.01), 转染后40 h的活性是转染后8 h的5倍(P<0.01). H.pylori感染20 min后, p38MAPK信号通路被激活, 60 min达峰值; 加入p38MAPK信号通路特异性抑制剂SB203580抑制p38MAPK信号通路后, COX-2启动子的活性均明显下调.
结论: H.pylori感染通过p38MAPK信号通路上调COX-2启动子活性, 这可能是H.pylori促进胃癌发生发展的重要因素之一.
引文著录: 刘宣, 刘宁宁, 王炎, 殷佩浩, 吴琼, 周宁, 孙珏, 范忠泽, 李琦. 幽门螺杆菌通过p38MAPK信号通路上调人胃癌MKN45细胞中COX-2启动子的活性. 世界华人消化杂志 2010; 18(28): 3003-3007
Revised: August 26, 2010
Accepted: August 31, 2010
Published online: October 8, 2010
AIM: To investigate the effect of Helicobacter pylori (H.pylori) infection on the transcriptional activity of cyclooxygenase-2 (COX-2) promoter in gastric cancer MKN45 cells and to explore potential mechanisms involved.
METHODS: The recombinant vector pGL3-Basic-COX-2-promoter and a control vector (pRL-SV40) was transiently co-transfected into MKN45 cells. Twelve hours later, the transfected cells were infected with H.pylori (100 times the number of cells) for different durations. The COX-2 promoter activity was detected using the dual luciferase assay. The activation of p38MAPK pathway was evaluated by Western blot. The p38MAPK signal transduction pathway was then blocked with a specific inhibitor SB203580 to detect the effect of H.pylori infection on COX-2 promoter activity.
RESULTS: After transient transfection, the activity of COX-2 promoter in MKN45 cells was increased with time. At 40 h after transfection, the activity of dual-luciferase was 3.5 folds higher than that at 8 h (P < 0.05). H.pylori infection significantly increased the activity of dual-luciferase compared with control cells (all P < 0.05 or 0.01). The activity of dual-luciferase in cells infected with H.pylori at 40 h after transfection was 5 folds higher than that at 8 h (P < 0.01). The expression of p38MAPK was up-regulated at 20 min after infection and reached the peak at 60 min. Blockage of the p38MAPK signal transduction pathway with SB203580 significantly reduced the COX-2 promoter activity.
CONCLUSION: H.pylori infection increases the transcriptional activity of COX-2 promoter via the p38MAPK signal transduction pathway, which may be one of the important mechanisms by which H.pylori infection causes gastric cancer.
- Citation: Liu X, Liu NN, Wang Y, Yin PH, Wu Q, Zhou N, Sun J, Fan ZZ, Li Q. Helicobacter pylori infection increases the transcriptional activity of COX-2 promoter via the p38MAPK signal transduction pathway in MKN45 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(28): 3003-3007
- URL: https://www.wjgnet.com/1009-3079/full/v18/i28/3003.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i28.3003
研究表明长期的幽门螺杆菌(Helicobacter pylori, H.pylori)感染是胃癌重要的致病因素之一, 近年来研究发现H.pylori感染诱导环氧合酶-2(cyclooxygenase-2, COX-2)的过度表达是胃癌发生的重要环节. 我们的既往研究也发现H.pylori感染能上调体外培养的人胃癌细胞COX-2的表达[1,2]. 但COX-2过度表达是如何产生的尚不清楚. p38MAPK信号转导通路是细胞内重要的信号转导分子, 调控多种基因的表达, 参与细胞的增殖、分化、凋亡以及介导炎症、应激等多种生理病理过程. 我们在前期研究中, 成功构建了启动子荧光素酶报告基因重组质粒(pGL3-Basic-COX-2-promoter), 测序证实为COX-2基因启动子序列, 无碱基突变[3]. 为揭示COX-2在H.pylori感染诱导COX-2表达的机制, 本研究在既往研究的基础上进一步探讨p38MAPK信号通路对H.pylori感染的人胃癌MKN45细胞pGL3-Basic-COX-2-promoter的调控作用.
转染脂质体(transfection reagent)、双荧光素酶检测试剂盒(dual luciferase assay kit), 美国Promega公司. p38MAPK特异性抑制剂SB203580为美国Serologllcais公司产品; RPMI 1640培养基美国Gibco; 哥伦比亚琼脂培养基英国OXOID公司; 蛋白质抽提试剂试剂盒(Sangon S-415)、BCA蛋白质定量试剂Merk公司产品; SDS-PAGE电泳试剂上海博彩生物技术有限公司; 鼠抗人COX-2单克隆抗体购自Merck公司.
1.2.1 细胞株与菌株培养: MKN45细胞株、H.pylori国际标准株NCTC11637由上海中医药大学大学附属普陀医院肿瘤实验室提供. MKN45细胞在37 ℃, 50 mL/L CO2饱和湿度条件下置于含100 mL/L胎牛血清的RPMI 1640完全培养液中, 常规培养; 将冻存的H.pylori菌株复苏后, 接种于含10%脱纤维羊血的哥伦比亚琼脂培养基, 于50 mL/L O2、100 mL/L CO2、850 mL/L N2微需氧条件下培养48-72 h, 经尿素酶、氧化酶、过氧化氢酶试验及组织染色等证实为H.pylori.
1.2.2 H.pylori感染人胃癌MKN45细胞:H.pylori感染人胃癌MKN45细胞的方法根据我们实验室以前报道的方法并进行如下调整[1,2]: 取增殖活跃的MKN45细胞以每板4×105接种于6孔板中. 当细胞贴壁后, 更换不含抗生素的细胞培养液, 用接种环刮取培养基上的H.pylori活菌, 悬于PBS中, 按生物分光光度计测得A600值(1A = 108 CFU/mL), 调整H.pylori细菌密度, 按细菌和细胞数量100:1的比例向培养于6孔板中的MKN45细胞中加入菌液, 继续培养.
1.2.3 pGL3-Basic-COX-2质粒转染: 我们已合成pGL3-Basic-COX-2质粒, 合成方法见文献[1], 将其和内参质粒pRL-SV40共转染人胃癌MKN45细胞: 按0.5×105个细胞/孔的量在24孔板中接种指数生长期的细胞; 吸弃培养液, 添加500 μL无血清无抗生素的RPMI 1640培养基(RPMI 1640-FS)润洗细胞2-3次; 取2个1.5 mL离心管, 1个按50 μL/孔加入RPMI 1640-FS, 然后加入pGL3-Basic-COX-2和pRL-SV40质粒DNA, 每孔0.8 μg; 另1个按每孔50 μL加入RPMI 1640-FS, 按每孔2 μL加入LipofectamineTM 2000转染试剂; 将两管液体混合, 吸弃24孔板中的培养液, 将离心管中的混合液滴加到各组细胞上; 将细胞置于37 ℃、恒湿的含50 mL/L CO2的培养箱中培养3-5 h后, 吸去DNA/脂质体/RPMI 1640混合物, 加入500 μL的完全培养基或含100倍细胞数量H.pylori的有血清无抗生素的1640培养基, 分别加入不同浓度(0%、5%、10%、20%)的健脾解毒含药血清处理, 继续培养24-48 h. 然后对细胞进行双荧光素酶活性检测, 记录发光值为Renilla luciferase的发光单位(RLU).
1.2.4 Western blot检测蛋白的表达: 细胞用预冷PBS洗2次, 吸弃PBS, 加入预冷的含抑制剂的蛋白质抽提试剂, 轻轻摇动5 min; 后用一预冷的橡胶和塑料细胞刮刮下培养瓶壁上细胞, 转移细胞悬液到离心管中, 冰浴15 min. 裂解液于预冷的离心机中14 000 r/min离心15 min, 吸弃上清; BCA分析试剂测定蛋白质浓度. 50 μg总蛋白质在SDS聚丙烯酰胺凝胶电泳分离后, 电转移至PVDF膜, 膜在5% BSA溶液中室温孵育1 h以封闭膜上的非特异结合. 封闭过的膜加入一级抗体4 ℃过夜, 抗原抗体结合. TBST洗膜3次, 每次5 min, 再加入HRP标记的二级抗体以结合一级抗体, 及HRP标记的抗生物素抗体以结合分子量标准, 室温孵育膜1 h, TBST洗膜3次, 每次5 min; 同样方法标记鼠单克隆抗GAPDH作对照. 洗完膜稍干后, 按1:1加入DAB显影液(与二抗HRP结合), 在Bio-Rad的化学发光成像仪上显影. 然后分析灰度值, 再计算灰度系数比.
统计学处理 数据以mean±SD表示, 采用PEMS3.1统计软件包, 两样本均数比较用t检验, 多样本比较以单因素方差分析; 各组两两比较采用Newman-Keuls检验.
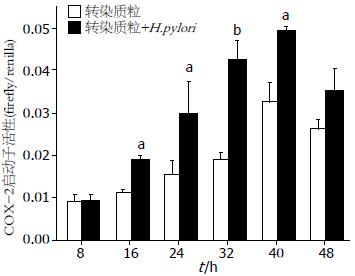
将载体质粒、重组质粒分别与内参质粒共转染胃癌MKN45细胞4 h后, 吸弃转染培养液常规培养16-24 h, 分别加H.pylori(H.pylori:MKN45 = 100:1)感染后8、16、24、32、40、48 h收集样品, 进行双荧光素酶活性检测. 结果显示pGL3-Basic-COX-2转染MKN45细胞后, 48 h内COX-2启动子的活性随时间的变化呈现明显的上升趋势, 在转染40 h后达到最大值, 与转染8 h相比活性增高3.5倍(P<0.01), COX-2启动子活性明显高于载体质粒转染对照组(P<0.01). 转染pGL3-Basic-COX-2的MKN45细胞, 经H.pylori感染16 h后, COX-2启动子的活性明显增强, 并随时间的变化呈上升的趋势, 40 h达到最大值, 与转染8 h组相比活性增高5倍(P<0.01). 同时, 与未经H.pylori感染组相比, COX-2启动子的活性表现出明显的上调(P<0.05, P<0.01). 特别是作用第32小时, 两者COX-2启动子活性的差异达到最大(P<0.01, 图1).
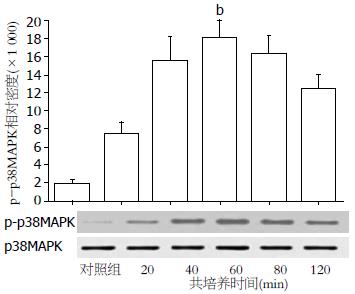
H.pylori与MKN45细胞按100:1的比例共培养20、40、60、90、120 min, 以正常细胞为对照, Western blot检测p38MAPK和磷酸化的p38MAPK(p-p38MAPK). 其结果发现常规培养的MKN45细胞p-p38MAPK微弱表达, H.pylori作用后MKN45细胞20 min后p38MAPK在被迅速激活, 随着作用时间的延长p-p38MAPK表达逐步增强, 60 min达峰值, 约为对照组的10倍. 同时, 各组p38MAPK的表达未见有明显差异(图2).
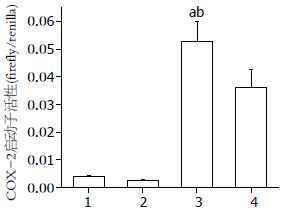
将MKN45细胞转染COX-2启动子荧光素酶重组质粒后, 加入20 μmol/L的p38MAPK特异性抑制剂SB203580处理2 h, 再加H.pylori感染. 以未用H.pylori感染和H.pylori感染而未用抑制的MKN45细胞为对照, 检测荧光素酶活性. 结果显示, 与MKN45细胞组(对照组)相比, MKN45细胞加p38MAPK抑制剂组的COX-2启动子转录活性无统计学差异(P>0.05), 在H.pylori感染的MKN45细胞中, COX-2启动子转录活性显著升高(P<0.01), 而加入p38MAPK抑制剂后H.pylori感染MKN45细胞的COX-2启动子活性明显降低(P<0.05, 图3).
自1983年Warren和Marshall成功分离和培养出H.pylori后[4], 国内外学者对其进行了深入的研究, 现已证实H.pylori是慢性胃炎的病原菌, 是消化性溃疡的重要致病因子, 是胃癌的协同致病因子[5,6]. 1994年WHO将H.pylori感染列为Ⅰ类致癌因子[7]. H.pylori感染引起胃癌的机制十分复杂, H.pylori本身并不分泌致癌物, 他导致胃癌的发生是一种间接复杂的形式. COX-2为诱导型基因, 静息时不表达, 当细胞受到各种诱导因子刺激时其表达上调, 迅速合成. 近年研究表明COX-2在多种肿瘤组织中表达增强, 与肿瘤的发生、发展及转移密切相关[8-10]. 检测COX-2的水平可能有助于肿瘤的早期诊断, 抑制COX-2的表达可能有助于肿瘤的治疗.
双荧光素酶报告基因法, 首先构建以目的基因启动子为启动序列的荧光素酶报告基因载体. 然后, 将构建好的载体同参照载体同时转染进细胞中, 通过检测荧光素酶的表达量反映启动序列的活性. 该方法具有可信度高、操作简单的优点[11], 而且还能够通过特异性的序列来靶向筛选抗肿瘤药物. 在我们前期的研究中, 已建立了基于双荧光素酶报告基因法的COX-2筛选模型. 该模型是通过构建含有COX-2基因启动子的萤火虫荧光素酶报告基因重组质粒, 并同含海肾荧光素酶报告基因的载体质粒共同组成双荧光素酶报告基因系统. 利用脂质体转染法将两个质粒共同转染到肿瘤细胞中, 利用双报告基因检测系统测定两种荧光强度的变化, 反映COX-2基因启动子的活性[3].
本研究证实经H.pylori感染MKN45细胞后, COX-2启动子的活性随感染时间的变化呈现明显的上升趋势, 在转染40 h达到最大值, 与转染8 h组相比活性增高5倍(P<0.01), 结果从COX-2启动子的转录方面证实H.pylori感染能够上调胃癌MKN45细胞COX-2基因的表达.
p38MAPK是MAPK家族中的一条重要的信号途径, 是一组细胞内信号转导分子, 在炎症、细胞生长、细胞分化、细胞周期及细胞死亡等过程中发挥重要的调控作用, 能够被多种细胞外的刺激因素激活[12-16]. MAPKK通过磷酸化p38MAPK的Thr-Gly-Tyr(TGY)位点中的苏氨酸和酪氨酸使其活化. 活化的p38MAPK进一步活化下游的蛋白激酶和转录因子ATF-2、CREB-1, 进而调控多种基因的表达[1,16]. 但p38MAPK信号通路是否在H.pylori诱导的COX-2表达中起作用尚不清楚.
我们研究发现, H.pylori感染MKN45细胞20 min后, p38MAPK信号通路被激活, 60 min达峰值, 随着作用时间的延长, 表达逐渐下降, 24 h仍有表达. 说明H.pylori可激活该信号通路, 而且在加入p38MAPK信号通路特异性抑制剂SB203580抑制p38MAPK信号通路后, COX-2启动子的活性均明显下调, 提示H.pylori可通过p38MAPK信号通路上调COX-2基因的表达, 这可能是其促进胃癌发生发展的重要因素.
自1983年Warren和Marshall成功分离和培养出H.pylori后, 国内外学者对其进行了深入的研究, 现已证实H.pylori是慢性胃炎的病原菌, 是消化性溃疡的重要致病因子, 是胃癌的协同致病因子, 1994年WHO将H.pylori感染列为Ⅰ类致癌因子. H.pylori感染引起胃癌的机制十分复杂, H.pylori本身并不分泌致癌物, 他导致胃癌的发生是一种间接复杂的形式. 近年来研究发现H.pylori感染诱导COX-2的过度表达是胃癌发生的重要环节, 但COX-2过度表达是如何产生的尚不清楚.
关玉盘, 教授, 首都医科大学附属北京朝阳医院消化科
国内外大量的流行病学研究表明, H.pylori感染胃癌胃黏膜细胞, COX-2表达增加是胃癌发生的重要因素. 但COX-2过度表达的具体机制目前尚不清楚, 亟待更深入地研究.
研究发现, 与H.pylori阴性者相比H.pylori感染胃黏膜上皮组织COX-2 mRNA表达的明显增加, 而体内外细胞实验也发现COX-2特异性抑制剂NS-398不仅能下调胃癌细胞表达COX-2, 而且对胃癌细胞的增殖有明显抑制作用, 并导致H.pylori感染的H5746T细胞caspase-3活化及胃上皮细胞凋亡的增加.
本研究将COX-2启动子荧光素酶报告基因重组质粒瞬时转染人胃癌MKN45细胞, 从p38MAPK信号转导途径揭示H.pylori感染后诱导COX-2过表达导致胃癌发生的部分机制.
本研究提示, H.pylori刺激细胞内MAPK, 磷酸化p38MAPK的Thr-Gly-Tyr(TGY)位点中的苏氨酸和酪氨酸, 使其活化. 活化的p38MAPK进一步上调COX-2启动子的转录活性, 导致COX-2表达增加, 揭示了H.pylori感染发生胃癌的关键环节, 即COX-2过表达的部分机制.
本研究方法有一定创新性, 结论明确, 分析可信, 为H.pylori致胃癌机制提供了有价值的理论.
编辑: 李薇 电编:何基才
| 1. | 李 琦, 范 忠泽, 孙 珏, 刘 宁宁, 周 利红, 吴 琼, 王 炎, 隋 华, 高 虹. 幽门螺杆菌对人胃癌MKN45细胞p38MAPK信号转导通路激活作用的研究. 中国癌症杂志. 2008;18:801-805. |
| 2. | Li Q, Liu N, Shen B, Zhou L, Wang Y, Wang Y, Sun J, Fan Z, Liu RH. Helicobacter pylori enhances cyclooxygenase 2 expression via p38MAPK/ATF-2 signaling pathway in MKN45 cells. Cancer Lett. 2009;278:97-103. [PubMed] [DOI] |
| 3. | 李 琦, 周 利红, 王 炎, 孙 珏, 高 虹, 范 忠泽. pGL3-Basic-COX-2-promoter报告基因重组质粒的构建及其功能鉴定. 世界华人消化志. 2008;16:3498-3504. [DOI] |
| 4. | Kuipers EJ, Uyterlinde AM, Peña AS, Roosendaal R, Pals G, Nelis GF, Festen HP, Meuwissen SG. Long-term sequelae of Helicobacter pylori gastritis. Lancet. 1995;345:1525-1528. [PubMed] [DOI] |
| 5. | Sachs G, Wen Y, Scott DR. Gastric infection by Helicobacter pylori. Curr Gastroenterol Rep. 2009;11:455-461. [PubMed] [DOI] |
| 6. | Belair C, Darfeuille F, Staedel C. Helicobacter pylori and gastric cancer: possible role of microRNAs in this intimate relationship. Clin Microbiol Infect. 2009;15:806-812. [PubMed] [DOI] |
| 7. | Schistosomes, liver flukes and Helicobacter pylori. IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum. 1994;61:1-241. [PubMed] |
| 8. | Sitarz R, Leguit RJ, de Leng WW, Morsink FH, Polkowski WP, Maciejewski R, Offerhaus GJ, Milne AN. Cyclooxygenase-2 mediated regulation of E-cadherin occurs in conventional but not early-onset gastric cancer cell lines. Cell Oncol. 2009;31:475-485. [PubMed] |
| 9. | Samaka RM, Abdou AG, Abd El-Wahed MM, Kandil MA, El-Kady NM. Cyclooxygenase-2 expression in chronic gastritis and gastric carcinoma, correlation with prognostic parameters. J Egypt Natl Canc Inst. 2006;18:363-374. [PubMed] |
| 10. | 李 琦, 范 忠泽, 孙 珏, 刘 宁宁, 王 炎, 周 利红, 吴 琼, 隋 华, 李 先茜, 高 虹. 幽门螺杆菌诱导人胃癌MKN45细胞COX-2表达的信号转导研究. 肿瘤. 2009;29:108-112. |
| 11. | Himes SR, Shannon MF. Assays for transcriptional activity based on the luciferase reporter gene. Methods Mol Biol. 2000;130:165-174. [PubMed] |
| 12. | Pearson G, Robinson F, Beers Gibson T, Xu BE, Karandikar M, Berman K, Cobb MH. Mitogen-activated protein (MAP) kinase pathways: regulation and physiological functions. Endocr Rev. 2001;22:153-183. [PubMed] [DOI] |
| 13. | Kim SJ, Ko CB, Park C, Kim BR, Sung TH, Koh DH, Kim NS, Oh KJ, Chung SY, Park R. p38 MAP kinase regulates benzo(a)pyrene-induced apoptosis through the regulation of p53 activation. Arch Biochem Biophys. 2005;444:121-129. [PubMed] [DOI] |