修回日期: 2010-07-05
接受日期: 2010-07-21
在线出版日期: 2010-10-08
目的: 探讨食管癌中医证方启膈散、沙参麦冬汤、通幽汤和补气运脾汤对hEGF刺激的人食管癌EC9706细胞生长的影响, 进而研究该证方抑制食管癌细胞生长信号转导的机制.
方法: 体外正常条件培养食管鳞癌细胞株EC9706细胞, 无血清饥饿细胞24 h, 用200 ng/mL hEGF刺激细胞45 min后, 加入启膈散、沙参麦冬汤、通幽汤和补气运脾汤, 通过镜下形态观察、MTT染色、流式细胞技术观察细胞增殖变化情况. 取抑制EGF刺激EC9706细胞增殖IC50所用的各方药物浓度处理细胞, 用Western blot方法检测细胞内PLC-γ1和PI3K介导的生长信号通路的蛋白表达和酪氨酸磷酸水平.
结果: 启膈散、沙参麦冬汤、通幽汤抑制细胞增殖的IC50值分别为849、1 004和1 615 mg/L, 以此浓度干预细胞, 可明显抑制细胞生长, 阻止细胞进入S期, 补气运脾汤对此细胞株无明显抑制作用. 在两个生长信号通路中, 3方可不同程度地抑制EGFR和PLC-γ1蛋白表达和酪氨酸磷酸化, 以及PKCα、MARCKS、PI3K、AKT-1和NF-κB p50蛋白的表达, 其中, 在PLC-γ1通路中, 抑制作用强弱依次是: 通幽汤>启膈散>沙参麦冬汤; 在PI3K通路中, 作用强弱依次是: 通幽汤>沙参麦冬汤>启膈散.
结论: 启膈散、沙参麦冬汤和通幽汤可不同程度地抑制hEGF刺激的EC9706细胞生长. 抑制PLC-γ1和PI3K介导的生长信号转导是其抑制EC9706细胞生长的重要机制.
引文著录: 司富春. 启膈散、沙参麦冬汤、通幽汤和补气运脾汤对hEGF刺激的人食管癌EC9706细胞生长信号转导的调节. 世界华人消化杂志 2010; 18(28): 2956-2965
Revised: July 5, 2010
Accepted: July 21, 2010
Published online: October 8, 2010
AIM: To investigate the effects of Qigesan, Shashenmaidongtang, Tongyoutang and Buqiyunpitang on the proliferation of human esophageal carcinoma EC9706 cells stimulated with human epidermal growth factor (hEGF), and to explore potential mechanisms involved.
METHODS: After cultured EC9706 cells were stimulated with hEGF and then treated with Qigesan, Shashenmaidongtang, Tongyoutang and Buqiyunpitang, respectively, cell morphological changes were observed under an inverted microscope, cell proliferation was determined by MTT assay, cell cycle progression was measured by flow cytometry, and protein expression and tyrosine phosphorylation in PLC-γ1 and PI3K-mediated signaling pathways were determined by Western blot.
RESULTS: The half-maximum inhibitory concentrations (IC50) of Qigesan, Shashenmaidongtang and Tongyoutang were 849, 1 004 and 1 615 mg/L, respectively. These drugs at a concentration of IC50 inhibited hEGF-stimulated cell proliferation and prevented cell cycle progression into S phase. Buqiyunpitang could only weakly inhibit the proliferation of EC9706 cells. Qigesan, Shashenmaidongtang and Tongyoutang inhibited the protein expression and tyrosine phosphorylation of EGFR and PLC-γ1 as well as the protein expression of PKCα, MARCKS, PI3K, AKT-1 and NF-κB p50. Tongyoutang had the strongest inhibitory effects on the PLC-γ1 signaling pathway, followed by Qigesan and Shashenmaidongtang. In contrast, the order of the inhibitory potency for the PI3K signaling pathway was Tongyoutang, Shashenmaidongtang and Qigesan.
CONCLUSION: Qigesan, Shashenmaidongtang and Tongyoutang can, to varying degrees, inhibit hEGF-stimulated cell proliferation by suppressing PLC-γ1 and PI3K-mediated signaling pathways.
- Citation: Si FC. Effects of Qigesan, Shashenmaidongtang, Tongyoutang and Buqiyunpitang on hEGF-stimulated proliferation of human esophageal carcinoma EC9706 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(28): 2956-2965
- URL: https://www.wjgnet.com/1009-3079/full/v18/i28/2956.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i28.2956
食管癌属中医噎膈病的范畴, 临床上分为痰气交阻、津亏热结、瘀血内结和气虚阳微4种证型, 分别用启膈散、沙参麦冬汤、通幽汤和补气运脾汤四方治疗[1]. 近10年我们的研究表明食管癌临床辨证施治常用证方启膈散、沙参麦冬汤和通幽汤能明显抑制食管癌细胞生长、诱导细胞凋亡, 其作用机制与磷脂酶C-γ1介导的细胞信号转导相关; 食管癌病理组织和细胞超量表达表皮生长因子受体(epidermal growth factor receptor, EGFR)和血小板衍生生长因子受体(platelet-derived growth factor receptor, PDGFR)等生长因子受体[2-4], 但是单一生长因子在食管癌病变中的信号转导机制以及食管癌中医证方的干预作用尚有待深入研究. 我们以往的研究发现, 人表皮生长因子(human epidermal growth factor, hEGF)在200 ng/mL浓度作用食管癌EC9706细胞24 h可以使细胞增殖增加1/2, 表明人hEGF可以刺激EC9706细胞增殖. 本研究进一步观察了食管癌常用证方干预hEGF刺激的食管癌EC9706细胞生长作用及其调节细胞生长信号转导的作用机制.
启膈散(《医学心悟》)、沙参麦冬汤(《温病条辨》)、通幽汤(《脾胃论》)和补气运脾汤(《统旨方》)均以原方用量[5], 中药购自河南中医学院三附院; 启膈散药用丹参9 g、郁金1.5 g、砂仁壳1.2 g、北沙参9 g、川贝母4.5 g、茯苓3 g; 沙参麦冬汤药用北沙参9 g、玉竹6 g、生甘草3 g、桑叶4.5 g、麦冬9 g、生扁豆4.5 g、天花粉4.5 g; 通幽汤药用桃仁0.3 g、红花0.3 g、生地1.5 g、当归3 g、炙甘草3 g、升麻3 g、槟榔1.5 g; 补气运脾汤药用人参6 g、白术9 g、橘皮4.5 g、炙黄芪3 g、茯苓4.5 g、砂仁2.4 g、炙甘草1.2 g、半夏3 g、生姜1片、大枣1枚. 煎煮2 h、浓缩、5 000 r/min离心15 min, 取上清, 0.22 μm滤膜过滤, 取部分药液干燥称质量, 计算药物浓度, -20 ℃冻存备用, 用时调至所需浓度. 人食管癌细胞株EC9706由中国协和医科大学肿瘤研究所分子肿瘤学国家重点实验室惠赠. RPMI 1640培养基(Gibco公司); 小牛血清(Gibco公司); PMSF和亮抑酶肽(Amresco公司); 丙烯酰胺(Biomol公司); hEGF(Sigma公司); 磷脂酶C-γ1(phospholipase C-γ1, PLC-γ1)、酪氨酸磷酸化(tyrosine phosphorylation, P-Tyr)和PI3K单克隆抗体(韩国浦项科技大学国家信号转导网络实验室惠赠); PKCα兔多克隆抗体(Santa Cruz公司); EGFR多克隆抗体(Santa Cruz公司); 磷酸化MARCKS(Ser152/156)多克隆抗体(Cell Signal公司产品); AKT-1(PKB, 蛋白激酶B)兔多克隆抗体(武汉博士德生物工程有限公司); NF-κB p50兔多克隆抗体(武汉博士德生物工程有限公司); 山羊抗小鼠IgG-HRP和山羊抗兔IgG-HRP(华美公司); 增强化学发光(enhanced chemiluminescence, ECL)试剂盒(Santa Cruz公司); 考马斯亮蓝G250(Amresco公司); 其余化学药品均为分析纯. Heraeus细胞培养箱(德国, Kendro公司); 倒置显微镜(Zeiss公司); 紫外分光光度计(Thermo公司); SG-603生物安全柜(Bake公司); ELx800型酶标仪(Bio-Tek公司); 蛋白电泳系统(Bio-Rad公司); 高速冷冻离心机(Hitachi公司); 台式高速冷冻离心机(Sigma公司).
1.2.1 细胞培养: 从液氮中迅速取出冻存的EC9706细胞, 37 ℃水浴使之立即解冻, 将细胞悬液移入含有10 mL RPMI 1640培养液的离心管中, 1 000 r/min×10 min离心, 用10 mL含10%小牛血清的RPMI 1640培养液混匀细胞沉淀, 接种于直径100 mm培养皿中, 置于37 ℃、50 mL/L CO2培养箱中培养, 每间隔48 h更换1次培养基, 待细胞生长至70%汇合率时, 用胰蛋白酶溶液(用D-Hans液配制, 含0.25%胰蛋白酶, 0.02% EDTA, pH8.3)消化, 按实验要求接种于96孔培养板或直径100培养皿中.
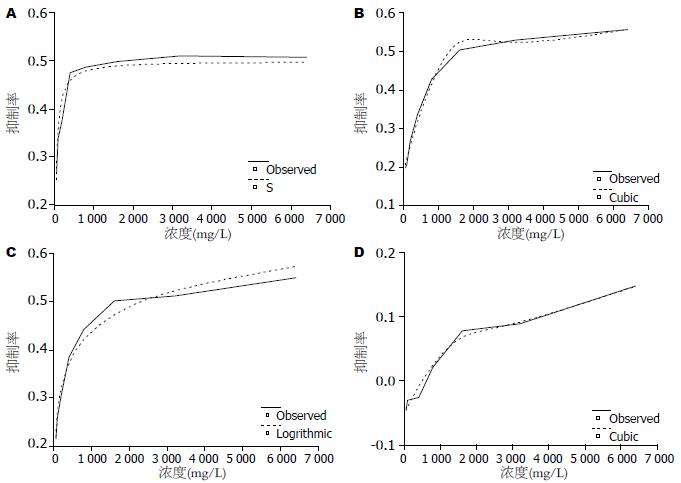
1.2.2 MTT测定: 以1×104个细胞/孔接种于96孔培养板, 含小牛血清培养液200 μL/孔, 于37 ℃、50 mL/L CO2、饱和湿度的CO2培养箱培养24 h, 弃旧培养液, 用250 μL/孔不含血清RPMI 1640培养液清洗各孔贴壁细胞中残留血清, 重复1次. 加入不含血清培养液200 μL/孔, 饥饿细胞24 h, 弃旧培养液, 分别加入含启膈散、沙参麦冬汤、通幽汤、补气运脾汤的不含血清培养液100 μL/孔, 浓度分为100、200、400、800、1 600、3 200、6 400、12 800 mg/L 8个梯度, 放入培养箱45 min, 然后用hEGF工作液400 μg/L, 100 μL/孔加入上述加药各孔中, 使药物和hEGF浓度均稀释1倍, 即药物浓度为: 50、100、200、400、800、1 600、3 200、6 400 mg/L; hEGF浓度为200 μg/L; hEGF对照组加入200 μg/L不含血清培养液配制的hEGF 200 μL/孔; 空白对照组加入200 μL/孔不含血清培养液, 继续培养24 h. 吸去上清液, 每孔加100 μL含0.5 g/L MTT的无血清培养液, 37 ℃继续培养4 h, 用150 μL DMSO溶解MTT, 在酶标仪上以570 nm/630 nm测定吸光度(A)值. 实验重复3次. 按照公式: 肿瘤细胞生长抑制率(%) = (1-实验组A值/对照组A值)×100%. 计算各药物组对肿瘤细胞增殖的抑制率. F检验, 绘制量效关系曲线图, 作拟合曲线, 求出各药半数有效量(IC50).
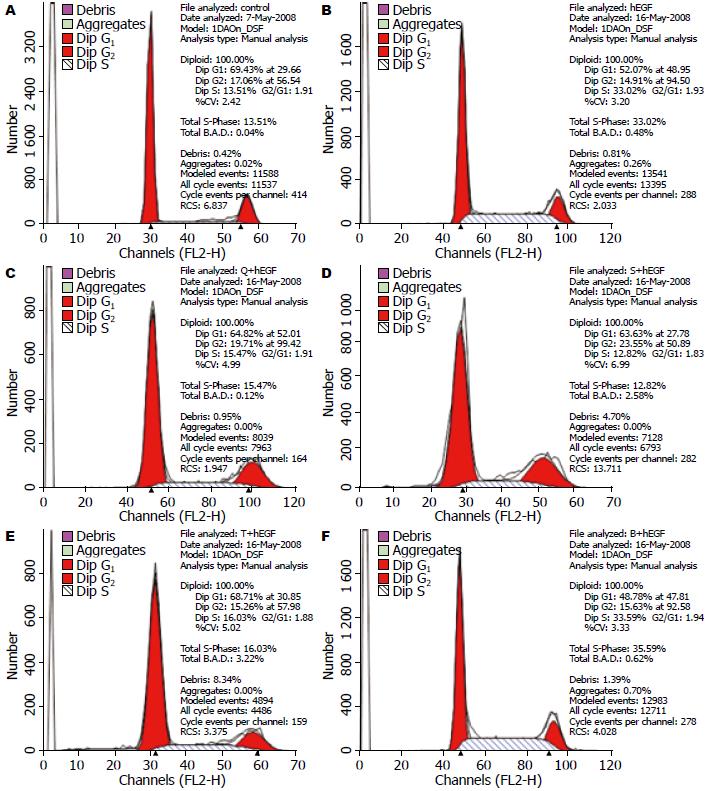
1.2.3 流式细胞仪分析: 以1×106个细胞/皿接种于直径100 mm培养皿中, 10 mL/皿含血清培养液, 共6皿, 分为空白对照组、hEGF对照组、hEGF+启膈散组、hEGF+沙参麦冬汤组、hEGF+通幽汤组和hEGF+补气运脾汤共6组. 于37 ℃, 50 mL/L CO2, 饱和湿度的CO2培养箱贴壁24 h, 弃旧培养液, 用不含血清培养液清洗皿中贴壁细胞2次, 去除残余血清, 加入不含血清培养液10 mL/皿, 饥饿细胞24 h, 4个中药组加入抑制细胞增殖IC50值所用药物浓度, 45 min后hEGF对照组和各中药物组加入200 μg/L hEGF, 空白对照组加不含血清培养液, 各皿体积均为10 mL, 继续培养24 h后, 在倒置显微镜下观察各组细胞增殖情况和形态学变化、拍照. 用3 mL/皿胰蛋白酶消化细胞, 收集入15 mL离心管中, 1 000 r/min×10 min离心, 弃上清液, 加入PBS 2 mL重悬细胞, 1 000 r/min×5 min离心, 重复1次. 弃掉PBS, 加入100 µL PBS, 用微量移液器吹打混匀, 加入700 mL/L乙醇固定细胞, 放入冰箱4 ℃过夜. 200 g×5 min离心固定细胞, 用3 mL预冷的PBS重悬细胞, 静息1 min, 200 g×5 min, 重复1次. 弃掉PBS, 依次加入PBS 850 µL, 10 g/L RNaseA 10 µL, 1% Triton X-100 100 µL, 1 g/L PI 40 µL, 37 ℃避光孵育5 min. 用400目筛网过滤细胞, 上流式细胞仪用Cellquest Pro进行细胞周期分析, 并用Modifit LT细胞周期分析软件分析结果, 得出各组细胞在各细胞周期的百分比率.
1.2.4 Western blot分析: 细胞培养、分组和药物处理同流式细胞仪分析. 用预冷PBS洗收获的细胞2次, 用细胞裂解液(20 mmol/L Hepes, pH7.2, 1% Triton X-100, 10%三酰甘油, 150 mmol/L NaCl, 1 mmol/L Na3OV4, 10 mg/L亮抑酶肽, 1 mmol/L PMSF)提取蛋白, Bradford法测定蛋白浓度. 配制8%和12% SDS聚丙烯酰胺凝胶, 10 μg/孔上样, 电泳后, 转至硝酸纤维素膜, 5%脱脂奶粉TTBS溶液封闭滤膜1 h, 加入一抗室温反应5 h, TTBS洗涤30 min, 加入相应的二抗室温反应2 h, 洗涤30 min, 用ECL试剂显影、定影、洗片[6]. 每个结果重复3次. EGFR、PLC-γ1、PI3K蛋白表达和P-Tyr检测用8% SDS-PAGE电泳, 分离的蛋白质转移到硝酸纤维素膜, 50 g/L脱脂奶粉TTBS溶液封闭滤膜后, 用PLC-γ1单克隆抗体或PI3K单克隆抗体或EGFR多克隆抗体反应, 再用辣根过氧化物酶偶联的抗鼠IgG抗体或抗兔IgG抗体检测和ECL底物显影. 随后用抗原抗体解离缓冲液(100 mmol/L甘氨酸, pH2.8, 500 mmol/L NaCl)室温1 h除去免疫印迹膜上结合的一抗和二抗, TTBS重新平衡免疫印迹滤膜, 再用抗P-Tyr单抗检测.
以药物浓度为横坐标、抑制率为纵坐标绘制剂量-效应关系曲线, 并根据拟合后的曲线方程求出各组药的IC50(表1, 图1). 启膈散、沙参麦冬汤和通幽汤可不同程度地抑制hEGF刺激的EC9706细胞增殖, 抑制率随药物浓度增加而上升, 呈剂量效应依赖关系, 在药物浓度为3 200 mg/L时, 启膈散、沙参麦冬汤和通幽汤抑制率均超过50%. 根据生长抑制作用剂量效应关系拟合曲线方程求出各组IC50, 分别是: 启膈散IC50 = 849 mg/L, 沙参麦冬汤IC50 = 1 004 mg/L, 通幽汤IC50 = 1 615 mg/L. 补气运脾汤对hEGF刺激的EC9706增殖抑制作用很弱, 即使至6 400 mg/L时, 抑制率也仅有14.74%.
| 药物浓度(mg/L) | 抑制率 | |||
| hEGF+启膈散组 | hEGF+沙参麦冬汤组 | hEGF+通幽汤组 | hEGF+补气运脾汤组 | |
| 50 | 26.59±1.33 | 19.78±1.15 | 21.52±1.51 | -4.43±0.14 |
| 100 | 33.75±2.03 | 20.66±1.46 | 25.89±1.66 | -3.07±0.43 |
| 200 | 37.30±1.02 | 26.68±1.19 | 30.40±0.46 | -2.86±0.95 |
| 400 | 47.53±1.27 | 33.58±1.83 | 38.46±1.06 | -2.59±0.15 |
| 800 | 48.66±1.53 | 42.69±0.43 | 44.21±1.14 | 2.07±0.34 |
| 1 600 | 49.84±1.41 | 50.37±0.41 | 50.07±0.25 | 7.75±0.27 |
| 3 200 | 51.02±0.42 | 52.87±0.49 | 51.14±0.46 | 8.34±0.24 |
| 6 400 | 50.69±0.22 | 55.61±0.36 | 54.91±1.37 | 14.74±2.32 |
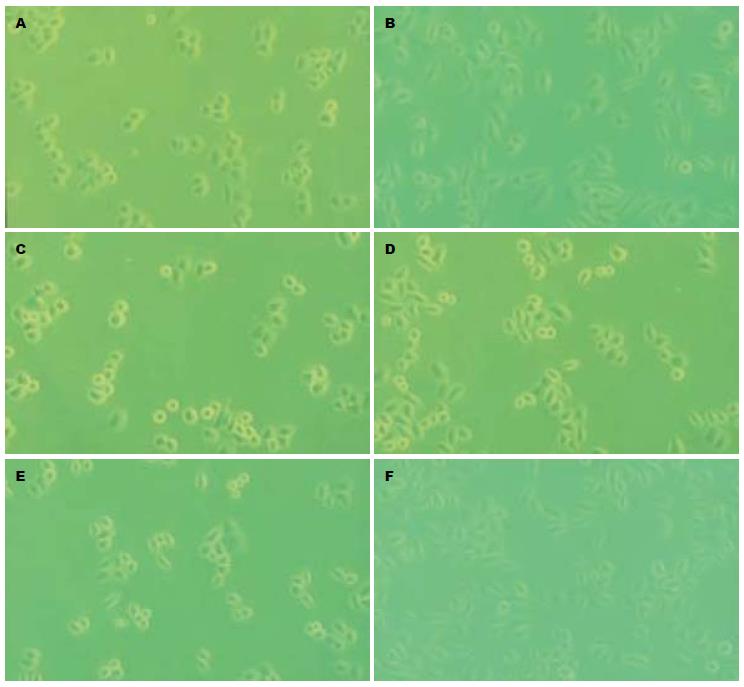
接种培养细胞24 h, 空白对照组细胞饥饿48 h后, 近半数细胞呈透明、形态变圆、漂浮状, 细胞贴壁能力减弱. hEGF组和中药组细胞饥饿24 h和药物处理24 h后, hEGF组多数细胞形态呈长梭型改变, 少数细胞呈星型、细胞周缘呈触角状, 细胞遍布视野范围, 折光度较好. 补气运脾汤组细胞状态与hEGF对照组相近, 视野下细胞数目明显多于其他3个药物组, 对细胞增殖无明显抑制作用; 启膈散、沙参麦冬汤和通幽汤组对hEGF刺激的人食管癌细胞EC9706增殖均有明显的抑制作用. 镜下观察启膈散、沙参麦冬汤和通幽汤组贴壁细胞数量明显少于hEGF对照组, 细胞汇合率低, 增长缓慢, 细胞间隙加大. 各药物组细胞形态学变化差异明显, 启膈散组细胞疏松分散, 多数细胞呈圆形, 并有细胞聚集现象, 胞内充满大量颗粒状或空泡样物质; 沙参麦冬汤组细胞表面粗糙, 可见半数细胞呈扁平多角形, 有少量细胞呈梭形, 细胞间隙加大; 通幽汤组多数细胞呈周缘发亮, 形态变圆, 少量细胞呈梭形, 透光度减低, 形态不规则(图2).
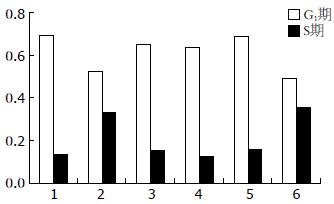
空白对照组、hEGF组及启膈散、沙参麦冬汤、通幽汤和补气运脾汤用药组细胞G1期所占百分比分别为69.43%、52.07%、64.82%、63.63%、68.71%、48.78%, 细胞S期所占百分比分别为13.51%、33.02%、15.47%、12.82%、16.03%、35.59%. hEGF组细胞与空白对照组相比, G1期比例减少, S期增加, 说明hEGF促进了细胞DNA合成; 启膈散、沙参麦冬汤、通幽汤组与hEGF组相比, 细胞G1期比例增加, S期减少, 说明此3方抑制了细胞DNA合成, 将细胞阻止在G1期, 从而减少了细胞增殖, 3方对hEGF刺激的EC9706细胞周期抑制强弱为: 通幽汤>启膈散>沙参麦冬汤; 补气运脾汤细胞G1期和S期比例与hEGF组相似, 提示补气运脾汤对hEGF刺激的细胞周期无明显影响(图3, 4).
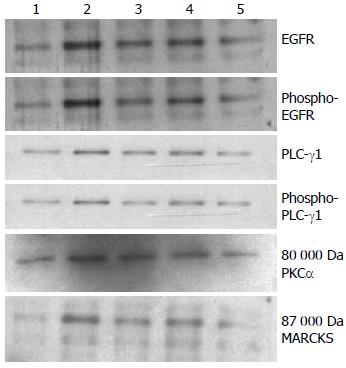
2.4.1 3方对PLC-γ1介导的信号转导通路的影响: hEGF对照组比空白对照组各蛋白表达水平和P-Tyr水平明显增强, 应用启膈散、沙参麦冬汤和通幽汤处理的EC9706细胞, 各蛋白表达和磷酸化水平与hEGF对照组相比显著减弱. 说明hEGF明显增强细胞EGFR- PLCγ-1-PKCα生长信号转导, 该3方对此通路的信号转导有不同程度的抑制作用, 其作用大小为通幽汤>启膈散>沙参麦冬汤(图5).
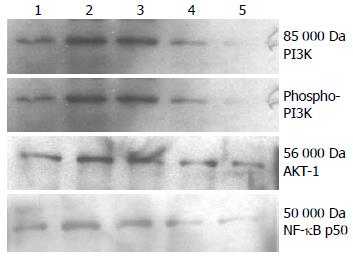
2.4.2 3方对PI3K信号转导通路的影响: hEGF刺激EC9706细胞后PI3K、AKT-1、NF-κB p50蛋白表达水平和PI3K P-Tyr化水平明显增加, 用启膈散、沙参麦冬汤和通幽汤处理细胞后, 这3种蛋白表达和P-Tyr水平比hEGF对照组显著减少. 说明EGF同样增强PI3K介导的生长信号传导, 这3个方剂对此信号转导通路也具有不同程度的抑制作用, 其作用强弱为通幽汤>沙参麦冬汤>启膈散(图6).
以往我们已经发现食管癌辨证施治常用证方启膈散、沙参麦冬汤和通幽汤明显抑制食管癌细胞生长的作用, 为了深入了解这些证方对单一生长因子刺激细胞生长的干预作用和机制, 本研究以高分化的食管鳞癌EC9706细胞系为研究对象, 观察了启膈散、沙参麦冬汤、通幽汤和补气运脾汤对EGF刺激的食管癌细胞生长的作用, 进而通过对PLC-γ1和PI3K介导的两条生长信号通路的检测, 探讨了证方影响食管癌细胞生长信号转导的机制.
我们采用MTT法、倒置显微镜下观察法和流式细胞仪分析法观察到启膈散、沙参麦冬汤和通幽汤都能够抑制hEGF刺激的食管癌细胞生长, 并且使细胞形态发生多种形状的改变. 细胞周期中的G1期代表了细胞生长处于抑制状态, 其在总细胞中所占百分比率是衡量细胞生长受抑制状况的重要指标[7]. 在用4个证方作用于hEGF刺激的EC9706细胞24 h后, 通幽汤组G1期占到了68.71%, 对细胞生长抑制最强, 其后依次是启膈散、沙参麦冬汤和补气运脾汤. 补气运脾汤组G1期占48.78%, 比hEGF对照组还低, 提示该方剂对hEGF刺激的EC9706细胞生长抑制作用很小. 这些结果表明, 启膈散、沙参麦冬汤和通幽汤通过抑制EC9706细胞从G1期进入S、G2、M增殖期, 从而抑制了细胞的生长.
EGF通过与其细胞膜上的EGFR结合产生广泛的刺激细胞增殖的作用. EGFR由原癌基因C-erbB1表达的170 000 Da糖蛋白[8], 是广泛存在于上皮细胞和间质细胞膜上的跨膜受体, 有一个细胞外配体结合区、跨膜区和细胞内的酪氨酸激酶活性部位[9,10]. EGF与其受体细胞外部分结合引起受体胞内部分的酪氨酸残基磷酸化, 形成酪氨酸底物结合位点, 使EGFR激活, 再通过识别一系列底物酶将细胞外信号转导致细胞内[11-13]. EGFR酪氨酸激酶的底物有PLC-γ1, PI3K、Ras GTPase激活蛋白、GTPase中的Eps8、Eps15和Eps15R、GRB2[14-17]. 以往研究表明EGFR在食管癌细胞中高度表达, 表达及活性的强度与食管癌的恶性程度、耐药性及发展和预后相关[2,18-22]. 本研究发现, 经hEGF刺激的EC9706细胞EGFR蛋白表达显著增强, 启膈散、沙参麦冬汤和通幽汤在抑制细胞生长的同时, 可不同程度地减少EGFR表达, 各方对EGFR表达和细胞生长作用强弱型式一致, 提示启膈散、沙参麦冬汤和通幽汤通过干预EGFR介导的生长信号发挥其抑制细胞生长的作用. 因而我们进一步观察了EGFR在其配体EGF激活后, PLC-γ1和PI3K介导的细胞生长信号转导状况及中药方剂的干预作用.
PLC-γ1是细胞膜磷脂水解酶, 在生长因子信号通路中起着重要作用[23], 他被受体酪氨酸激酶磷酸化而活化后, 水解磷脂酰肌醇-4, 5-二磷酸(phosphatidylinositol-4, 5-bisphosphate, PIP2), 产生第二信使: 三磷酸肌醇(inositol triphosphate, IP3)和三酰甘油, IP3能引起细胞内钙库的释放, 三酰甘油能激活蛋白激酶C(PKC), 通过这两条通路或蛋白与蛋白相互作用途经传递细胞生长信号. PLC-γ1超量表达、活性和信号传导增强可导致多种肿瘤的发生和发展[4]. 食管癌组织细胞过度表达EGF和EGFR, 通过自分泌环路刺激细胞增殖, 与食管癌的发生发展和预后密切相关[18,19,24]. 我们在以往的研究中也发现在人食管癌病理组织、裸鼠肿瘤组织和体外培养的食管癌细胞增殖时EGFR和PLC-γ1超量表达、信号传导大幅增强[2,3,25], 提示生长因子信号传导在食管癌病变中起着重要作用. 本实验在用单一生长因子EGF刺激食管癌细胞增殖过程中, EGFR与PLC-γ1蛋白表达和P-Tyr、PKCα蛋白表达和PKC活性明显增强, 有力地证明了EGF-PLC-γ1信号转导增强对食管癌细胞增殖的促进作用. 十四烷基富丙氨酸蛋白激酶底物(myristoylated alanine-rich C kinase substrate, MARCKS)是PKC的重要底物, 其相对分子质量约为87 000 Da, 分布于各种细胞中, 参与细胞运动、有丝分裂、膜运输等细胞活动[26], MARCKS停留于细胞膜, 依赖于PKC对其磷酸化往来于膜质之间[27,28], 其他磷酸激酶都不能催化他, 以往我们曾采用Western blot分析MARCKS磷酸化水平和纯化PKC, 使Histone Ⅲs磷酸化. 体外测定两种方法检测PKC活性, 其结果一致. 因此, 本研究选用检测磷酸化MARCK磷酸化水平表示PKC活性.
细胞中P-Tyr是一种重要的信号传导机制, P-Tyr受蛋白质P-Tyr酶的调控. 酪氨酸蛋白激酶型受体与相应配体结合后, 受体二聚化或多聚化, 表现酪氨酸蛋白激酶活性, 催化受体自身和底物P-Tyr, 进而引发细胞信号转导级联反应. 在癌症细胞中, 由酪氨酸激酶启动癌化是一种常见特征, 酪氨酸激酶已作为抗癌药物研制的靶标[29]. EGFR就是一种酪氨酸蛋白激酶型受体, 当EGF与其受体结合导致受体二聚化, 形成同源或异源二聚体, 激活受体酪氨酸激酶活性, 从而在二聚体内彼此相互磷酸化受体胞内肽段的酪氨酸残基[30]. 信号蛋白的SH2结构域能识别磷酸化的酪氨酸残基并与之结合, PLC-γ1含有2个SH2结构域和1个SH3结构域, SH2与磷酸化的酪氨酸残基结合而被磷酸化, 由此引起一系列的磷酸化级联反应、蛋白相互作用和激活酶活性通路[31]. 本实验结果显示hEGF刺激的EC9706细胞EGFR和PLC-γ P-Tyr水平及PKC表达和活性显著增强, 启膈散、沙参麦冬汤和通幽汤3方有不同程度抑制作用, 说明抑制EGFR-PLC-γ P-Tyr是食管癌3证方作用机制之一. 上述结果表明中医临床上治疗食管癌的常用方剂启膈散、沙参麦冬汤和通幽汤在抑制细胞生长的同时, 3方可不同程度地减少信号转导通路上的蛋白表达和活性, 并且各方对细胞生长和对信号蛋白作用强弱型式一致. 因此, 通过EGF- PLC-γ1信号转导通路抑制食管癌细胞增殖是3方治疗食管癌的部分机制.
PI3K/AKT-NF-κB信号通路在肿瘤发生发展中起重要作用. PI3K是一类特异的催化PIP2的激酶, 根据其结构可分为3种类型. Ⅰ型是由催化亚基P110和调节亚基P85所组成的异源二聚体, P85含有N端SH3区、RHO结合域/断裂点簇集区(breakpoint cluster region, BCR)同源区、SH2区及连接区, P110有N端P85结合域、Ras结合域、富含脯氨酸区、PI3K同源区、HR3区、HR2区及C端HR1区共6个结构域. P85调节亚基是许多受体酪氨酸激酶的磷脂蛋白底物, 可被受体酪氨酸激酶和非受体酪氨酸激酶活化, P-Tyr残基立即成为细胞内信号蛋白的结合位点, 通过与P85的SH2结构域结合而把P85-P110复合物聚集到细胞膜上并使之活化[32-34]; 或者通过Ras和P110直接结合, 导致P13K的活化. 活化的PI3K催化细胞膜上PIP2在D3位磷酸化生成PIP3, 后者与AKT的PH结构域结合, 促使AKT从细胞质转位到细胞膜以及构象改变, Ser473和Thr308位点发生磷酸化而被激活. 活化的AKT再进一步激活其下游因子, 通过直接磷酸化NF-κB和mTOR等多种转录因子参与调节细胞增殖、分化、凋亡和浸润等多种细胞活动[35,36]. 文献报道食管癌病变与PI3K/AKT-NF-κB信号通路激活相关[37-39], 该通路已作为癌症治疗的靶标[40-42]. 本研究结果表明hEGF刺激EC9706细胞增殖过程中EGFR和PI3K P-Tyr水平及AKT和NF-κB表达增强, 启膈散、沙参麦冬汤和通幽汤3方对其有不同程度的下调作用, 说明EGF-PI3K信号转导增强促进食管癌细胞增殖, 抑制PI3K介导的生长信号传导是食管癌证方作用机制之一. 本研究首次发现EGF增强食管癌细胞PLC-γ1和PI3K介导的生长信号转导和启膈散、沙参麦冬汤和通幽汤的抑制作用, 揭示信号通路对食管癌细胞生长的重要作用, 以及食管癌证方抑制细胞生长的作用机制, 为食管癌治疗提供了关键信号转导通路和靶点, 也为深入研究中医药抗癌的分子机制提供了参考思路.
食管癌属中医噎膈病的范畴, 临床上分为痰气交阻、津亏热结、瘀血内结和气虚阳微4种证型, 分别用启膈散、沙参麦冬汤、通幽汤和补气运脾汤四方治疗.
管冬元, 副教授, 上海中医药大学基础医学院实验中医学教研室
单一生长因子在食管癌病变中的信号转导机制以及食管癌中医证方的干预作用尚有待深入研究.
文献报道食管癌病变与PI3K/AKT-NF-κB信号通路激活相关, 该通路已作为癌症治疗的靶标.
本研究首次发现EGF增强食管癌细胞PLC-γ1和PI3K介导的生长信号转导和启膈散、沙参麦冬汤和通幽汤的抑制作用, 揭示信号通路对食管癌细胞生长的重要作用, 以及食管癌证方抑制细胞生长的作用机制.
本研究以高分化的食管鳞癌EC9706细胞系为研究对象, 观察了启膈散、沙参麦冬汤、通幽汤和补气运脾汤对EGF刺激的食管癌细胞生长的作用, 进而通过对PLC-γ1和PI3K介导的两条生长信号通路的检测, 探讨了证方影响食管癌细胞生长信号转导的机制.
本文创新性好, 设计严整, 实验方法实用合理, 结果对临床有一定的指导意义.
编辑: 李军亮 电编:何基才
| 6. | Sambrook J, Russell DW. Molecular Cloning: A Laboratory Manual. New York: Cold Spring Harbor Laboratory Press 1989; 852-898. |
| 7. | Zhang YX, Kong CZ. [The role of mitogen-activated protein kinase cascades in inhibition of proliferation in human prostate carcinoma cells by raloxifene: an in vitro experiment]. Zhonghua Yixue Zazhi. 2008;88:271-275. [PubMed] |
| 8. | Ozawa S, Kitagawa Y, Kitajima M. [Molecular alterations in esophageal cancer]. Nippon Geka Gakkai Zasshi. 2002;103:457-462. [PubMed] |
| 9. | Pomerantz RG, Grandis JR. The epidermal growth factor receptor signaling network in head and neck carcinogenesis and implications for targeted therapy. Semin Oncol. 2004;31:734-743. [PubMed] [DOI] |
| 10. | Thompson DM, Gill GN. The EGF receptor: structure, regulation and potential role in malignancy. Cancer Surv. 1985;4:767-788. [PubMed] |
| 11. | Wells A. EGF receptor. Int J Biochem Cell Biol. 1999;31:637-643. [PubMed] [DOI] |
| 12. | Jorissen RN, Walker F, Pouliot N, Garrett TP, Ward CW, Burgess AW. Epidermal growth factor receptor: mechanisms of activation and signalling. Exp Cell Res. 2003;284:31-53. [PubMed] [DOI] |
| 13. | Tabernero J, Macarulla T, Ramos FJ, Baselga J. Novel targeted therapies in the treatment of gastric and esophageal cancer. Ann Oncol. 2005;16:1740-1748. [PubMed] [DOI] |
| 14. | Di Fiore PP, Scita G. Eps8 in the midst of GTPases. Int J Biochem Cell Biol. 2002;34:1178-1183. [PubMed] [DOI] |
| 15. | Confalonieri S, Di Fiore PP. The Eps15 homology (EH) domain. FEBS Lett. 2002;513:24-29. [PubMed] [DOI] |
| 17. | Salcini AE, Chen H, Iannolo G, De Camilli P, Di Fiore PP. Epidermal growth factor pathway substrate 15, Eps15. Int J Biochem Cell Biol. 1999;31:805-809. [PubMed] [DOI] |
| 18. | Mukaida H, Toi M, Hirai T, Yamashita Y, Toge T. Clinical significance of the expression of epidermal growth factor and its receptor in esophageal cancer. Cancer. 1991;68:142-148. [PubMed] [DOI] |
| 19. | Andl CD, Mizushima T, Nakagawa H, Oyama K, Harada H, Chruma K, Herlyn M, Rustgi AK. Epidermal growth factor receptor mediates increased cell proliferation, migration, and aggregation in esophageal keratinocytes in vitro and in vivo. J Biol Chem. 2003;278:1824-1830. [PubMed] [DOI] |
| 20. | Hanawa M, Suzuki S, Dobashi Y, Yamane T, Kono K, Enomoto N, Ooi A. EGFR protein overexpression and gene amplification in squamous cell carcinomas of the esophagus. Int J Cancer. 2006;118:1173-1180. [PubMed] [DOI] |
| 21. | Tanaka S, Sugimachi K, Kawaguchi H, Saeki H, Ohno S, Wands JR. Grb7 signal transduction protein mediates metastatic progression of esophageal carcinoma. J Cell Physiol. 2000;183:411-415. [PubMed] [DOI] |
| 22. | Janmaat ML, Gallegos-Ruiz MI, Rodriguez JA, Meijer GA, Vervenne WL, Richel DJ, Van Groeningen C, Giaccone G. Predictive factors for outcome in a phase II study of gefitinib in second-line treatment of advanced esophageal cancer patients. J Clin Oncol. 2006;24:1612-1619. [PubMed] [DOI] |
| 23. | Thomas SM, Coppelli FM, Wells A, Gooding WE, Song J, Kassis J, Drenning SD, Grandis JR. Epidermal growth factor receptor-stimulated activation of phospholipase Cgamma-1 promotes invasion of head and neck squamous cell carcinoma. Cancer Res. 2003;63:5629-5635. [PubMed] |
| 24. | Ryan PD, Chabner BA. On receptor inhibitors and chemotherapy. Clin Cancer Res. 2000;6:4607-4609. [PubMed] |
| 26. | Ramsden JJ. MARCKS: a case of molecular exaptation? Int J Biochem Cell Biol. 2000;32:475-479. [PubMed] [DOI] |
| 27. | Ohmori S, Sakai N, Shirai Y, Yamamoto H, Miyamoto E, Shimizu N, Saito N. Importance of protein kinase C targeting for the phosphorylation of its substrate, myristoylated alanine-rich C-kinase substrate. J Biol Chem. 2000;275:26449-26457. [PubMed] [DOI] |
| 28. | Thelen M, Rosen A, Nairn AC, Aderem A. Regulation by phosphorylation of reversible association of a myristoylated protein kinase C substrate with the plasma membrane. Nature. 1991;351:320-322. [PubMed] [DOI] |
| 29. | Noble ME, Endicott JA, Johnson LN. Protein kinase inhibitors: insights into drug design from structure. Science. 2004;303:1800-1805. [PubMed] [DOI] |
| 30. | Di Fiore PP, Segatto O, Taylor WG, Aaronson SA, Pierce JH. EGF receptor and erbB-2 tyrosine kinase domains confer cell specificity for mitogenic signaling. Science. 1990;248:79-83. [PubMed] [DOI] |
| 31. | Meisenhelder J, Suh PG, Rhee SG, Hunter T. Phospholipase C-gamma is a substrate for the PDGF and EGF receptor protein-tyrosine kinases in vivo and in vitro. Cell. 1989;57:1109-1122. [PubMed] |
| 32. | Duronio V. The life of a cell: apoptosis regulation by the PI3K/PKB pathway. Biochem J. 2008;415:333-344. [PubMed] [DOI] |
| 33. | Zhao L, Vogt PK. Class I PI3K in oncogenic cellular transformation. Oncogene. 2008;27:5486-5496. [PubMed] [DOI] |
| 34. | Ali K, Bilancio A, Thomas M, Pearce W, Gilfillan AM, Tkaczyk C, Kuehn N, Gray A, Giddings J, Peskett E. Essential role for the p110delta phosphoinositide 3-kinase in the allergic response. Nature. 2004;431:1007-1011. [PubMed] [DOI] |
| 35. | Sheng S, Qiao M, Pardee AB. Metastasis and AKT activation. J Cell Physiol. 2009;218:451-454. [PubMed] [DOI] |
| 36. | Bader AG, Kang S, Zhao L, Vogt PK. Oncogenic PI3K deregulates transcription and translation. Nat Rev Cancer. 2005;5:921-929. [PubMed] [DOI] |
| 37. | Tian F, Zang WD, Hou WH, Liu HT, Xue LX. Nuclear factor-kB signaling pathway constitutively activated in esophageal squamous cell carcinoma cell lines and inhibition of growth of cells by small interfering RNA. Acta Biochim Biophys Sin (Shanghai). 2006;38:318-326. [PubMed] [DOI] |
| 38. | Li B, Tsao SW, Li YY, Wang X, Ling MT, Wong YC, He QY, Cheung AL. Id-1 promotes tumorigenicity and metastasis of human esophageal cancer cells through activation of PI3K/AKT signaling pathway. Int J Cancer. 2009;125:2576-2585. [PubMed] [DOI] |
| 39. | Li B, Cheung PY, Wang X, Tsao SW, Ling MT, Wong YC, Cheung AL. Id-1 activation of PI3K/Akt/NFkappaB signaling pathway and its significance in promoting survival of esophageal cancer cells. Carcinogenesis. 2007;28:2313-2320. [PubMed] [DOI] |
| 40. | Chen YL, Law PY, Loh HH. Inhibition of PI3K/Akt signaling: an emerging paradigm for targeted cancer therapy. Curr Med Chem Anticancer Agents. 2005;5:575-589. [PubMed] [DOI] |
| 41. | Lu Y, Wang H, Mills GB. Targeting PI3K-AKT pathway for cancer therapy. Rev Clin Exp Hematol. 2003;7:205-228. [PubMed] |
| 42. | Nguyen DM, Chen GA, Reddy R, Tsai W, Schrump WD, Cole G Jr, Schrump DS. Potentiation of paclitaxel cytotoxicity in lung and esophageal cancer cells by pharmacologic inhibition of the phosphoinositide 3-kinase/protein kinase B (Akt)-mediated signaling pathway. J Thorac Cardiovasc Surg. 2004;127:365-375. [PubMed] [DOI] |