修回日期: 2010-07-30
接受日期: 2010-08-10
在线出版日期: 2010-09-08
目的: 观察互隔交链孢霉素(ALT)对NIH3T3细胞中蛋白激酶A(PKA)活化的影响.
方法: 15 μmol/L ALT作用NIH3T3细胞1 h, 同时设烷化剂甲璜酸甲酯(MMS)为阳性对照, 二甲亚枫(DMSO)为溶剂对照组. 用免疫荧光、免疫细胞化学染色法和Western blot方法检测磷酸化PKA催化亚基表达水平. 利用PKA特异性抑制剂10 μmol/L H89预处理细胞1 h, 再进行15 μmol/L ALT刺激实验.
结果: 免疫荧光结果表明, ALT作用后, PKA活化、催化亚基转位入核. 免疫细胞化学结果和Western blot显示, 与溶剂对照组和H89预处理组相比较, ALT组、MMS组的细胞中磷酸化PKA催化亚基水平明显增加(1.85±0.22, 1.97±0.05 vs 1.43±0.08, 1.63±0.13, P<0.05; 0.89±0.09, 0.96±0.10 vs 0.13±0.07, 0.39±0.10, P<0.05).
结论: 一定浓度的ALT能够诱导NIH3T3细胞中PKA活化, H89能降低ALT对PKA的活化作用.
引文著录: 刘康栋, 王瑾瑾, 赵继敏, 杨洪艳, 黄幼田, 郑智敏, 董子明. 互隔交链孢霉素活化NIH3T3细胞中蛋白激酶A. 世界华人消化杂志 2010; 18(25): 2637-2641
Revised: July 30, 2010
Accepted: August 10, 2010
Published online: September 8, 2010
AIM: To observe the effects of altenuene (ALT) on the level of active catalytic subunit of protein kinase A (PKA) in NIH3T3 cells.
METHODS: NIH3T3 cells were cultured for 1 h in the medium containing 15 μmol/L ALT, 0.8 mmol/L methylmethane sulfonate (MMS, positive control) or dimethyl sulfoxide (DMSO, vehicle control). The level of active catalytic subunit of PKA in NIH3T3 cells was detected by immunofluorescence, immunocytochemistry and Western blot. NIH3T3 cells were then pretreated with H89 and used to detect the effects of ALT on PKA activation.
RESULTS: After NIH3T3 cells were exposed to ALT, the level of active catalytic subunit of PKA was significantly increased compared with cells treated with DMSO (1.85 ± 0.22 vs 1.43 ± 0.08, P < 0.05). The level of active catalytic subunit of PKA was also increased in the positive control group (1.97 ± 0.05 vs 1.43 ± 0.08, P < 0.05). Pretreatment with H89 decreased ALT-induced elevation of the level of active catalytic subunit of PKA (1.63 ± 0.13 vs 1.85 ± 0.22, P < 0.05).
CONCLUSION: ALT increases the level of active catalytic subunit of PKA in NIH3T3 cells. Pre-treatment with H89 decreases ALT-induced elevation of the level of active catalytic subunit of PKA.
- Citation: Liu KD, Wang JJ, Zhao JM, Yang HY, Huang YT, Zheng ZM, Dong ZM. Altenuene activates protein kinase A in NIH3T3 cells. Shijie Huaren Xiaohua Zazhi 2010; 18(25): 2637-2641
- URL: https://www.wjgnet.com/1009-3079/full/v18/i25/2637.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i25.2637
互隔交链孢霉(alternaria alternata)广泛分布于泥土和植物里, 包括谷物、蔬菜、水果[1], 是污染食物和饲料最普遍的真菌之一. 也是食管癌高发区河南省林县粮食中的优势污染菌. 互隔交链孢霉能产生多种二级代谢产物, 目前从食物中检出的有: 互隔交链孢酚(alternariol, AOH)、交链孢酚单甲醚(alternariol methyl ether, AME)、互隔交链孢霉素(altenuene, ALT)等7类. 互隔交链孢霉在肿瘤病因学中的作用也被大多数学者所认同, 目前对AOH、AME的研究较多且其致癌性已经得以证实[2,3], 但对ALT在肿瘤发生中的作用尚不清楚. 蛋白激酶A(protein kinase A, PKA)是Kerbs等在继Setherland等提出cAMP第二信使的概念之后, 在研究糖原的代谢过程中发现的, 是普遍存在与动物体内的一种蛋白激酶. PKA全酶是由两个调节亚基和两个催化亚基组成的四聚体, 当cAMP和PKA的调节亚基结合后, 将使催化亚基从四聚体中解离出来, 而成为有活性的催化亚基部分, 活化的催化亚基部分可以转位进入核内发挥其作用. PKA作为细胞中调节生长、代谢、增殖的一个重要信号分子, 研究证实, PKA在肿瘤细胞中的作用, 与PKA的亚型、细胞的类型以及刺激信号的不同而呈现不同的表现[4-6], 其机制有待于深入研究. 本研究拟观察ALT对小鼠胚胎成纤维细胞(NIH3T3)中PKA活化的影响, 为进一步研究ALT异常激活信号通路及在肿瘤发生作用奠定基础.
NIH3T3细胞, 即小鼠胚胎成纤维细胞, 购自中国细胞库武汉典藏中心. RPMI 1640培养液(美国Gibco公司); ALT, 二甲亚砜(DMSO)(美国Sigma公司); PKA特异性抑制剂H89(上海康成生物公司); SABC免疫组织化学试剂盒(武汉博士德公司); 磷酸化PKA催化亚基抗体(美国Santa Cruz公司); CO2培养箱(德国Heraeus公司); 垂直电泳槽(北京六一实验仪器厂); 半干式电转移槽, 凝胶电泳成像分析系统(美国Bio-Rad公司).
1.2.1 药物的配置: ALT、H89均采用DMSO溶解, 配置成20 mmol/L储存液. 使用时用培养液稀释成相应的工作浓度.
1.2.2 细胞培养: NIH3T3细胞在培养瓶中用含100 mL/L胎牛血清的RPMI 1640培养液, 37 ℃、50 mL/L CO2饱和湿润空气的孵育箱中常规培养. 待细胞汇合至70%-80%时, 对用于免疫荧光和免疫细胞化学实验的细胞, 先用胰酶消化、制备成单细胞悬液, 然后接种于装有小盖玻片的6孔培养板中. 待爬片上的细胞汇合至70%-80%时, 换新鲜培养基, 进行分组和药物处理; 对用于做Western blot实验的细胞, 换新鲜培养基, 进行实验分组和药物处理.
1.2.3 实验分组: (1)ALT和MMS处理组: 用15 μmol/L ALT或0.8 mmol/L MMS作用NIH3T3细胞1 h; (2)H89预处理组: 用10 μmol/L H89预处理NIH3T3细胞1 h, 再用15 μmol/L ALT作用细胞1 h; (3)溶剂对照组: 0.75 mL/L DMSO作用NIH3T3细胞1 h.
1.2.4 免疫荧光细胞化学染色: 用磷酸盐缓冲液(phosphate buffered sodium, PBS)清洗长有细胞的盖玻片3次, 轻轻吸去残余液体; 室温用40 g/L多聚甲醛固定细胞30 min, PBS冲洗细胞, 5 min 3次; 用含有2 g/L Triton X-100的PBS穿透固定细胞10 min, PBS冲洗细胞, 5 min 3次; 用含50 g/L牛血清白蛋白(bovine serum albumin, BSA)的封闭液封闭非特异性结合位点, 室温静置30 min; 用含50 g/L BSA的PBS稀释一抗(1:200), 吸净盖玻片的液体, 勿洗, 将稀释后的一抗滴加至盖玻片上, 湿盒中静置, 4 ℃过夜, PBS代替一抗作阴性对照. PBS冲洗细胞, 5 min 3次; 用含50 g/L BSA的PBS稀释FITC标记的二抗, 滴加二抗稀释液至玻片上, 室温避光孵育1 h, 荧光显微镜观察.
1.2.5 免疫细胞化学染色: 细胞经药物处理后, 操作方法同免疫荧光细胞化学, 直至滴加HRP标记的二抗后室温孵育60 min; PBS冲洗细胞, 5 min 3次; DAB染色, 室温避光孵育5-15 min; 去离子水冲洗, 用滤纸吸去过量液体, 并防止干燥; 在显微镜下观察显色情况, 显色充分后及时将标本置于蒸馏水中终止反应; 滴加一小滴香柏油, 盖上盖玻片, 避免气泡产生, 用小片滤纸置于盖玻片边缘吸去过量的封片剂, 封片. 光镜下观察细胞免疫反应, 拍照. 用Biosens Digital Imaging System灰度扫描软件随机选取5个视野, 扫描视野中每一个细胞的灰度值, 再求其平均灰度值, 为PKA的磷酸化水平.
1.2.6 Western blot检测: 收集各组细胞样本, 预冷PBS洗涤2次, 离心, 弃上清, 细胞中加入裂解液, 吹打混匀, 置于冰上, 每3 min震摇1次, 作用30 min. 4 ℃以12 000 g离心15 min, 取上清液, 按考马斯亮蓝蛋白测定试剂盒测总蛋白含量, -80 ℃储存备用. 制备含120 g/L丙烯酰胺的分离胶和50 g/L丙烯酰胺的浓缩胶, 以进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳. 取待测的样品各50 μg及蛋白分子质量标准上样, 电泳. 采用半干式电转移法, 将蛋白转移至二氟化树脂膜上. 室温封闭(50 g/L BSA)3 h, 加入PKA一抗(1:200), 4 ℃过夜. 三羟甲基氨基甲烷(trisamine, Tris)缓冲液洗膜3次, 加入辣根酶标记的二抗, 室温孵育1 h. Tris缓冲液洗膜后, 化学发光法显色, 暗室压片成像. 每次实验至少重复3次. 结果以Gel-Doc图像分析软件扫描各条带灰度值并分析结果.
统计学处理 统计学多样本均数采用单因素方差分析, SPSS10.0统计软件处理. 以P<0.05为差异有统计学意义.
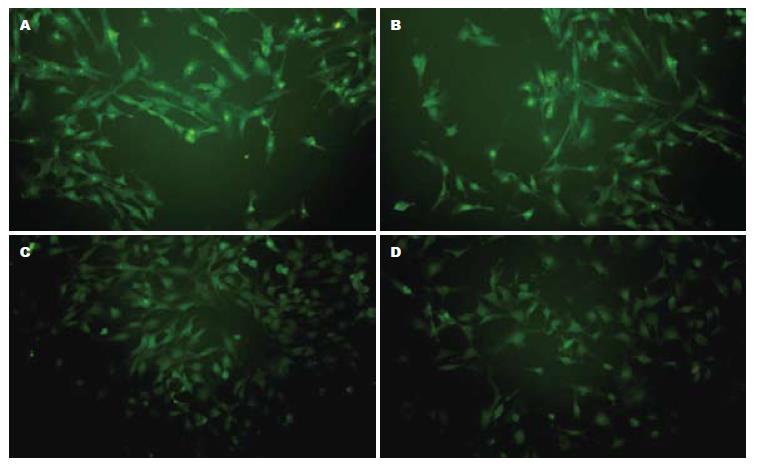
15 μmol/L ALT作用NIH3T3细胞1 h, 免疫荧光的结果表明, 阳性对照MMS和ALT刺激细胞后, 细胞核内出现明显的绿色荧光, 而H89预处理组胞核内绿色荧光明显减少, 溶剂对照细胞核内没有明显的荧光, 仅仅其背景呈现均匀的绿色(图1). 说明ALT和MMS均能够使PKA催化亚基被活化并发生核转位.
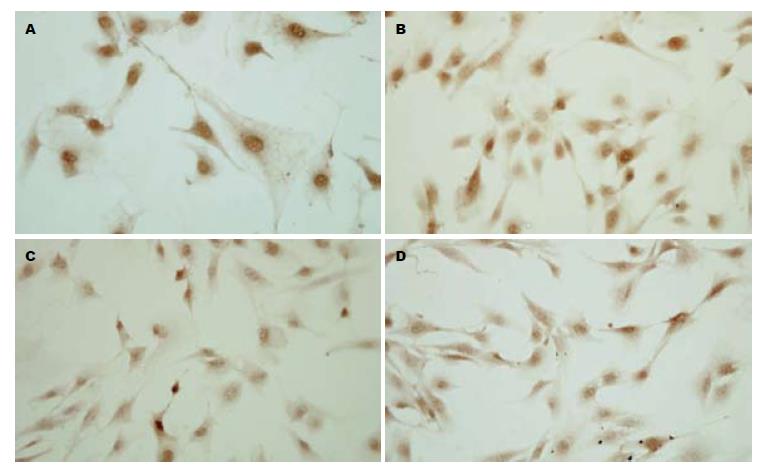
免疫细胞化学结果表明, MMS处理的阳性对照组和ALT处理的实验组细胞核呈明显的棕黄色着色. 在MMS处理组与ALT处理组中细胞阳性区平均灰度值明显高于溶剂对照组(P<0.05), 而在H89预处理过后再加入ALT后, 阳性区平均灰度值下降(P<0.05, 图2, 表1).
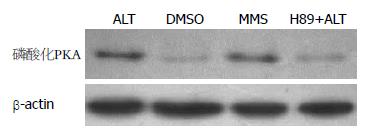
以15 μmol/L的ALT作用NIH3T3细胞1 h后, 用磷酸化的PKA催化亚基的特异性抗体检测PKA的活化水平, Western blot结果表明, 15 μmol/L的ALT能够强烈激活了PKA, 与溶剂对照组相比有明显差异(P<0.05), 与阳性对照MMS组结果一致. 应用PKA特异性抑制剂H89预处理细胞, 再观察ALT对PKA催化亚基的活性的影响. 结果显示, H89明显抑制ALT诱导的PKA的活化, H89预处理组活化PKA水平低于ALT直接处理组(P<0.05, 图3, 表2).
河南省林州地区是我国食管癌的高发区, 该地区粮食污染情况流行病学调查表明, 互隔交链孢霉菌是污染林州地区粮食的优势菌[7]. AOH、AME和ALT是该菌最重要的代谢产物. AOH作为一种DNA诱变剂, 可以引起DNA损伤, 具有明确的致突变性[8], Brugger等[9]的研究结果表明10 μmol/L和更高浓度的AOH能够引起哺乳动物细胞中HPRT基因和TK基因位点突变, 并且表现为剂量依赖性. ALT的细胞毒理学实验表明, ALT对NIH/3T3细胞有毒性作用, 可抑制细胞增殖并诱导G2/M期细胞阻滞[10].
肿瘤的发生与发展是一个多因素作用、多基因参与、经过多个阶段才最终形成的、极其复杂的生物学现象. 在一个多细胞生物体中, 每种类型的细胞增殖都必须服从整体的利益. 肿瘤细胞的恶性生长是调控细胞增殖的信号转导机制失调所导致, 是一些与细胞生长、分裂和增殖有关的如Wnt、PKA、PI3K、Notch信号传递通路处于异常活化状态[11-14]. 研究细胞信号转导通路将对癌症的发病学与治疗提供一条新的思路. 霉菌毒素是如何激活细胞信号通路引起细胞恶性转化是目前探明其致癌机制的重要途径.
蛋白激酶A(protein kinase A, PKA)又称cAMP依赖的蛋白激酶(cyclic AMP-dependent protein kinase), 是由2个调节亚基(regulatory subunit, R)和2个催化亚基(catalytic subunit, C/CAT)构成的异四聚体. 依据其氨基酸顺序的差异, 调节亚基可以分为类型Ⅰ(RⅠ)和类型Ⅱ(RⅡ)[15]. 当PKA的调节亚基和cAMP结合后将导致催化亚基从四聚体中解离出来, 而成为有活性的催化亚基部分, 活化的催化亚基部分在胞质中, 磷酸化相应的底物; 催化亚基还可以直接转位进入核内, 调节一些转录因子的活性, 如CREB家族. PKA通过对底物蛋白激酶或转录因子的磷酸化反应, 调节基因的转录或翻译, 从而介导细胞对外界刺激的反应, 与细胞内的多种生理和病理功能有关, 并且在细胞的增殖和转化中具有重要的作用. Yokozaki等[5]对人直肠癌、胃癌和神经母细胞瘤肺癌细胞株研究中也发现, PKARIα亚基能有效地促进肿瘤细胞的生长, PKARI反义寡核甘酸能消除PKARIα亚基对肿瘤细胞生长的刺激. PKA活化后, 催化亚基能够进入胞核中, 使下游底物磷酸化, CREB是PKA催化亚基最主要的底物, 磷酸化的CREB启动目的基因的转录, 在维持细胞存活方面有重要作用[16,17], 新的研究表明, PKA通路的抑制表现出抗乳腺癌细胞[18]和前列腺癌细胞[19]增殖的作用并且PKA参与肿瘤细胞耐药[20].
本实验研究了ALT对细胞中PKA影响, 免疫荧光、免疫细胞化学和免疫印迹结果发现经15 μmol/L浓度的ALT刺激NIH3T3细胞1 h后, 细胞内活化的PKA催化亚基水平明显升高, 且定位于核内, 这是PKA发挥促进基因表达作用的前提. 用PKA特异性的阻断剂H89预处理细胞, 观察到H89抑制了ALT诱导的PKA的活化, 进一步肯定了ALT对PKA信号通路的激活作用. 本研究中还发现, 与对照组相比, H89预处理组的PKA磷酸化水平并没有降到对照组水平, 说明H89并没完全阻断ALT对PKA的激活作用, 推测这可能与阻断剂H89的药物浓度和作用时间有一定的关系. 总之, 本文为深入研究ALT激活细胞信号通路致癌机制奠定了基础.
我国是食管癌高发地区, 涉及10余个省市, 覆盖近两亿人口, 严重威胁我国人民的生命健康. 尤其在河南的林州地区, 食管癌的发生率和死亡率均较高. 在河南省食管癌病因学方面研究发现互隔交链孢霉在食管癌的发生中有重要作用. AOH、AME、ALT从互隔交链孢霉中分离出的重要产物, 目前对AOH、AME的研究较多且其致癌性已经得以证实, 但对ALT在肿瘤发生中的作用的研究还知之甚少.
李淳, 副教授, 汕头大学医学院病理教研室
细胞信号转导通路在维持细胞正常的增殖、分化、凋亡方面具有重要作用, 信号通路的异常激活, 促进了细胞异常的存活, 在肿瘤的发生中具有重要作用. 从信号转导这一新的角度来研究细胞恶性转化的机制, 认识到针对信号转导异常环节进行信号转导干预治疗是探索肿瘤预防和治疗的新思路, 对于认识肿瘤病因及发病学具有重要意义.
AOH, AME和ALT是互隔交链孢霉菌最重要的代谢产物. Brugger等的研究结果表明10 μmol/L和更高 浓度 的 AOH能够引起 哺乳动物细胞中HPRT基因和TK基因位点突变, 这可能是其致癌机制之一.
本研究发现经一定浓度ALT刺激过后的NIH3T3细胞内PKA催化亚基水平有所增高, 而加入PKA抑制剂H89预处理过后, PKA催化亚基水平下降, 提示可以通过使用调节信号通路等干预措施逆转致癌物对细胞的不良影响.
互隔交链孢霉素(altenuene, ALT): 是互隔交链孢霉的二级代谢产物, 互隔交链孢霉存在于谷物、蔬菜、水果中, 是食管癌高发区河南省林县粮食中的优势污染菌.
本实验设计合理, 实验结果对食管癌的病因及发病机制的研究有很好的意义.
编辑: 曹丽鸥 电编:何基才
| 1. | Lehmann L, Wagner J, Metzler M. Estrogenic and clastogenic potential of the mycotoxin alternariol in cultured mammalian cells. Food Chem Toxicol. 2006;44:398-408. [PubMed] [DOI] |
| 2. | Liu GT, Qian YZ, Zhang P, Dong WH, Qi YM, Guo HT. Etiological role of Alternaria alternata in human esophageal cancer. Chin Med J (Engl). 1992;105:394-400. [PubMed] |
| 3. | 单 杰, 董 伟华, 单 英, 刘 桂亭, 苗 健, 马 涧泉, 陈 惠君. 交链孢酚(AOH)处理人胎食管上皮组织c-myc癌基因, Rb抗癌 基因扩增的研究. 中国病理生理杂志. 1996;12:175-177. |
| 5. | Yokozaki H, Budillon A, Tortora G, Meissner S, Beaucage SL, Miki K, Cho-Chung YS. An antisense oligodeoxynucleotide that depletes RI alpha subunit of cyclic AMP-dependent protein kinase induces growth inhibition in human cancer cells. Cancer Res. 1993;53:868-872. [PubMed] |
| 6. | Mantovani G, Lania AG, Bondioni S, Peverelli E, Pedroni C, Ferrero S, Pellegrini C, Vicentini L, Arnaldi G, Bosari S. Different expression of protein kinase A (PKA) regulatory subunits in cortisol-secreting adrenocortical tumors: relationship with cell proliferation. Exp Cell Res. 2008;314:123-130. [PubMed] [DOI] |
| 7. | 杨 胜利, 董 子明, 裴 留成, 丁 兰平, 张 慧芳, 宋 爱云, 宫 亚欧, 刘 桂亭, 薛 乐勋. 河南林县居民粮食中互隔交链孢霉及其 毒素污染和人群暴露状况研究. 癌变·畸变·突变. 2007;19:44-46. |
| 8. | Schrader TJ, Cherry W, Soper K, Langlois I. Further examination of the effects of nitrosylation on Alternaria alternata mycotoxin mutagenicity in vitro. Mutat Res. 2006;606:61-71. [PubMed] |
| 9. | Brugger EM, Wagner J, Schumacher DM, Koch K, Podlech J, Metzler M, Lehmann L. Mutagenicity of the mycotoxin alternariol in cultured mammalian cells. Toxicol Lett. 2006;164:221-230. [PubMed] [DOI] |
| 12. | Naviglio S, Caraglia M, Abbruzzese A, Chiosi E, Di Gesto D, Marra M, Romano M, Sorrentino A, Sorvillo L, Spina A. Protein kinase A as a biological target in cancer therapy. Expert Opin Ther Targets. 2009;13:83-92. [PubMed] [DOI] |
| 15. | Taylor SS, Kim C, Vigil D, Haste NM, Yang J, Wu J, Anand GS. Dynamics of signaling by PKA. Biochim Biophys Acta. 2005;1754:25-37. [PubMed] |
| 16. | Sandoval S, Pigazzi M, Sakamoto KM. CREB: A Key Regulator of Normal and Neoplastic Hematopoiesis. Adv Hematol. 2009;2009:634292. [PubMed] |
| 17. | Shukla A, Bosenberg MW, MacPherson MB, Butnor KJ, Heintz NH, Pass HI, Carbone M, Testa JR, Mossman BT. Activated cAMP response element binding protein is overexpressed in human mesotheliomas and inhibits apoptosis. Am J Pathol. 2009;175:2197-2206. [PubMed] [DOI] |
| 18. | Gao N, Hibi Y, Cueno ME, Asamitsu K, Okamoto T. A-kinase interacting protein 1 (AKIP1) acts as a molecular determinant of the role of PKA in NF-{kappa}B signaling. J Biol Chem. 2010;. [PubMed] |
| 19. | Desiniotis A, Schäfer G, Klocker H, Eder IE. Enhanced antiproliferative and proapoptotic effects on prostate cancer cells by simultaneously inhibiting androgen receptor and cAMP-dependent protein kinase A. Int J Cancer. 2010;126:775-789. [PubMed] [DOI] |
| 20. | Gu L, Lau SK, Loera S, Somlo G, Kane SE. Protein kinase A activation confers resistance to trastuzumab in human breast cancer cell lines. Clin Cancer Res. 2009;15:7196-7206. [PubMed] [DOI] |