修回日期: 2010-07-03
接受日期: 2010-07-05
在线出版日期: 2010-08-08
目的: 探讨JAK/STAT3和MAPK/ERK两条信号转导通路在分析和推断CagA调控胃泌素基因表达机制中的作用.
方法: 将含caga基因的表达质粒和幽门螺杆菌(CagA阳性)株分别转染和感染胃癌细胞AGS和SGC-7901, 同时用siRNA阻断jak2及erk1基因的表达, 48 h后通过RT-PCR、Western blot检测细胞中有无CagA蛋白表达, 实时荧光定量PCR检测胃泌素的变化.
结果: 转染组和感染组中均检测到CagA蛋白的表达, 与对照相比胃泌素mRNA在转染组分别增加了26.58倍(AGS细胞)和5.59倍(SGC-7901), 在感染组分别增加1.88倍(AGS细胞)和8.59倍(SGC-7901), 表达量显著增高; siRNA干扰JAK2和ERK1后胃泌素mRNA表达量降低, 在转染组JAK2干扰抑制率分别为81.50%(AGS)和99.00%(SGC-7901), ERK1干扰抑制率分别75.55%(AGS)和97.00%(SCG-7901). 在感染组JAK2干扰抑制率分别为55.30%(AGS)和90.00%(SGC-7901), ERK1干扰抑制率分别38.30%(AGS)和92.00%(SGC-7901). 结果显示ERK/MAPK和JAK/STAT通路阻断, 抑制了CagA调控的胃泌素mRNA表达.
结论: CagA上调胃泌素基因的表达, siRNA干扰阻断JAK/STAT和ERK/MAPK这两个信号通路, 可以抑制CagA对胃泌素mRNA表达的调控.
引文著录: 谢渊, 周建奖, 赵艳, 汪苏, 陈娴. JAK2、ERK1干扰对幽门螺杆菌毒素相关蛋白CagA调控胃泌素基因表达的影响. 世界华人消化杂志 2010; 18(22): 2317-2321
Revised: July 3, 2010
Accepted: July 5, 2010
Published online: August 8, 2010
AIM: To investigate the role of the JAK/STAT3 and ERK/MAPK signaling pathways in Helicobacter pylori (H. pylori) cytotoxin-associated protein A (CagA)-induced gastrin up-regulation in gastric cancer cell lines AGS and SGC-7901 by knocking down the JAK2 and ERK1 genes by RNA interference.
METHODS: AGS and SGC-7901 cells were transfected with a CagA expression vector (transfection group) or infected with CagA-positive H. pylori (infection group). Meanwhile, the JAK2 and ERK1 genes were knocked down by RNA interference. At 48 h postinfection, the expression of CagA protein and gastrin mRNA was detected by Western blot and real-time fluorescence quantitative PCR, respectively.
RESULTS: CagA protein was highly expressed in cells either transfected with the CagA expression vector or infected with H. pylori. Compared with control cells, gastrin mRNA levels increased 26.58 times (AGS) and 5.59 times (SGC-7901) in the transfection group and 1.88 times (AGS) and 8.59 times (SGC-7901) in the infection group, respectively. After JAK2 and ERK1 knockdown, gastrin mRNA levels significantly decreased in the two groups (P < 0.05). In the transfection group, the reduced rates of gastrin mRNA expression were 81.50% (AGS) and 99.00% (SGC-7901) after JAK2 knockdown and 75.55% (AGS) and 97.00% (SCG-7901) after ERK1 knockdown. In the infection group, the reduced rates of gastrin mRNA expression were 55.30% (AGS) and 90.00% (SGC-7901) after JAK2 knockdown and 38.30% (AGS) and 92.00% (SCG-7901) after ERK1 knockdown. These data suggest that the blockage of the ERK/MAPK and JAK/STAT signaling pathways can inhibit CagA-induced gastrin up-regulation.
CONCLUSION: CagA up-regulates the expression of the gastrin gene. The blockage of the JAK/STAT3 and ERK/MAPK signaling pathway by RNA interference can inhibit CagA-mediated gastrin up-regulation.
- Citation: Xie Y, Zhou JJ, Zhao Y, Wang S, Chen X. RNA interference-mediated knockdown of JAK2 and ERK1 inhibits Helicobacter pylori CagA-induced gastrin up-regulation in gastric cancer cell lines AGS and SGC-7901. Shijie Huaren Xiaohua Zazhi 2010; 18(22): 2317-2321
- URL: https://www.wjgnet.com/1009-3079/full/v18/i22/2317.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i22.2317
幽门螺杆菌(Helicobacter pylori, H. pylori)是一种可长期定植于人类胃黏膜的革兰氏阴性螺旋形微需氧菌, 在全世界范围内感染率超过50%[1], 流行病学和动物实验证实H. pylori慢性感染是导致胃癌的重要危险因素[2], 其中H. pylori分泌的细胞毒素相关基因A蛋白(cytotoxin-associated gene A, CagA)与胃癌的发生密切相关[3]. 磷酸化CagA能结合并激活含有SH2结构域的酪氨酸磷酸酶SHP-2, 主要介导JAK-STAT及ERK/MAPK激酶等信号通路, 在诱导细胞成活、增生及分化中起重要作用[4]. 胃泌素是一种多肽激素, 由胃泌素分泌细胞(G细胞)产生, 主要具有刺激胃酸分泌和对胃肠黏膜的营养作用. 有学者研究认为, 胃癌细胞能自分泌胃泌素, 作为生长因子与癌细胞上胃泌素受体结合, 形成自分泌环, 在胃癌的发生中起重要作用[5]. Wang等[6]研究发现胃泌素水平和血清CagA阳性率在大多数胃癌患者中明显增加, 高胃泌素血症与H. pylori感染在胃癌的发生、发展过程中有协同作用, 但两者的相互关系如何, CagA蛋白能否调控胃泌素基因的表达, 以及通过什么途径对胃泌素基因表达进行调控并未阐明. 本研究通过小干扰RNA阻断JAK2和ERK1的表达, 探讨JAK/STAT3和MAPK/ERK两条信号转导通路在分析和推断CagA调控胃泌素基因表达机制中的作用.
人胃癌细胞AGS、SGC-7901(中科院上海细胞库), H. pylori标准菌株NCTC1163(中国幽门螺杆菌菌株管理与保藏中心馈赠), 真核表达质粒(含CagA基因)pcDNA3.1Zeo(-)/cagA7由本室构建. 改良型RPMI 1640(HyClone公司), 胎牛血清(四季青公司); Lipofectamine 2000(Invitrogen公司), JAK2和ERK1特异小干扰RNA(上海吉玛公司), 兔多抗CagA、HRP标记二抗(Santa Cruz公司), HRP-GAPDH(康成公司), Real time RT-PCR所用试剂及探针(Applied Biosystems); β-actin Taqman探针(基康公司); 普通化学试剂(Sigma公司). PVDF膜、ECL-Plus发光试剂、高效显影胶片(Amersham公司). 7300型荧光定量PCR仪(Applied Biosystems公司), 双垂直电泳槽DYCZ-24D(北京六一仪器厂).
1.2.1 转染组: AGS、SGC-7901细胞用改良型RPMI 1640培养基(100 mL/L胎牛血清、青霉素100 kU/L, 链霉素100 kU/L), 50 mL/L CO2、37 ℃恒温培养. 用0.25%胰酶消化对数生长期的细胞, 计数并按每孔4×105个细胞接种于6孔培养板, 置37 ℃培养箱培养至细胞生长达到90%-95%的融合率后进行细胞共转染. 实验组分为: 空白对照组(细胞未作任何处理)、空载转染组[pcDNA3.1 Zeo(-)/空载体]、CagA转染组[pcDNA3.1 Zeo(-)/cagA7]、JAK2干扰组[pcDNA3.1 Zeo(-)/cagA7+ JAK2 siRNA]和ERK1干扰组[pcDNA3.1 Zeo(-)/cagA7+ERK1 siRNA]. 质粒: siRNA: LipofectamineTM 2000为1:1:3, 将培养板放入37 ℃、50 mL/L CO2培养箱, 6 h后更换成含100 mL/L胎牛血清培养基, 继续培养48 h后收集细胞.
1.2.2 感染组: AGS、SGC-7901细胞培养及siRNA转染同转染组. 实验分组: 空白对照组(细胞未作任何处理)、CagA感染组(H. pylori感染)、JAK2干扰组(H. pylori+JAK2 siRNA)和ERK1干扰组(H. pylori+ERK1 siRNA). H. pylori标准株NCTC11637接种于哥伦比亚血琼脂板, 50 mL/L O2、100 mL/L CO2、850 mL/L N2、37 ℃培养3 d后, 悬于PBS中, 用麦式比浊法调细菌浓度达15×108个/mL. 细胞用siRNA转染42 h后按细菌与细胞的比例100:1感染细胞, 6 h后收集细胞.
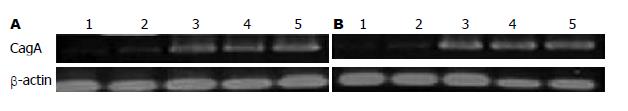
1.2.3 RT-PCR检测转染组CagA表达: 根据文献设计CagA引物. 上游引物: 5'-AAT ACA CCA ACG CCT CCA AG-3'; 下游引物: 5'-TTG TTG CCG CTT TTG CTC TC-3'. PCR产物以1.5%琼脂糖凝胶电泳, 约397 bp条带即为目的DNA.
1.2.4 细胞总蛋白提取及Western blot检测转染组及感染组CagA蛋白: 细胞经PBS洗涤后用细胞裂解液(含PMSF和复合蛋白酶抑制剂)裂解, 定量后分装, -20 ℃保存备用; Western blot检测CagA蛋白表达.
1.2.5 细胞总RNA提取及RT-Real time PCR检测胃泌素表达水平: 采用TRIzol一步法提取细胞总RNA, 逆转录合成cDNA, 运用TaqMan Universal PCR Master Mix试剂盒在7300型实时荧光定量PCR仪上检测Gastrin和β-actin基因表达. 以 SDS1.4软件进行荧光收集和分析ΔΔCt值及RQ(relative quantity)值, RQ = 2-ΔΔCt. 分析实验结果时以β-actin为内对照, 计算Gastrin扩增水平, 然后将其与对照组的结果进行比较并计算Gastrin的相对表达水平. 采用SPSS11.5统计软件进行方差分析, 组间比较采用t检验.
通过检测发现在所设立的5个组内, 均可见到CagA表达, 但明显的转染了pcDNA3.1ZEO(-)/CagA7的组中, cagA高表达(图1).
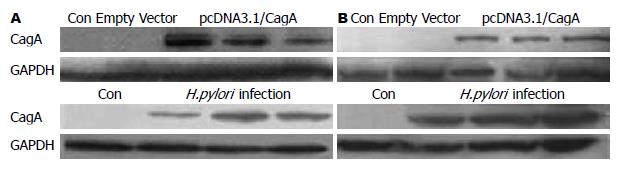
pcDNA3.1Zeo(-)/cagA7和小干扰RNA转染后, 在AGS和SGC-7901细胞中均检测到CagA蛋白表达, 说明pcDNA3.1Zeo(-)/cagA7转染成功; H.pylori感染SGC-7901和AGS细胞后Western blot检测CagA蛋白, 结果显示有CagA蛋白存在, 说明发生了CagA蛋白转位(图2).
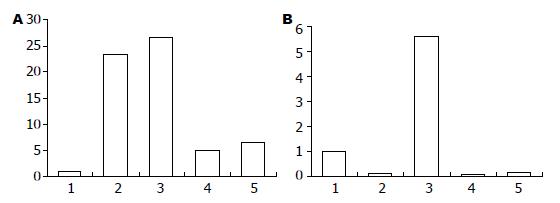
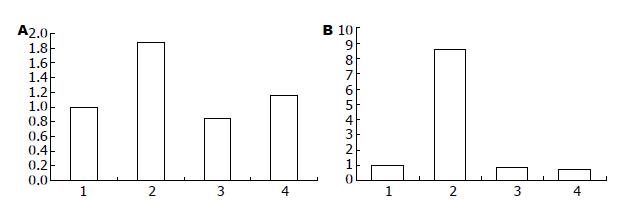
在AGS和SGC-7901细胞中pcDNA3.1Zeo(-)/CagA7转染组胃泌素mRNA表达水平较空白对照组均显著增高(P<0.05), 分别增加了26.58倍和5.59倍, 表明CagA蛋白能上调胃泌素基因的表达. 在JAK2和ERK1干扰后这种上调作用被抑制, 胃泌素基因的表达量显著降低(P<0.05), JAK2干扰组抑制率分别为81.5%(AGS)和99%(SGC-7901), ERK1干扰组抑制率分别75.55%(AGS)和97%(SCG-7901)(表1, 图3).
| 分组 | Ct of gastrin | Ct of β-actin | 2-ΔΔCt | ||||
| AGS | SCG-7901 | AGS | SCG-7901 | AGS | SCG-7901 | ||
| 空白对照组 | 28.10±1.32 | 21.94±2.02 | 22.28±0.49 | 1.00 | 1.00 | ||
| pcDNA3.1+empty vecter组 | 29.21±1.62 | 27.70±3.77 | 21.92±0.46 | 18.92±6.10 | 23.22 | 0.13 | |
| pcDNA3.1/CagA组 | 28.38±1.50 | 23.19±2.99 | 21.28±1.24 | 19.96±1.97 | 26.58a | 5.59a | |
| pcDNA3.1/CagA+ siRNA/JAK2组 | 30.82±3.06 | 29.07±5.02 | 21.30±1.55 | 19.33±5.32 | 4.94 | 0.07 | |
| pcDNA3.1/CagA+ siRNA/ERK1组 | 31.91±2.17 | 25.96±5.18 | 22.79±1.30 | 17.53±4.18 | 6.51 | 0.16 | |
H. pylori感染和RNAi转染AGS细胞, 其胃泌素mRNA表达水平较空白对照组略有增高, 为1.88倍, 经JAK2和ERK1干扰后这种上调作用被抑制, 抑制率为分别为55.3%和38.3%. 在SGC-7901细胞胃泌素mRNA表达水平较空白对照组显著增高(P<0.05), 增加了约8.59倍, JAK2和ERK1干扰后这种上调作用被抑制, 胃泌素基因的表达量显著降低(P<0.05), 抑制率为分别为90%和92%(表2, 图4).
| 分组 | Ct of gastrin | Ct of β-actin | 2-ΔΔCt | |||
| AGS | SCG-7901 | AGS | SCG-7901 | AGS | SCG-7901 | |
| 空白对照组 | 21.05±1.15 | 30.86±1.03 | 14.74±1.08 | 21.89±5.26 | 1.00 | 1.00 |
| CagA+H. pylori组 | 21.37±0.18 | 29.59±0.63 | 15.97±2.54 | 23.72±1.53 | 1.88a | 8.59a |
| CagA+H. pylori+ siRNA/JAK2组 | 25.71±5.06 | 26.11±2.89 | 19.16±4.05 | 16.89±3.83 | 0.84 | 0.84 |
| CagA+H. pylori+ siRNA/ERK1组 | 25.27±5.25 | 25.12±2.90 | 19.17±5.88 | 15.64±1.74 | 1.16 | 0.70 |
胃癌的形成是一个多因素、多步骤的复杂的过程, H. pylori感染、宿主遗传因素和环境因素起共同作用, 而H. pylori感染可能为先导, 从慢性活动性胃炎、慢性萎缩性胃炎、肠上皮化生和不典型性增生最终发展成胃癌的癌变模式已被国内外大多数学者承认, 但H. pylori感染导致胃癌发生的确切机制尚不清楚. H. pylori具有多种毒力因子, 其中CagA是主要的毒力因子, 可能是胃癌发生的始动因素. CagA表达于60%-70%的H. pylori菌株中, 西方国家的研究结果认为, CagA阳性H. pylori为毒力菌株, 与消化性溃疡、萎缩性胃炎、胃癌发生密切相关. 研究证实CagA通过Ⅳ型分泌系统进入宿主细胞后, 其C端的酪氨酸位点发生了酪氨酸磷酸化, 磷酸化的CagA可以特异地与SHP-2结合并激活其磷酸酶的活性, 这种相互作用激活了多个信号级联反应[7]. Bronte-Tinkew等[8]已证实H. pylori CagA蛋白在体内外能激活STAT3信号通路, 转录因子STAT是JAK直接底物, 他可将细胞因子信号从受体JAK直接传到核内, 调节特定基因表达, 促进胃癌的发生. Mimuro等[9]证明H. pylori分泌的CagA转位到胃上皮细胞与接头蛋白Grb2相互作用, 激活ERK/MAPK信号通路, 从而促进了细胞分散和增生, 这是胃癌发生中的重要进程之一. 故而我们推测JAK/STAT3和ERK/MAPK两条细胞内信号转导通路在CagA影响H. pylori与胃黏膜细胞相互作用, 诱导胃癌发生发展过程中起到了非常重要的作用. Ferrand等[10]研究发现, 在高表达前胃泌素和甘氨酸胃泌素转基因大鼠, 其结肠上皮发生瘤变时可测到明显上调的STAT3, 表明STAT3信号转导途径可能参与了胃泌素诱导结肠上皮细胞癌变过程. Konturek等[11]研究发现胃癌患者中CagA的血清阳性率及胃泌素水平显著增高, 多因素分析发现仅有CagA蛋白及胃泌素浓度可能在胃癌的形成中起重要作用.
为探讨CagA与胃泌素在诱导胃癌发生发展之间的可能关系, 我们建立了CagA基因转染人胃癌细胞和CagA+H. pylori感染人胃癌细胞两个平行的实验组, 然后用Real time PCR检测胃泌素基因表达, 结果发现无论是在转染组或感染组胃泌素基因的表达水平较对照均显著上调(P<0.05), 表明H.pylori的CagA蛋白确实具有调控胃泌素基因表达的作用. 通过RNAi靶向关键信号蛋白JAK2和ERK1阻断JAK/STAT3和ERK/MAPK两条细胞内信号转导通路后检测胃泌素基因表达, 发现CagA对胃泌素基因表达的上调作用均在一定程度上被抑制, 提示JAK/STAT3和ERK/MAPK两条细胞内信号转导通路参与了CagA对胃泌素的调控. 本研究与课题组采用化学阻断剂阻断JAK/STAT3和ERK/MAPK两条细胞内信号转导通路获得相似性结果[12], 故而我们推测H. pylori CagA阳性菌株感染后, 在CagA蛋白的协同作用下, 使胃泌素基因表达增强, 胃泌素作为生长因子, 与细胞表面的CCK-B受体结合, 形成自分泌环, 促进胃溃疡乃至胃癌的形成. JAK/STAT和ERK/MAPK这两个信号通路参与CagA蛋白对胃泌素基因表达的调控, 通过siRNA干扰阻断这两个信号通路可有效抑制CagA上调胃泌素mRNA的表达, 实验研究结果可为探讨H. pylori感染导致胃癌发生发展的机制及治疗提供新的理论依据.
幽门螺杆菌(H. pylori)慢性感染是导致胃癌的重要危险因素, CagA是H. pylori主要的毒力因子, 可能是胃癌发生的始动因素. 胃泌素(gastrin, GAS)由GAS分泌细胞(G细胞)产生, 具有刺激胃酸分泌和对胃肠黏膜的营养作用, 同时GAS也是一种促生长因子, 可刺激胃肠道黏膜增殖, 促进胃癌的发生. 前期研究成果中认为胃癌细胞自分泌的GAS(产生自分泌环)是胃癌发生发展的重要因素. CagA蛋白是否调控GAS基因表达以及通过何种信号通路发挥作用尚不清楚.
高国全, 教授, 中山大学中山医学院生化系
了解高胃泌素血症与H. pylori感染在胃癌的发生、发展过程中的协同作用机制, 明确H. pylori感染诱发胃癌的机制, 是目前研究的热点.
本课题组前期已研究用pcDNA 3.1ZEO(-)/CagA7瞬时转染和H.pylori感染AGS细胞和SGC-7901细胞; 然后用化学阻断剂阻断JAK/STAT3和ERK/MAPK两条细胞内信号转导通路, 分析和推断CagA调控胃泌素基因表达的作用机制.
本研究首次将H. pylori的毒力蛋白CagA与胃癌细胞自分泌胃泌素假说联系起来, 设想CagA蛋白可能通过JAK/STAT3和ERK/MAPK两条细胞内信号转导通路调控胃泌素基因的表达.
本文主要探讨了CagA调控胃泌素产生和分泌的机制, 选题尚可, 设计基本合理, 有一定参考价值.
编辑: 李军亮 电编:何基才
| 1. | 张 莉, 付 晓霞. 幽门螺杆菌感染研究现状. 中国煤炭工业医学杂志. 2009;12:1327-1328. |
| 4. | Qu CK. Role of the SHP-2 tyrosine phosphatase in cytokine-induced signaling and cellular response. Biochim Biophys Acta. 2002;1592:297-301. [PubMed] [DOI] |
| 5. | Zhou JJ, Chen ML, Zhang QZ. Human gastric tissues simultaneously express the classical and alternative splicing cholecystokinin-B/gastrin receptors. Receptors Channel. 2004;10:1-4. [PubMed] |
| 6. | Wang TC, Dangler CA, Chen D, Goldenring JR, Koh T, Raychowdhury R, Coffey RJ, Ito S, Varro A, Dockray GJ. Synergistic interaction between hypergastrinemia and Helicobacter infection in a mouse model of gastric cancer. Gastroenterology. 2000;118:36-47. [PubMed] [DOI] |
| 8. | Bronte-Tinkew DM, Terebiznik M, Franco A, Ang M, Ahn D, Mimuro H, Sasakawa C, Ropeleski MJ, Peek RM Jr, Jones NL. Helicobacter pylori cytotoxin-associated gene A activates the signal transducer and activator of transcription 3 pathway in vitro and in vivo. Cancer Res. 2009;69:632-639. [PubMed] [DOI] |
| 9. | Mimuro H, Suzuki T, Tanaka J, Asahi M, Haas R, Sasakawa C. Grb2 is a key mediator of helicobacter pylori CagA protein activities. Mol Cell. 2002;10:745-755. [PubMed] [DOI] |
| 10. | Ferrand A, Bertrand C, Portolan G, Cui G, Carlson J, Pradayrol L, Fourmy D, Dufresne M, Wang TC, Seva C. Signaling pathways associated with colonic mucosa hyperproliferation in mice overexpressing gastrin precursors. Cancer Res. 2005;65:2770-2777. [PubMed] [DOI] |
| 11. | Konturek PC, Konturek SJ, Pierzchalski P, Bielański W, Duda A, Marlicz K, Starzyńska T, Hahn EG. Cancerogenesis in Helicobacter pylori infected stomach--role of growth factors, apoptosis and cyclooxygenases. Med Sci Monit. 2001;7:1092-1107. [PubMed] |
| 12. | 汪 苏, 周 建奖, 单 可人, 赵 燕, 谢 渊. 幽门螺杆菌毒素相关蛋白CagA上调胃泌素基因表达. 中华微生物学和免疫学 杂志. 2009;29:976-980. |