修回日期: 2010-06-19
接受日期: 2010-06-28
在线出版日期: 2010-07-28
目的: 研究短发夹RNA(shRNA)真核表达载体在人脐静脉内皮细胞(HUVECs)中对IKKα基因表达的抑制作用.
方法: 设计3条靶向IKKα的shRNA, 经退火成互补双链, 克隆到质粒 pGPU6/GFP/Neo中构建重组载体, 经酶切鉴定和测序确认后, 将3个重组表达载体转染到HUVECs, 利用Western blot检测并筛选出抑制效果最好的重组表达载体.
结果: 通过酶切鉴定和测序分析, 靶向IKKα的3个pGPU6/GFP/Neo-shRNA重组载体构建成功, Western blot结果显示pGPU6/GFP/Neo-shRNA3可有效抑制高糖诱导HUVECs中IKKα基因的表达, 抑制率为70.6%.
结论: 靶向IKKα基因的shRNA真核表达载体构建成功, 且能有效抑制HUVECs中IKKα基因的表达.
引文著录: 刘丽丽, 陈芳辉, 李宙雪, 占日新, 高艳, 陈元红, 李丽, 黄起壬. IKKα基因靶向shRNA真核表达载体的构建及表达. 世界华人消化杂志 2010; 18(21): 2253-2257
Revised: June 19, 2010
Accepted: June 28, 2010
Published online: July 28, 2010
AIM: To construct eukaryotic expressing plasmids of short hairpin RNA (shRNA) targeting the IKKα gene and to evaluate their inhibitory effect on IKKα expression in human umbilical vein endothelial cells (HUVECs).
METHODS: Three pairs of complementary shRNA oligonucleotides targeting the IKKα gene were designed, synthesized, annealed and inserted into the pGPU6/GFP/Neo plasmid. The recombinant plasmids were identified by restriction enzyme analysis and sequence analysis. The inhibitory effect of recombinant plasmids on IKKα expression in HUVECs was detected by Western blot.
RESULTS: After restriction enzyme analysis and sequence analysis, three eukaryotic expression plasmids of shRNA targeting the IKKα gene were successfully constructed. Western blot analysis showed that pGPU6/GFP/Neo-shRNA3 reduced IKKα expression by 70.6% in HUVECs induced with high glucose.
CONCLUSION: Three eukaryotic expression plasmids of shRNA targeting the IKKα gene are successfully constructed. These recombinant plasmids can efficiently inhibit IKKα expression in HUVECs.
- Citation: Liu LL, Chen FH, Li ZX, Zhan RX, Gao Y, Chen YH, Li L, Huang QR. Construction and expression of eukaryotic expression plasmids of shRNA targeting the IKKα gene. Shijie Huaren Xiaohua Zazhi 2010; 18(21): 2253-2257
- URL: https://www.wjgnet.com/1009-3079/full/v18/i21/2253.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i21.2253
核因子-κB(nuclear factor kappaB, NF-κB)信号转导通路调控多种促炎因子、趋化因子、黏附分子等基因的表达, 在胰岛素抵抗的发生发展过程中起着重要作用[1].
IκB激酶(IκB kinase, 又称IKK复合体)是NF-κB信号转导通路中的一个关键激酶, 直接影响NF-κB的活性而调控相关基因的转录表达[2]. 目前的研究证实血管内皮细胞也是胰岛素敏感细胞, 胰岛素抵抗在高糖、氧化应激等条件下与血管内皮功能紊乱密切相关[3]. 近年来, IKKα介导的NF-κB信号转导通路参与血管内皮胰岛素抵抗的分子机制研究是近期本领域关注的热点. RNA干扰(RNA interference, RNAi)是通过RNaseⅢ内切酶Dicer的作用产生与靶基因的转录产物mRNA同源互补的21-23 bp双链RNA(称为小干扰RNA, short interfering RNA, siRNA), 介导其互补同源mRNA序列的特异性降解, 从而使靶基因沉默、相应功能表型缺失[4]. 我们构建了针对IKKα基因的短发夹环状小干扰RNA(short hairpin RNA, shRNA)重组载体, 并将其转染到人脐静脉内皮细胞(human umbilical vein endothelial cells, HUVECs)进行真核表达; 进一步观察转染后细胞IKKα蛋白表达情况, 筛选出抑制效果最好的重组表达载体, 从而为研究IKKα, NF-κB信号转导通路与血管内皮胰岛素抵抗之间的相互关系奠定实验基础.
pGPU6/GFP/Neo质粒购自上海吉玛公司; 脂质体LipofectamineTM2000、DMEM培养基干粉购自Invitrogen公司; 限制性内切酶BbsⅠ和BamHⅠ购自美国NEB公司; 限制性内切酶PstⅠ购自Promega公司; T4连接酶和DNA Marker购自TaKaRa公司; 质粒小提试剂盒和DNA胶回收纯化试剂盒购自Qiagen公司; Top10感受态细胞购自天根公司; 人脐静脉内皮细胞株购自ATCC; 特级胎牛血清购自杭州四季青生物制品公司; Kanamycin购自Sigma公司; IKKα多克隆抗体及HRP标记的二抗购自Santa Cruz公司; BCA蛋白浓度测定试剂盒购自碧云天生物技术公司; DNA由上海生工合成.
1.2.1 siRNA靶序列的设计与shRNA的合成: 利用GenBank检索IKKα基因核苷酸序列(NM_001278), 根据siRNA设计原则, 通过Ambion公司在线设计软件辅助设计, 使用Blast将选定的序列进行同源性分析, 最后选出三条片段作为IKKα基因干扰片段.设计shRNA模板中的loop结构选用了TTCAAGAGA以避免形成终止信号, shRNA的转录终止序列采用TTTTTT结构. 正义链模板的5'端添加了CACC, 与BbsⅠ酶切后形成的黏端互补; 反义链模板的5'端添加了GATC与BamHⅠ酶切后形成的黏端互补; 如果siRNA的第一个碱基不是G, 则在CACC后补加个G(表1). 将合成的发夹结构寡核苷酸单链用无核酶水稀释为浓度3 g/L. 按照以下体系退火得到shRNA模板: 1 μL正义链、1 μL反义链、48 μL TE(pH8.0)共50 μL在PCR仪上按照如下程序进行退火处理: 90 ℃ 4 min, 80 ℃ 4 min, 75 ℃ 4 min, 70 ℃ 10 min, 37 ℃ 20 min, 10 ℃ 40 min, 4 ℃保存. 将退火后产物稀释20倍, 终浓度为6 mg/L用于连接反应.
| 起始位置 | shRNA序列 | |
| shRNA1 | 185-205 bp | 正义链5'CACCGTCTTGTCGCCTAGAGCTATTCAAGAGATAGCTCTAGGCGACAAGACTTTTTTG3' |
| 反义链5'GATCCAAAAAAGTCTTGTCGCCTAGAGCTATCTCTTGAATAGCTCTAGGCGACAAGAC3' | ||
| shRNA2 | 1 110-1 130 bp | 正义链5'CACCGAACTTCTTTCAGAGACAGTTCAAGAGACTGTCTCTGAAAGAAGTTCTTTTTTG3' |
| 反义链5'GATCCAAAAAAGAACTTCTTTCAGAGACAGTCTCTTGAACTGTCTCTGAAAGAAGTTC3' | ||
| shRNA3 | 1 510-1 530 bp | 正义链5'CACCGCATTCAGCTTGACTTGGATTCAAGAGATCCAAGTCAAGCTGAATGCTTTTTTG3' |
| 反义链5'GATCCAAAAAAGCATTCAGCTTGACTTGGATCTCTTGAATCCAAGTCAAGCTGAATGC3' |
1.2.2 酶切和连接反应: pGPU6/GFP/Neo载体按如下反应体系进行双酶切: 10×NEBbuffer 2 μL、100×BSA 0.2 μL、 pGPU6/GFP/Neo 1 μg、BbsⅠ 0.8 μL、BamHⅠ 0.5 μL、加无核酶水至20 μL, 37 ℃酶切3 h. 1% TAE琼脂糖凝胶电泳, 使用凝胶回收试剂盒回收. 将退火片段与经双酶切后的载体按摩尔比4:1进行连接反应, 置16 ℃连接16 h.
1.2.3 重组质粒的转化、筛选和鉴定: 将连接产物接种于Top10感受态细胞进行转化, 涂布到3 mL含Kanamycin(终浓度为30 mg/L)的LB固体培养基平板上, 37 ℃恒温箱培养过夜, 各挑取2个菌落, 接种到含30 mg/L Kanamycin的LB液体培养基中摇菌过夜. 用质粒小提试剂盒抽提质粒, 所得质粒用PstⅠ和BamHⅠ分别酶切鉴定. 得到的重组质粒分别命名pGPU6/GFP/Neo-shRNA1, 2, 3. 将初步鉴定证实的细菌扩增培养, 取1 mL菌液送北京三博远志进行测序鉴定. 测序引物为T7, 测序方向为正向测序.
1.2.4 重组质粒转染HUVECs: 取处于对数生长期的HUVECs, 用胰酶消化后使用不含血清和抗生素的正常培养基重悬为2×105个/mL-8×105个/mL后, 接种至6孔培养板上, 待细胞生长至70%-80%汇合时进行转染. LipofectamineTM2000试剂和质粒比例为10 μL:4 μg, 按照转染试剂说明书进行转染, 6 h后换成高糖培养基(33 mmol/L). 转染24 h时荧光显微镜下观察HUVECs绿色荧光的表达情况, 观察质粒的转染效率. 实验分为空白对照组(Control组)、高糖组(HG组)、空质粒转染组(HG+Non-silencing shRNA组)和重组质粒转染组(HG+RNAi 1, 2, 3组), 每组重复3次.
1.2.5 Western blot检测IKKα基因的蛋白表达: 转染48 h后提取HUVECs总蛋白, BCA试剂盒检测蛋白浓度. 上样量为20 μg, 经SDS-PAGE电泳后, PVDF膜印迹, 室温封闭2 h, 加入IKKα一抗孵育过夜, 辣根过氧化物酶HRP标记的二抗孵育2 h, ECL化学发光显色, X-光片显影、定影. ImageTool图像分析软件测定各条带灰度值, 以β-actin为内参照进行数据分析, 计算抑制率.
统计学处理 采用SPSS16.0统计分析软件对实验数据进行单因素方差分析, 实验数据比较采用t检验, 所得数值均以mean±SD表示, P<0.05为差异有显著性.
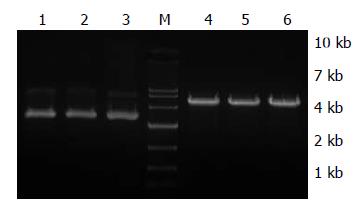
pGPU6/GFP/Neo的BamHⅠ和BbsⅠ酶切位点之间是PstⅠ的酶切位点, 插入目的基因干扰片段之后, PstⅠ酶切位点被取代, 故不能被PstⅠ所酶切, 但可被BamHⅠ酶切开, 条带在5 100 bp左右(图1).
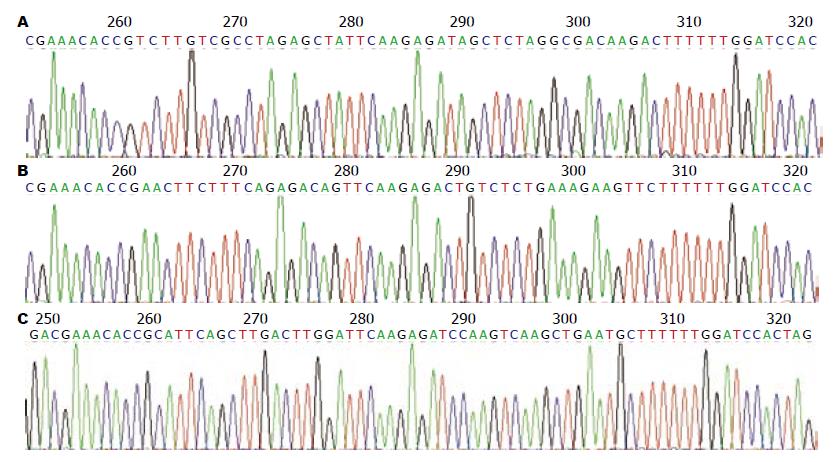
3个重组质粒测序鉴定shRNA编码序列与设计的片段完全一致, 表明载体构建成功(图2).
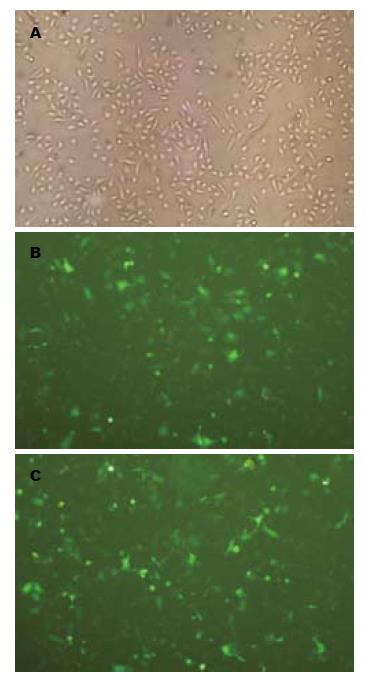
可见光显微镜(×100)下观察, 正常HUVECs贴壁生长, 呈铺路石状镶嵌排列, 细胞为梭形或扁平多角形.重组质粒转染入HUVECs 24 h后, 荧光显微镜(×100)下观察, 较多细胞发出绿色荧光, 转染效率约为65%-70%(图3).
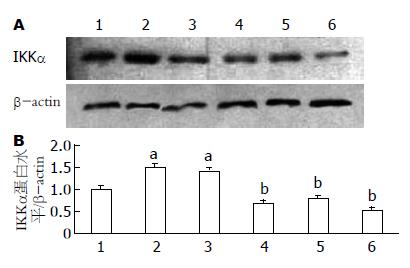
Western blot检测结果显示, 以β-actin为内参照, IKKα在正常HUVECs中呈基础表达(图4). 高糖培养48 h后, HUVECs中IKKα蛋白表达量上升, 与对照组相比具有显著性差异(P<0.05); 而转入了IKKα shRNA后用高糖培养基培养48 h, RNAi 1, 2, 3组HUVECs中IKKα蛋白表达较HG组和Non-silencing shRNA组均显著性降低(P<0.01); 但HG组和Non-silencing shRNA组间相比无明显差异, 说明转入IKKα shRNA后, 部分抑制了IKKα基因的表达, 使IKKα蛋白在高糖诱导下转录生成减少. RNAi 1, 2, 3组与HG组比较IKKα表达抑制率分别为54.1%、46.7%、70.6%.
血管内皮胰岛素抵抗发生发展的机制一直是近年来研究的热点, 目前大量的研究表明, NF-κB信号转导通路的激活在血管内皮胰岛素抵抗的分子机制中发挥重要作用[5,6]. IKK复合体是NF-κB信号转导途径中的关键激酶, 包括IKKα、IKKβ和IKKγ/NEMO, 可使IκB蛋白磷酸化, 从而活化NF-κB, 调控多种基因的转录[7,8].
Yuan等[9]对小鼠IKKβ基因缺失和胰岛素抵抗研究发现, 遗传性肥胖和高脂喂养的小鼠因IKKβ基因缺失杂合体而避免了胰岛素抵抗的发生. 目前人们的研究主要集中在IKKβ与胰岛素抵抗的相关性, 而对于IKKα在胰岛素抵抗发病机制方面的研究较少. Li等[10]在用肿瘤坏死因子-α(tumor necrosis factor α, TNF-α)刺激小鼠胚胎成纤维细胞研究中发现, IKKα与IKKβ及IKKγ/NEMO一样对于NF-κB依赖性靶基因的表达起着重要作用. Yamamoto等[11]发现IKKα具有组蛋白H3激酶的特性, 在细胞因子的刺激下, IKKα可进入细胞核使组蛋白H3磷酸化, 激活NF-κB介导的基因表达. 因此, 研究IKKα介导的NF-κB信号转导通路对于探讨血管内皮胰岛素抵抗的分子机制有重要意义.
RNAi技术是近年来发展起来的一种基因沉默技术, 是进行基因治疗有力可靠的研究工具[12,13]. 与传统的反义核酸技术和基因敲除技术相比, RNAi技术具有快速、高效、便于操作等优点, 被广泛应用到基因功能研究、基因表达调控机制研究等热门领域[14,15]. 因此, 本实验采用RNAi技术, 利用GenBank检索IKKα基因核苷酸序列, 根据siRNA设计原则, 使用Blast将选定的序列进行同源性分析, 最后选出三条片段作为IKKα基因干扰片段, 然后将真核表达载体pGPU6/GFP/Neo与针对IKKα基因设计的shRNA相连接, 构建重组体. 在成功构建了重组载体pGPU6/GFP/Neo-shRNA后, 通过脂质体转染法导入HUVECs, 进行Western blot检测, 筛选出了沉默效果最好的重组表达载体, 为进一步研究IKKα介导血管内皮细胞胰岛素抵抗的机制奠定了基础.
胰岛素抵抗是指组织和细胞对于正常剂量的胰岛素敏感性和(或)反应性减弱而产生的一种病理状态, 目前人们对于胰岛素抵抗机制的研究主要集中在肝脏、骨骼肌、脂肪组织等胰岛素敏感的传统靶器官, 然而血管内皮胰岛素抵抗日益受到人们的关注, 但其机制尚未完全清楚.
徐庆, 教授, 桂林医学院药理教研室.
IKKα是IκB激酶的一个催化亚基, 调控着NF-κB信号转导通路. 近年来研究发现, IKKα介导的NF-κB信号转导通路对于探讨血管内皮胰岛素抵抗机制有着重要意义.
有研究报道IKKα不仅可调控NF-κB信号转导通路, 而且可直接进入细胞核内, 并有可能参与基因的调控.
本研究利用RNA干扰技术, 通过构建shRNA真核表达载体, 下调人脐静脉内皮细胞系中IKKα的表达, 并利用Western blot方法进行验证.
本研究构建并筛选出的shRNA重组质粒对IKKα基因有明显沉默效应, 为进一步研究NF-κB信号转导通路与血管内皮胰岛素抵抗奠定基础.
本文实验设计合理, 结果真实可信, 并具有一定的创新性.
编辑: 李军亮 电编:吴鹏朕
| 1. | Ruan H, Pownall HJ. The adipocyte IKK/NFkappaB pathway: a therapeutic target for insulin resistance. Curr Opin Investig Drugs. 2009;10:346-352. [PubMed] |
| 2. | O'Neill LA, Kaltschmidt C. NF-kappa B: a crucial transcription factor for glial and neuronal cell function. Trends Neurosci. 1997;20:252-258. [DOI] |
| 3. | Richards OC, Raines SM, Attie AD. The role of blood vessels, endothelial cells, and vascular pericytes in insulin secretion and peripheral insulin action. Endocr Rev. 2010;31:343-363. [PubMed] [DOI] |
| 5. | Austin RL, Rune A, Bouzakri K, Zierath JR, Krook A. siRNA-mediated reduction of inhibitor of nuclear factor-kappaB kinase prevents tumor necrosis factor-alpha-induced insulin resistance in human skeletal muscle. Diabetes. 2008;57:2066-2073. [PubMed] [DOI] |
| 6. | Shoelson SE, Lee J, Yuan M. Inflammation and the IKK beta/I kappa B/NF-kappa B axis in obesity- and diet-induced insulin resistance. Int J Obes Relat Metab Disord. 2003;27 Suppl 3:S49-S52. [PubMed] [DOI] |
| 7. | Tedgui A, Mallat Z. Anti-inflammatory mechanisms in the vascular wall. Circ Res. 2001;88:877-887. [PubMed] [DOI] |
| 8. | Häcker H, Karin M. Regulation and function of IKK and IKK-related kinases. Sci STKE. 2006;2006:re13. |
| 9. | Yuan M, Konstantopoulos N, Lee J, Hansen L, Li ZW, Karin M, Shoelson SE. Reversal of obesity- and diet-induced insulin resistance with salicylates or targeted disruption of Ikkbeta. Science. 2001;293:1673-1677. [PubMed] [DOI] |
| 10. | Li X, Massa PE, Hanidu A, Peet GW, Aro P, Savitt A, Mische S, Li J, Marcu KB. IKKalpha, IKKbeta, and NEMO/IKKgamma are each required for the NF-kappa B-mediated inflammatory response program. J Biol Chem. 2002;277:45129-45140. [PubMed] [DOI] |
| 11. | Yamamoto Y, Verma UN, Prajapati S, Kwak YT, Gaynor RB. Histone H3 phosphorylation by IKK-alpha is critical for cytokine-induced gene expression. Nature. 2003;423:655-659. [PubMed] [DOI] |
| 12. | Kim D, Rossi J. RNAi mechanisms and applications. Biotechniques. 2008;44:613-616. [PubMed] [DOI] |
| 13. | Shrivastava N, Srivastava A. RNA interference: an emerging generation of biologicals. Biotechnol J. 2008;3:339-353. [PubMed] [DOI] |
| 15. | Nencioni A, Sandy P, Dillon C, Kissler S, Blume-Jensen P, Van Parijs L. RNA interference for the identification of disease-associated genes. Curr Opin Mol Ther. 2004;6:136-140. [PubMed] |