修回日期: 2010-06-06
接受日期: 2010-06-22
在线出版日期: 2010-07-08
目的: 观察并比较两种方法抑制RhoA的表达对细胞外基质成分, 如Ⅰ型胶原、透明质酸以及层粘连蛋白合成的影响, 为肝纤维化的基因治疗寻求新的途径.
方法: 设计并合成针对RhoA相同靶点的反义寡核苷酸和小干扰RNA, 分别转染肝星状细胞株HSC-T6, 逆转录PCR技术检测细胞中RhoA和Ⅰ型胶原mRNA的表达; Western blot检测细胞中RhoA蛋白质的表达; ELISA检测培养上清中透明质酸(HA)、层黏蛋白(LN)及PIIIP的含量.
结果: 转染RhoA反义寡核苷酸和小干扰RNA Rat1质粒后, HSC-T6中RhoA mRNA的表达分别由0.892±0.051、0.937±0.044降为0.113±0.024、0.212±0.042; 蛋白质表达水平均明显下调; 细胞内Ⅰ型胶原mRNA的表达分别由0.709±0.067、0.695±0.087降为0.436±0.037、0.201±0.044; 细胞外基质成分如HA、LN及PIIIP的表达水平明显下降. 两者相比, 小干扰RNA具有更强的生物学效应.
结论: 靶向抑制细胞因子RhoA的表达可明显减少肝星状细胞株HSC-T6细胞外基质的合成, 且小干扰RNA的效果明显优于针对同一靶点的反义寡核苷酸, 显示RNAi技术应用于肝纤维化基因治疗的良好前景.
引文著录: 王波, 王艳芬, 田德安, 王天才. 抑制细胞因子RhoA的表达对肝星状细胞株HSC-T6胶原分泌的影响. 世界华人消化杂志 2010; 18(19): 2038-2042
Revised: June 6, 2010
Accepted: June 22, 2010
Published online: July 8, 2010
AIM: To investigate the effects of antisense oligodeoxynucleotide- and small-interfering RNA (siRNA)-mediated inhibition of RhoA expression on the secretion of extracellular matrix components in hepatic stellate cells (HSC-T6) to seek new approaches for the treatment of liver fibrosis.
METHODS: An antisense oligodeoxynucleotide and a siRNA targeting the RhoA gene were designed and transfected into HSC-T6 cells. The expression of RhoA and type I collagen (Col I) mRNAs in HSC-T6 cells was detected by RT-PCR. The expression of RhoA protein in HSC-T6 cells was detected by Western blot. The contents of hyaluronic acid, laminin and PIIIP in cell supernatants were measured by ELISA.
RESULTS: After antisense oligodeoxynucleotide or siRNA transfection, the relative expression levels of RhoA mRNA were changed from 0.892 ± 0.051 and 0.937 ± 0.044 to 0.113 ± 0.024 and 0.212 ± 0.042, respectively; the expression of RhoA protein and the contents of extracellular matrix components decreased markedly; and the relative expression levels of Col I mRNA decreased from 0.709 ± 0.067 and 0.695 ± 0.087 to 0.436 ± 0.037 and 0.201 ± 0.044, respectively.
CONCLUSION: Specific blockade of RhoA expression decreases the secretion of extracellular matrix components in HSC-T6 cells. RhoA-specific siRNA is superior to antisense oligodeoxynucleotide in down-regulating RhoA expression and therefore represents a better strategy for gene therapy of liver fibrosis.
- Citation: Wang B, Wang YF, Tian DA, Wang TC. Inhibition of RhoA expression reduces the secretion of extracellular matrix components in hepatic stellate cells. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 2038-2042
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/2038.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.2038
肝纤维化是各种慢性肝病进展到肝硬化的必经中间环节. 肝星状细胞(hepatic stellate cell, HSC)是肝纤维化发生发展的关键细胞, HSC活化为肌成纤维细胞是肝纤维化发生发展的核心事件. 研究证实, HSC的活化是由肝细胞变性坏死引发的大量细胞因子、受体和转录因子激活的一系列复杂的过程, 早期抑制HSC的活化是最为有效的逆转肝纤维化的途径之一[1]. 近年来, 细胞因子RhoA在HSC活化过程中的地位日益引起人们的关注, 我们既往通过动态观察RhoA在肝纤维化形成过程中的表达变化, 证实RhoA和细胞骨架重排在肝纤维化发生过程中起着重要的作用[2]. 小干扰RNA(small interferon RNA, siRNA)和反义寡核苷酸(antisense oligodeoxynucleotide, ASODN)是相继发展起来的较为成熟的反义RNA技术, 在病毒感染、肿瘤和遗传疾病的治疗方面显示出很强的优势和潜力. 对比研究这两种技术抑制RhoA表达来干扰活化的HSC分泌细胞外基质国内外未见报道. 本实验采取体外转录合成针对RhoA基因序列上相同靶点的siRNA和ASODN, 转染大鼠肝星状细胞株HSC-T6, 通过比较检测细胞外基质成分的表达, 观察抑制RhoA信号传导途经对活化HSC的作用, 并为下一步肝纤维化的试验性基因治疗提供依据.
大鼠肝星状细胞株HSC-T6为本实验室冻存, 带有绿色荧光蛋白(enhanced green fluorescent protein, EGFP)并表达大鼠RhoA特异性siRNA的质粒(Rat1质粒和Rat2质粒)及阴性对照质粒(HK-A质粒)为本实验室保存; 针对其相同靶点设计的ASODN以及用于对照的正义寡核苷酸(sense oligodeoxynucleotide, SODN)为本实验室保存; DMEM培养基及新生牛血清购自Gibco公司; 脂质体LipofectamineTM2000购自Invitrogen公司; MML-V逆转录酶、Taq DNA聚合酶购自Promega公司; DNA Marker Ⅰ购自北京天为时代科技有限公司; PCR引物由上海生工公司合成; RhoA抗体购自Santa Cruz公司; 透明质酸、层粘连蛋白及Ⅲ型前胶原肽定量ELISA试剂盒购自上海森雄科技实业有限公司.
1.2.1 细胞分组: 待HSC-T6生长到对数生长期, 0.25%胰蛋白酶消化传代, 按每孔5×105接种到六孔培养板. 针对ASODN, 分为空白对照组、脂质体对照组、阴性对照组(转染SODN 400 nmol/L)和ASODN组(包括A组, 300 nmol/L以及B组600 nmol/L两种浓度); 对于siRNA, 分为空白对照组、脂质体对照组、阴性对照组(转染HK-A质粒)、siRNA组(包括A组, 转染Rat1以及B组转染Rat2质粒), 每组另设3个复孔作为对照.
1.2.2 细胞转染: 在超净工作台内, 将脂质体、无血清DMEM培养基、寡核苷酸或质粒按一定比例配制好0.1 mL转染液, 室温静置5 min使用. 待细胞生长到70%融合时, 将培养板中的培养基吸出, 将转染液依次加入各培养孔中, 然后每孔加入含100 mL/L FBS的DMEM培养基0.9 mL, 继续培养; 24 h后荧光倒置显微镜下观察细胞荧光, 转染48 h后收集细胞和上清, 进行下一步检测.
1.2.3 RT-PCR: 培养细胞总RNA的提取按TRIzol试剂盒操作说明书进行, 反应分两步进行, 取总RNA 5 μg, 在M-MLV逆转录酶作用下逆转录为cDNA, 以此为模板, 按以下条件进行PCR反应: RhoA的上游引物为5'-GTAGAGTTGGCTTTATGGG-3', 下游引物为5'-CTCACTCCGTCTTTGGTC-3', 扩增的片段长度为347 bp. 扩增的条件为94 ℃预变性3 min后, 进入32个循环: 变性94 ℃ 1 min, 退火53 ℃ 50 s, 延伸72 ℃ 40 s, 最后再延伸: 72 ℃, 8 min. ColⅠ上游引物为5'-TGGCGTTCGTGGCTCTCAGGGTAG-3', 下游引物为5'-GCATGTGCGGGCAGGGTTCTTTC-3', 扩增的片段长度为259 bp. 扩增的条件为95 ℃预变性5 min后, 进入32个循环: 变性95 ℃ 1 min, 退火53 ℃ 50 s, 延伸72 ℃ 40 s, 最后再延伸: 72 ℃, 8 min. 内参照β-actin扩增片段为525 bp. PCR反应产物5 μL在1.5%琼脂糖凝胶上电泳30 min(80 V). 图像分析仪采集图像, 以内参β-actin为基准, 做半定量分析, 即以扩增目的片段/β-actin的灰度比值表示所扩增的目的基因片段的相对表达水平.
1.2.4 Western blot: 按分子克隆操作指南方法, 收集细胞提取细胞蛋白质, 考马斯亮蓝染色测定样品浓度并调整上样量至50 μg. 12%的SDS-PAGE凝胶电泳. NC膜印迹, 而后依次以含5%脱脂奶粉TBS-T溶液封闭、小鼠抗大鼠RhoA抗体4 ℃过夜, 辣根过氧化物酶标记二抗孵育, 最后采用ECL系统感光显像. 报告结果至少重复二遍以上.
1.2.5 ELISA: 按试剂盒说明术操作, 标准品行倍比稀释, 待测品孔中每孔加待测上清100 μL, 反应板混匀后置37 ℃ 120 min. 先后加一抗工作液、酶标抗体工作液及底物工作液孵育, 最后加50 μL终止液混匀, 在492 nm处测吸光值, 根据标准品浓度计算待测样品的含量.
统计学处理 数据采用mean±SD表示, 采用SAS统计软件统计分析, 组间分析采用t检验, P<0.05表示差异具有统计学意义.
荧光倒置显微镜下可见HSC中发出绿色荧光, 说明转染成功, 各干扰组细胞贴壁生长与空白对照组无明显变化.
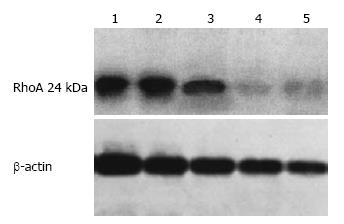
转染siRNA质粒后, 只有Rat1组能够下调RhoA mRNA的表达. 转染ASODN后, RhoA mRNA的表达下降, 尤其是高浓度转染组. 而对照组和SODN转染组之间无明显差异(表1). 选择转染高浓度ASODN和Rat1质粒组细胞株, 检测RhoA蛋白质的表达. 干扰组细胞中RhoA蛋白质的表达明显下调, 显示出ASODN和siRNA均能有效抑制RhoA的表达, 结果见图1.
组内比较, 转染高浓度的ASODN或siRNA质粒均明显下调Ⅰ型胶原mRNA的表达; 组间比较, siRNA质粒的干扰效果较ASODN明显增强(表2).
组内比较, 转染高浓度的ASODN或siRNA质粒均明显下调Ⅰ型胶原mRNA的表达; 组间比较, siRNA质粒的干扰效果较ASODN明显增强(表3).
| 分组 | HA | LN | PIIIP | |||
| ASODN | siRNA | ASODN | siRNA | ASODN | siRNA | |
| 空白对照组 | 6.468±0.677 | 6.433±0.946 | 59.441±4.846 | 60.042±2.016 | 31.941±3.008 | 34.821±2.621 |
| 脂质体对照组 | 7.635±1.184 | 6.475±0.696 | 57.884±6.076 | 59.761±3.008 | 38.592±4.832 | 49.597±9.237 |
| 阴性对照组 | 7.105±1.302 | 6.019±0.726 | 54.725±2.943 | 56.704±3.295 | 35.937±9.850 | 46.263±3.081 |
| 干预组 | 3.925±0.228a | 2.887±0.382ac | 13.087±2.939a | 5.709±1.817ac | 22.231±2.221a | 8.920±4.515ac |
我们既往的研究证实, 肝纤维化时HSC细胞骨架重排是HSC活化的重要细胞生物学基础, 细胞因子RhoA在肝纤维化时的表达显著上调, 并和HSC中肌动蛋白细胞骨架成分的表达变化一致, 表明其参与了HSC活化过程且发挥了重要的生物学效应[2,3].
HSC-T6是由SV40-T6抗原转染原代大鼠HSC而来, 他表达Desmin和α-SMA, 具有活化HSC的特征, 常用于探讨肝纤维化形成的分子机制[4]. 本实验在我们前期的研究基础上[5], 借助HSC-T6这一体外细胞模型, 采用分子生物学方法高度特异性的抑制RhoA的表达, 观察其对下游细胞外基质成分分泌的影响, 试图为肝纤维化的治疗寻找新的靶点.
反义技术是指根据核酸间碱基配对结合的原理, 用人工或生物合成的特定互补配对的反义核酸或他们的化学修饰物与细胞内的特定基因相互作用, 从基因水平上干扰遗传信息从核酸向蛋白质的传递过程. ASODN和siRNA是相继发现的两种反义技术. 两者均是以mRNA为靶点, 通过序列特异性结合并降解同源mRNA抑制靶基因表达功能[6].
由于ASODN和siRNA作用机制上具有共性, 两者对于目标mRNA的作用靶点是否一致呢? 在本实验中, 我们首先采用计算机模拟设计合成针对RhoA的siRNA, 通过实测筛选出具有抑制效应的Rat1质粒, 然后根据此质粒的作用位点合成ASODN. 结果显示, siRNA Rat1质粒和不同浓度的ASODN都能够有效的抑制RhoA的表达. 证实利用反义技术沉默星状细胞中目的基因的表达是可行的, 而且siRNA和ASODN的可接近位点基本上是一致性的.
尽管反义技术能够有效抑制靶基因的表达, 但是也有其自身的弱点. 天然的ASODN和siRNA都是不稳定的, 容易被体内各种酶所破坏. 另外, 与靶细胞内特定的位点发生作用, 必须有较好的细胞通透性, 且能在靶细胞内保持一定的浓度. 天然的ASODN和siRNA难以同时满足以上要求. 因此, 必须对其结构进行化学修饰来提高其反义活性, 基本手段包括磷酸骨架修饰、核糖修饰和碱基修饰等[7]. 本实验采用磷硫酰修饰的ASODN即使高浓度转染亦能够保持分子结构稳定发挥作用, 且对靶细胞无明显的毒性反应. 提示设计合理的反义寡核苷酸仍有希望应用于肝纤维化的基因治疗.
对下游指标的检测发现, 尽管ASODN和siRNA均能下调Ⅰ型胶原mRNA和细胞外基质成分的表达, 但是两者相比其抑制效率siRNA远高于ASODN. 除去分子结构可能带来的差异外, 提示两者具有不同的反义作用机制. 一般认为, ASODN在细胞核内与mRNA的前体相互作用形成mRNA DNA双链, 激活RnaseH, 水解该mRNA, 阻断其进入胞质从而破坏蛋白质的翻译过程[8,9]. 而双链siRNA导入细胞后, 在细胞质内先形成核糖核苷酸蛋白复合物及RNA诱导的基因沉默复合体(RNA-induced silencing complex, RISC), 通过反义链的介导下识别和降解成熟mRNA发挥效应[10]. 我们推测mRNA前体和成熟mRNA一级结构的轻微差异可能导致其二级结构的不同, 从而引起两者抑制效应的差别.
目前siRNA正逐步取代ASODN成为分子生物学尤其是肿瘤学研究领域的热门工具. 但是有科学家认为, 相对于RNA分子, DNA分子更稳定且容易大量合成从而满足临床需要, 这也是时至今日大家仍然未放弃探讨ASODN机制的原因之一. 况且研究ASODN的成功经验对于siRNA具有借鉴和指导意义[11]. 根据本实验结果我们认为, 无论是siRNA还是ASODN, 都有希望用于干预肝纤维化时HSC活化带来的细胞外基质成分沉积. 两者本质上都只是技术手段, 最终能否用于临床治疗仍然有很多问题亟待解决.
肝纤维化是各种慢性肝病进展到肝硬化的必经中间环节. 肝星状细胞是肝纤维化发生发展的关键细胞, 肝星状细胞活化并产生大量细胞外基质是肝纤维化发生发展的核心步骤. 本课题组既往的研究显示RhoA在肝纤维化发生过程中起着重要的作用. 本实验采用体外合成的反义寡核苷酸和小干扰RNA转染大鼠肝星状细胞株HSC-T6, 检测细胞外基质成分的表达, 比较两种不同反义技术抑制RhoA信号传导途经对活化HSC的作用, 为下一步肝纤维化的试验性基因治疗提供依据.
唐世刚, 教授, 大连大学附属中山医院消化内科
细胞骨架结构的改变是肝星状细胞活化的始动环节, RhoA信号传导途径在调控细胞骨架成分过程中起着重要作用, 因此其在星状细胞活化过程中的地位日益引起人们的关注. 以RhoA为靶点, 利用分子生物学技术抑制RhoA的表达将有助于维持肝星状细胞于"静态"表型, 从而延缓肝纤维化的进程.
2000年Nawata等首先发现RhoA通过调节肌动蛋白骨架结构参与肝星状细胞的活化, 给予Y27632抑制RhoA信号传导途径后能降低星状细胞的增殖. 随后, 人们在研究一氧化氮、血管紧张素Ⅱ和瘦素等细胞因子与肝纤维化的关系时, 均发现了RhoA信号传导途径的参与.
Nawata试图采用Y27632抑制RhoA信号传导途径, 来达到逆转肝纤维化的目的. Y27632主要调节RhoA通路的下游因子, 作用及调控机制显然更为复杂. 因此, 本研究试图采用分子生物学技术直接抑制RhoA的表达. 反义寡核苷酸和小干扰RNA都是成熟的反义技术, 对比研究有利于寻找更有效的治疗手段, 为今后的实验提供依据.
肝星状细胞活化是肝纤维化的核心事件, 细胞表型改变是其早期关键步骤. 由于RhoA是目前发现为数不多的能够调控肝星状细胞形态学的细胞因子, 因此对其进行充分的研究有助于寻找阻断星状细胞的激活的途径, 从而延缓肝纤维化的进程.
本研究设计合理, 结果可信, 有较好的研究价值.
编辑 李军亮 电编 吴鹏朕
| 1. | Friedman SL. Mechanisms of hepatic fibrogenesis. Gastroenterology. 2008;134:1655-1669. [PubMed] [DOI] |
| 3. | 王 波, 王 天才, 梁 扩寰. Stress fiber、Vinculin和FAK对大鼠肝纤维化作用机制的研究. 华中科技大学学报(医学版). 2004;33:282-286. |
| 4. | Vogel S, Piantedosi R, Frank J, Lalazar A, Rockey DC, Friedman SL, Blaner WS. An immortalized rat liver stellate cell line (HSC-T6): a new cell model for the study of retinoid metabolism in vitro. J Lipid Res. 2000;41:882-893. [PubMed] |
| 5. | 王 艳芬, 田 德安, 王 波, 张 琼, 刘 梅, 但 自力, 王 南下, 刘 南植. RhoA特异性RNA干扰对肝星状细胞T6细胞外基质表达的影响. 中华消化杂志. 2007;27:495-496. |
| 6. | Hebert CG, Valdes JJ, Bentley WE. Beyond silencing--engineering applications of RNA interference and antisense technology for altering cellular phenotype. Curr Opin Biotechnol. 2008;19:500-505. [PubMed] [DOI] |
| 7. | Miyake H, Fujisawa M. Promise of antisense oligodeoxynucleotide-based therapy for bladder cancer. Expert Rev Anticancer Ther. 2008;8:1851-1854. [PubMed] [DOI] |
| 8. | Jin Y, Liu S, Yu B, Golan S, Koh CG, Yang J, Huynh L, Yang X, Pang J, Muthusamy N. Targeted delivery of antisense oligodeoxynucleotide by transferrin conjugated pH-sensitive lipopolyplex nanoparticles: a novel oligonucleotide-based therapeutic strategy in acute myeloid leukemia. Mol Pharm. 2010;7:196-206. [PubMed] [DOI] |
| 9. | Du L, Gatti RA. Progress toward therapy with antisense-mediated splicing modulation. Curr Opin Mol Ther. 2009;11:116-123. [PubMed] |
| 10. | Nowotny M, Yang W. Structural and functional modules in RNA interference. Curr Opin Struct Biol. 2009;19:286-293. [PubMed] [DOI] |
| 11. | Rayburn ER, Zhang R. Antisense, RNAi, and gene silencing strategies for therapy: mission possible or impossible? Drug Discov Today. 2008;13:513-521. [PubMed] [DOI] |