修回日期: 2010-06-10
接受日期: 2010-06-22
在线出版日期: 2010-07-08
目的: 研究胃印戒细胞癌的发生与胃腺增殖区的关系, 探讨其细胞起源和癌前病变.
方法: 以42例早期胃印戒细胞癌为研究对象, 观测其组织形态, 采用免疫组织化学双染标记癌灶内分化标志物MUC5AC和MUC6的表达情况, 检测癌灶不同区域Ki-67以及胃肠道干/祖细胞标志物musashi-1的表达差异, 并与癌旁胃腺进行对比.
结果: 早期胃印戒细胞癌具有特征性的分层结构. 该结构分为两层, 浅表层为典型的印戒细胞, 体积大, 胞质丰富, 基底层为原始的癌细胞, 体积小, 核/浆比大; 在形态和解剖定位上, 基底层癌细胞与癌旁胃腺增殖区细胞类似, 免疫组织化学显示其MUC5AC、MUC6表达均为阴性, 或仅微弱表达MUC5AC, 而Ki-67、musashi-1表达率显著高于浅表层印戒细胞(t = 31.0和22.8, P<0.01); 基底层癌细胞可向浅表层印戒细胞分化过渡, 这与增殖区细胞向胃小凹上皮分化的过程相似; 癌旁可见胃腺增殖区细胞异型增生, 其表型与分层结构基底层癌细胞一致.
结论: 胃印戒细胞癌可能起源于增殖区MUC5AC-/lowMUC6-的胃小凹前体细胞, 同时增殖区的异型增生是此类胃癌的癌前病变
引文著录: 周志华, 张建东, 赵海滨, 赵玲娜, 单宝珍. 胃印戒细胞癌的细胞起源及其癌前病变的病理学. 世界华人消化杂志 2010; 18(19): 2001-2006
Revised: June 10, 2010
Accepted: June 22, 2010
Published online: July 8, 2010
AIM: To investigate the cell origin and premalignant lesions of gastric signet-ring cell carcinoma (SRCC).
METHODS: A total of 42 cases of early gastric SRCC were included in this study. The histological morphology of gastric SRCC was observed. Differentiation markers MUC5AC and MUC6 were labeled by immunohistochemical double-staining of gastric SRCC tissue. The expression of Ki-67 and gastrointestinal stem/progenitor cell marker musashi-1 in SRCC was detected by immunohistochemistry. Additionally, the immunophenotype of gastric glands adjacent to carcinoma was also detected.
RESULTS: Early gastric SRCC was characterized by a two-layered structure consisting of superficial layer and basal layer. The superficial layer contained typical large signet-ring cells that possessed abundant cytoplasm, whereas the basal layer was composed of small-sized primitive cancer cells with a high nucleus/cytoplasm ratio. Cells in the basal layer shared common morphologic features and a similar anatomic location with those in the proliferative zone of gastric glands. These cells were negative for both MUC5AC and MUC6, or merely exhibited a weak MUC5AC expression. Compared with the superficial layer, the percentages of Ki-67- and musashi-1-positive cells were significantly higher in the basal layer (t = 31.0 and 22.8, respectively, both P < 0.01). Cells in the basal layer could differentiate into typical signet-ring cells, which resembles the differentiation process of proliferitive zone cells into gastric pit cells. Dysplasia of the proliferative zone of gastric glands adjacent to SRCC was noted, and dysplastic cells in the proliferative zone were phenotypically consistent with cancer cells in the basal layer.
CONCLUSION: Gastric SRCC may originate from MUC5AC-/lowMUC6- pre-pit cells in the proliferative zone of gastric glands. Dysplasia of the proliferative zone may represent the premalignant lesions of gastric SRCC.
- Citation: Zhou ZH, Zhang JD, Zhao HB, Zhao LN, Shan BZ. Cell origin and premalignant lesions of gastric signet-ring cell carcinoma: a histopathologic study. Shijie Huaren Xiaohua Zazhi 2010; 18(19): 2001-2006
- URL: https://www.wjgnet.com/1009-3079/full/v18/i19/2001.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i19.2001
基于临床病理特征的不同, 胃癌可分为肠型和弥漫型两类[1]. 近年的流行病学调查显示, 胃癌的总体发病率已明显下降[2], 但弥漫型胃癌尤其是印戒细胞癌的发病率却显著升高[3], 因此这类胃癌也受到越来越多的关注. 迄今, 胃印戒细胞癌的早期诊断率不高, 一个重要原因是对此类胃癌的病理形成机制和癌前病变尚不清楚. 胃印戒细胞癌与肠型胃癌相似, 起源于胃黏膜上皮. 组织学上, 胃黏膜的基本结构单位是胃单元(gastric units), 该结构为单克隆起源[4], 由胃小凹和胃腺组成, 其中胃腺又依次分为峡部、腺颈和基底部. 胃腺的峡部以及腺颈上部的细胞增殖活跃, 被称为增殖区. 研究证实, 增殖区是胃印戒细胞癌起源的部位[5]. 然而, 这一区域实际上含有多种低分化细胞, 并具有不同分化方向[6,7], 印戒细胞癌究竟起源于增殖区的何种细胞, 目前尚不清楚. 为探讨这一问题, 本研究以早期胃印戒细胞癌为观测模型, 采用免疫组织化学双染的方法, 观测了早期肿瘤细胞的空间分布、分化表型和增殖特性, 希望为认识此类肿瘤的细胞起源及其癌前病变提供新的病理学依据.
回顾我院1988-2008年以及无锡市第三人民医院2007-2008年手术切除的胃癌根治标本约2 200例, 根据最新WHO国际肿瘤病理分类对胃印戒细胞癌的病理诊断标准(印戒细胞占癌细胞总数的50%以上), 以及早期胃癌的诊断标准(癌细胞浸润深度不超过黏膜下层), 共确认42例早期印戒细胞癌标本作为研究对象, 患者年龄30-77岁, 其中男25例, 女17例, 均无家族史; 肿瘤分期: 24例为T1a期, 局限于黏膜内; 18例为T1b期, 累及黏膜下层. 对所有标本的存档蜡块连续切片(厚3 μm), 苏木精-伊红(HE)染色. 另取10例正常胃黏膜作为对照.
1.2.1 免疫组织化学染色: 采用免疫组织化学双染标记MUC5AC和MUC6阳性细胞, 其中MUC5AC主要表达于胃小凹、峡部和腺颈部的黏液细胞[8](抗体购自福州迈新公司, 为工作液), MUC6则局限于腺颈的黏液细胞和基底部的幽门腺上皮[8](浓缩抗体购自上海长岛公司, 稀释度1∶50), 此二者常被用来作为胃上皮分化的标志物. 操作按产品说明书进行, 并根据文献略有改变[9], 步骤简述如下: 石蜡切片脱蜡至水; 柠檬酸缓冲液(pH6.0)95 ℃修复10 min, 保温10 min; 3% H2O2室温孵育后血清封闭10 min; 而后采用SP法先标记MUC6, 显色系统为BCIP/NBT, 阳性呈蓝黑色, 定位于细胞质; 随后再次进行抗原修复, 目的为暴露MUC5AC抗原, 同时灭活前一次染色时残留抗体的免疫活性, 抗原修复方法同前. 采用SP法标记MUC5AC, 显色系统为HRP/AEC, 阳性部位呈红色, 定位于细胞质. 另取连续切片单独标记Ki-67(抗体购自福州迈新公司, 为工作液)和musashi-1(Santa Cruz公司, 浓缩液, 稀释度1∶100), 其中musashi-1为一类RNA结合蛋白, 与干细胞的不对称分裂有关[10], 是神经干细胞和胃肠道干/祖细胞的标志物[11-13]. 染色仍采用SP法, 显色系统为HRP/DAB, 阳性部位呈棕黄色, 定位于细胞核. 阴性对照采用PBS替代一抗与切片孵育, 其余操作相同.
1.2.2 不同区域印戒细胞平均Ki-67、musashi-1阳性细胞比例的测定及比较: 免疫组织化学染色标记Ki-67、musashi-1后, 检测不同区域阳性癌细胞的比率. 每例标本测定两个区域: 癌灶靠近黏膜表面上皮的浅表部分和浸润最深的部位. 每个区域随机选取5个视野, 计数Ki-67、musashi-1表达呈阳性的癌细胞数, 除以上述5个视野内癌细胞总数, 即得到阳性细胞比率. 采用t检验比较不同区域阳性细胞比率的差异.
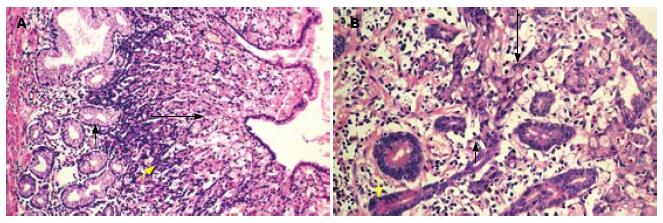
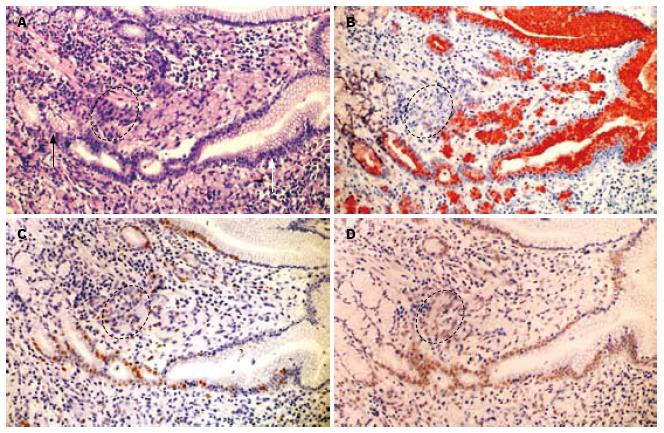
HE切片显示, 印戒细胞在胃黏膜层形成典型的分层结构(layered structure), 见于38例标本. 该结构可分为上下两层, 浅表层为经典型印戒细胞, 体积较大, 靠近胃黏膜表面, 而基底层位于黏膜中部, 其细胞构成具有两种形式: (1)由体积较小的印戒细胞或原始癌细胞构成, 其核/浆比大, 并逐渐向浅表层过渡为体积较大的印戒细胞(图1A); (2)由异型增生的峡/颈部细胞构成, 直接向黏膜浅表层移行过渡为典型的印戒细胞(图1B). 在解剖位置上, 分层结构位于黏膜层的中上部, 与胃单元的峡/颈部区域重叠(图2A), 同时分层结构下方的胃腺细胞可保持正常(图1A), 或仅有轻度异型增生(图1B).
分层结构上下层细胞在形态上显示两者分化程度不同: 浅表层典型的印戒细胞, 其体积较大, 胞质内黏液丰富, 细胞核受挤压呈弯月形, 偏位, 总体形态上接近于胃小凹上皮; 基底层的癌细胞体积较小, 核/浆比大, 胞质略嗜碱, 形态与峡/颈部细胞相似, 并可向黏膜浅表移行为经典的印戒细胞, 反映其分化更为原始(图1). 免疫组织化学双染显示, 在所有病例中, 浅表层印戒细胞MUC5AC表达呈强阳性, 而越接近基底层MUC5AC表达越弱, 到达分层结构底部时癌细胞MUC5AC表达呈弱阳性或不表达(图2B). MUC6在大多数病例的分层结构内不表达, 只有少数病例(11/42)可在分层结构的基底层见少数MUC6阳性的癌细胞(比例<10%).
Ki67标记显示胃单元的增殖区, 并可见分层结构尤其是基底层的癌细胞与癌旁胃单元的增殖区在空间位置上重叠. 进一步观测发现, 分层结构基底层的癌细胞增殖较活跃(阳性比率为28.7%±4.3%), 而越靠近浅表层, 印戒细胞Ki67阳性率越低(图2C), 经统计浅表层的经典型印戒细胞Ki67表达率为6.2%±1.2%, 显著低于基底层低分化的癌细胞(t = 31.0, P<0.01).
musashi-1染色标记胃单元峡/颈部区域, 与Ki67标记的连续切片对比可发现这一区域涵盖了增殖区. 分层结构上下两层细胞musashi-1的表达不同, 其中基底层低分化癌细胞的阳性率为35.3%±4.4%, 向浅表层移行的过程中musashi-1表达下降, 分层结构浅表层经典型印戒细胞的表达阳性率为13.8%±3.8%, 显著低于基底层低分化的癌细胞(t = 22.8, P<0.01, 图2D).
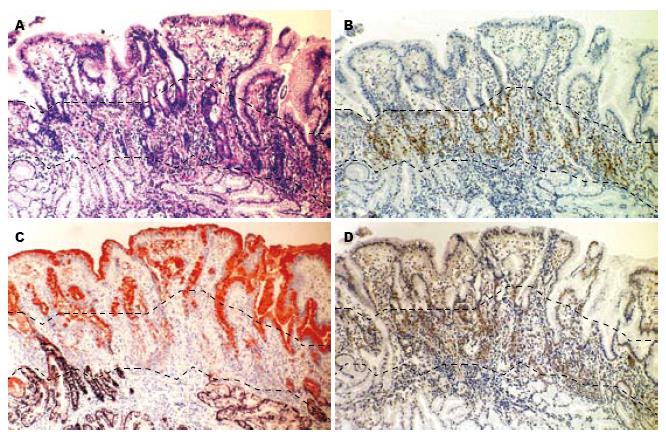
对癌旁胃黏膜的观察显示, 其形态与正常胃黏膜存在差异, 这种差异主要位于增殖区(31/42)及胃小凹(39/42). 增殖区的改变表现为该区域延长, 细胞增殖活跃, 并具有异型性, 其细胞核增大、深染, 分裂象易见, 而胞质减少, 明显嗜碱性(图3A, B), 免疫组织化学染色显示增生的细胞MUC6呈阴性, 而MUC5AC呈弱阳性, 并表达musashi-1(图3C, D). 胃小凹表现为长度增加, 并且分枝, 黏液细胞体积明显增大, 可呈气球状(球样增生), 胞质黏液丰富(图3A); 而在部分病例(23/42), 可见胃小凹的黏液细胞增生, 排列密集, 细胞质减少, 且细胞核增大, 并可出现异型性.
本研究以早期胃印戒细胞癌为观测模型, 探讨了印戒细胞癌形成初期时的组织学特点及分化表型. 与以往研究结果相似[5,14-16], 本研究在早期胃印戒细胞癌内亦发现特征性的分层结构, 证实印戒细胞癌发生于胃腺增殖区, 依据为: (1)分层结构位于黏膜层中上部, 与胃腺的颈/峡部对应, 空间范围上涵盖了增殖区; (2)颈/峡部细胞(包括增殖区细胞)可发生异型增生, 并向黏膜表浅层延伸, 移行过渡为经典的印戒细胞; (3)分层结构基底部的癌细胞增殖活跃并表达musashi-1, 表型与胃腺增殖区相似; (4)癌旁胃黏膜内增殖区扩展, 细胞具有异型性.
在以上研究基础上, 我们进一步发现: (1)印戒细胞具有胃小凹上皮的分化表型, 表达MUC5AC, 这与以往研究一致[17]; (2)分层结构模拟了增殖区细胞向胃小凹细胞的分化过程: 基底层癌细胞向黏膜浅表层移行为经典印戒细胞的过程中, 细胞分化渐趋成熟, 表现为干/祖细胞标志物musashi-1表达减少, 而MUC5AC表达增强, 在形态上也逐渐接近胃小凹上皮; (3)基底层癌细胞移行为印戒细胞的过程中, 增殖活性不断减弱, 这与正常增殖区细胞向胃小凹上皮分化的过程相似; (4)癌旁胃腺的增殖区扩展, 细胞增殖活跃, 其表型与低分化癌细胞类似, MUC5AC呈弱阳性或阴性, MUC6不表达; (5)癌旁黏膜可见胃小凹上皮球样增生或具有异型性, 说明癌旁的胃小凹细胞虽未癌变, 但在分化上出现紊乱. 故综合以上结果, 我们认为胃印戒细胞癌可能起源于增殖区内MUC5AC弱阳性或阴性、MUC6阴性(MUC5AC-/lowMUC6-)的细胞. 这些细胞在分化为胃小凹上皮的过程中发生恶性转化, 导致了印戒细胞癌的形成.
近年来, 随着肿瘤干细胞学说的兴起, 有学者提出了胃癌干细胞的概念[18], 并认为胃癌干细胞是驱动胃癌发生发展的根源, 这在针对胃癌细胞系的研究中已获得了初步的证据[19]. 而在胃印戒细胞癌, Humar等[20]发现同一癌灶内的印戒细胞其CDH1基因甲基化的位点相同, 说明病灶具有单克隆性, 起源于同一始祖细胞, 因此也提示胃印戒细胞癌内很可能存在胃癌干细胞. 本研究发现分层结构基底部MUC5AC-/lowMUC6-的低分化癌细胞表达musashi-1, 说明部分癌细胞具有干细胞特性, 与上述观点吻合. 理论上, 肿瘤干细胞很可能由正常干细胞转化而来, 而并非源自分化的细胞. 因为干细胞存活寿命较长, 有足够长的时间积累癌变所需的基因事件, 同时, 其自我更新相关的信号通路已激活, 只需更少的基因事件就可能完成恶性转化[21]. 研究发现, 与结直肠腺瘤形成有重要关系的抑癌基因APC在小鼠的结肠干细胞失活后可诱发腺瘤形成, 并可演进为腺癌, 证实了上述观点[22,23]. 故据此推测胃干细胞是印戒细胞癌的起源细胞似乎具有一定的合理性.
但实际上, 具有一定分化程度的前体细胞(祖细胞)也可癌变成为肿瘤干细胞, 这在白血病的研究中已得到证实[24]. 而且新近对小鼠胃腺的研究有力地证实, 胃干细胞实际上位于胃腺的基底部[25,26], 而非增殖区. 因此, 如果人的胃干细胞确实位于胃腺基底部, 现有的病理形态学观察结果不支持胃印戒细胞癌起源于胃干细胞的观点, 因为部分病例内可见胃腺颈/峡部异型增生并过渡为印戒细胞, 而此时胃腺基底部细胞保持正常或仅有轻度异型增生. 考虑到分层结构模拟了增殖区向胃小凹上皮分化的过程, 同时上述分层结构基底层的低分化癌细胞仍可微弱表达MUC5AC, 我们认为胃小凹前体细胞是最可能的来源.
此外, 有关胃印戒细胞癌是否存在癌前病变目前仍有不同的观点. Humar等[27]认为增殖区细胞由于CDH1基因失活导致细胞失去黏附性和分化极性, 直接从腺体基板上脱离侵入间质, 形成了印戒细胞癌. 这一发生模式并不包括异型增生的阶段. 但Carneiro等[28]及Rogers等[29]观察印戒细胞癌标本发现, 癌旁黏膜内存在原位印戒细胞癌病灶和上皮异型增生, 说明胃印戒细胞癌的发生同其他类型的肿瘤一样, 是一个多步骤多阶段的过程, 而上皮异型增生可能为此类肿瘤的癌前病变. 本研究发现癌旁胃黏膜的增殖区扩展, 并且细胞具有异型性, 其免疫表型也与基底层癌细胞一致, 提示增殖区细胞的异型增生是胃印戒细胞癌的癌前病变. 在以往的研究中, 我们也曾提出: 具有胃型分化(主要表达MUC5AC)的上皮异型增生病变是胃印戒细胞癌的癌前病变[30], 因为在早期胃印戒细胞癌的癌旁黏膜内常观察到表达MUC5AC的异型性腺体. 根据本研究结果, 我们认为上述异型性腺体实质上可能源于增殖区细胞的异型增生. 本研究观察到癌旁胃小凹延长、分支以及小凹上皮的异型增生, 与以往研究结果类似, 均可能为增殖区细胞向胃小凹上皮分化的过程中发生紊乱所导致.
总之, 本研究认为胃印戒细胞癌起源于胃腺增殖区MUC5AC-/lowMUC6-的胃小凹前体细胞, 同时, 该区域细胞的异型增生可能是此类胃癌的癌前病变. 上述结论对我们深入了解胃印戒细胞癌的发生机制, 尽早实施医学干预降低其死亡率可能具有一定意义.
近年来, 世界范围内胃印戒细胞癌的发生率呈现上升趋势, 其发生机制尚不十分清楚. 多数的研究认为, 胃印戒细胞癌起源于胃腺的增殖区, 该区域存在较多不成熟细胞, 可能包括了干细胞和多种前体细胞.
王娅兰, 教授, 重庆医科大学基础医学院病理教研室
胃癌包括胃印戒细胞癌起源于干细胞还是具有一定分化程度的前体细胞, 以及此类胃癌是否存在癌前病变, 为较多研究者所关注.
Humar等以早期的遗传性弥漫型胃癌为研究模型, 发现在胃腺增殖区细胞黏附性的下降或缺失是胃印戒细胞癌发生的重要机制.
本研究以早期胃印戒细胞癌为观测模型, 采用免疫组织化学双染的方法, 观测早期肿瘤细胞的空间分布、分化表型和干细胞/前体细胞标志物musashi-1的表达情况, 为认识此类肿瘤的细胞起源及其癌前病变提供了病理学依据.
本文研究胃印戒细胞癌的起源, 并探讨其癌前病变, 对此类胃癌的早期防治可能具有一定意义.
分层结构: 是早期胃印戒细胞癌的特征性组织结构, 可分为两层: 浅层为分化成熟的印戒细胞, 体积较大; 底层为低分化的癌细胞, 体积小. 有时分层结构除以上两层外, 在底层下方还有一层分化程度较高的癌细胞, 具有胃腺基底部细胞的分化表型.
本研究拟探讨胃印戒细胞癌的发生, 对胃癌防治具有一定意义.
编辑 曹丽鸥 电编 吴鹏朕
| 1. | Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. an attempt at a histo-clinical classification. Acta Pathol Microbiol Scand. 1965;64:31-49. [PubMed] [DOI] |
| 2. | Jemal A, Siegel R, Ward E, Hao Y, Xu J, Murray T, Thun MJ. Cancer statistics, 2008. CA Cancer J Clin. 2008;58:71-96. [PubMed] |
| 3. | Henson DE, Dittus C, Younes M, Nguyen H, Albores-Saavedra J. Differential trends in the intestinal and diffuse types of gastric carcinoma in the United States, 1973-2000: increase in the signet ring cell type. Arch Pathol Lab Med. 2004;128:765-770. [PubMed] |
| 4. | McDonald SA, Greaves LC, Gutierrez-Gonzalez L, Rodriguez-Justo M, Deheragoda M, Leedham SJ, Taylor RW, Lee CY, Preston SL, Lovell M. Mechanisms of field cancerization in the human stomach: the expansion and spread of mutated gastric stem cells. Gastroenterology. 2008;134:500-510. [PubMed] [DOI] |
| 5. | Humar B, Fukuzawa R, Blair V, Dunbier A, More H, Charlton A, Yang HK, Kim WH, Reeve AE, Martin I. Destabilized adhesion in the gastric proliferative zone and c-Src kinase activation mark the development of early diffuse gastric cancer. Cancer Res. 2007;67:2480-2489. [PubMed] [DOI] |
| 6. | Karam SM, Straiton T, Hassan WM, Leblond CP. Defining epithelial cell progenitors in the human oxyntic mucosa. Stem Cells. 2003;21:322-336. [PubMed] [DOI] |
| 7. | Karam SM. A focus on parietal cells as a renewing cell population. World J Gastroenterol. 2010;16:538-546. [PubMed] [DOI] |
| 8. | Babu SD, Jayanthi V, Devaraj N, Reis CA, Devaraj H. Expression profile of mucins (MUC2, MUC5AC and MUC6) in Helicobacter pylori infected pre-neoplastic and neoplastic human gastric epithelium. Mol Cancer. 2006;5:10. [PubMed] [DOI] |
| 10. | Okabe M, Imai T, Kurusu M, Hiromi Y, Okano H. Translational repression determines a neuronal potential in Drosophila asymmetric cell division. Nature. 2001;411:94-98. [PubMed] [DOI] |
| 11. | Kaneko Y, Sakakibara S, Imai T, Suzuki A, Nakamura Y, Sawamoto K, Ogawa Y, Toyama Y, Miyata T, Okano H. Musashi1: an evolutionally conserved marker for CNS progenitor cells including neural stem cells. Dev Neurosci. 2000;22:139-153. [PubMed] [DOI] |
| 12. | Akasaka Y, Saikawa Y, Fujita K, Kubota T, Ishikawa Y, Fujimoto A, Ishii T, Okano H, Kitajima M. Expression of a candidate marker for progenitor cells, Musashi-1, in the proliferative regions of human antrum and its decreased expression in intestinal metaplasia. Histopathology. 2005;47:348-356. [PubMed] [DOI] |
| 13. | Brittan M, Wright NA. Stem cell in gastrointestinal structure and neoplastic development. Gut. 2004;53:899-910. [PubMed] |
| 14. | Akamatsu T, Katsuyama T. Histochemical demonstration of mucins in the intramucosal laminated structure of human gastric signet ring cell carcinoma and its relation to submucosal invasion. Histochem J. 1990;22:416-425. [PubMed] [DOI] |
| 15. | Natsagdorj L, Sugihara H, Bamba M, Hattori T. Intratumoural heterogeneity of intestinal expression reflects environmental induction and progression-related loss of induction in undifferentiated-type gastric carcinomas. Histopathology. 2008;53:685-697. [PubMed] [DOI] |
| 17. | Nguyen MD, Plasil B, Wen P, Frankel WL. Mucin profiles in signet-ring cell carcinoma. Arch Pathol Lab Med. 2006;130:799-804. [PubMed] |
| 18. | Takaishi S, Okumura T, Wang TC. Gastric cancer stem cells. J Clin Oncol. 2008;26:2876-2882. [PubMed] [DOI] |
| 19. | Takaishi S, Okumura T, Tu S, Wang SS, Shibata W, Vigneshwaran R, Gordon SA, Shimada Y, Wang TC. Identification of gastric cancer stem cells using the cell surface marker CD44. Stem Cells. 2009;27:1006-1020. [PubMed] [DOI] |
| 20. | Humar B, Blair V, Charlton A, More H, Martin I, Guilford P. E-cadherin deficiency initiates gastric signet-ring cell carcinoma in mice and man. Cancer Res. 2009;69:2050-2056. [PubMed] [DOI] |
| 21. | Reya T, Morrison SJ, Clarke MF, Weissman IL. Stem cells, cancer, and cancer stem cells. Nature. 2001;414:105-111. [PubMed] [DOI] |
| 22. | Barker N, Ridgway RA, van Es JH, van de Wetering M, Begthel H, van den Born M, Danenberg E, Clarke AR, Sansom OJ, Clevers H. Crypt stem cells as the cells-of-origin of intestinal cancer. Nature. 2009;457:608-611. [PubMed] [DOI] |
| 23. | Brabletz S, Schmalhofer O, Brabletz T. Gastrointestinal stem cells in development and cancer. J Pathol. 2009;217:307-317. [PubMed] [DOI] |
| 24. | Krivtsov AV, Twomey D, Feng Z, Stubbs MC, Wang Y, Faber J, Levine JE, Wang J, Hahn WC, Gilliland DG. Transformation from committed progenitor to leukaemia stem cell initiated by MLL-AF9. Nature. 2006;442:818-822. [PubMed] [DOI] |
| 25. | Qiao XT, Ziel JW, McKimpson W, Madison BB, Todisco A, Merchant JL, Samuelson LC, Gumucio DL. Prospective identification of a multilineage progenitor in murine stomach epithelium. Gastroenterology. 2007;133:1989-1998. [PubMed] [DOI] |
| 26. | Barker N, Huch M, Kujala P, van de Wetering M, Snippert HJ, van Es JH, Sato T, Stange DE, Begthel H, van den Born M. Lgr5(+ve) stem cells drive self-renewal in the stomach and build long-lived gastric units in vitro. Cell Stem Cell. 2010;6:25-36. [PubMed] [DOI] |
| 27. | Humar B, Guilford P. Hereditary diffuse gastric cancer and lost cell polarity: a short path to cancer. Future Oncol. 2008;4:229-239. [PubMed] [DOI] |
| 28. | Carneiro F, Huntsman DG, Smyrk TC, Owen DA, Seruca R, Pharoah P, Caldas C, Sobrinho-Simões M. Model of the early development of diffuse gastric cancer in E-cadherin mutation carriers and its implications for patient screening. J Pathol. 2004;203:681-687. [PubMed] [DOI] |
| 29. | Rogers WM, Dobo E, Norton JA, Van Dam J, Jeffrey RB, Huntsman DG, Kingham K, Chun N, Ford JM, Longacre TA. Risk-reducing total gastrectomy for germline mutations in E-cadherin (CDH1): pathologic findings with clinical implications. Am J Surg Pathol. 2008;32:799-809. [PubMed] [DOI] |