修回日期: 2010-05-14
接受日期: 2010-05-18
在线出版日期: 2010-06-28
目的: 研究硼替佐米对TRAIL诱导胃癌细胞凋亡的影响, 探讨PI3K/Akt通路在TRAIL诱导凋亡中的作用.
方法: 不同浓度的TRAIL和/或硼替佐米作用于人胃癌细胞系MGC803细胞, MTT法检测细胞存活率, 流式细胞术PI染色检测细胞凋亡. Western blot法检测caspase裂解及p-Akt表达水平的变化.
结果: 50 nmol/L硼替佐米预处理细胞2 h, 之后予100 μg/L TRAIL继续作用24 h, 细胞存活率明显低于TRAIL单独处理组(35.1%±2.7% vs 71.0%±4.3%, P<0.01); 细胞凋亡率明显高于TRAIL单药组(31.3%±2.0% vs 8.2%±0.8%, P<0.01). 20 nmol/L硼替佐米预处理未能增强细胞对TRAIL的敏感性. 进一步研究发现, TRAIL可活化PI3K/Akt通路, 硼替佐米预处理可阻止PI3K/Akt通路的活化, 进而增强细胞对TRAIL诱导凋亡的敏感性.
结论: 硼替佐米通过抑制TRAIL诱导的PI3K/ Akt通路活化, 增强胃癌MGC803细胞对TRAIL诱导凋亡的敏感性.
引文著录: 刘静, 徐玲, 刘云鹏, 曲秀娟, 张晔, 侯科佐, 胡雪君, 姜又红. 硼替佐米抑制PI3K/Akt通路增强胃癌细胞对TRAIL诱导凋亡的敏感性. 世界华人消化杂志 2010; 18(18): 1854-1859
Revised: May 14, 2010
Accepted: May 18, 2010
Published online: June 28, 2010
AIM: To investigate the effect of bortezomib on TRAIL-induced apoptosis in human gastric cancer cells, and to elucidate the role of the phosphoinositide 3-kinases (PI3K)/Akt signaling pathway in TRAIL-induced apoptosis of gastric cancer cells.
METHODS: Human gastric cancer MGC803 cells were cultured and treated with TRAIL and/or bortezomib. Cell viability was determined by MTT assay. Apoptosis was detected by flow cytometry. Caspase cleavage and the level of phosphor-Akt were determined by Western blot.
RESULTS: Cells were treated with either 20 or 50 nmol/L bortezomib, or 100 μg/L TRAIL for 24 h, or pretreated with bortezomib for 2 h followed by exposure to TRAIL for an additional 24 h. Compared with cells treated with TRAIL alone, cell viability was obviously lower and apoptosis rate was obviously higher in cells co-treated with TRAIL and 50 nmol/L bortezomib (cell viability: 35.1% ± 2.7% vs 71.0% ± 4.3%, P < 0.01; apoptosis rate: 31.3% ± 2.0% vs 8.2% ± 0.8%, P < 0.01). Pretreatment with 20 nmol/L bortezomib did not enhance the sensitivity of cells to TRAIL-induced apoptosis. TRAIL engagement led to PI3K/Akt activation. Bortezomib blocked the activation of PI3K/Akt signaling and enhanced the sensitivity of cells to TRAIL-induced apoptosis.
CONCLUSION: Bortezomib enhances TRAIL-induced apoptosis by blocking the activation of PI3K/Akt signaling pathway in human gastric cancer MGC803 cells.
- Citation: Liu J, Xu L, Liu YP, Qu XJ, Zhang Y, Hou KZ, Hu XJ, Jiang YH. Bortezomib enhances the sensitivity of gastric cancer cells to TRAIL-induced apoptosis by inhibiting the PI3K/Akt pathway. Shijie Huaren Xiaohua Zazhi 2010; 18(18): 1854-1859
- URL: https://www.wjgnet.com/1009-3079/full/v18/i18/1854.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i18.1854
胃癌是我国常见肿瘤, 其发病率及死亡率均居恶性肿瘤的前三位, 严重危害人类健康. 大约2/3的患者在发现时已属晚期, 无法行手术治疗. 目前晚期胃癌的治疗以化疗为主, 但是疗效较差, 5年生存率不足10%[1]. NCCN推荐的化疗方案如DCF, ECF等, 毒性较大, 国人难以耐受. 因此, 需要寻找新的有效的抗肿瘤药物, 以增强胃癌治疗疗效, 延长患者的生存时间. 肿瘤坏死因子相关凋亡诱导配体(tumor necrosis factor-related apoptosis-inducing ligand, TRAIL)是肿瘤坏死因子超家族成员之一, 体内外研究已证实可诱导多种肿瘤细胞凋亡, 而对正常细胞毒性很小, 是很有潜力的新型抗肿瘤药物[2,3]. 然而研究也显示一些肿瘤细胞对TRAIL诱导的凋亡存在天然或获得性耐药[4,5]. 我们之前的研究结果提示, 胃癌细胞对TRAIL诱导的凋亡也存在耐药现象[6]. 硼替佐米是一种新型蛋白酶体抑制剂, 已被批准用于多发性骨髓瘤和淋巴瘤的治疗[7]. 有报道硼替佐米可增强肺癌, 卵巢癌和胰腺癌对TRAIL诱导凋亡的敏感性, 但对TRAIL诱导胃癌细胞凋亡的影响尚不清楚[8-10]. 本研究将硼替佐米与TRAIL在胃癌中联合应用, 探讨硼替佐米对TRAIL诱导凋亡的影响, 以及对PI3K/Akt活性的影响, 进而探讨硼替佐米增强TRAIL抗肿瘤活性的机制.
重组人TRAIL/Apo2L购自Cytolab/Peprotech公司; 硼替佐米购自Millennium Pharmaceuticals公司, RPMI 1640培养基购自Gibco公司; 胎牛血清购自天津血液研究所; 碘化丙啶(PI), LY294002购自Sigma-Aldrich公司; RNaseA购自AMRESCO公司; 抗caspase-3, p-Akt, Akt及tubulin抗体购自Santa Cruz公司; 抗caspase-8抗体购自NeoMarkers公司. 辣根过氧化物酶标记的二抗购于北京中杉金桥生物技术有限公司; ECL试剂盒购于PIERCE公司.
1.2.1 细胞培养: 人胃癌细胞株MGC803为本实验室常规传代培养, 生长于含有100 mL/L灭活胎牛血清, 青霉素(100 kU/L)和链霉素(100 g/L)的RPMI 1640培养基中, 于37 ℃, 50 mL/L CO2, 饱和湿度的培养箱内培养. 细胞常规每2-3 d传代1次, 所有实验采用对数生长期细胞.
1.2.2 MTT法测定细胞活力: 取对数生长期细胞, 常规胰酶消化成单个细胞悬液, 将细胞浓度调至1×105/mL, 接种于96孔板, 于培养箱内孵育过夜后, 每孔加入不同浓度的TRAIL和/或硼替佐米, 孵育24 h, 之后加入20 μL MTT(5 g/L), 继续孵育4 h. 吸走上清, 每孔加入200 μL DMSO, 振荡摇匀. 用酶标仪于570 nm波长测定吸光度值(A值). 按照下列公式计算细胞活力: 细胞活力(%) = (实验组A值/对照组A值)×100%.
1.2.3 流式细胞术检测细胞凋亡: 细胞以3×105个/孔的密度接种于六孔板, 孵育过夜后加入不同浓度的TRAIL和/或硼替佐米, 24 h后收集细胞, PBS洗2次, 70%冷乙醇固定过夜. 之后再用PBS洗2次, 加入20 mg/L RNase A, 37 ℃孵育30 min, 之后加入10 mg/L碘化丙啶(PI), 避光孵育30 min. 使用流式细胞术进行检测, WinMDI软件进行数据分析.
1.2.4 Western blot检测蛋白表达变化: 收集细胞, PBS洗2次, 加入1% Triton裂解液(1% Triton X-100, 50 mmol/L Tris-Cl[pH7.4], 150 mmol/L NaCl, 10 mmol/L EDTA, 100 mmol/L NaF, 1 mmol/L Na3VO4, 1 mmol/L PMSF, 2 mg/L aprotinin), 冰上裂解30 min, 之后高速离心(15 000 g)30 min, 取上清, Lowry法进行蛋白定量. 将样品与3×样品缓冲液混合后, 煮沸5 min, 于10%-15%的SDS-聚丙烯凝胶中进行电泳, 之后电转移至硝酸纤维素膜上, 5%脱脂牛奶封闭1 h, 加入一抗4 ℃孵育过夜. TBST(10 mmol/L Tris[pH7.4], 150 mmol/L NaCl, 0.1% Tween 20)洗4次后, 加入辣根过氧化物酶标记的二抗, 室温下孵育30 min, TBST洗后, ECL法显色, GIS凝胶图像分析系统成像并分析处理.
统计学处理 采用SPSS13.0统计软件进行统计学分析. 所有数据均为3次独立实验结果, 以mean±SD表示. 两组间差异采用t检验, P<0.05 认为有统计学意义.
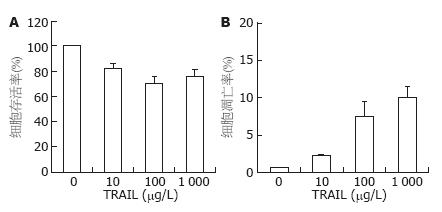
10, 100及1 000 μg/L TRAIL作用于MGC803细胞24 h, 细胞存活率分别为82.0%±4.4%, 70.7%±5.1%及75.7%±4.9%(图1A); 细胞凋亡率分别为2.3%±0.1%, 7.5%±2.1%及9.9%±1.6%(图1B). 这些数据提示MGC803细胞对TRAIL诱导的凋亡耐药.
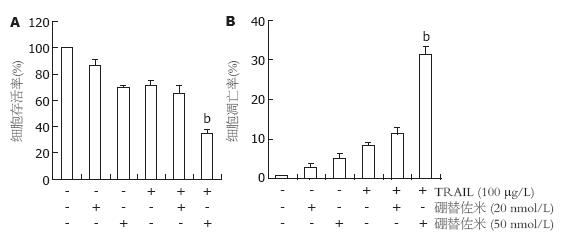
20 nmol/L及50 nmol/L硼替佐米单独作用细胞24 h, 细胞存活率分别为86.6%±4.9%及69.9%±1.5%, 细胞凋亡率分别为2.8%±1.0%及5.1%±1.2%. 50 nmol/L硼替佐米预处理细胞2 h, 之后再予100 μg/L TRAIL处理24 h, 细胞存活率明显低于TRAIL单独处理组(35.1%±2.7% vs 71.0%±4.3%, P<0.01, 图2A), 细胞凋亡率明显升高(31.3%±2.0% vs 8.2%±0.8%, P<0.01, 图2B). 20 nmol/L硼替佐米预处理细胞不能增强TRAIL的诱导凋亡作用.
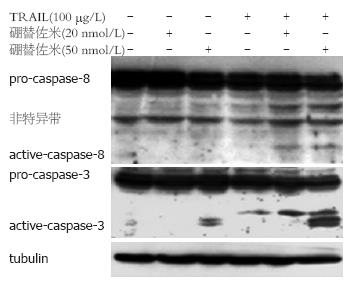
100 μg/L TRAIL单独作用细胞24 h, 不能裂解caspase-8及caspase-3. 50 nmol/L硼替佐米预处理细胞2 h后, 再予TRAIL作用24 h, 可见到caspase-8被裂解, 产生活化片段, 并继而裂解caspase-3, 同时可见caspase-3及caspase-8前体减少. 20 nmol/L硼替佐米预处理虽能裂解部分caspase-8, 但未能完全裂解caspase-3, 且caspase前体无明显变化(图3).
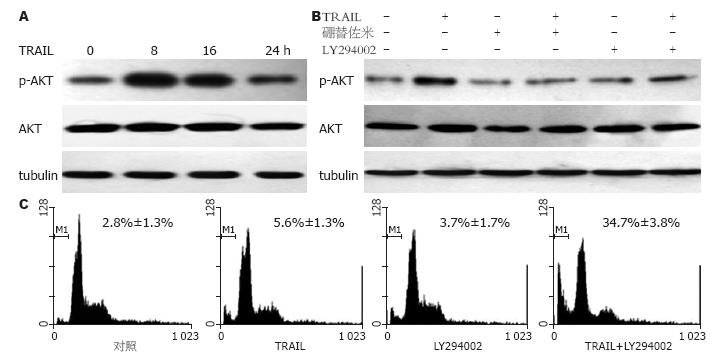
100 μg/L的TRAIL处理细胞8, 16及24 h, 可以检测到Akt被磷酸化, p-Akt水平在8 h时达高峰, 16 h及24 h有所下降, 但仍高于基线水平(图4A). 使用50 nmol/L硼替佐米预处理细胞2 h, 之后再予TRAIL作用8 h, 磷酸化Akt水平被抑制至基线水平, 其抑制程度与PI3K特异性抑制剂LY294002相近(图4B). 为进一步验证PI3K/Akt通路活性与TRAIL诱导凋亡的关系, 我们检测了LY294002对TRAIL诱导凋亡的影响. 如图4C所示, 同TRAIL单药组相比, LY294002(25 μmol/L)预处理细胞1 h后再予TRAIL作用24 h, 细胞凋亡的百分比明显升高(34.7%±3.8% vs 5.6%±1.3%, P<0.01), 提示抑制PI3K/Akt通路活性是硼替佐米增强TRAIL诱导凋亡作用的机制之一.
TRAIL对胃癌细胞的有限毒性提出了一个新的问题, 即如何克服胃癌细胞对TRAIL的耐药性, 从而使这一安全的特异性抗肿瘤药物更好的应用于胃癌的临床治疗. 之前的研究显示一些化学制剂可以增强TRAIL对不同肿瘤细胞的诱导凋亡作用, 然而克服胃癌细胞对TRAIL的耐药相关研究十分有限, 仅在近几年发现少数化合物可增强胃癌细胞对TRAIL的敏感性[6,11-13]. 硼替佐米作为一种新型抗肿瘤生物制剂, 已经在多种肿瘤细胞中显示出很好的抗肿瘤活性. 除多发性骨髓瘤和套细胞淋巴瘤外, 硼替佐米与化疗药的联合方案已在其他肿瘤如肺癌, 结肠癌中进行Ⅰ, Ⅱ期临床实验研究[14,15]. 有报道不同剂量的硼替佐米可增强TRAIL对其他肿瘤细胞的诱导凋亡作用[8-10]. 在本研究中, 我们首次报告了低浓度硼替佐米可以显著增强胃癌细胞对TRAIL的敏感性, 逆转对TRAIL的耐药. 这一发现为胃癌的内科治疗提供了又一有潜力的治疗措施.
TRAIL主要通过外源性途径诱导细胞凋亡. 当TRAIL与死亡受体结合后, 形成的死亡诱导凋亡信号复合体可募集无活性的caspase-8, 使其发生裂解而活化. 如果caspase-8被充分裂解, 则下游的效应caspase被相继活化, 继而启动凋亡. 在本研究中, TRAIL单独处理细胞未能产生明显活化的caspase-8. 用50 nmol/L硼替佐米预处理细胞后再予TRAIL作用24 h, 可以见到明显活化的caspase-8, 进而活化caspase-3. 上述结果提示硼替佐米联合TRAIL促进了caspase的裂解, 进而增强细胞TRAIL诱导凋亡的敏感性.
研究表明TRAIL可激活生存通路, 拮抗其诱导凋亡作用[16]. 在众多生存通路中, PI3K/Akt通路在多种肿瘤细胞耐药中起重要作用[17]. 有报告静息状态下Akt过度活化的肿瘤细胞对TRAIL诱导的凋亡耐药[18]. 而关于TRAIL对Akt的活化及活化后的PI3K/Akt通路对TRAIL敏感性影响的报告较少. 最近Chen等[19]报道在肝癌细胞中TRAIL可诱导Akt磷酸化, 进一步增加肝癌细胞对TRAIL的耐药性. 本研究中静息状态下的胃癌细胞可检测到基础水平的Akt磷酸化, TRAIL作用后可诱导Akt的进一步磷酸化, 提示Akt通路的活化可能是胃癌细胞对TRAIL耐药的原因之一, 为胃癌细胞对TRAIL的耐药机制提出了一个新的见解.
虽然硼替佐米对TRAIL的增效作用已经在多种肿瘤细胞中证实, 但是其作用机制非常复杂, 在不同的细胞中可能涉及不同的分子机制. 有报告硼替佐米可以改变细胞内Akt通路活性, 提示Akt可能是硼替佐米的作用靶点之一[20]. 本研究发现在胃癌细胞中, 硼替佐米可以有效阻断TRAIL诱导的Akt磷酸化, 其阻断Akt磷酸化的能力与PI3K特异性抑制剂LY294002相近. 同时LY294002也可以明显增强TRAIL诱导的细胞凋亡, 提示硼替佐米逆转胃癌细胞对TRAIL诱导凋亡的耐药部分是通过抑制了TRAIL诱导的PI3K/Akt通路活化, 进而抑制了生存通路. 上述研究结果为胃癌的多药联合治疗提供了分子水平的依据.
总之, 我们的研究证实了在胃癌细胞中, 低浓度硼替佐米可增强细胞对TRAIL诱导凋亡的敏感性, 其增效作用部分可能通过抑制了TRAIL引起的PI3K/Akt通路活化, 进而抑制生存通路. 这一研究结果提示硼替佐米与TRAIL的联合很可能成为今后胃癌治疗的联合用药方案.
硼替佐米作为一种新型蛋白酶体抑制剂, 可增强多种肿瘤细胞对TRAIL诱导凋亡的敏感性, 本文探讨了硼替佐米对TRAIL诱导胃癌细胞凋亡的影响及机制.
曹秀峰, 教授, 南京医科大学附属南京第一医院肿瘤中心
胃癌对TRAIL耐药原因目前尚不明确, 需要深入探讨机制及逆转方法.
Kozuch等于2008年报道硼替佐米与化疗药伊立替康的联合方案已在结肠癌中进行Ⅱ期临床实验研究, 提示硼替佐米可能是有效的 TRAIL增敏剂, 值得在其他肿瘤中进一步研究.
文章中通过将硼替佐米与TRAIL在胃癌中联合应用, 证实了低浓度硼替佐米可增强细胞对TRAIL诱导凋亡的敏感性, 提示硼替佐米与TRAIL的联合很可能成为今后治疗胃癌的联合用药方案.
晚期胃癌的治疗疗效较差, 新的联合用药方案的发现是提高疗效的关键. 本文通过研究硼替佐米对TRAIL诱导胃癌细胞凋亡的影响, 为临床制定合理的联合用药方案提供了重要的理论依据.
本研究选题新颖性强, 设计合理, 结果可靠, 文章的科学性、创新性和可读性能较好地反映我国胃肠病学基础研究的先进水平.
编辑 曹丽鸥 电编 何基才
| 1. | Liakakos T, Roukos DH. More controversy than ever - challenges and promises towards personalized treatment of gastric cancer. Ann Surg Oncol. 2008;15:956-960. [PubMed] [DOI] |
| 2. | Ashkenazi A. Targeting death and decoy receptors of the tumour-necrosis factor superfamily. Nat Rev Cancer. 2002;2:420-430. [PubMed] [DOI] |
| 3. | Ashkenazi A, Pai RC, Fong S, Leung S, Lawrence DA, Marsters SA, Blackie C, Chang L, McMurtrey AE, Hebert A. Safety and antitumor activity of recombinant soluble Apo2 ligand. J Clin Invest. 1999;104:155-162. [PubMed] [DOI] |
| 4. | Wang P, Zhang J, Bellail A, Jiang W, Hugh J, Kneteman NM, Hao C. Inhibition of RIP and c-FLIP enhances TRAIL-induced apoptosis in pancreatic cancer cells. Cell Signal. 2007;19:2237-2246. [PubMed] [DOI] |
| 5. | Song JH, Tse MC, Bellail A, Phuphanich S, Khuri F, Kneteman NM, Hao C. Lipid rafts and nonrafts mediate tumor necrosis factor related apoptosis-inducing ligand induced apoptotic and nonapoptotic signals in non small cell lung carcinoma cells. Cancer Res. 2007;67:6946-6955. [PubMed] [DOI] |
| 6. | Xu L, Qu X, Zhang Y, Hu X, Yang X, Hou K, Teng Y, Zhang J, Sada K, Liu Y. Oxaliplatin enhances TRAIL-induced apoptosis in gastric cancer cells by CBL-regulated death receptor redistribution in lipid rafts. FEBS Lett. 2009;583:943-948. [PubMed] [DOI] |
| 7. | Sterz J, von Metzler I, Hahne JC, Lamottke B, Rademacher J, Heider U, Terpos E, Sezer O. The potential of proteasome inhibitors in cancer therapy. Expert Opin Investig Drugs. 2008;17:879-895. [PubMed] [DOI] |
| 8. | Liu X, Yue P, Chen S, Hu L, Lonial S, Khuri FR, Sun SY. The proteasome inhibitor PS-341 (bortezomib) up-regulates DR5 expression leading to induction of apoptosis and enhancement of TRAIL-induced apoptosis despite up-regulation of c-FLIP and survivin expression in human NSCLC cells. Cancer Res. 2007;67:4981-4988. [PubMed] [DOI] |
| 9. | Saulle E, Petronelli A, Pasquini L, Petrucci E, Mariani G, Biffoni M, Ferretti G, Scambia G, Benedetti-Panici P, Cognetti F. Proteasome inhibitors sensitize ovarian cancer cells to TRAIL induced apoptosis. Apoptosis. 2007;12:635-655. [PubMed] [DOI] |
| 10. | Bai J, Sui J, Demirjian A, Vollmer CM, Marasco W, Callery MP. Predominant Bcl-XL knockdown disables antiapoptotic mechanisms: tumor necrosis factor-related apoptosis-inducing ligand-based triple chemotherapy overcomes chemoresistance in pancreatic cancer cells in vitro. Cancer Res. 2005;65:2344-2352. [PubMed] [DOI] |
| 11. | Ishiguro K, Ando T, Maeda O, Ohmiya N, Niwa Y, Kadomatsu K, Goto H. Ginger ingredients reduce viability of gastric cancer cells via distinct mechanisms. Biochem Biophys Res Commun. 2007;362:218-223. [PubMed] [DOI] |
| 12. | Chaudhari AA, Seol JW, Kim SJ, Lee YJ, Kang HS, Kim IS, Kim NS, Park SY. Reactive oxygen species regulate Bax translocation and mitochondrial transmembrane potential, a possible mechanism for enhanced TRAIL-induced apoptosis by CCCP. Oncol Rep. 2007;18:71-76. [PubMed] |
| 13. | Jin CY, Park C, Cheong J, Choi BT, Lee TH, Lee JD, Lee WH, Kim GY, Ryu CH, Choi YH. Genistein sensitizes TRAIL-resistant human gastric adenocarcinoma AGS cells through activation of caspase-3. Cancer Lett. 2007;257:56-64. [PubMed] [DOI] |
| 14. | Davies AM, Chansky K, Lara PN, Gumerlock PH, Crowley J, Albain KS, Vogel SJ, Gandara DR. Bortezomib plus gemcitabine/carboplatin as first-line treatment of advanced non-small cell lung cancer: a phase II Southwest Oncology Group Study (S0339). J Thorac Oncol. 2009;4:87-92. [PubMed] [DOI] |
| 15. | Kozuch PS, Rocha-Lima CM, Dragovich T, Hochster H, O'Neil BH, Atiq OT, Pipas JM, Ryan DP, Lenz HJ. Bortezomib with or without irinotecan in relapsed or refractory colorectal cancer: results from a randomized phase II study. J Clin Oncol. 2008;26:2320-2326. [PubMed] [DOI] |
| 16. | Zhang L, Fang B. Mechanisms of resistance to TRAIL-induced apoptosis in cancer. Cancer Gene Ther. 2005;12:228-237. [PubMed] [DOI] |
| 17. | Cully M, You H, Levine AJ, Mak TW. Beyond PTEN mutations: the PI3K pathway as an integrator of multiple inputs during tumorigenesis. Nat Rev Cancer. 2006;6:184-192. [PubMed] [DOI] |
| 18. | Dida F, Li Y, Iwao A, Deguchi T, Azuma E, Komada Y. Resistance to TRAIL-induced apoptosis caused by constitutional phosphorylation of Akt and PTEN in acute lymphoblastic leukemia cells. Exp Hematol. 2008;36:1343-1353. [PubMed] [DOI] |
| 19. | Chen KF, Yeh PY, Hsu C, Hsu CH, Lu YS, Hsieh HP, Chen PJ, Cheng AL. Bortezomib overcomes tumor necrosis factor-related apoptosis-inducing ligand resistance in hepatocellular carcinoma cells in part through the inhibition of the phosphatidylinositol 3-kinase/Akt pathway. J Biol Chem. 2009;284:11121-11133. [PubMed] [DOI] |
| 20. | Chen KF, Yeh PY, Yeh KH, Lu YS, Huang SY, Cheng AL. Down-regulation of phospho-Akt is a major molecular determinant of bortezomib-induced apoptosis in hepatocellular carcinoma cells. Cancer Res. 2008;68:6698-6707. [PubMed] [DOI] |