修回日期: 2010-04-29
接受日期: 2010-05-10
在线出版日期: 2010-06-18
目的: 探讨肝脏切除术后标准残肝体积(standard remnant liver volume, SRLV)大小与患者术后肝功能代偿不全的关系.
方法: 对我院2007-03/2008-02收治的75例因肝癌行肝切除术的患者进行研究, 术前采用CT测定患者的全肝体积, 术中被切除的肝脏组织的体积由排水法测定, 全肝体积与术中切除肝脏组织体积之差除以患者的体表面积即为标准残肝体积. 根据术后患者肝功能代偿状况进行分组, 比较不同组间标准残肝体积均数的差异; 并根据标准残肝体积再分组, 比较组间术后发生肝功能中、重度代偿不全发生率的差异.
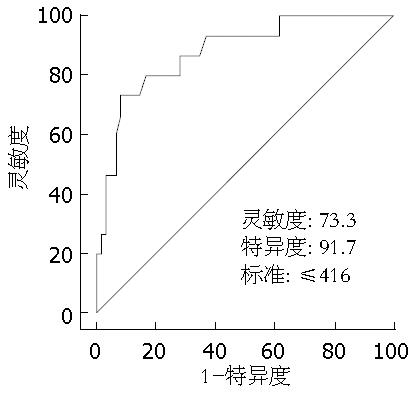
结果: 术后肝功能轻度代偿不全组60例, 中度代偿不全组12例, 重度代偿不全组3例(因重度代偿不全组例数过少, 纳入中度代偿不全组进行统计分析). 术后肝功能轻度代偿不全组标准残肝体积均值为545±93 mL/m2, 而术后肝功能中、重度代偿不全组仅为398±82 mL/m2, 两者间比较有统计学差异(P<0.001), 术后发生肝功能中、重度代偿不全患者标准残肝体积较小. 按标准残肝体积416 mL/m2为界将所有患者分为两组, A组SRLV≤416 mL/m2, 而B组SRLV>416 mL/m2, 两组术后肝功能中、重度代偿不全发生率分别为68.8%和6.8%, 组间差异有显著性意义(P<0.001), SRLV≤416 mL/m2术后肝功能中、重度代偿不全发生率较高.
结论: 标准残肝体积是评估肝切除术患者肝脏储备功能的有效且简便的方法, 对预测患者术后发生肝功能损害的程度及避免患者术后发生肝功能衰竭有重要的临床指导作用.
引文著录: 陈熙, 杜正贵, 李波, 魏永刚, 严律南, 文天夫. 标准残肝体积对肝脏储备功能的评价. 世界华人消化杂志 2010; 18(17): 1829-1833
Revised: April 29, 2010
Accepted: May 10, 2010
Published online: June 18, 2010
AIM: To investigate the relationship between the size of standard remnant liver volume (SRLV) and liver insufficiency after liver resection.
METHODS: Seventy-five patients with hepatocellular carcinoma who underwent liver resection from March 2007 to February 2008 at West China Hospital were included in our study. All the patients received CT examination to estimate the total liver volume before operation. The volume of resected liver during the operation was estimated by drainage. The standard remnant liver volume was expressed as the difference between the total liver volume and the resected liver volume divided by the body surface area of patients. The patients were divided into two groups based on the level of liver function compensation after hepatectomy to compare the differences in standard remnant liver volume. Then the patients were divided into two groups according to standard remnant liver volume to compare the incidence of moderate and severe liver insufficiency.
RESULTS: Mild, moderate and severe liver insufficiency was noted in 60, 12 and 3 patients, respectively. The average standard remnant liver volume was significantly higher in patients with mild liver insufficiency than in those with moderate or severe liver insufficiency (545 mL/m2 ± 93 mL/m2vs 398 mL/m2 ± 82 mL/m2). According to the standard remnant liver volume, the patients were divided into two groups: group A (≤ 416 mL/m2) and group B (> 416 mL/m2). The incidence of moderate and severe liver insufficiency was significantly higher in the group A than in the group B (68.8% vs 6.8%).
CONCLUSION: Standard remnant liver volume (SRLV) is an effective parameter to evaluate hepatic function reserve in patients undergoing hepatectomy and can be used to predict and avoid liver dysfunction after hepatectomy.
- Citation: Chen X, Du ZG, Li B, Wei YG, Yan LN, Wen TF. Value of measurement of standard remnant liver volume in the evaluation of liver reserve function. Shijie Huaren Xiaohua Zazhi 2010; 18(17): 1829-1833
- URL: https://www.wjgnet.com/1009-3079/full/v18/i17/1829.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i17.1829
随着CT成像设备、扫描和重建技术的不断进步, 精确测量肝脏体积以及预计残留肝体积已成为可能. 最开初肝脏体积测定用于活体肝移植供体术前评估, 目前已可以通过多排螺旋CT对活体肝移植供体肝脏进行术前CT体积测量, 通过公式较为精确的计算出对应的移植肝质量, 为供体的选择和制定恰当的手术方案提供重要依据[1], 随之这种技术被广泛用于评价肝叶切除时患者的耐受性, 因为肝体积大小可以反映肝脏实质细胞容量的变化, 从而与肝功能储备有关. 在国内外, 肝脏体积已被视为与Child-Pugh分级同等重要的评价患者肝脏储备功能指标[2,3]. 肝实质切除率与术后肝功能不全的关系已有文献报道, 肝切除量的多少与术后肝功能衰竭有关[4]. 然而由于不同个体间身高体重存在较明显的差异, 相同的残肝体积在不同的个体表现出的肝脏储备功能亦有所不同, 而以体表面积标准化的残肝体积缩小了个体间的差异, 使个体间的比较成为可能. 因此, 本研究旨在采用标准残肝体积对四川大学华西医院收治的75例因肝癌行肝切除术患者的肝脏储备功能进行评价.
选取四川大学华西医院普外科2007-03/2008-02因肝癌行肝切除术的患者75例, 其中男66例, 女9例, 年龄31-62(平均50.4)岁. 肝脏切除术的手术方式取决于肿瘤位置和肿瘤侵犯的范围, 以及其他临床、生化指标如ICG试验、血总胆红素、腹水等. 手术方式: 肿瘤局部切除23例, 左半肝切除6例, 左外叶切除12例, 右半肝切除18例, 右前叶切除8例, 右后叶切除7例, 尾状叶切除1例. 所有患者术后标本均行病理检查证实为肝细胞肝癌, 并且发现59例患者术后合并结节性肝硬化, 肝硬化合并率为78.7%. 纳入标准: 接受术前吲哚氰绿排泄试验和肝癌切除术的原发性肝细胞癌患者. 排除标准: (1)胆管细胞癌或肝脏转移癌; (2)梗阻性黄疸; (3)未接受肝癌切除术治疗; (4)术前接受放化疗或介入治疗者; (5)术前未接受吲哚氰绿排泄试验.
1.2.1 术前肝功能检查: 所有患者术前均行常规肝功能检查, 依据检查结果进行Child-Pugh评分并分级.
1.2.2 测定患者体质量, 身高, 计算患者体表面积: 计算公式根据参考文献[5]为: 体表面积(m2) = 0.0061×身高(cm)+0.0128×体质量(kg)-0.1529.
1.2.3 CT检查及术前肝脏体积测定: 所有患者均于术前行CT检查, 并测定其术前肝脏总体积.
1.2.4 术中切除肝脏组织体积测量: 术中切除的肝脏组织包括肿瘤和肿瘤周围的肝脏组织, 可采用排水法测量其总体积并记录, 精确度达到10 mL. 同时计算患者残留肝体积(患者术前CT测得全肝体积与术中切除肝脏组织体积之差), 并与计算所得患者体表面积相除而得到患者的标准残肝体积. 标准残肝体积计算公式为: 标准残肝体积 = 残肝体积/患者体表面积 = (CT测全肝体积-实测肝切除体积)/患者体表面积.
1.2.5 术后肝功能恢复判断标准: 肝功能损害判断标准参照文献[6].
统计学处理 试验数据中的计量资料均以mean±SD表示, 两组间均数比较采用t检验, 如数据不呈正态分布或方差不齐, 则采用秩和检验; 计数资料率的比较采用χ2检验; 采用相关检验处理相关分析, 检验水准P<0.05. 所有统计分析均用SPSS13.0统计软件与MedCalc 7.5统计软件完成.
行肝脏切除术患者术后肝功能轻度代偿不全组、中度肝功能代偿不全组、重度肝功能代偿不全组分别为60例、12例、3例. 因重度肝功能代偿不全组例数过少, 并入中度肝功能代偿不全组进行统计比较. 轻度代偿不全组(n = 60)与中、重度肝功能代偿不全组(n = 15), 两组间各项指标均数比较, 术前全肝体积测定无统计学差异, 而标准残肝体积却有统计学差异, 在中、重度代偿不全组患者切除体积大于轻度代偿不全组, 而术后残肝体积和标准残肝体积均小于轻度代偿不全组(表1).
| 代偿不全组 | P值 | ||
| 轻度 | 中、重度 | ||
| 术前全肝体积 | 1 269±266 | 1 427±379 | 0.063 |
| 标准残肝体积 | 545±93 | 398±82 | <0.010 |
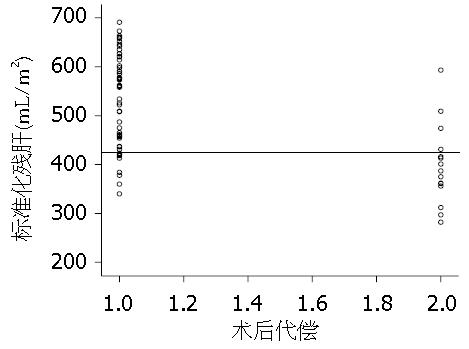
由MedCalc 7.5统计软件的受试者操作曲线分析计算出患者术后发生中、重度肝功能代偿不全时的标准残肝体积的临界值为416 mL/m2(图1), 按此标准将所有患者分为两组, A组(SRLV 416 mL/m2)共有16例, 其中5例术后表现为肝功能轻度代偿不全, 11例术后发生中、重度代偿不全, 中、重度代偿不全发生率为68.8%. B组(SRLV>416 mL/m2)共有59例, 其中55例术后表现为肝功能轻度代偿不全, 4例术后发生中、重度代偿不全, 中、重度代偿不全发生率为6.8%. 两组间比较有统计学差异(P<0.001), 标准残肝体积 416 mL/m2组术后肝功能中、重度代偿不全发生率较高(表2, 图2).
| 分组 | 轻度代偿不全组 | 中、重度代偿不全组 | 中、重度代偿不全发生率(%) | 总计 |
| A组(≤416 mL/m2) | 5 | 11 | 68.8 | 16 |
| B组(>416 mL/m2) | 55 | 4 | 6.8b | 59 |
| 总计 | 60 | 15 | 20.0 | 75 |
一般情况下, 肝脏体积与肝脏的储备功能具有很强的相关性, 可以用于评估肝脏患者手术风险和指导选择治疗方式[2,6], 在国外己被视为与Child分级同等重要的评价肝脏储备功能的指标[3]. 近年来随着各种影像检查技术飞速发展, 螺旋CT, 磁共振(MR), 超声不断更新换代, 为临床提供了更好的测量肝脏体积的手段. Wigmore等[7]采用CT三维成像技术不仅测量出肝脏解剖学体积, 而且还计算出实质肝脏切除率及剩余肝脏体积, 后两者均为正确估计肝切除量提供了一种有效的方法.
肝脏切除术后发生肝功能代偿不全甚至肝功能衰竭主要与术后残肝体积大小相关. 肝切除术前通过测定全肝体积并预计术后残肝体积对患者手术的安全性和切除范围的估计有重要意义. Gruttadauria等[8]通过由公式法求得的全肝体积减去根据肝段切除数量估计的手术切除量再减去肝脏脂肪变组织的体积, 计算得到有效肝脏组织体积, 他发现有效肝脏组织体积与术后早期死亡率及并发症率有密切关系, 从而证明了肝脏储备功能与有效肝脏组织体积间的联系, 对决定肝脏切除范围起到了一定指导作用. 目前临床上可通过多种软件重建肝脏的三维模型, 不仅可直观地显示肿块在肝脏中的位置以及和各主要血管胆道的关系, 而且可通过虚拟切除精确地估计残肝体积, 已成为肝脏外科手术不可缺少的工具[7,9].
国外对于残余肝体积的研究大多排除了肝炎肝硬化患者, 手术切除范围较广, 得出的结论为残肝体积 25%的患者中, 术后严重并发症增加[10]. Schindl等[11]得出的残肝分数(relative residual volume, %RLV)临界值为26.6%. Shoup等[12]利用三维体积CT在术前测量患者的全肝体积以及肿瘤体积进而得到残肝体积, 并将残肝体积与术后结果进行相关性分析后, 发现约90%的术后残肝体积小于25%全肝体积的患者都发生了肝功能不全. 国内潘华峰等[13]用CT检查测量肝脏体积和残肝体积来评估肝切除的安全性, 并与Child肝功能分级进行对比, 认为CT检查可更有效的预测肝癌手术切除的安全性.
Shirabe等[4]观察了80例肝切除患者, 发现标准残肝体积(standard remnant liver volume, SRLV)是术后肝衰竭的重要因素,标准残肝体积<250 mL/m2者术后肝衰竭发生率为38%(7/20), 而>250 mL/m2者肝衰竭发生率为0. 在我国, 肝癌伴肝硬化率高, 我国1949-1979年500例尸检肝癌的肝硬化合并率为84.6%[14], 第二军医大学报告1 102例手术切除的肝癌中, 合并肝硬化者占85.2%[15], 伴有肝硬化时肝脏的再生能力明显降低, 所以我们不能简单的利用国外关于标准残肝体积临界值的研究结果.
本研究发现术后肝功能轻度代偿不全组与中、重度代偿不全组术前经CT测量的全肝体积组间比较差异无显著性意义(P>0.05). 而术中切除体积、术后残肝体积以及标准残肝体积组间比较均有显著性差异(P<0.05), 在中、重度代偿不全组患者术中切除体积大于轻度代偿不全组, 而术后残肝体积和标准残肝体积均小于轻度代偿不全组, 这与国外的研究结果一致, 表明切除体积、术后残肝体积以及标准残肝体积均是影响术后肝功能代偿的因素. 然而术中切除体积受肿瘤大小影响较大, 术后残肝体积因未考虑个体间的差异, 此二者均不及SRLV理想.
本研究中由MedCalc 7.5统计软件的受试者操作曲线分析计算出术后发生中、重度肝功能代偿不全时标准残肝体积的临界值为416 mL/m2, 以此为界进行分组, 发现组间中、重度肝功能代偿不全发生率差有显著性差异(P<0.001), 标准残肝体积416 mL/m2术后肝功能中、重度代偿不全发生率较高. 该临界值大于Shirabe所确定的250 mL/m2主要有以下两方面原因: 一是研究确定的标准不一样, Shirabe是以术后是否发生肝衰为研究标准, 本研究则是以术后是否发生肝功能中、重度代偿不全为研究标准; 另一个原因是在我国大部分肝癌患者均伴有明显肝硬化, 而肝硬化患者相同的肝体积其肝脏储备功能差于无肝硬化患者.
我们可于术前通过CT三维重建测量患者的全肝体积, 通过虚拟切除精确地估计切除体积和残肝体积, 从而计算出患者术后标准残肝体积, 若此标准残肝体积416 mL/m2, 则患者术后发生肝功能中、重度代偿不全的风险较大, 手术方案需慎重考虑, 以保证患者安全. 由此我们认为标准残肝体积是评估肝切除术患者肝脏储备功能的有效且简便的方法, 对预测患者术后发生肝功能损害的程度及避免患者术后发生肝功能衰竭有重要的临床指导作用.
原发性肝癌的首选治疗方案是外科手术切除, 肝切除量的多少与术后患者发生肝功能衰竭有关, 近年来随着各种影像检查技术飞速发展, 螺旋CT, 磁共振(MR), 超声不断更新换代, 为临床提供了更好的测量肝脏残余体积的手段.
陈光, 教授, 吉林大学第一医院消化器官外科.
利用影像学手段测量出肝切除术后残余肝脏的体积, 并在残余肝脏体积与患者术后发生肝功能不全之间找到联系为治疗方案的选择及预测术后发生肝功能不全, 成为当今国内外学者研究热点.
Wigmore等采用CT三维成像技术不仅测量出肝脏解剖学体积, 而且还计算出实质肝脏切除率及剩余肝脏体积, 后两者均为正确估计肝切除量提供了一种有效的方法. Shoup等利用三维体积CT在术前测量患者的全肝体积以及肿瘤体积进而得到残肝体积, 并将残肝体积与术后结果进行相关性分析后, 发现约90%的术后残肝体积小于25%全肝体积的患者都发生了肝功能不全.
由于我国与国外肝癌发病原因不同, 造成我国肝癌患者大多伴有不同程度的肝硬化, 而肝硬化患者相同的肝体积其肝脏储备功能差于无肝硬化患者的, 故不能简单的套用国外关于残余肝体积临界值的研究结果. 本研究将肝硬化这一因素考虑其中, 更符合我国实际情况.
标准残肝体积是评估肝切除术患者肝脏储备功能的有效且简便的方法, 对患者治疗方案的选择及预测术后发生肝功能损害的程度, 避免发生肝功能衰竭有重要的临床指导作用.
本研究设计合理, 论据充分, 有临床实际意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | 袁 元, 宋 彬, 吴 苾, 徐 隽, 李 迎春. 活体肝移植供体术前肝脏CT测量体积与术中脏质量的关系研究. 四川大学学报(医学版). 2007;38:526-528. |
| 3. | Schiano TD, Bodian C, Schwartz ME, Glajchen N, Min AD. Accuracy and significance of computed tomographic scan assessment of hepatic volume in patients undergoing liver transplantation. Transplantation. 2000;69:545-550. [PubMed] [DOI] |
| 4. | Shirabe K, Shimada M, Gion T, Hasegawa H, Takenaka K, Utsunomiya T, Sugimachi K. Postoperative liver failure after major hepatic resection for hepatocellular carcinoma in the modern era with special reference to remnant liver volume. J Am Coll Surg. 1999;188:304-309. [PubMed] [DOI] |
| 7. | Wigmore SJ, Redhead DN, Yan XJ, Casey J, Madhavan K, Dejong CH, Currie EJ, Garden OJ. Virtual hepatic resection using three-dimensional reconstruction of helical computed tomography angioportograms. Ann Surg. 2001;233:221-226. [PubMed] [DOI] |
| 8. | Gruttadauria S, Vasta F, Minervini MI, Piazza T, Arcadipane A, Marcos A, Gridelli B. Significance of the effective remnant liver volume in major hepatectomies. Am Surg. 2005;71:235-240. [PubMed] |
| 9. | Rau HG, Schauer R, Helmberger T, Holzknecht N, von Rückmann B, Meyer L, Buttler E, Kessler M, Zahlmann G, Schuhmann D. Impact of virtual reality imaging on hepatic liver tumor resection: calculation of risk. Langenbecks Arch Surg. 2000;385:162-170. [PubMed] [DOI] |
| 10. | Vauthey JN, Chaoui A, Do KA, Bilimoria MM, Fenstermacher MJ, Charnsangavej C, Hicks M, Alsfasser G, Lauwers G, Hawkins IF. Standardized measurement of the future liver remnant prior to extended liver resection: methodology and clinical associations. Surgery. 2000;127:512-519. [PubMed] [DOI] |
| 11. | Schindl MJ, Redhead DN, Fearon KC, Garden OJ, Wigmore SJ. The value of residual liver volume as a predictor of hepatic dysfunction and infection after major liver resection. Gut. 2005;54:289-296. [PubMed] [DOI] |
| 12. | Shoup M, Gonen M, D'Angelica M, Jarnagin WR, DeMatteo RP, Schwartz LH, Tuorto S, Blumgart LH, Fong Y. Volumetric analysis predicts hepatic dysfunction in patients undergoing major liver resection. J Gastrointest Surg. 2003;7:325-330. [PubMed] [DOI] |