修回日期: 2010-05-20
接受日期: 2010-05-27
在线出版日期: 2010-06-18
目的: 探讨肝肉瘤样癌患者的临床病理学特征、诊断、鉴别诊断、治疗方法和预后.
方法: 以我院收治的1例肝肉瘤样癌患者为对象, 分析其临床表现及诊疗经过, 并进行随访, 同时对送检标本进行病理学检查, 结合有关文献探讨该病的临床病理学特点.
结果: 肿瘤位于肝脏右后叶, 呈浸润性生长. 组织学上可见上皮源性肿瘤成分与梭形细胞肉瘤成分同时存在并伴有移行现象; 肿瘤中见大片凝固性坏死. 免疫组织化学显示肿瘤细胞呈CK(Pan)和EMA强阳性, AFP和Hepar-1呈弱阳性表达, 免疫组织化学阴性为: CK7, CK8, CK18, CK(H), CD34, CD117, Dog-1, Actin, SMA, Caldesmon, Desmin, CD10, CD21, CD23, CD35, CD1a, CD2, CD3, CD20, CD45, ALK, CD68, CD163, CD30, CD15, HMB45, S-100. 病理诊断: 肝肉瘤样癌.
结论: 肝肉瘤样癌是一种罕见的高度恶性肿瘤, 临床与病理上需要与肝癌肉瘤、炎症性滤泡树突细胞肉瘤、炎性肌纤维母细胞肉瘤等相鉴别, 预后与肿瘤分期有关.
引文著录: 黄海建, 余英豪, 郑智勇. 肝肉瘤样癌的临床病理特征. 世界华人消化杂志 2010; 18(17): 1780-1785
Revised: May 20, 2010
Accepted: May 27, 2010
Published online: June 18, 2010
AIM: To explore the clinical and pathological features of sarcomatoid hepatocellular carcinoma and to discuss its diagnosis, differential diagnosis, treatment and prognosis.
METHODS: One case of sarcomatoid hepatocellular carcinoma was treated at our hospital. The clinical, pathological, histopathological and immunohistological features, diagnosis and treatment of this disease were investigated. A literature review was performed to summarize the characteristics of the disease.
RESULTS: The tumor was located in the right lobe of the liver, demonstrating an infiltrative growth pattern. Histopathological and immunohistochemistry analyses showed coexistence of epithelial carcinoma and spindle cell sarcoma and presence of transitional area between carcinoma and sarcoma. Coagulative necrosis was noted in some areas of the tumor. Immunohistochemistrically, the tumor cells were strongly positive for CK (Pan) and EMA, weakly positive for AFP and Hepar-1, and negative for CK7, CK8, CK18, CK (H), CD34, CD117, Dog-1, Actin, SMA, Caldesmon, Desmin, CD10, CD21, CD23, CD35, CD1a, CD2, CD3, CD20, CD45, ALK, CD68, CD163, CD30, CD15, HMB45 and S-100.
CONCLUSION: Sarcomatoid hepatocellular carcinoma is a rare tumor with high malignancy. Clinically, differential diagnosis is needed to distinguish sarcomatoid hepatocellular carcinoma from hepatic carcinosarcoma, inflammatory follicular dendritic cell sarcoma and inflammatory myofibroblastoma. The prognosis of sarcomatoid hepatocellular carcinoma is correlated with tumor stage and morphological characteristics.
- Citation: Huang HJ, Yu YH, Zheng ZY. Clinicopathologic analysis of sarcomatoid hepatocellular carcinoma. Shijie Huaren Xiaohua Zazhi 2010; 18(17): 1780-1785
- URL: https://www.wjgnet.com/1009-3079/full/v18/i17/1780.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i17.1780
肉瘤样癌(sarcomatoid carcinoma, SS)是指形态学似梭形细胞肉瘤但实为癌的一类肿瘤的总称[1], 比较少见, 多脏器均可发生, 常见于食管、上呼吸道、甲状腺、子宫、肺、乳腺、胃肠道、膀胱等部位[2]. 肝肉瘤样癌(sarcomatoid hepatocellular carcinoma, SHC)是原发于肝的恶性上皮性肿瘤, 恶性度高, 预后差, 十分罕见[3]. 梭形细胞成分中有10%存在恶变区域[2], 梭形细胞似异常增生的纤维母细胞[4]、平滑肌细胞、横纹肌细胞[5,6]、骨母细胞等[7], 但免疫组织化学显示梭形细胞常CK(Pan)强阳性表达, 而Vimentin阴性. SHC可以合并胆囊癌[8]、肝细胞癌[9], 多位于肝被膜下, 呈实性占位, 可侵破肝脏胞膜, 累及临近脏器及组织, 并有坏死. 本文报道我院收治的SHC病例1例, 并复习文献探讨该病的发生发展、临床表现、病理学特征、诊断、治疗和预后.
因"腹痛、腹胀2 mo"于2009-12-01入院患者, 男, 63岁. 疼痛为阵发性胀痛, 无明显诱因. 轻度发热及黄疸, 发病以来消瘦明显, 体质量减轻约5 kg. 既往史: 有"乙型肝炎小三阳"15年及"糖尿病"1年, 自口服拜糖平治疗, 血糖控制好. 本次入院后体检: 一般状态可, 皮肤巩膜轻度黄染, 腹部平坦, 未触及包块, 肝脾肋下未及, 肝上界位于右锁骨中线第五肋间, 移动性浊音弱阳性, 肝区轻度叩击痛. 腹部MRI检查显示肝左叶内侧段片状低密度影. 肿瘤标志物检查: CA19-9: 69.7 kU/L(0-37 kU/L), CEA: 11.27 μg/L(0-5 μg/L), AFP: 301.25 kIU/L(0-9 kIU/L). 治疗: 胆囊及肝左叶部分切除术+肝右叶部分切除术. 术后10 d CA19-9降至37.7 kU/L, AFP降至39.17 kIU/L. 术后1 mo入我院肿瘤内科开始正规化疗, 2 mo后增强CT扫描发现肝脏再次出现多发转移病灶, 伴有腹膜后脏器侵犯, AFP再次升高达236.39 kU/L, 于2010-2-4再次肝右叶部分切除, 术后AFP降至31.9 kU/L, 其二次手术后20 d增强CT扫描肝脏未见异常.
手术结合术中超声, 将胆囊、肝脏Ⅱ、Ⅲ、Ⅵ段和肝脏所有病灶(共计4处)完整切除. 手术标本经40 g/L甲醛溶液固定, 常规石蜡包埋, 4 μm厚切片, HE染色; 采用EliVision法分别进行CK(Pan), EMA, CEA, CK(L), Ki-67, Vimentin, AFP, Hepar-1, HBsAg, HBcAg, CK7, CK8, CK18, CK(H), CD34, CD117, Dog-1, Actin, SMA, Caldesmon, Desmin, CD10, CD21, CD23, CD35, CD1a, CD2, CD3, CD20, CD45, ALK, CD68, CD163, CD30, CD15, HMB45, S-100等免疫组织化学染色. 光镜观察. 所用一抗和EliVision试剂盒均购自福建迈新生物技术有限公司.
第1次手术标本: 部分肝切除标本: 大小约7 cm×7 cm×6 cm, 灰黄色, 切面于肝脏被膜下见一灰红灰黄色肿物, 大小约5 cm×4.6 cm×4.5 cm, 质硬, 部分区出血坏死, 肿物与周围肝界限不清, 浸润性生长, 周围肝小结节性肝硬化伴胆汁淤积, 胆管弥漫轻度扩张. 胆囊大小约9 cm×6 cm×5 cm, 浆膜面充血水肿灰白色, 内含墨绿色胆汁约50 mL, 黏膜光滑, 壁厚约0.5 cm, 未见息肉及结石. 第2次手术标本: 部分肝组织, 大小11 cm×8 cm×8 cm, 灰黄色, 切面于肝脏被膜下见4个灰红灰黄色肿物, 直径在3.5-5.5 cm之间, 质硬, 部分区出血坏死, 肿物与周围肝界限不清, 浸润性生长, 周围肝小结节性肝硬化伴胆汁淤积.
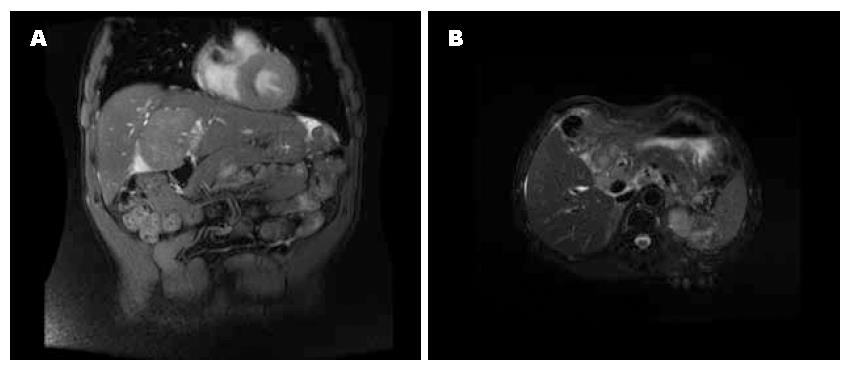
第1次术前腹部MRI检查示: 肝左内叶见一团块状实性异常信号影, 大小约5 cm×5 cm×6 cm, 边界不清, 边缘呈浅分叶状, 病灶T1WI状呈稍低信号, T2WI呈稍高信号, DWI呈高信号, 增强扫描动脉期病灶边缘不规则环形强化, 门静脉期示病灶中央斑片状强化, 延迟期示中央及边缘强化程度减低(图1A). 第2次术前CT示: 现胆囊及部分肝叶缺如, 呈术后改变, 肝脏内见多发大小不等、形态不规则异常团块影, 大小3.5-4.5 cm, 增强扫描病灶呈明显环形强化(图1B).
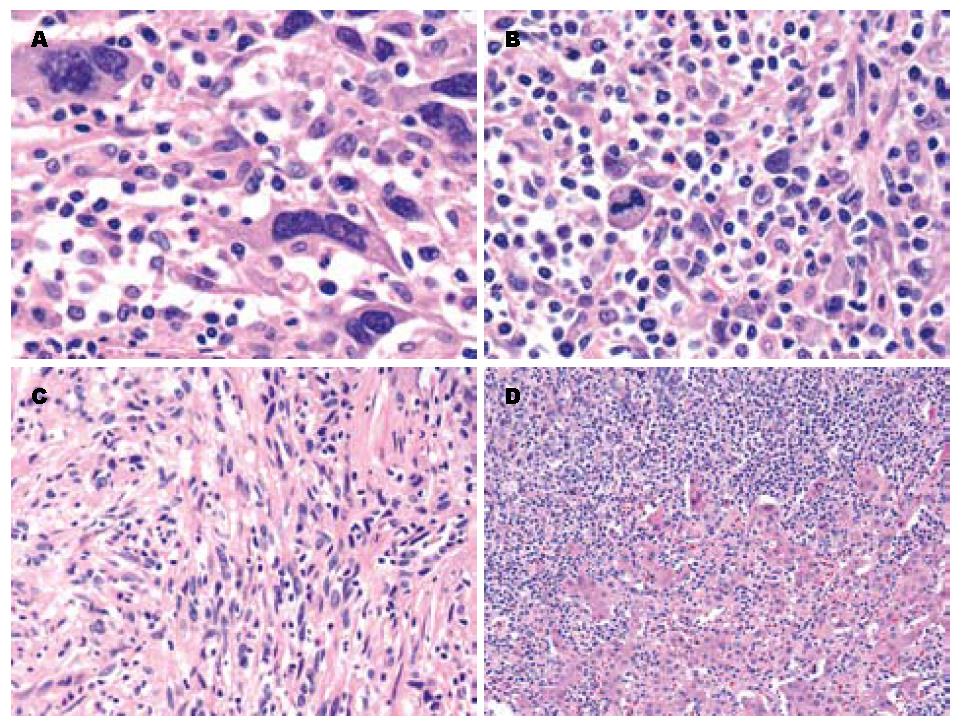
两次手术切除肿物组织学表现相似. 肿瘤组织由数量不等的肝细胞癌和肉瘤样成分构成; 肿瘤细胞部分呈上皮样、星状、多边形, 胞质丰富嗜伊红染色, 核大深染, 异型明显, 可见奇异型瘤巨细胞, 排列呈小梁状、条索状、实性巢状, 瘤细胞排列3层以上(图2A); 瘤细胞部分呈梭形或短梭形, 类似软组织的梭形细胞肉瘤, 胞质少, 核染色深且染色质分布不均, 细胞界限不清, 瘤细胞排列呈束状、编织状或弥漫分布, 可见病理学核分裂象(图2B); 两种形态细胞之间有移行; 肿瘤间质富于炎症细胞, 可见较多的淋巴细胞、浆细胞、分叶核细胞及组织细胞等类似于炎症性树突细胞肉瘤(图2C); 肿瘤组织中可见大片凝固性坏死及局灶性出血; 肿瘤细胞呈浸润性生长, 侵及周围的肝组织(图2D), 周围肝呈小结节性肝硬化, 汇管区中度炎症, 浸润以小淋巴细胞质细胞为主, 小胆管增生明显, 且围绕假小叶的周围分布, 肝细胞中度浊肿伴胆汁淤积, 及轻度萎缩. 胆囊示黏膜慢性炎症伴黏膜糜烂.
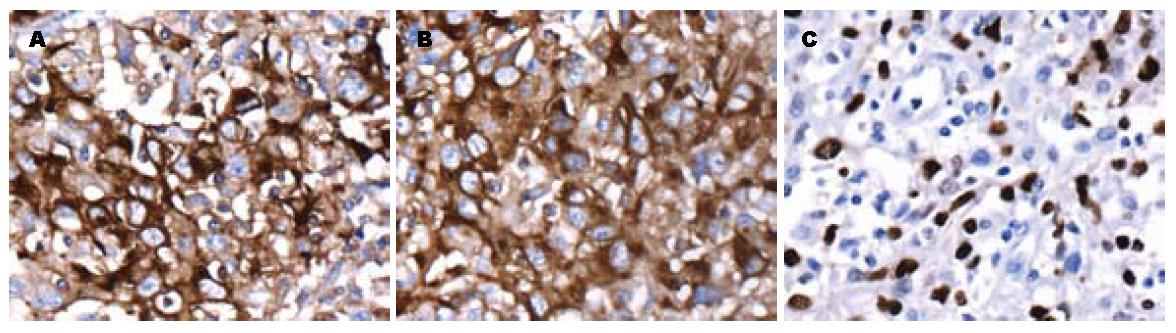
肿瘤细胞CK(Pan)(+)(图 3A), EMA(+)(图3B), CEA(±), CK(Pan)的阳性分布与肿瘤细胞的形态有关, 即在肿瘤细胞呈上皮样伴巢状、梁状分布区域, CK(Pan)呈强阳性表达, 而肿瘤细胞呈梭形伴肉瘤样变区域, CK(Pan)呈若阳性表达. EMA的表达也有类似的特点, CK(L)显示肿瘤组织中残留少量小胆管上皮细胞阳性. 肿瘤细胞弱表达AFP和Hepar-1. Vimentin显示癌细胞巢及梭形细胞肉瘤样变区域弱阳性表达. Ki-67标记约25%(图3C), 周围肝组织表达HBsAg和HBcAg. 免疫组织化学阴性有: CK7, CK8, CK18, CK(H), CD34, CD117, Dog-1, Actin, SMA, Caldesmon, Desmin, CD10, CD21, CD23, CD35, CD1a, CD2, CD3, CD20, CD45, ALK, CD68, CD163, CD30, CD15, HMB45, S-100.
病理诊断为肝肉瘤样癌.
SHC是一种罕见的肝恶性上皮性肿瘤. SHC约占外科手术切除肝癌的1.8%, 活检病例的3.9%-9.4%[2]. 目前国外的文献报道20多例, 国内报道8例[10-17]. 复习文献易发现SHC以老年多见, 发病年龄24-59(平均40)岁[16], 男性多于女性, 但国外Hanet等报道SHC无性别差异[2]. 至今SHC病因不明[18], 可能和病毒感染、放疗、化疗等有关. 临床表现不一, 可有腹痛、腹胀不适等消化系症状, 若继发于肝硬化基础, 可有腹水、脾肿大、上消化道出血、蜘蛛痣、黄疸等症状[19]. 部分可无明显的症状, 仅在体检时发现肝脏占位. 本例患者有乙型肝炎病史15年, 以腹痛入院, 体检有肝硬化表现.
目前关于SHC的报道大多是散在个例, SHC发生的确切机制还不清楚. SHC的肉瘤样细胞可能起源于未分化胆管上皮, 也可能起源于原始的未分化肝细胞, 其分化异常而导致细胞肉瘤样变[20]. 本例肿瘤细胞显示AFP和Hepar-1弱阳性表达, 提示SHC的肉瘤样细胞可能起源于未分化肝细胞. 其次, 本例有"乙型肝炎小三阳"15年, 并已进展为小结节性肝硬化, 肿物周围肝组织HBsAg和HBcAg强阳性, 提示HBV感染和肝硬化与SHC的发生相关[21,22].
SHC的诊断主要依赖临床、影像学及病理组织学, 确诊需病理形态学和免疫组织化学. AFP检测有利发现肝癌, 尤其是超过400 kIU/L排除胚胎性肿瘤后提示肝癌. CA19-9作为胆道系统恶性肿瘤的标志物, 有助于排除肝内胆管癌. 本例术前AFP高达301.25 kIU/L, 显著高于正常值(0-9 kIU/L), CA19-9为69.7 kU/L(0-37 kU/L)有轻度升高, 在肿瘤首次完全切除后, AFP迅速下降(39.17 kIU/L), 3 mo后肿瘤复发AFP再次上升(236.39 kIU/L). 这提示SHC的发生和AFP得升高有关, AFP可以辅助诊断SHC. 首发时CA19-9只轻度升高, 复发时处于正常值, 故对于诊断SHC意义不明显. 其次HBV和SHC可能有关, 本例乙型肝炎有"乙型肝炎小三阳"15年, 已进展为肝硬化, 肿瘤继发于肝硬化, 这与文献的报道一致[16]. CT检查是早期发现病灶的主要方法[23], 增强CT扫描对SHC与肝癌的鉴别有一定的价值. 对肉瘤样癌增强扫描, 中央区域强化不明显, 而肝癌常表现为瘤体均匀强化, 或肿瘤内不规则强化[24].
病理学特点包括: (1)肿瘤中应包含明确的恶性上皮性成分, 同时可见梭形细胞肉瘤样成分, 且两者之间有一定的移行[25]. (2)免疫组织化学, 肿瘤细胞上皮性标记CK(Pan)(+), EMA(+)等强阳性, 而间叶性标记弱阳性或阴性. 肉瘤样梭形细胞可弱表达SMA, Vimentin等间叶性标记, 表明肿瘤细胞向平滑肌方向分化. 另外中间性的角蛋白CAM 5.2, CK8, CK18, CK19可呈阳性表达[24], 但本例没有此特点. (3)电镜表现为, SHC的癌细胞可见中间丝蛋白, 细胞内少见有基质. 本例在诊断时, 临床及影像学均考虑肝癌可能, 形态学主要是异型性明显的梭形细胞及炎症性背景, 病理诊断时曾考虑炎症性滤泡树突细胞肉瘤, 炎性肌纤维母细胞肉瘤. 本例诊断为SHC的主要依据是[1]: (1)临床及影像学均支持肝脏原发性肿瘤; (2)形态学上可见恶性上皮及梭形细胞肉瘤样区域, 二者之间分界不清; (3)免疫组织化学显示肿瘤细胞上皮标记(CK, EMA)强阳性, 而间叶标记(Vimentin)弱阳性或阴性.
SHC在临床与病理学上需与肝癌肉瘤、淋巴瘤及梭形细胞肿瘤鉴别. (1)肝癌肉瘤, 肝癌肉瘤是指肿瘤中同时包含恶性上皮成分和间叶成分, 但二者之间没有移行; 上皮成分可以是腺癌、鳞状细胞癌或两者均有; 间叶成分表现为梭形细胞肉瘤, 包括骨肉瘤、软骨肉瘤、纤维肉瘤和横纹肌肉瘤等. 免疫组织化学显示肉瘤样细胞表达间叶性标记(Vimentin), 而上皮性标记(CK, EMA)阴性, 这是诊断癌肉瘤的最重要依据[26]; (2)淋巴瘤, 尤其是具有肉瘤样表现的淋巴瘤[27], 如炎症性滤泡树突细胞肉瘤, 形态学似SHC, 需要鉴别诊断, 但前者LCA, CD21, CD23, CD35阳性的免疫组织化学特点可以和SHC鉴别; (3)恶性纤维组织细胞瘤, 细胞异型性明显, 核分裂多, 免疫组织化学显示肿瘤细胞表达Vimentin及组织细胞标记CD68, CD163等阳性[28]; (4)炎性肌纤维母细胞瘤/肉瘤, 表现为梭形细胞肿瘤[29], 有时单从形态学上难与肉瘤样癌鉴别[30], 但是前者表达肌源性标记, 如Actin, SMA, Caldesmon, Desmin等可以与之鉴别[31]; (5)胃肠道外间质瘤, 肝脏是胃肠道外间质瘤的好发脏器, 形态学主要为上皮样细胞和梭形细胞组成的软组织肉瘤, 所以需与SHC鉴别, 但前者表达间质瘤特异标记CD34, CD117, Dog-1可与之鉴别[32]. 此外, 还应根据肿瘤发生的部位和形态学表现及免疫组织化学结果与其他梭形细胞肿瘤如恶性外周神经鞘膜瘤、恶性纤维组织细胞瘤、滑膜肉瘤等相鉴别.
手术完整切除是治疗SHC主要手段, 必要时可以辅以放疗和化疗. 因为限于个例报道, 化疗或放疗对SHC治疗的有效性还不清楚. 对于由肝穿刺等方法确诊而无手术机会的患者应及时给予射频消融术、肝动脉栓塞术[18]等综合治疗.
复习文献报道肉瘤样癌的预后主要与肿瘤分级、临床分期、手术切除范围有关. 临床分期可以参照肝癌的TNM系统分期标准. 根据不同的T、N、M分类将肝癌分4期: Ⅰ期: 肿瘤单发累及一叶肝组织. Ⅱ期: 肿瘤单发累及一叶肝组织伴血管浸润或肿瘤多发但直径不超过5 cm. Ⅲ期: 肿瘤多发且直径大于5 cm; 或肿瘤浸润血管和肝静脉; 或肿瘤侵犯胆囊以外血管及肝脏脏层腹膜; 或肿瘤出现淋巴结转移. Ⅳ期: 肿瘤出现远处转移[33].
大多数SHC发现时已经处于晚期, 因而错失手术治疗的最佳时机, 预后差[34]. 本例第一次手术完整切除肿物, 短期内迅速复发, 提示肿瘤恶性浸润行为, 但是二次手术完整切除后, 随访1 mo, CT检查无肿瘤复发及残留, 一般状况尚可. 预示早期发现和完整切除可以有效地提高患者生存质量[35].
肝肉瘤样癌(SHC)是一种少见的原发于肝的恶性上皮性肿瘤, 与一般的肝细胞癌相比, SHC的临床表现、形态学特征及预后等均有显著差异, 因此SHC的准确诊断对于提高该类肿瘤的认识显得尤为重要.
杜祥, 教授, 复旦大学附属肿瘤医院病理科; 刘丽江, 教授, 江汉大学医学院病理学.
肝肉瘤样癌(SHC)是原发于肝的恶性上皮性肿瘤, 恶性度高, 预后差, 十分罕见.
本文主要对1例接受手术治疗的原发性SHC的临床表现、CT影像学特征、病理形态学特征进行总结, 讨论原发性SHC的临床及病理形态学特征.
原发性SHC的临床及病理形态学表现均有一定的特征性, 肉瘤样成分与肝细胞癌同时存在, 二者并有移行, 需病理形态学和免疫组织化学支持方能确诊.
本文系统回顾了肝肉瘤样癌的临床特点、组织发生、诊断及形态学特点以及鉴别诊断以及治疗和预后, 尽管国内已有报道, 但作为罕见肿瘤可供个病理学和肿瘤临床医生同行交流.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Seok JY, Kim YB. [Sarcomatoid hepatocellular carcinoma]. Korean J Hepatol. 2010;16:89-94. [PubMed] [DOI] |
| 2. | Han JH, Park YN, Jung WH, Chi HS, Park C. A case with sarcomatoid hepatocellular carcinoma. Yonsei Med J. 1998;39:390-394. [PubMed] [DOI] |
| 3. | Koo HR, Park MS, Kim MJ, Lim JS, Yu JS, Jin H, Kim KW. Radiological and clinical features of sarcomatoid hepatocellular carcinoma in 11 cases. J Comput Assist Tomogr. 2008;32:745-749. [PubMed] [DOI] |
| 4. | Inoue T, Kudo M, Minami Y, Chung H, Fukunaga T, Kawasaki T. Case of rapidly progressed sarcomatoid hepatocellular carcinoma in a young female without risk factor. Liver Int. 2007;27:1428-1430. [PubMed] [DOI] |
| 5. | Park MY, Kim KR, Park HS, Park BH, Choi HN, Jang KY, Chung MJ, Kang MJ, Lee DG, Moon WS. Expression of the serum response factor in hepatocellular carcinoma: implications for epithelial-mesenchymal transition. Int J Oncol. 2007;31:1309-1315. [PubMed] [DOI] |
| 6. | Losada M H, Roa JC, García M D, Araya JC, Burgos Sj L, Silva A J. [Hepatocarcinoma with sarcomatoid transformation: case report]. Rev Med Chil. 2007;135:768-772. [PubMed] [DOI] |
| 7. | Ikeda T, Seki S, Maki M, Noguchi N, Kawamura T, Arii S, Igari T, Koike M, Hirokawa K. Hepatocellular carcinoma with osteoclast-like giant cells: possibility of osteoclastogenesis by hepatocyte-derived cells. Pathol Int. 2003;53:450-456. [PubMed] [DOI] |
| 8. | Murata M, Miyoshi Y, Iwao K, Wada H, Shibata K, Tateishi H, Shimano T, Ohasawa M, Imai Y, Nishikawa M. Combined hepatocellular/cholangiocellular carcinoma with sarcomatoid features: genetic analysis for histogenesis. Hepatol Res. 2001;21:220-227. [PubMed] [DOI] |
| 9. | Mirejovský T, Mirejovský P. [Sarcomatous hepatocellular carcinoma]. Cesk Patol. 1997;33:127-131. [PubMed] |
| 11. | 曾 勇, 李 寿柏. 巨大肉瘤样肝癌1例报告. 中华外科基础与临床杂志. 2002;9:138. |
| 18. | Koda M, Maeda Y, Matsunaga Y, Mimura K, Murawaki Y, Horie Y. Hepatocellular carcinoma with sarcomatous change arising after radiofrequency ablation for well-differentiated hepatocellular carcinoma. Hepatol Res. 2003;27:163-167. [PubMed] [DOI] |
| 19. | Jeong BJ, Hyun DH, Lee KW, Ryu ST, Lee JW, Lee JI, Jeong S, Lee DH, Kim PS, Kim HG. [A case of sarcomatoid combined hepatocellular-cholangiocarcinoma]. Korean J Gastroenterol. 2004;43:56-60. [PubMed] |
| 20. | Cho MS, Lee SN, Sung SH, Han WS. Sarcomatoid hepatocellular carcinoma with hepatoblastoma-like features in an adult. Pathol Int. 2004;54:446-450. [PubMed] [DOI] |
| 21. | Amarapurkar AD, Vibhav V. Angiogenesis in liver cirrhosis and hepatocellular carcinoma. Indian J Pathol Microbiol. 2008;51:323-328. [PubMed] [DOI] |
| 22. | Chu PG, Ishizawa S, Wu E, Weiss LM. Hepatocyte antigen as a marker of hepatocellular carcinoma: an immunohistochemical comparison to carcinoembryonic antigen, CD10, and alpha-fetoprotein. Am J Surg Pathol. 2002;26:978-988. [PubMed] [DOI] |
| 24. | Schneidera G, Massmanna A, Friesa P, Kramanna B, Remberger K. MRI of sarcomatoid carcinoma of the liver. European J Radiol Extra. 2005;54:63-67. [DOI] |
| 25. | Kim DG, Park SY, Kim H, Chun YH, Moon WS, Park SH. A comprehensive karyotypic analysis on a newly established sarcomatoid hepatocellular carcinoma cell line SH-J1 by comparative genomic hybridization and chromosome painting. Cancer Genet Cytogenet. 2002;132:120-124. [PubMed] [DOI] |
| 26. | Lao XM, Chen DY, Zhang YQ, Xiang J, Guo RP, Lin XJ, Li JQ. Primary carcinosarcoma of the liver: clinicopathologic features of 5 cases and a review of the literature. Am J Surg Pathol. 2007;31:817-826. [PubMed] [DOI] |
| 27. | Hayashi H, Ohtani H, Ueda T, Yamaguchi J, Izawa K, Hayashida T, Higami Y, Shimokawa I. Primary hepatic lymphoma with spindle cell components: a case report. Virchows Arch. 2006;449:591-596. [PubMed] [DOI] |
| 28. | Kim HS, Kim GY, Lim SJ, Lee SM, Kim YW. Undifferentiated pleomorphic sarcoma of the liver presenting as a unilocular cyst. Hepatobiliary Pancreat Dis Int. 2009;8:541-543. [PubMed] |
| 29. | Park JS, Federle MP, Sass DA. Education and imaging. Hepatobiliary and pancreatic: Budd-Chiari syndrome presenting as a caudate lobe pseudotumor. J Gastroenterol Hepatol. 2010;25:219. [PubMed] [DOI] |
| 30. | Sevinç AI, Unek T, Astarcioğlu H. Inflammatory myofibroblastic tumour (IMT) of the liver: a report of two cases. Acta Chir Belg. 2010;110:87-89. [PubMed] [DOI] |
| 31. | So K, Macquillan GC, Adams LA, Delriviere L, Mitchell A, Moody H, Wood DJ, Junckerstorff RC, Jeffrey GP. Malignant fibrous histiocytoma complicating nephrogenic systemic fibrosis post liver transplantation. Intern Med J. 2009;39:613-617. [PubMed] [DOI] |
| 32. | Yamamoto H, Miyamoto Y, Nishihara Y, Kojima A, Imamura M, Kishikawa K, Takase Y, Ario K, Oda Y, Tsuneyoshi M. Primary gastrointestinal stromal tumor of the liver with PDGFRA gene mutation. Hum Pathol. 2010;41:605-609. [PubMed] [DOI] |
| 34. | Nishie W, Iitoyo M, Koshiyama T, Kusama T. Sarcomatoid carcinoma of the liver with skin and pleural metastases. Br J Dermatol. 2003;148:1069-1071. [PubMed] [DOI] |
| 35. | Nam HS, Kim HK, Ma SU, Yu BH, Jung KM, Gong KT, Lee YJ, Park TI, Hu BW, Park SH. [A case of sarcomatoid hepatocellular carcinoma in a young female without risk factor]. Korean J Gastroenterol. 2006;47:458-462. [PubMed] |