修回日期: 2010-04-24
接受日期: 2010-04-27
在线出版日期: 2010-05-18
目的: 探讨肿瘤坏死因子-α(TNF-α)和白介素-6(IL-6)在非酒精性脂肪性肝病(NAFLD)患者血清中的水平及意义.
方法: 收集NAFLD组患者57例[包括单纯性脂肪肝21例、非酒精性脂肪性肝炎(NASH)29例肝硬化7例和正常对照组22例. 采用ELISA法检测受试者血清TNF-α和IL-6水平. 同时检查受试者体质量指数、血压、空腹血糖、空腹胰岛素、血脂, 用以计算胰岛素抵抗指数(HOMA-IR)和了解合并代谢综合征情况. 比较各组间血清TNF-α和IL-6水平的变化, 并分析TNF-α、IL-6水平与胰岛素抵抗指数和代谢综合征发生的关系.
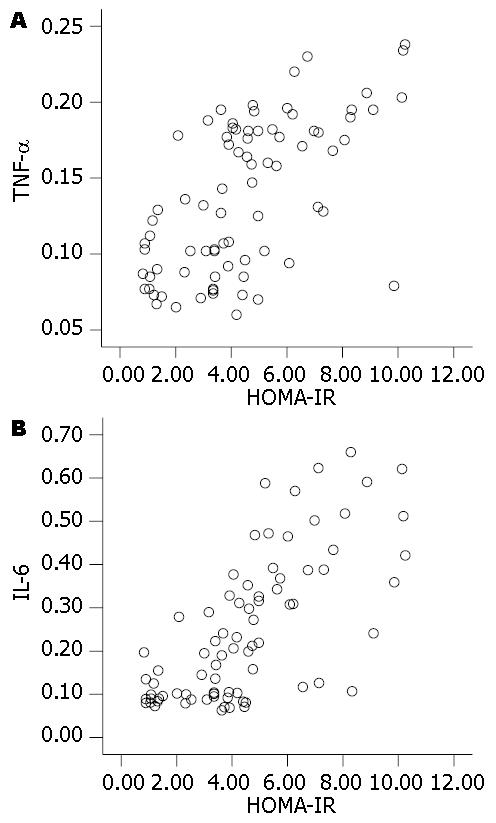
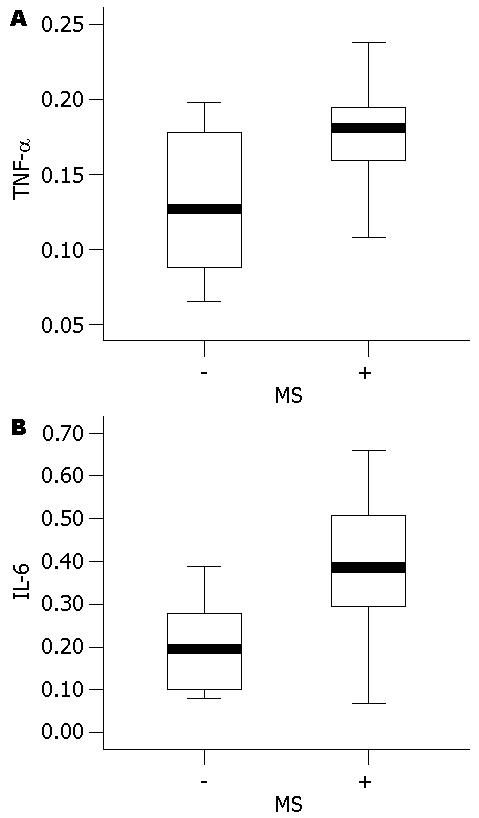
结果: 单纯性脂肪肝、NASH和肝硬化组患者血清TNF-α、IL-6水平均显著高于对照组(P<0.05), 其中以NASH组水平最高, 且显著高于单纯性脂肪肝和肝硬化组(P<0.05). 受试者血清TNF-α、IL-6水平与HOMA-IR均呈显著性正相关(r = 608, 0.709, 均P = 0.000). 合并代谢综合征的NAFLD患者血清TNF-α、IL-6水平均显著高于不合并代谢综合征的患者(P<0.05). 患者血清TNF-α、IL-6水平与是否合并代谢综合征呈显著性相关(r = 0.409, P = 0.002; r = 0.552, P = 0.000).
结论: TNF-α、IL-6通过诱导胰岛素抵抗对NAFLD疾病的发生发展起重要作用, 并有助于NAFLD患者代谢综合征的形成.
引文著录: 谢伶俐, 周力, 李丽滨, 陈晓琴, 张永宏, 杨杰. TNF-α和IL-6在非酒精性脂肪性肝病患者血清中的水平及意义. 世界华人消化杂志 2010; 18(14): 1492-1496
Revised: April 24, 2010
Accepted: April 27, 2010
Published online: May 18, 2010
AIM: To evaluate the significance of serum levels of tumor necrosis factor-alpha (TNF-α) and interleukin-6 (IL-6) in patients with nonalcoholic fatty liver disease (NAFLD).
METHODS: Fifty-seven NAFLD patients, including 21 patients with simple steatosis, 29 patients with nonalcoholic steatohepatitis (NASH) and 7 patients with cirrhosis, and 22 healthy control subjects were included in this study. Serum TNF-α and IL-6 levels were determined by enzyme-linked immunosorbent assay (ELISA). Body weight index, blood pressure, serum glucose, serum insulin and serum lipids were also measured to assess insulin resistance and metabolic syndrome complicated with NAFLD. The differences in serum levels of TNF-α and IL-6 between various groups were compared. The association of serum TNF-α and IL-6 levels with homeostasis model assessment of insulin resistance (HOMA-IR) and the risk of metabolic syndrome was analyzed.
RESULTS: The levels of serum TNF-α and IL-6 significantly increased in patients with simple steatosis, NASH and cirrhosis compared with normal subjects (all P < 0.05). The levels of serum TNF-α and IL-6 were significantly higher in NASH patients than in patients with simple steatosis or cirrhosis (both P < 0.05). A significant positive correlation was found between serum TNF-α and IL-6 levels and HOMA-IR (r = 608, 0.709, both P = 0.000). In NAFLD patients complicated with metabolic syndrome, serum TNF-α and IL-6 levels were significantly elevated compared with NAFLD patients without evidence of metabolic syndrome (P < 0.05). A significant correlation was also observed between serum TNF-α and IL-6 levels and the risk of metabolic syndrome (r = 0.409 and 0.552; P = 0.002 and 0.000, respectively).
CONCLUSION: Increased TNF-α and IL-6 production not only plays an important role in the development and progression of NAFLD but also contributes to the development of metabolic syndrome in NAFLD patients by inducing insulin resistance.
- Citation: Xie LL, Zhou L, Li LB, Chen XQ, Zhang YH, Yang J. Significance of serum levels of tumor necrosis factor-alpha and interleukin-6 in patients with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2010; 18(14): 1492-1496
- URL: https://www.wjgnet.com/1009-3079/full/v18/i14/1492.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i14.1492
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)与代谢综合征密切相关, 胰岛素抵抗是NAFLD和代谢综合征的中心环节[1]. 肿瘤坏死因子-α(tumor necrosis factor-alpha, TNF-α)和白介素6(interleukin-6, IL-6)等炎症细胞因子是调节胰岛素抵抗的重要细胞因子[2-4]. 研究发现, NAFLD患者存在脂肪组织和肝脏的天然免疫功能紊乱, 机体产生过多的TNF-α、IL-6等致炎细胞因子[5], 但这些因子与NAFLD疾病本身, 以及与其相伴发的胰岛素抵抗和代谢综合征之间的关系尚不明确. 我们研究NAFLD不同时期患者血清TNF-α和IL-6水平的变化, 并与胰岛素抵抗及代谢综合征进行相关分析, 旨在探讨TNF-α和IL-6在NAFLD发病机制中的作用及意义.
收集2008-12/2009-06在本院消化内科、内分泌科住院处及门诊收治的NAFLD患者57例, 其中单纯性脂肪肝21例、非酒精性脂肪性肝炎(NASH)29例、肝硬化7例, 男26例, 女31例, 年龄52.75岁±14.57岁. 全部病例符合2006年中华医学会肝脏病学分会脂肪肝和酒精性肝病学组制定的NAFLD诊疗指南中临床诊断及分型标准[6]. 另收集同期本院体检的健康志愿者22例为正常对照组, 男10例, 女12例, 年龄48.27岁±19.36岁, 并排除2型糖尿病、肥胖、高血压、高脂血症等代谢综合征相关性疾病、肝炎等病史及大量饮酒史. NAFLD组与对照组在性别、年龄等方面的差异无统计学意义. 所有受试者抽血前1 wk未服用抗生素、糖皮质激素、免疫抑制剂、胰岛素增敏剂、降血脂及护肝等药物. 血清TNF-α和IL-6采用ELISA法进行检测, 试剂盒采用武汉博士德生物工程有限公司进口分装ELISA试剂盒, 两种细胞因子的检测范围分别定为≤15.6 ng/L和≤4.69 ng/L. 空腹胰岛素采用放射免疫法检测, 试剂盒采用潍坊三维生物工程集团有限公司放免试剂盒.
1.2.1 TNF-α、IL-6检测: 所有受试者清晨空腹抽取5 mL静脉血, 室温凝固2 h, 3 500 r/min离心10 min, 收集血清2 mL, 立即分装后-40 ℃保存. 血清TNF-α和IL-6采用ELISA法, 严格按说明书进行检测.
1.2.2 胰岛素抵抗及代谢综合征相关性检测: 检测受试者的身高、体质量、血压、空腹血糖(fasting blood glucose, FBG)及餐后2 h血糖、空腹胰岛素(fasting blood insulin, FBIn)、血脂(三酰甘油和高密度脂蛋白胆固醇), 用于评价胰岛素抵抗程度和代谢综合征合并情况. 胰岛素抵抗程度的确定采用稳态模型评价法(homeostatic model assessment, HOMA), 公式如下: 胰岛素抵抗指数(HOMA-IR) = (FBG×FBIn)/22.5. 代谢综合征诊断采用2004年中华医学会糖尿病学分会建议的诊断标准[7], 其中体质量指数(BMI) = 体质量(kg)/身高2(m2).
统计学处理 采用SPSS13.0统计软件, 计量资料以mean±SD表示, 采用Kruskal-Wallis H检验和Mann-Whitney U检验比较组间血清TNF-α、IL-6水平及HOMA-IR的差异, 采用Spearman相关分析评价TNF-α、IL-6水平与HOMA-IR及是否合并代谢综合征的关系, P<0.05表示差异有统计学意义.
对NAFLD不同时期及对照组受试者血清TNF-α、IL-6水平进行比较, 结果显示单纯性脂肪肝、NASH和肝硬化组TNF-α、IL-6水平均显著高于对照组(P<0.05), 其中以NASH组水平最高, 且显著高于肝硬化和单纯性脂肪肝组(P<0.05); 尽管肝硬化组水平高于单纯性脂肪肝组, 但两者差异无统计学意义(P>0.05, 表1).
对于HOMA-IR, 各组间变化趋势与血清TNF-α、IL-6水平变化趋势相似, 但两两比较差异均有统计学意义(P<0.05, 表1). 进一步相关分析结果显示受试者血清TNF-α、IL-6水平与HOMA-IR均呈显著性正相关(分别为r = 0.608, P = 0.000; r = 0.709, P = 0.000, 图1).
以NAFLD患者作为整体, 比较合并代谢综合征的NAFLD患者与不合并代谢综合征的NAFLD患者之间血清TNF-α、IL-6水平的差异. 结果显示合并代谢综合征的NAFLD患者血清TNF-α、IL-6水平及HOMA-IR均显著高于不合并代谢综合征患者(P<0.05, 表2). 进一步的相关分析结果显示, NAFLD患者血清TNF-α、IL-6水平与是否合并代谢综合征显著性相关(分别为r = 0.409, P = 0.002; r = 0.552, P = 0.000, 图2).
NAFLD发病率上升, 并且常与代谢综合征相伴发生, 两者已成为威胁人类健康的重要疾病. 胰岛素抵抗被认为是NAFLD和代谢综合征的中心环节[1]. 炎症细胞因子是影响胰岛素敏感性的重要因素[2]. 近来研究发现, NAFLD和代谢综合征患者体内炎症细胞因子的水平均发生显著变化[2,5], 表明炎症细胞因子可能参与NAFLD疾病的发生与发展. 本研究结果显示了NAFLD患者炎症细胞因子水平的变化及其与胰岛素抵抗和代谢综合征的关系, 有助于理解NAFLD的发病机制以及该病与胰岛素抵抗和代谢综合征的内在联系.
TNF-α、IL-6参与NAFLD疾病的发生与发展. TNF-α和IL-6是重要的致炎细胞因子, 主要由巨噬细胞等免疫细胞产生. 以往研究证实, NAFLD患者存在脂肪组织和肝脏的天然免疫功能紊乱, 脂肪组织和肝脏聚集了异常增多的巨噬细胞[5], 后者是炎症细胞因子的重要来源; 另外脂肪细胞和肝细胞也可分泌TNF-α、IL-6, 后者又可介导巨噬细胞浸润[8]. 本研究显示, NASH和单纯性脂肪肝患者血清TNF-α、IL-6水平均显著高于正常对照组, 以NASH组水平最高. 本结果与Hui等[9]及Wieckowska等[10]研究结果类似, 表明TNF-α、IL-6水平升高是NAFLD患者普遍存在的现象. 单纯性脂肪肝患者血清TNF-α、IL-6水平的升高可能是脂肪代谢紊乱引起致炎细胞因子分泌增多的结果[2,5], 而NASH患者TNF-α、IL-6水平达峰值可能与此期肝细胞内NF-κB等信号通路激活产生大量炎症细胞因子, 以及肝脏发生Th-1极化有关[2,5]. 另外, 本研究发现肝硬化患者血清TNF-α、IL-6水平尽管高于对照组, 但却显著低于NASH患者. 以往研究亦报道少数NASH患者发展为肝硬化后, 其肝脏脂肪变性和炎症反应往往减轻或消失. 原因可能是NAFLD肝硬化的形成还需要其他细胞因子的参与[5], 如IL-13等Th-2细胞因子可能是诱导肝纤维化的主要因子[11].
TNF-α、IL-6诱导的胰岛素抵抗可能是NAFLD疾病发生与发展的重要机制. 研究证实, 胰岛素抵抗是NAFLD的基本特征, 他通过多种直接或间接的机制与NAFLD的发生发展密切相关[1]. 而炎症细胞因子的分泌变化是影响组织对胰岛素敏感性的重要因素[2,12]. TNF-α通过激活NF-κB或JNK信号转导通路抑制肝细胞胰岛素受体底物1(insulin receptor substrate-1, IRS-1)和胰岛素受体底物2(insulin receptor substrate-2, IRS-2)的磷酸化, 导致肝细胞胰岛素抵抗形成[13]. IL-6通过诱导细胞因子信号转导抑制因子3(suppressors of cytokine signaling 3, SOCS3)的表达, 促进局部(如肝脏)和系统的胰岛素抵抗[14]. 本研究进一步发现对照组和NAFLD患者各组间HOMA-IR的变化趋势与两种细胞因子水平的变化趋势相似, 并且TNF-α、IL-6水平均与HOMA-IR呈显著性正相关. 这与以往的动物实验及临床调查结果一致[10,15], 表明TNF-α、IL-6可能是通过改变胰岛素敏感性在NAFLD疾病发生发展中发挥重要作用.
TNF-α、IL-6诱导的胰岛素抵抗参与NAFLD患者中代谢综合征的形成. 流行病学调查发现, NAFLD与代谢综合征密切相关; NAFLD发展成肝硬化以及死于肝脏相关并发症的比率较低[16], 而合并的代谢综合征, 特别是其组分的终末器官严重并发症成为影响NAFLD疾病预后的重要因素[17]. NAFLD和代谢综合征相关联的机制尚未完全阐明. 尽管胰岛素抵抗被认为是NAFLD和代谢综合征的中心环节, 但其间关系可能互为因果、错综复杂. 本研究发现, 除血清TNF-α、IL-6水平与胰岛素抵抗程度正相关以外, 合并代谢综合征的NAFLD患者血清TNF-α、IL-6水平均显著高于不合并代谢综合征的患者, 并且TNF-α、IL-6水平与是否合并代谢综合征亦呈显著性相关. 结果表明炎症细胞因子可能是NAFLD、胰岛素抵抗和代谢综合征之间的重要联结因子.
总之, 我们认为TNF-α、IL-6通过诱导胰岛素抵抗, 不但对NAFLD疾病本身的发生与发展起重要作用, 还可能参与NAFLD相关疾病代谢综合征的形成, 从而对NAFLD患者的预后产生影响. TNF-α、IL-6是否可以作为可靠的标志物用于NAFLD严重程度及预后的评估, 或成为有潜力的靶点用于疾病治疗, 有待进一步研究证实.
NAFLD发病率上升, 并且常与代谢综合征相伴发生, 两者已成为威胁人类健康的重要疾病. 然而NAFLD的发病机制及其与代谢综合征的内在联系仍未明确.
党双锁, 教授, 西安交通大学第二医院感染科
以往研究发现NAFLD患者体内炎症细胞因子水平发生显著变化,但这些炎症细胞因子与胰岛素抵抗及代谢综合征的关系尚不清楚.
本研究检测NAFLD不同时期患者血清TNF-α和IL-6水平变化, 并与胰岛素抵抗及代谢综合征进行相关分析, 结果显示TNF-α、IL-6可能通过诱导胰岛素抵抗, 对NAFLD疾病发生与发展起重要作用, 还可能参与NAFLD相关疾病代谢综合征的形成.
本研究突出了TNF-α和IL-6在NAFLD发病过程中的变化及意义, 使其有可能成为可靠的标志物用于NAFLD严重程度及预后的评估, 或成为有潜力的靶点用于疾病治疗.
本文设计合理, 方法可靠, 结果有临床意义.
编辑: 李军亮 电编: 何基才
| 1. | Abdelmalek MF, Diehl AM. Nonalcoholic fatty liver disease as a complication of insulin resistance. Med Clin North Am. 2007;91:1125-1149, ix. [PubMed] [DOI] |
| 2. | Shoelson SE, Herrero L, Naaz A. Obesity, inflammation, and insulin resistance. Gastroenterology. 2007;132:2169-2180. [PubMed] [DOI] |
| 5. | Choi S, Diehl AM. Role of inflammation in nonalcoholic steatohepatitis. Curr Opin Gastroenterol. 2005;21:702-707. [PubMed] [DOI] |
| 8. | Marra F, Bertolani C. Adipokines in liver diseases. Hepatology. 2009;50:957-969. [PubMed] [DOI] |
| 9. | Hui JM, Hodge A, Farrell GC, Kench JG, Kriketos A, George J. Beyond insulin resistance in NASH: TNF-alpha or adiponectin? Hepatology. 2004;40:46-54. [PubMed] [DOI] |
| 10. | Wieckowska A, Papouchado BG, Li Z, Lopez R, Zein NN, Feldstein AE. Increased hepatic and circulating interleukin-6 levels in human nonalcoholic steatohepatitis. Am J Gastroenterol. 2008;103:1372-1379. [PubMed] [DOI] |
| 11. | Kaviratne M, Hesse M, Leusink M, Cheever AW, Davies SJ, McKerrow JH, Wakefield LM, Letterio JJ, Wynn TA. IL-13 activates a mechanism of tissue fibrosis that is completely TGF-beta independent. J Immunol. 2004;173:4020-4029. [PubMed] [DOI] |
| 13. | Schenk S, Saberi M, Olefsky JM. Insulin sensitivity: modulation by nutrients and inflammation. J Clin Invest. 2008;118:2992-3002. [PubMed] [DOI] |
| 14. | Farrell GC. Signalling links in the liver: knitting SOCS with fat and inflammation. J Hepatol. 2005;43:193-196. [PubMed] [DOI] |
| 15. | De Taeye BM, Novitskaya T, McGuinness OP, Gleaves L, Medda M, Covington JW, Vaughan DE. Macrophage TNF-alpha contributes to insulin resistance and hepatic steatosis in diet-induced obesity. Am J Physiol Endocrinol Metab. 2007;293:E713-E725. [PubMed] [DOI] |
| 16. | Adams LA, Lymp JF, St Sauver J, Sanderson SO, Lindor KD, Feldstein A, Angulo P. The natural history of nonalcoholic fatty liver disease: a population-based cohort study. Gastroenterology. 2005;129:113-121. [PubMed] [DOI] |
| 17. | Jepsen P, Vilstrup H, Mellemkjaer L, Thulstrup AM, Olsen JH, Baron JA, Sørensen HT. Prognosis of patients with a diagnosis of fatty liver--a registry-based cohort study. Hepatogastroenterology. 2003;50:2101-2104. [PubMed] |