修回日期: 2010-04-07
接受日期: 2010-04-13
在线出版日期: 2010-04-28
目的: 观察P2X7嘌呤能受体在体外培养的Cajal间质细胞(ICC)的表达及高糖的影响, 探讨P2X7嘌呤能受体在糖尿病胃肠功能紊乱的细胞机制.
方法: 以小鼠小肠组织为来源, 联合使用机械分离法和酶解法分离ICC, 培养在50 mL/L CO2温箱里. 同时应用ICC特异的c-Kit抗体和P2X7受体抗体进行免疫荧光染色, 在激光共聚焦显微镜下进行鉴定, 以确定P2X7受体是否表达于ICC. 实验分组: 正常对照组(葡萄糖浓度为5.5 mmol/L), 高糖组(葡萄糖浓度为33 mmol/L). 通过倒置显微镜观察细胞形态, RT-PCR对P2X7和c-Kit受体的表达进行比较.
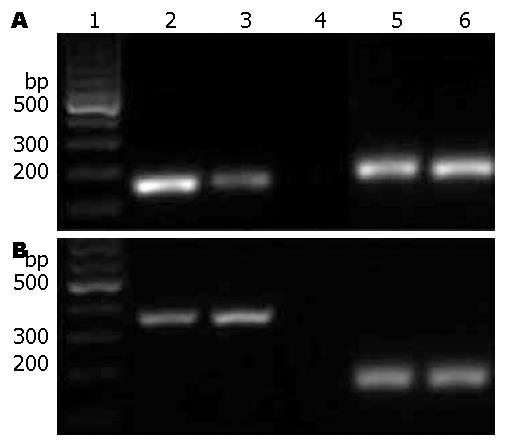
结果: 激光共聚焦显微镜下P2X7受体在c-Kit抗体阳性的细胞上的免疫荧光染色是阳性的; 与正常组比较, 加入葡萄糖后的ICC细胞变大, 突起变短, 与周围细胞的网络连接减少; RT-PCR结果显示P2X7受体表达于ICC, 加入高糖后的ICC的c-Kit受体表达减弱, 而P2X7受体的表达是增强的.
结论: P2X7受体表达于体外培养的ICC上, 高糖使ICC的形态发生了改变、减弱了c-Kit的表达、加强了P2X7受体的表达. 这可能在糖尿病胃肠功能紊乱的发生中发挥一定的作用.
引文著录: 高显奎, 余跃, 杨琰, 陈军, 王巧民. 高糖对体外培养的Cajal间质细胞P2X7嘌呤能受体表达的影响. 世界华人消化杂志 2010; 18(12): 1211-1216
Revised: April 7, 2010
Accepted: April 13, 2010
Published online: April 28, 2010
AIM: To investigate the effects of high concentration of glucose on the expression of P2X7 purine receptor in the interstitial cells of Cajal (ICC) in vitro and to explore the mechanisms underlying gastrointestinal dysmotility in diabetic mellitus.
METHODS: ICC were isolated from the intestine of newborn mice by enzymatic dissociation and centrifugation and cultured in an incubator containing 50 mL/L CO2. Cultured ICC were identified by immunofluorescence staining using antibodies directed against c-Kit receptor and P2X7 receptor. ICC were then divided into two groups: control group and experimental group, which were treated with normal and high concentrations of glucose, respectively. After treatment, cell morphology was observed under an inverted light microscope. The expression of P2X7 receptor and c-Kit receptor mRNAs in ICC was detected by reverse transcription-polymerase chain reaction (RT-PCR).
RESULTS: Immunofluorescence staining demonstrated that both P2X7 receptor and c-Kit receptor were positive on ICC cells. After treatment with high concentration of glucose, ICC became bigger, and cell processes became shorter. RT-PCR analysis proved the expression of P2X7 receptor in ICC. The expression level of c-Kit receptor mRNA was weaker and that of P2X7 receptor mRNA was stronger in the experimental group than in the control group.
CONCLUSION: P2X7 receptor is expressed in ICC. Hyperglycemia may alter cell morphology, decrease the expression of c-Kit receptor, enhance the expression of P2X7 receptor in ICC, and thereby play a role in the pathogenesis of gastrointestinal dysmotility in diabetic mellitus.
- Citation: Gao XK, Yu Y, Yang Y, Chen J, Wang QM. High concentration of glucose enhances the expression of P2X7 purine receptor in interstitial cells of Cajal in vitro. Shijie Huaren Xiaohua Zazhi 2010; 18(12): 1211-1216
- URL: https://www.wjgnet.com/1009-3079/full/v18/i12/1211.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i12.1211
胃肠动力障碍是糖尿病(diabetes mellitus, DM)的一个常见并发症, 资料显示50%-76% DM患者有胃排空障碍[1]. 很多研究证实Cajal间质细胞(interstitial cells of Cajal, ICC)与其关系密切[2,3]. 嘌呤受体是非肾上腺能非胆碱能受体, 他广泛地分布于胃肠道, 越来越多的研究证明嘌呤受体在胃肠道平滑肌的收缩和舒张中发挥着重要作用[4-6]. 其中P2X7受体最近备受人们关注. 一般认为DM胃动力障碍与DM自主神经病变和胃肠激素失衡有关, 而DM的代谢紊乱, 特别是糖代谢紊乱可能是产生本症的基础[7]. 本研究首先证实了P2X7受体表达于小鼠小肠ICC, 然后观察高糖对ICC上P2X7受体表达的影响, 进而探讨DM胃肠动力紊乱的可能机制.
Balb/c小鼠, 9-14 d, 雌雄不限, 由安徽医科大学实验动物中心提供; Ca2+-free-Hanks'液的成分(mmol/L): NaCl 125, KCl 5.36, NaHCO3 15.5, Na2HPO4 0.336, KH2PO4 0.44, 葡萄糖10, 蔗糖2.9, 乙磺酸11, 用NaOH调节pH至7.2; Krebs-Ringer bicarbonate液(KRB液)的成分(mmol/L): NaCl 118.5, KCl 4.5, MgCl2 1.2, NaHCO3 23.8, KH2PO4 1.2, dextrose 11.0, CaCl2 2.4, 37 ℃±0.5 ℃通950 mL/L O2-50 mL/L CO2的气体其pH值为7.4; SCF(Perotech公司)、胶原酶Ⅱ(Solarbio公司)、胰蛋白酶抑制剂(Sigma公司)、M199(Gibco公司)、兔P2X7(Santa Cruz公司)、山羊c-Kit(Santa Cruz公司)、Cy3标记的山羊抗兔IgG(Sigma公司)、异硫氰酸荧光素(fluorescinisothiocyate, FITC)标记的兔抗山羊IgG(武汉博士德生物工程有限公司)、TRIzol(Faraday Ave carisbad), 逆转录试剂盒(TaKaRa), 胎牛血清蛋白(Sigma公司)、洁净工作台(上海博讯实业有限公司), 3111型二氧化碳培养箱(美国Thermo life science公司), Z200A型离心机(德国Hermle公司), SP5型激光共聚焦扫描显微镜(德国Leica公司)、CK300型倒置显微镜(日本Olympus公司)等.
1.2.1 细胞分离和培养: 小鼠禁食不禁水24 h, 无菌条件下取出小肠组织, 放入盛有KRB液(含有青霉素1 IU/mL、链霉素100 mg/L)的无菌平皿里, 在解剖显微镜下钝性分离出小肠肌条, 然后将分离出的肌条在无Ca2+的Hanks'液(含有青霉素1 IU/mL、链霉素100 mg/L)中冲洗约30 min, 剪碎至1-2 mm3小块, 加入酶解液(胶原酶Ⅱ 1.2 g/L、ATP 0.25 g/L、胎牛血清100 mL/L、胰蛋白酶抑制剂2 g/L)消化20-25 min, 然后去除上清液, 加入上述无Ca2+的Hanks'液冲洗3-5次, 反复吹打3-5 min. 用M199培养基(10%小牛血清、SCF 5 µg/L、青霉素1 IU/mL、链霉素100 mg/L、M199)将细胞接种至预先放置包被鼠尾胶原蛋白的盖薄片六孔培养板或者直接在皿底包被鼠尾胶原蛋白的六孔培养板然后放入50 mL/L CO2培养箱内, 37 ℃条件下培养.
1.2.2 细胞分组: 细胞培养24 h后换不含有双抗的M199培养基, 继续培养3 d后, 分为两组: 正常对照组(葡萄糖浓度为5.5 mmol/L); 高糖组(葡萄糖浓度为33 mmoL/L)培养48 h后待用.
1.2.3 细胞观察: 用倒置显微镜观察各组细胞情况, 每天1次, 每次最好不超过30 min, 并摄像.
1.2.4 免疫荧光实验: 正常对照组细胞稳定培养6 d后, 进行荧光检测. 步骤: 选择贴壁良好的盖薄片, 用吸管吸掉培养基, 0.01 mol/mL的PBS冲洗3×5 min, 丙酮在室温下固定10 min, 0.01 mol/mL的PBS冲洗3×5 min, 加入10%的小牛血清37 ℃下封闭35 min, 0.01 mol/mL的PBS冲洗3×5 min, 加山羊c-Kit(1:150)和兔P2X7受体(1:180)混合物, 4 ℃过夜, 0.01 mol/mL的PBS冲洗3×5 min, 加入兔抗山羊IgG(1:35)和山羊抗兔IgG(1:150), 37 ℃下作用100 min, 0.01 mol/mL的PBS冲洗3×5 min, 50%的甘油封片. 激光共聚焦显微镜下观察并摄片.
1.2.5 细胞内总RNA的提取: 在去除上清液的培养皿中加入1 mL TRIzol混匀, 移出细胞裂解物于EP管中, 加入0.2 mL氯仿, 室温孵育3 min, 4 ℃ 12 000 r/min离心15 min, 吸取上清至新管加入等体积的异丙醇, 在-20 ℃下放置30 min, 4 ℃ 12 000 r/min离心10 min, 在管底部可见微量的RNA沉淀, 弃上清, 加入750 mL/L的乙醇1 mL, 振荡7 500 r/min 4 ℃下离心10 min, 弃上清室温干燥5-10 min, 分光光度计测定260 nm、280 nm的吸光度(A)值. 求出A260/280比值.
1.2.6 逆转录-多聚酶链反应(RT-PCR): 取9 μL RNA为模板, 加入MgCl2 2 μL、10×RT Buffer 1 μL、dNTP 1 μL、Rnase Inhibitor 0.25 μL、AMV Reverse Transcriptase 0.5 μL、Random 9 mers 0.5 μL、RNase free H2O 0.5 μL混匀后30 ℃ 10 min, 42 ℃ 60 min, 99 ℃ 5 min, 5 ℃ 5 min逆转录合成cDNA, 再以他为模板进行聚合酶链反应, 反应体系如下: 5×Buffer 2.5 μL、聚合酶Ex Tap HS 0.125 μL、H2O 3.875 μL、cDNA 5 μL、上游表达引物0.5 μL、下游表达引物0.5 μL. P2X7基因引物的反应条件: 94 ℃ 30 s(94 ℃ 30 s, 55.5 ℃ 30 s, 72 ℃ 30 s)×35循环, 72 ℃ 5 min. c-Kit基因引物的反应条件: 94 ℃ 30 s(94 ℃ 30 s, 57.5 ℃ 30 s, 72 ℃ 30 s)×35循环, 72 ℃ 5 min. 取出12 μL聚合酶链反应产物以1.5%的琼脂凝胶进行电泳分析. RT-PCR引物和内参由上海生工生物技术有限公司合成, c-Kit基因上游引物为5'-CGCCTGCCGAAATGTATGACG-3', 下游引物为5'-GGTTCTCTGGGTTGGGGTTGC-3', P2X7基因上游引物为5'-CCAAGCCGACGTTGAAGTAT-3', 下游引物为5'-AGAGCTTGGAGGTGGTGATG-3'. 分析内参3-磷酸甘油醛脱氢酶(GAPDH)引物序列上游引物为5'-GTCTTCACCACCATGGAGA-3', 下游引物为5'-AAGCAGTTGGTGGTGCAG-3'.
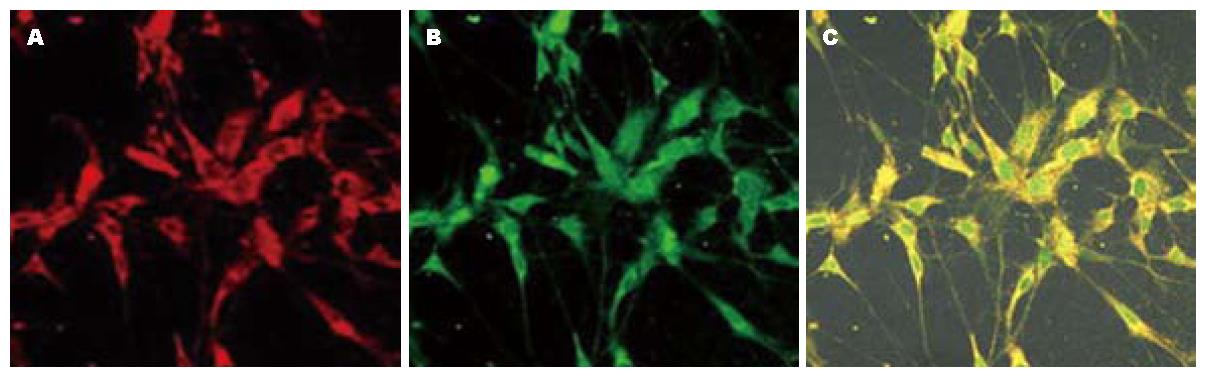
图1A说明P2X7受体在该细胞上免疫反应是阳性的, c-Kit是ICC的特异性标记, 所以图1B说明该细胞就是ICC, 图1C则说明P2X7与c-Kit共表达于该细胞, 也就意味着P2X7受体在ICC上免疫反应是阳性的.
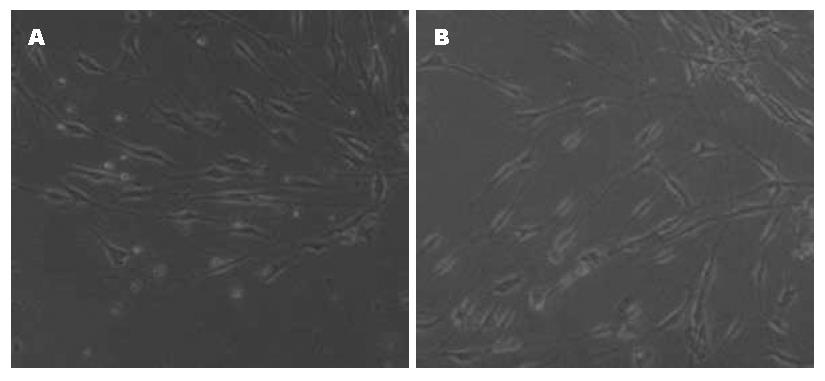
与正常组比较, 加入葡萄糖后的ICC细胞变圆, 突起变短, 与周围细胞的网络连接减少(图2).
ICC是胃肠运动的起搏细胞, 是其基本电节律的起搏器, 也参与其传导, 并对神经肌肉传导起重要调节作用[8,9], 他以网络状分布于胃肠道, 在胃肠道运动中发挥着关键作用. ICC的体外培养一直是个难题, 我们成功建立了一套小鼠胃肠ICC的分离培养方法, 并提出实验过程中应当注意选择适当天龄的小鼠、尽量减小机械化学损伤、避免污染等问题[10-15].
本实验观察到加入高糖后的ICC细胞变大, 突起变短, 与周围细胞的网络连接减少, 这与国内文献报道结果是一致的[16]. 有研究表明在DM胃肠动力障碍患者的ICC数量减少、形态和网状结构出现改变[2,3,17]. 这为高糖改变细胞功能提供了重要的形态学依据. 另外RT-PCR研究也发现高糖使c-Kit在ICC的表达减弱, 进一步从量的变化表明高糖影响了ICC的功能.
嘌呤受体分为P1和P2, 其中前者以腺苷为配体, 后者则以ATP/ADP为配体. 迄今为止, 已有P1受体的4种亚型(A, A2, A2, A3)、P2X受体的7种亚型(P2X1、P2X2、P2X3、P2X4、P2X5、P2X6和P2X7)、P2Y受体的8种亚型(P2Y1、P2Y2、P2Y4、P2Y6、P2Y11、P2Y12、P2Y13和P2Y14)被克隆[18]. P2X7受体是具有595个氨基酸(AA)的蛋白质, 有着独特的C-末端(239AA), 比其他嘌呤受体长的多, 而没有更长的跨膜疏水区, 与其他已知蛋白质也没有同源性, 这可能是其具有独特功能的分子基础[19]. 他广泛地表达于造血系统细胞如多能造血干细胞、肥大细胞、淋巴细胞等. 也表达与多种正常的组织如心、脑、脾血管平滑肌等和一些肿瘤如神经母细胞瘤细胞等, 另外, 近几年已分别从大鼠神经细胞、小鼠神经胶质细胞和人单核细胞克隆出来鼠或人P2X7受体, 但是否表达于ICC, 国内外鲜有报道. c-Kit是ICC细胞的一个特异性受体, 在胃肠道95%以上的c-Kit阳性细胞是ICC细胞[20], 我们用c-Kit抗体和P2X7受体抗体免疫荧光双标方法和RT-PCR的方法都证实了P2X7受体表达于体外培养的小肠ICC上. 嘌呤能受体在胃肠道运动中有着重要的功能, 国内黄旭等认为P2X受体激动剂通过P2X受体抑制豚鼠胃窦环形肌自发性收缩或者对他具有舒张作用, 其作用机制不依赖内在神经, 也不依赖细胞膜离子通道以及膜电位改变[21]. 在大鼠, ATP可以通过P2Y受体介导远端胃的收缩, 通过P2X受体介导其舒张[22]. P2X受体能调节小鼠胃的收缩或舒张[4], P2X受体激动剂可以通过平滑肌上的P2X受体介导小鼠和犬类回肠平滑肌的收缩[5,23]. P2Y1和P2Y2受体可以调节小鼠回肠平滑肌的舒张, 另外回肠平滑肌的舒张还受一种不确定的对α, β-MeATP敏感的P2Y受体调节[5]. 在大鼠, ATP可以通过P2Y受体引起远端结肠的舒张[6]. P2X2受体可以调节小鼠结肠平滑肌的收缩[5]. 总之, 嘌呤受体在不同物种、不同胃肠道部位所介导的平滑肌的反应不同, 或者兴奋或者抑制.
作为胃肠道起搏细胞的ICC, 关于其起搏电流的机制尚存在争议, 如以加拿大学者Huizinga为代表的学者们认为ICC起搏电流的产生与钙敏感氯电流有关[24], 而以Sanders为代表的美国学者们认为ICC起搏电流与非选择阳离子电流有关[25]. P2X受体是配体门控离子通道, 他的激活可以打开非选择性离子通道[19,26], 作为P2X的一员, 与其他受体不同的是, P2X7具有双功能, 他既是离子通道, 又允许小分子有机离子通过[26], 而且具有非选择性的特性, 对一价、二价阴阳离子均可通过[27]. 近年来有研究表明P2X7受体存在于神经元上且发挥着一定的功能[28-33], 另外有关药理学研究证明他可以影响神经递质释放和神经损伤, 调节突触后联系[34]. ICC虽是一种特殊的间质细胞, 形态上同神经细胞很相似, 胞体有锥形的、三角形的、多边形的, 有像神经突触一样的突起, 突起之间又相互联系呈网状, 在功能上也类似于神经细胞, 如他是胃肠运动基本电节律的起搏器, 也参与其传导, 并对神经肌肉传导起重要调节作用. 我们已经证实P2X7在ICC上有表达, 那么他有可能参与了ICC功能的调节.
另外本研究RT-PCR结果提示高糖增加了P2X7受体的表达. 有研究观察到, 在链脲菌素所致DM大鼠胃上给予透壁性神经刺激时, 平滑肌的电记录显示其抑制性神经肌肉接头电位的振幅减小, 且不产生兴奋性接头电位. 由ATP引起的超极化在链脲菌素所致DM大鼠和非控制的盲肠环行肌组是相似的, 只是在DM组织上抑制性接头点位的超极化频率相对慢些. 虽然来自胃底的ATP引起的胃底纵行肌舒张在DM组和正常组之间并没有明显的不同, 但是刺激引起的ATP释放增加了3倍. 在胃底, 对ATP受体使用α, β亚甲基-ATP酶进行脱敏, 可以使得他对ATP和电刺激引起的舒张反应减弱, 这说明ATP在大鼠胃底的NANC神经传递中发挥一定的作用, 而这一减弱现象在DM鼠上更为明显. 这些资料表明在DM大鼠上嘌呤受体元件可能是增加的[35]. 这与我们的结果也是相似的.
总之, 高糖损伤了ICC细胞形态与功能, 同时使P2X7受体的表达增强, 这可能在DM胃肠动力障碍的发生发挥了一定的作用.
胃肠动力障碍是糖尿病的一个常见并发症, 其发生机制尚不清楚, 近年来ICC的研究取得了很大的进展, 已经证实其和糖尿病胃肠动力障碍的关系密切. P2X7是一个结构和功能独特的嘌呤受体, 在多种生理功能中发挥着重要的作用.
陈贻胜, 教授, 福建省立医院消化内科
近年来, ICC已经成为研究糖尿病胃肠动力障碍发生机制的一个新的突破口, 而P2X7受体也成为相关研究的热点.
嘌呤受体广泛分布于胃肠道, 在胃肠道的感觉、运动功能中发挥着重要的作用, 与胃肠道的许多疾病密切相关. P2X7受体是其中一个较为特殊的受体, 具有独特的结构和功能, 已成为研究热点.
P2X7受体存在于多种细胞组织中, 但关于其是否存在于ICC国内外鲜有报道, 本研究证实他表达于体外培养的ICC, 且高糖使ICC的c-Kit表达减弱, P2X7表达增强, 从而为研究糖尿病胃肠动力障碍提供理论依据.
本研究可能为探讨糖尿病胃肠动力障碍发生机制提供新的理论依据, ICC上表达的P2X7受体成为其一个新的治疗靶点.
本研究选题新颖, 设计合理, 结果可靠, 具有较好的参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Camilleri M. Advances in diabetic gastroparesis. Rev Gastroenterol Disord. 2002;2:47-56. [PubMed] |
| 2. | Yamamoto T, Watabe K, Nakahara M, Ogiyama H, Kiyohara T, Tsutsui S, Tamura S, Shinomura Y, Hayashi N. Disturbed gastrointestinal motility and decreased interstitial cells of Cajal in diabetic db/db mice. J Gastroenterol Hepatol. 2008;23:660-667. [PubMed] [DOI] |
| 3. | Miller SM, Narasimhan RA, Schmalz PF, Soffer EE, Walsh RM, Krishnamurthi V, Pasricha PJ, Szurszewski JH, Farrugia G. Distribution of interstitial cells of Cajal and nitrergic neurons in normal and diabetic human appendix. Neurogastroenterol Motil. 2008;20:349-357. [PubMed] [DOI] |
| 4. | Mulè F, Naccari D, Serio R. Evidence for the presence of P2y and P2x receptors with different functions in mouse stomach. Eur J Pharmacol. 2005;513:135-140. [PubMed] [DOI] |
| 5. | Giaroni C, Knight GE, Ruan HZ, Glass R, Bardini M, Lecchini S, Frigo G, Burnstock G. P2 receptors in the murine gastrointestinal tract. Neuropharmacology. 2002;43:1313-1323. [PubMed] [DOI] |
| 6. | Christofi FL, Wunderlich J, Yu JG, Wang YZ, Xue J, Guzman J, Javed N, Cooke H. Mechanically evoked reflex electrogenic chloride secretion in rat distal colon is triggered by endogenous nucleotides acting at P2Y1, P2Y2, and P2Y4 receptors. J Comp Neurol. 2004;469:16-36. [PubMed] [DOI] |
| 7. | Petrakis IE, Vrachassotakis N, Sciacca V, Vassilakis SI, Chalkiadakis G. Hyperglycaemia attenuates erythromycin-induced acceleration of solid-phase gastric emptying in idiopathic and diabetic gastroparesis. Scand J Gastroenterol. 1999;34:396-403. [PubMed] [DOI] |
| 8. | Takayama I, Horiguchi K, Daigo Y, Mine T, Fujino MA, Ohno S. The interstitial cells of Cajal and a gastroenteric pacemaker system. Arch Histol Cytol. 2002;65:1-26. [PubMed] [DOI] |
| 9. | Hanani M, Freund HR. Interstitial cells of Cajal--their role in pacing and signal transmission in the digestive system. Acta Physiol Scand. 2000;170:177-190. [PubMed] [DOI] |
| 10. | Lee JC, Thuneberg L, Berezin I, Huizinga JD. Generation of slow waves in membrane potential is an intrinsic property of interstitial cells of Cajal. Am J Physiol. 1999;277:G409-G423. [PubMed] |
| 11. | Mikkelsen HB, Malysz J, Huizinga JD, Thuneberg L. Action potential generation, Kit receptor immunohistochemistry and morphology of steel-Dickie (Sl/Sld) mutant mouse small intestine. Neurogastroenterol Motil. 1998;10:11-26. [PubMed] [DOI] |
| 12. | Ordög T, Ward SM, Sanders KM. Interstitial cells of cajal generate electrical slow waves in the murine stomach. J Physiol. 1999;518:257-269. [PubMed] [DOI] |
| 13. | Ward SM, Ordög T, Bayguinov JR, Horowitz B, Epperson A, Shen L, Westphal H, Sanders KM. Development of interstitial cells of Cajal and pacemaking in mice lacking enteric nerves. Gastroenterology. 1999;117:584-594. [PubMed] [DOI] |
| 14. | Wu JJ, Rothman TP, Gershon MD. Development of the interstitial cell of Cajal: origin, kit dependence and neuronal and nonneuronal sources of kit ligand. J Neurosci Res. 2000;59:384-401. [PubMed] [DOI] |
| 16. | 侯 艳, 范 玲玲, 杜 军, 林 琳, 戈 应滨. 高糖对体外培养的Cajal间质细胞nNOS、HO-2表达的影响. 南京医科大学学报(自然科学版). 2007;27:1102-1105. |
| 17. | Lin L, Xu LM, Zhang W, Ge YB, Tang YR, Zhang HJ, Li XL, Chen JD. Roles of stem cell factor on the depletion of interstitial cells of Cajal in the colon of diabetic mice. Am J Physiol Gastrointest Liver Physiol. 2010;298:G241-G247. [PubMed] [DOI] |
| 18. | Burnstock G. Introduction: P2 receptors. Curr Top Med Chem. 2004;4:793-803. [PubMed] [DOI] |
| 19. | Surprenant A, Rassendren F, Kawashima E, North RA, Buell G. The cytolytic P2Z receptor for extracellular ATP identified as a P2X receptor (P2X7). Science. 1996;272:735-738. [PubMed] [DOI] |
| 20. | Ohshiro K, Yamataka A, Kobayashi H, Hirai S, Miyahara K, Sueyoshi N, Suda K, Miyano T. Idiopathic gastric perforation in neonates and abnormal distribution of intestinal pacemaker cells. J Pediatr Surg. 2000;35:673-676. [PubMed] [DOI] |
| 22. | Otsuguro K, Ito S, Ohta T, Nakazato Y. Influence of purines and pyrimidines on circular muscle of the rat proximal stomach. Eur J Pharmacol. 1996;317:97-105. [PubMed] [DOI] |
| 23. | Lee HK, Ro S, Keef KD, Kim YH, Kim HW, Horowitz B, Sanders KM. Differential expression of P2X-purinoceptor subtypes in circular and longitudinal muscle of canine colon. Neurogastroenterol Motil. 2005;17:575-584. [PubMed] [DOI] |
| 24. | Zhu Y, Mucci A, Huizinga JD. Inwardly rectifying chloride channel activity in intestinal pacemaker cells. Am J Physiol Gastrointest Liver Physiol. 2005;288:G809-G821. [PubMed] [DOI] |
| 25. | Koh SD, Jun JY, Kim TW, Sanders KM. A Ca(2+)-inhibited non-selective cation conductance contributes to pacemaker currents in mouse interstitial cell of Cajal. J Physiol. 2002;540:803-814. [PubMed] [DOI] |
| 26. | Rassendren F, Buell GN, Virginio C, Collo G, North RA, Surprenant A. The permeabilizing ATP receptor, P2X7. Cloning and expression of a human cDNA. J Biol Chem. 1997;272:5482-5486. [PubMed] [DOI] |
| 27. | Dubyak GR, el-Moatassim C. Signal transduction via P2-purinergic receptors for extracellular ATP and other nucleotides. Am J Physiol. 1993;265:C577-C606. [PubMed] |
| 28. | Brändle U, Kohler K, Wheeler-Schilling TH. Expression of the P2X7-receptor subunit in neurons of the rat retina. Brain Res Mol Brain Res. 1998;62:106-109. [PubMed] [DOI] |
| 29. | Deuchars SA, Atkinson L, Brooke RE, Musa H, Milligan CJ, Batten TF, Buckley NJ, Parson SH, Deuchars J. Neuronal P2X7 receptors are targeted to presynaptic terminals in the central and peripheral nervous systems. J Neurosci. 2001;21:7143-7152. [PubMed] [DOI] |
| 30. | Ishii K, Kaneda M, Li H, Rockland KS, Hashikawa T. Neuron-specific distribution of P2X7 purinergic receptors in the monkey retina. J Comp Neurol. 2003;459:267-277. [PubMed] [DOI] |
| 31. | Moores TS, Hasdemir B, Vega-Riveroll L, Deuchars J, Parson SH. Properties of presynaptic P2X7-like receptors at the neuromuscular junction. Brain Res. 2005;1034:40-50. [PubMed] [DOI] |
| 32. | Sperlágh B, Köfalvi A, Deuchars J, Atkinson L, Milligan CJ, Buckley NJ, Vizi ES. Involvement of P2X7 receptors in the regulation of neurotransmitter release in the rat hippocampus. J Neurochem. 2002;81:1196-1211. [PubMed] [DOI] |
| 33. | Deng Z, Fyffe RE. Expression of P2X7 receptor immunoreactivity in distinct subsets of synaptic terminals in the ventral horn of rat lumbar spinal cord. Brain Res. 2004;1020:53-61. [PubMed] [DOI] |
| 34. | Anderson CM, Nedergaard M. Emerging challenges of assigning P2X7 receptor function and immunoreactivity in neurons. Trends Neurosci. 2006;29:257-262. [PubMed] [DOI] |
| 35. | Belai A, Lefebvre RA, Burnstock G. Motor activity and neurotransmitter release in the gastric fundus of streptozotocin-diabetic rats. Eur J Pharmacol. 1991;194:225-234. [PubMed] [DOI] |