修回日期: 2009-05-15
接受日期: 2009-05-25
在线出版日期: 2010-01-08
目的: 建立简单易行的小鼠胰星状细胞(PSCs)原代培养方法, 为胰腺纤维化研究提供可靠的体外细胞模型.
方法: 采用植块法结合酶消化法进行培养, 即在无菌条件下取小鼠正常胰腺组织, 经过剪碎、胰蛋白酶消化后植入培养瓶中贴壁培养, 并予限制性条件培养基进行纯化, 通过倒置生物显微镜对传代前后所培养细胞进行形态学、自发荧光及油红染色脂滴的观察, 并结合细胞免疫化学和免疫荧光等方法来鉴定小鼠PSCs.
结果: 小鼠原代PSCs培养3-4 d后油红染色阳性, 并能观察到自发荧光现象; 传代后的细胞形态主要表现为体积较大, 伪足发达, 呈"星芒状"或"乌贼样"; 细胞免疫荧光染色和细胞免疫化学染色显示α-平滑肌肌动蛋白(α-SMA)表达阳性.
结论: 植块与酶消化结合法分离小鼠胰腺星状细胞, 简单实用、成功率高, 能够满足体外实验的要求.
引文著录: 唐元瑜, 苏式兵. 小鼠胰星状细胞的分离培养及鉴定. 世界华人消化杂志 2010; 18(1): 28-32
Revised: May 15, 2009
Accepted: May 25, 2009
Published online: January 8, 2010
AIM: To establish a simple method for culture of primary mouse pancreatic stellate cells (PSCs) and provides a reliable in vitro cell model of pancreatic fibrosis.
METHODS: Under sterile conditions, mouse pancreas tissue was collected, minced with scissors, digested with trypsin, and cultured in culture flasks. Cells were then purified in conditioned medium. To identify mouse PSCs, morphological observation, autofluorescence detection, oil red O staining, immunocytochemical staining and immunocytofluorescent staining were performed.
RESULTS: Autofluorescence and oil red O-stained lipid droplets were observed in primary PSCs cultured for 3 to 4 days. Passaged PSCs were large and had well-developed "astral-like]or "squid-like]pseudopodia. Immunocytochemical staining and immunocytofluorescent staining showed that PSCs expressed α-smooth muscle actin (α-SMA).
CONCLUSION: Enzymatic digestion in combination with tissue culture is a simple method for separation of mouse PSCs that has a high success rate and can meet the requirements of in vitro experiment.
- Citation: Tang YY, Su SB. Isolation, culture and identification of mouse pancreatic satellite cells. Shijie Huaren Xiaohua Zazhi 2010; 18(1): 28-32
- URL: https://www.wjgnet.com/1009-3079/full/v18/i1/28.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v18.i1.28
慢性胰腺炎是临床消化系疾病中的常见病, 其主要的病理变化包括不同程度的胰腺腺泡破坏, 间质纤维化, 胰腺导管扩张及囊肿形成等[1]. 目前国内外学者一致认为胰星状细胞的活化是胰腺纤维化形成的中心事件, 活化的星状细胞是胰腺纤维化形成的主要效应细胞[2], 而分离和培养胰星状细胞的经典方法是酶灌注消化法, 但该方法耗时耗力, 影响实验的研究进展, 与肝纤维化研究相比, 胰腺纤维化的研究已明显落伍, 其关键的重要原因之一就在于缺乏适合研究胰腺纤维化的体外细胞模型[3]. 虽然国内已有大鼠胰星状细胞分离培养成功的报道, 但迄今国内外尚未见到小鼠胰星状细胞分离培养的相关文献, 所以, 本研究旨在通过建立一种新的简单易行、重复性高的小鼠胰星状细胞的分离培养方法以提高工作效率, 为下一步开展胰腺纤维化研究奠定实验工作基础.
清洁级昆明种小鼠, 体质量20 g, 雌雄不限, 由上海中医药大学动物实验中心提供. 小鼠实验前自由进食、饮水. M199培养基(Gibco公司, 批号: 1279324)、胎牛血清(杭州四季青生物工程公司, 批号: 080626)、L型-谷氨酰胺(Amresco生物公司)、小鼠α-平滑肌肌动蛋白(α-SMA)mAb、小鼠结蛋白(desmin)mAb、FITC标记羊抗小鼠IgG抗体(以上3种抗体均由武汉博士德生物有限公司提供)、HRP标记的羊抗小鼠IgG抗体(北京博大泰克生物基因技术有限公司)、油红O染料(上海晶美生物有限公司). 美国Therma二氧化碳培养箱、日本Olympus CK41倒置荧光显微镜及DP-70成像系统、德国Eppendorf高速冷冻离心机.
1.2.1 小鼠胰星状细胞的分离与培养: 参考国外学者Kruse等[4]及国内吴凯等[5]培养胰星状细胞的方法, 对其进行改良, 主要包括取胰、消化、植块及纯化培养等步骤, (1)取胰: 取体质量为20 g左右的清洁级昆明种小鼠1只, 术前自由进食饮水, 在超净台外用乙醚将小鼠深度麻醉后, 用大头针将其呈仰卧位固定于泡沫鼠板上, 然后喷洒750 g/L乙醇使其全身湿透进行体外消毒, 5 min后行十字形剖腹术, 即用两把消毒眼科剪依次剪开小鼠皮层、肌层, 上至剑突, 下至耻骨联合, 左右至两侧腋中线, 再将皮瓣外翻、固定, 打开腹腔充分暴露内脏, 然后用眼科镊将小肠翻向左侧, 提起胃, 暴露胰腺, 用眼科剪及镊子小心将其游离, 迅速取出放入盛有预冷磷酸缓冲液的培养皿中. (2)消化与植块: 在培养皿中仔细剔除胰腺周围的被膜结缔组织, 用眼科剪将其粗剪成小块后, 再把组织块置于小烧杯中, 用预冷的磷酸缓冲液漂洗3次以去掉表面血污, 然后用滴管吸净漂洗液, 换用眼科剪再次反复剪切胰腺组织至0.5 mm×0.5 mm×0.5 mm大小为止. 加入预热的2.5 g/L胰蛋白酶5 mL消化6 min后, 予含血清20%的M199培养液终止消化, 然后用弯头吸管小心吸取组织块, 将其置于培养瓶中, 摆布在瓶底部, 小块间相互间距为0.5 cm左右. 拧紧瓶塞, 轻轻翻转培养瓶, 令瓶底朝上, 静置2 h. (3)纯化培养: 2 h后小心加入含有胎牛血清、蛋白酶抑制剂、促细胞生长因子的M199限制性条件培养液4 mL, 让培养液覆盖附于瓶底部的组织小块, 然后置入50 g/L CO2培养箱中静止培养. 每天观察组织块、细胞及培养液情况, 做好记录.
1.2.2 小鼠胰星状细胞的鉴定: 主要包括细胞形态学、自发荧光、脂肪滴的观察及细胞骨架蛋白标志物的检测4个方面内容: (1)形态学观察: 采用Olympus倒置生物显微镜, 观察胰星状细胞的形态结构, 主要包括胞质内的脂滴、细胞的伪足及细胞核等, 每天1次. (2)自发荧光观察: 采用Olympus荧光显微镜, 在波长为328 nm的紫外光激发下进行观察, 时间从原代培养的第3天开始. (3)吖啶橙(AO)染色观察: 取对数生长期的传代细胞, 弃培养液, 用预冷PBS液漂洗贴壁细胞2遍后, 滴加终浓度为100 mg/L吖啶橙荧光染液5滴, 随即在荧光显微镜下蓝色光激发观察细胞形态. (4)脂肪滴观察: 主要采用油红O染色法, 在观察到细胞自发荧光现象时立即进行染色, 即将培养细胞予100 g/L甲醛溶液固定15 min后, 用磷酸缓冲液漂洗细胞2遍以洗去残余固定液, 然后滴加5 g/L油红O染液覆盖细胞表面, 常温下染色45 min后即进行染色细胞脂肪滴观察并摄影成像. (5)骨架蛋白染色观察: 运用细胞免疫荧光及化学染色法, 对传代后所培养的细胞进行α-SMA骨架蛋白的染色观察. 方法按照武汉博士德生物公司提供的说明书步骤进行, 其中α-SMA mAb、FITC标记的羊抗鼠IgG二抗分别予牛血清白蛋白按照1:250和1:60稀释, 免疫化学法为辣根过氧化物酶(HRP)标记的羊抗鼠IgG, 并用DAB显色, 同时用PBS代替一抗做阴性对照.
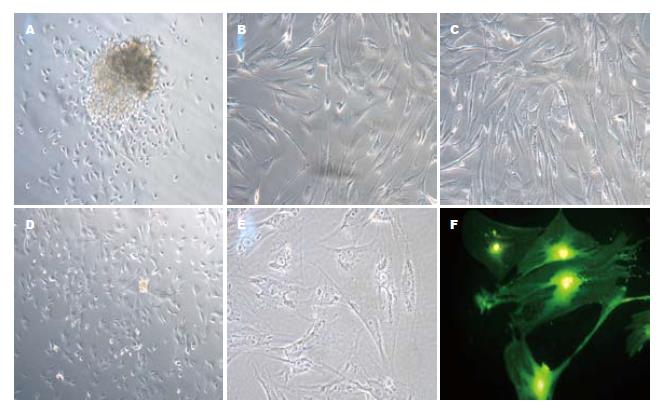
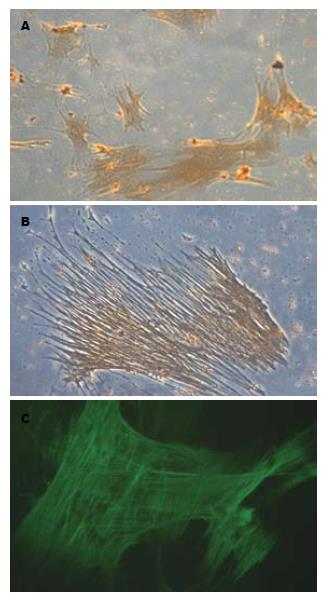
植块培养2 d, 细胞呈放射状爬出, 在组织块周围形成"生长晕", 表现为三角、四角、五角等多种星状形态, 同时在细胞核的周围可见到明显的环状脂肪滴, 第7天, 细胞处于完全融合状态, 体积变大, 脂肪滴逐渐减少. 传代培养2 d后, 其形态均匀, 杂细胞较少, 呈现典型的活化状态, 即胞体较大, 呈星状或不规则样; 伪足丰富, 伸展较开, 扁平, 呈典型的"星芒状"或"章鱼样"; 胞核较大, 核仁明显, 成"鱼眼样"(图1).
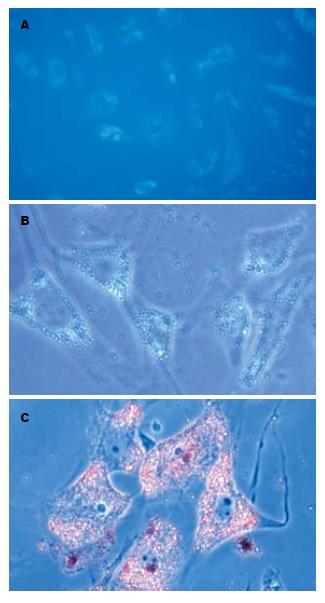
由于未活化的胰星状细胞中含有脂肪滴, 而维生素 A则属于天然荧光素, 易溶于脂肪滴中, 故在波长为328 nm的紫外光激发下发出了蓝色荧光, 而传代后的活化细胞则未见到蓝色荧光. 油红染色实验则可观察到未活化细胞的脂肪滴被染成红色, 成"环状"包绕在细胞核周围, 传代活化的细胞则未染色(图2).
传代培养48 h后的活化胰星状细胞采用免疫化学染色法观察α-SMA骨架蛋白染色, 可见到胞质染成深棕褐色, 400倍镜下可见到明显排列整齐的棕褐色肌丝. 免疫荧光染色法则观察到细胞发出绿色荧光, 胞质绿染, 亦可见到明显的、排列整齐的肌丝蛋白, 核染色则呈阴性(图3).
原代胰腺星状细胞的成功培养最早见于国外学者Bachem等[6]的报道, 其所采用的方法为组织块法, 细胞主要来源于慢性胰腺炎胰腺纤维化区的病理组织, 该方法简单易行, 便于操作, 但其培养的细胞多为成纤维细胞和活化的胰腺星状细胞混合体, 国内学者贾一韬、李兆申等[7]也认为组织块培养法所获得的细胞为肌成纤维样细胞, 而成纤维细胞和血管平滑肌细胞在体外均可活化为肌成纤维样细胞, 与胰星状细胞活化后的肌成纤维样细胞无法鉴别, 所以组织块法最大的弊端就是胰腺星状细胞的纯化问题没有得到很好的解决. 1998年国外学者Apte等[8]采用Ⅳ胶原酶和链霉蛋白酶E联合灌注消化法成功分离和培养了胰星状细胞, 其灌注的途径为胆总管顺、逆行灌注; 此后Shinji等[9]采用胸主动脉插管法灌注, 周龙安、杨桂元等[10]采用腹主动脉插管灌注, 也都同样获得了成功. 虽然酶灌注消化法是目前分离和培养胰星状细胞的经典方法, 但该方法所需要的胶原酶和链霉蛋白酶E价格较高, 同时其插管操作过程复杂, 并需要灌流泵等实验仪器, 这些特殊的条件和要求使得酶灌注消化法的推广运用受到了限制. 而本实验所采用的组织块法与酶消化法相结合的分离方法与其相比较, 则具有操作简单, 重复性好, 成功率高, 实验成本低的优点, 值得推广和借鉴. 细胞的纯化工作一直是原代培养过程中所碰到的不可避免且非常棘手的问题, 很多原代培养常常因为没有解决好该问题而以失败告终, 所以细胞的纯化一直是从事原代培养研究的工作者所关心和重视的问题. 在胰星状细胞的纯化培养中, 经典的酶灌注消化法常常根据胰星状细胞与其他细胞的比重不同而采用不连续密度梯度离心法对所分离获得的细胞进行纯化[11], 然而, 该方法不仅需要专用的梯度离心设备, 而且还要解决好胰星状细胞的纯度和得率之间的矛盾问题, 即需要灵活地人为设定细胞分离液的比重, 且分离的细胞需要成单细胞悬液状态, 生物活性亦要好, 这些较苛刻严格的条件严重影响了实验的重复性和稳定性. 此外密度梯度离心液昂贵的价格, 也增加了实验的成本. 胰腺是体内具有内外分泌功能的重要器官, 胰腺的细胞学研究提示胰腺组织主要是由胰星状细胞、腺泡细胞、胰岛细胞、导管细胞、血管内皮细胞及平滑肌细胞组成[12], 本实验通过运用M199培养基, 并添加适当的血清浓度、蛋白酶抑制剂、成纤维细胞生长抑制剂、细胞生长因子等手段建立了限制性条件培养基以利于胰腺星状细胞的生长和增殖, 通过胰腺星状细胞的生长优势和数量优势, 并利用一些上皮样细胞如胰腺导管上皮、血管内皮细胞等对培养液营养条件要求较高, 在传代培养过程中生长缓慢的劣势及胰腺腺泡细胞在体外只能存活3-4 d的有限生长期而达到了纯化胰星状细胞的目的, 同时也重视腺泡细胞中酶原颗粒激活后对细胞的再消化作用. 所以本实验通过建立限制性条件培养基, 并以传代为重要手段进一步纯化了胰星状细胞, 很好地解决了运用组织块法培养原代胰星状细胞时存在的细胞纯化问题. 在胰腺星状细胞的培养过程中, 细胞的活化也是众多研究者所关心的重要问题, 一般认为星状细胞的活化主要与细胞生长的外环境及细胞外基质有关, 活化的时间多以5 d为界限, 如德国学者Jesnowski等[13]观察到胰星状细胞在基质胶matrigel包被的培养瓶上能保持静止的未活化状态, 国内学者万远太、赵秋等[14]则观察到胰星状细胞在培养96 h后开始快速分裂,比文献报道的肝星状细胞分裂速度慢, 提示了胰星状细胞在体外培养时活化的时间稍慢于肝星状细胞. 在本实验中我们则体会到由于采用的是植块法培养, 其细胞生长的内环境更加接近于体内, 故细胞活化的时间应灵活看待, 可以往后延迟2-4 d, 一般原代细胞在培养7-10 d左右即可长满细胞培养瓶, 达到70%-80%的融合度, 细胞一旦传代, 几乎全部活化. 总之, 本实验运用小鼠正常的胰腺组织, 采用植块法与酶消化法相结合成功分离和培养了小鼠胰星状细胞, 我们建立的这种方法具有操作简单, 重复性好, 成功率高的特点, 并很好地解决了胰星状细胞的纯化问题, 为进一步开展胰腺纤维化研究提供了一种很好的体外细胞模型, 而且该方法同样适用于大鼠胰星状细胞的培养.
基于胰星状细胞的活化是胰腺纤维化形成的中心事件, 活化的星状细胞是胰腺纤维化形成的主要效应细胞, 故胰腺纤维化相关的体外实验多以该细胞为研究对象. 但目前胰腺星状细胞来源匮乏, 所以建立一种简单易行、重复性高的胰星状细胞的分离培养方法, 对于进一步开展胰腺纤维化研究有着重要意义.
李胜, 研究员, 山东省肿瘤防治研究院.
传统的胰星状细胞的培养方法分为植块法和酶灌注消化法, 前者操作简单, 但细胞纯化的难题尚未解决; 而后者虽然结合密度梯度离心法解决了细胞的纯化问题, 但操作繁琐, 实验成本代价高, 所以两种方法利弊各一, 需要进一步改进.
本实验运用小鼠正常的胰腺组织, 采用植块法与酶消化法相结合, 通过建立限制性条件培养基, 并以传代为重要手段进一步纯化了胰星状细胞, 很好地解决了运用组织块法培养原代胰星状细胞时存在的细胞纯化问题. 该方法具有操作简单, 重复性好, 成功率高的特点, 同样也适用于大鼠胰星状细胞的培养.
本文采用植块法与酶消化法相结合成功分离和培养了小鼠胰星状细胞, 较单纯采用组织块培养法或灌注胶原酶分离法, 方法简便易行, 耗费时间少, 且成功率高. 为进一步开展胰纤维化研究提供了一种很好的体外细胞模型.
本研究着眼于基础实验研究细胞培养与传代中亟待解决的问题, 提出了一种较新的简单易行的PSCs原代培养方法, 试图为胰腺纤维化研究提供可靠的体外细胞模型, 所提方法思路较新颖, 可重复性良好, 具有较高的实用价值和推广前景, 符合当前研究趋势, 有较高的参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | 李 兆申, 许 国铭. 现代胰腺病学. 第1版. 北京: 人民军医出版社 2006; 75. |
| 2. | Shek FW, Benyon RC, Walker FM, McCrudden PR, Pender SL, Williams EJ, Johnson PA, Johnson CD, Bateman AC, Fine DR. Expression of transforming growth factor-beta 1 by pancreatic stellate cells and its implications for matrix secretion and turnover in chronic pancreatitis. Am J Pathol. 2002;160:1787-1798. [PubMed] [DOI] |
| 3. | 袁 耀宗, 王 兴鹏. 胰腺病学新进展与新技术. 第1版. 上海: 上海科学技术术文献出版社 2000; 11. |
| 4. | Kruse ML, Hildebrand PB, Timke C, Fölsch UR, Schäfer H, Schmidt WE. Isolation, long-term culture, and characterization of rat pancreatic fibroblastoid/stellate cells. Pancreas. 2001;23:49-54. [PubMed] [DOI] |
| 6. | Bachem MG, Schneider E, Gross H, Weidenbach H, Schmid RM, Menke A, Siech M, Beger H, Grünert A, Adler G. Identification, culture, and characterization of pancreatic stellate cells in rats and humans. Gastroenterology. 1998;115:421-32. [PubMed] [DOI] |
| 8. | Apte MV, Haber PS, Applegate TL, Norton ID, McCaughan GW, Korsten MA, Pirola RC, Wilson JS. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 1998;43:128-133. [PubMed] |
| 9. | Shinji T, Ujike K, Ochi K, Kusano N, Kikui T, Matsumura N, Emori Y, Seno T, Koide N. Establishment of a novel collagenase perfusion method to isolate rat pancreatic stellate cells and investigation of their gene expression of TGF-beta1, type I collagen, and CTGF in primary culture or freshly isolated cells. Acta Med Okayama. 2002;56:211-218. [PubMed] [DOI] |
| 11. | Apte MV, Haber PS, Applegate TL, Norton ID, McCaughan GW, Korsten MA, Pirola RC, Wilson JS. Periacinar stellate shaped cells in rat pancreas: identification, isolation, and culture. Gut. 1998;43:128-133. [PubMed] [DOI] |
| 12. | 袁 耀宗, 王 兴鹏. 胰腺病学新进展与新技术. 第1版. 上海: 上海科学技术术文献出版社 2000; 8-11. |
| 13. | Jesnowski R, Fürst D, Ringel J, Chen Y, Schrödel A, Kleeff J, Kolb A, Schareck WD, Löhr M. Immortalization of pancreatic stellate cells as an in vitro model of pancreatic fibrosis: deactivation is induced by matrigel and N-acetylcysteine. Lab Invest. 2005;85:1276-1291. [PubMed] [DOI] |