修回日期: 2009-02-16
接受日期: 2009-02-23
在线出版日期: 2009-03-28
目的: 探讨原发性肝恶性淋巴瘤(primary liver lymphoma, PLL)的临床病理特点及诊治方法.
方法: 对我院1975-2008年收治的经病理确诊的7例原发性肝恶性淋巴瘤的病因、临床表现、形态学光镜、电镜、免疫组织化学、血清学甲胎蛋白(AFP)、乙型肝炎(HBsAg)、乳酸脱氢酶(LDH)和治疗结果进行系统分析.
结果: 本组7例患者, 4例均上腹痛发热, 3例有淋巴瘤B症状, 发热、盗汗、体质量减轻. 有5例合并慢性肝炎或肝硬化. 组织病理学5例为B细胞表型. 免疫组织化学显示CD20、CD79α阳性, 电镜示瘤细胞间毛细血管、胞质细胞器发达. 2例为T细胞表型, CD3、CD45RO阳性, 电镜下瘤细胞质稀疏, 细胞器不发达. 血清学检查5例AFP和CEA阴性. 5例HBsAg阳性, 2例HBsAg阴性. LDH 675.54 U/L-1246.5 U/L. 4例术后采用化疗者生存时间平均为9.5 mo. 3例术后采用生物化疗者生存时间为23.0 mo.
结论: PLL与HBV病毒感染有关; 伴有B症状, 常见肝内占位性病变和LDH增高; 首选手术切除联合生物化疗的治疗模式; 能够延长患者的生存时间.
引文著录: 刘玉国, 脱帅, 徐克, 孙士财. 原发性肝脏淋巴瘤的临床病理特点及其外科治疗. 世界华人消化杂志 2009; 17(9): 935-939
Revised: February 16, 2009
Accepted: February 23, 2009
Published online: March 28, 2009
AIM: To study clinicopathological features of primary liver lymphoma (PLL) and its diagnostic as well as therapeutic methods.
METHODS: Seven cases of primary liver lymphoma, diagnosed and treated at our hospital during 1975 and 2008, were retrospectively studied. The etiology, clinical presentations, morphology (detected by light microscopy, electron microscopy, or immunohistochemistry), serological tests of alpha fetal protein (AFP), carcinoma embryonic antigen (CEA), hepatitis B surface antigen (HBsAg), and lactate dehydrogenase (LDH), as well as therapeutic results were systematically analyzed.
RESULTS: Of the 7 patients, 4 patients presented with epigastric pain and fever, and 3 patients had fever, night sweats, and loss of weight. Five patients were complicated with chronic hepatitis or cirrhosis. Histopathological findings showed that 5 patients were B cell phenotype with positive staining of CD20 and CD79α. Electron microscopy of B cell lymphoma revealed an abundance of blood capillaries among tumor cells and organelles in cytoplasm. The other 2 patients belonged to T cell phenotype with positive expression of CD3 and CD45RO. Scant cytoplasm and few of organelles were prominent ultrastructural characteristics of T cell lymphoma. Serological test showed that 5 patients were negative for AFP and CEA, and HBsAg was positive in 5 patients. LDH level was elevated (range: 675.54 U/L-1246.5 U/L). The longer survival time was achieved in the 3 patients treated by surgical resection plus biochemotherapy (average survival: 23 months), compared with the 4 patients receiving surgical resection plus chemotherapy (average survival: 9.5 months).
CONCLUSION: Hepatitis B virus (HBV) infection is prevalent in PLL patients. The major clinicopathological features of PLL include B symptoms, space-occupying lesion in the liver, and elevated LDH level. Surgical resection plus biochemotherapy is a more effective approach, which prolongs survival time of PLL patients.
- Citation: Liu YG, Tuo S, Xu K, Sun SC. Clinicopathological features of primary liver lymphoma and its surgical therapy. Shijie Huaren Xiaohua Zazhi 2009; 17(9): 935-939
- URL: https://www.wjgnet.com/1009-3079/full/v17/i9/935.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i9.935
原发性肝脏恶性淋巴瘤(primary lymphoma of the liver, PLL)发病率占肝脏恶性肿瘤的0.1%, 占结外淋巴瘤的0.4%[1-2]. 按照结外淋巴瘤的定义, PLL是指病变局限于肝内, 早期无淋巴结及肝外扩散具有淋巴细胞标记的恶性肿瘤[3]. 其病因学和发病机制尚不清楚, 无特异临床症状, 术前误诊率高, 往往误诊为原发性肝癌或肝转移性肿瘤[4]. 目前, PLL标准的治疗方法尚未确定. 本研究收集了中国人民解放军第313医院于1975-01/2008-10收治的7例PLL患者的临床资料, 并结合相关文献, 回顾性分析其临床病理特征和治疗方式对患者生存状况的影响.
1975-01/2008-10我院普通肝胆外科病房收治的经病理学和手术证实的PLL 7例, 男性5例, 女性2例, 年龄25-59(平均44.57±12.62)岁.
1.2.1 组织学和免疫组织化学检查: 所有病例手术切除瘤组织经40 g/L中性甲醛溶液固定, 常规石蜡包埋, 切片厚度4 μm, 行HE染色. 对所有病例石蜡包埋组织切片行多个免疫组织化学染色观察. 采用LSAB法, 包括CD20、CD3、CD79a、CD45RO(购自美国Dako公司).
1.2.2 电镜检查: 肿瘤组织以25 g/L戊二醛和10 g/L锇酸双重固定, Epon包埋, 超薄切片, 铀-铅染色、PHIPIS-CM10透射电镜观察.
1.2.3 诊断标准及方法: 按照WHO《造血与淋巴组织肿瘤疾病》结外淋巴瘤的诊断分类方法[5]. (1)临床症状主要由肝浸润引起; (2)无其他组织、器官侵犯和远处淋巴结肿大; (3)无外周血白细胞浸润; (4)骨髓像正常. 诊断以手术标本的病理诊断为准.
1.2.4 治疗方法: 手术7例, 手术方式部分肝叶切除; 手术者中, 手术加化疗4例, [化疗CHOP方案(环磷酰胺, 多柔比星, 长春新碱, 泼尼松)]疗程4-6 wk. 手术加生物化疗3例, [生物化疗(生物治疗树突状细胞dendritic cell, DC)回输治疗为主, 辅以细胞因子诱导的杀伤细胞(cytokine induced killer, CIK)白介素2(interleukin-2, IL-2), α-干扰素(interferon-α, INF-α), 粒单核细胞集落刺激因子(granulocyte-macrophage colony stimulating factor, GM-CSF)]等免疫治疗.
7例患者均符合原发性肝恶性淋巴瘤诊断标准. 首发症状肝区胀痛或上腹不适4例. B超常规检查发现肝内占位7例, 扪及肿块4例. 发热、盗汗、体质量减轻3例, 无浅表淋巴结肿大. 患慢性肝炎或肝硬化者5例. 血清学检查: 5例AFP和CEA阴性. 2例AFP阳性, 1例CA19-9阳性, 5例HBsAg阳性, 2例HBsAg阴性, LDH 657.5-1246.5 U/L. 所有患者外周血涂片均未发现幼稚白细胞. 4例骨髓穿刺细胞学检查未发现异常细胞. CT、胸片及手术均未发现其他器官占位病灶, 临床特点见表1.
| 病例 | 性别/年龄(岁) | 临床症状/体征 | 病史 | 化验 | 影像学 | 治疗 | 组织学 | 诊断后生存 (mo) |
| 1 | 男/59 | 右上腹隐痛, 发热, 浅表LN(-) | 乙肝病史20年 | HBsAg(+)AF P (-) CEA(-)骨髓及血常规正常 | CT: 肝左叶内见一直径8 cm低密度影; B超发现肝占位 | 肝不规则切除术, CHOP方案6周期 | B细胞性低度恶性, 破坏汇管区浸润 | 12 |
| 2 | 女/51 | 右上腹隐痛, 合并肝硬化, 浅表LN(-) | 乙肝病史18年 | AFP(-), CEA(-)肝功正常, 血常规正常 | CT: 肝右叶内见一直径5 cm低密度影, B超发现肝占位 | 肝不规则切除术, CHOP方案6周期 | T细胞性低度恶性淋巴瘤, 肝细胞癌, 破坏肝窦隙和汇管区浸润 | 10 |
| 3 | 男/25 | 发热, 浅表LN(-) | 乙肝携带者8年 | AFP(-), CEA(-)LDH增高, 血常规正常 | CT: 肝左叶内见一直径6 cm低密度影; B超发现肝占位 | 肝不规则切除术CHOP方案6周期放疗 | 霍奇金氏恶性淋巴瘤, 破坏性肝窦隙和汇管区浸润 | 11 |
| 4 | 女/31 | 右上腹隐痛, 发热, 合并肝硬化, 浅表LN(-) | 乙肝病史5年 | AFP(+), CEA(-), CA199(+), r-GT增高, 血常规正常 | CT: 肝右叶内见一直径14 cm低密度影; B超发现肝占位 | 肝不规则切除术, CHOP方案6周期 | T细胞性恶性淋巴瘤, 腹膜后恶性神经鞘瘤, 肝脏大部分被瘤组织替代 | 5 |
| 5 | 男/41 | 偶有上腹部疼痛, 浅表LN(-) | 乙肝病史10年 | AFP(-), CEA(-), 肝功正常, 血常规正常 | MRI: 两肝有多个结节或团块状信号区大小2.8-7.1 cm, B超发现肝占位 | 肝肿瘤切除术, 生物化疗 | 非霍奇金大B细胞性, 破坏性肝窦隙和汇管区浸润 | 24 |
| 6 | 男/52 | 无任何不适, 浅表LN(-) | - | AFP(-), 肝功正常, 抗-HCV(+), 血常 规正常 | CT: 肝左叶内5 cm×7 cm大小低密度占位性病变; B超发现肝 占位B超发现左肝占位 | 肝不规则切除术, 生物化疗 | 大B细胞性, 破坏性肝窦隙和汇管区浸润 | 14 |
| 7 | 男/53 | 偶有上腹部疼痛, 发热, 浅表LN(-) | 乙肝病史13年 | AFP(-), CEA(-), 肝功正常, 血常规正常 | CT: 肝右叶内见一直径6 cm×5 cm低密度影; B超发现肝占位 | 肝不规则切除术, 生物化疗 | 非霍奇金B细胞源性, 肝脏大部分被瘤组织替代, 破坏性肝窦隙和汇管区浸润 | 31 |
本组手术加化疗者4例, 平均生存时间为9.5 mo. 3例手术加生物治疗者生存时间为23.0 mo. 影像学检查: 7例患者超声检查病灶7个, 检出率100%. 超声考虑血管瘤3例, 误诊率42.8%; CT检查7次; 诊断为肝细胞肝癌5例, 误诊率71.4%; MRI诊断肝癌和血管瘤各1例, 误诊率28.5%.
病理学检查: 所有肝脏标本都含有单个大肿瘤(除1例多个结节或弥散存在的肿块), 4例位于肝左叶, 2例位于肝右叶, 1例位于肝脏中央. 大体上肿瘤与其他原发性肝脏肿瘤类似, 但肿瘤切面十分特征, 即瘤结节中间部分黄白色, 周边有红色不规则充血带.
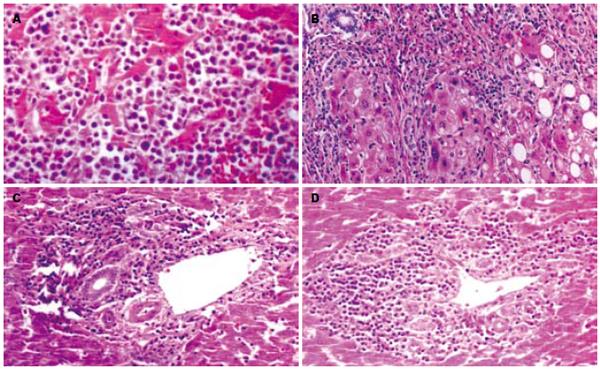
组织学检查: 瘤细胞呈弥漫性分布, 细胞较大, 呈圆形, 卵圆形或不规则形. 核大浓染, 核膜厚, 染色质不均匀. 可见核仁, 胞质少, 可见多核瘤细胞, 病理核分裂象多见(图1A). 肿瘤周边肝组织的汇管区, 可见小叶间静脉, 小叶间动脉、小叶间胆管和大量成熟的淋巴细胞(图1B). 瘤细胞侵入并破坏临近肝组织和汇管区内胆管、静脉和动脉(图1C-D). 免疫组化检查证实5例为非霍奇金B细胞性淋巴瘤. 对CD20CD79a呈阳性表达; 2例为非霍奇金T细胞淋巴瘤, 对CD3、CD45RO呈阳性表达.
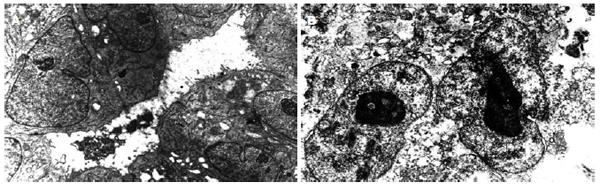
电镜检查: 瘤细胞形态、大小不规则. 瘤细胞内毛细胆管扩张, 腔面微绒毛减少. 腔内有胆汁淤滞, 胆栓形成. 相邻细胞有紧密联接, 细胞核明显不规则, 胞质内可见粗面内质网、线粒体及空泡结构(图2A). 瘤细胞呈圆形、椭圆形及不规则形. 胞质比例大, 核形有的比较规则, 周界平滑整齐, 有的核膜不规则, 有较深凹陷, 核内异染色质成小块沿核膜分布, 可见核仁, 胞质稀疏, 细胞器少, 可见少量变性线粒体及短小扩张粗面内质网(图2B).
原发性肝淋巴瘤临床罕见, 自从Ata于1965年首次报道以来, 至今英语文献仅251例[5]. 其病因和发病机制尚不清楚. 文献报道, 免疫系统异常, 或乙肝病毒(HBV)/丙肝病毒(HCV)诱发的慢性活动型肝炎在PLL发生、发展中起重要作用[6]. Aozasa et al[7]在所研究的69例PLL患者中HBV阳性检出率为20%, 在PLL发病之前有9.6%-44%的患者有慢性肝病[8]. 本组亦有5例有HBV感染, 2例有结节性肝硬变改变. Ohsawa et al[4]首次报道了在PLL病例的淋巴瘤细胞中检测到HCV基因组, HCV的直接形式通过感染肝细胞引起外源性抗原刺激参与PLL发生有关. PLL组织发生可能起源于肝脏汇管区内的淋巴组织. 作者不仅观察到肿瘤周围汇管区可见到大量成熟淋巴细胞浸润, 而且观察到瘤细胞弥漫浸润肝脏, 破坏汇管区胆管及肝小叶结构. 本研究结果证实了PLL组织发生起源于肝脏汇管区的淋巴细胞以及肝炎病毒长期持续刺激可诱发细胞恶变是造成PLL发生的重要因素. 另外, PLL和自身免疫病或工业毒素有关[9]. 本组患者未发现这些危险因素.
PLL诊断标准不一, 根据外淋巴瘤的诊断标准[10-11]: (1)临床症状主要为肝脏浸润引起的; (2)无其他组织、器官侵犯和远处淋巴结肿大; (3)无外周白细胞浸润; (4)骨髓像正常. 本组病例皆符合上述诊断标准. 既往文献表明[12]PLL典型地发生在50岁男性, 但是, 患者年龄范围实际分布很广. 本文报道的病例中有5例男性, 年龄在25-59岁之间, 2例女性, 年龄分别为31岁和51岁, 平均年龄44.57岁. 男、女比是5:2与文献报道相似.
PLL临床特征表现为, 上腹部疼痛、食欲减退、呕吐等消化道症状. 淋巴瘤B症状, 消瘦、发热、体重减轻. 体检, 肝肿大. 实验室检查血清转氨酶、乳酸脱氢酶(LDH)、β-2微球蛋白升高, 血小板减少. 肿瘤标志物(AFP、CEA)在正常范围内. 本组病例中4例上腹部疼痛和肝肿大较为明显. PLL患者中有B症状者占一半以上, 提示伴有B症状的肝占位性病变, 必须要考虑到PLL鉴别诊断. Page et al[1]通过动态观察PLL变化, 发现术前LDH明显升高, 术后PLL常下降至正常. 本组病例中有5例LDH术前增高, 术后LDH降至正常. 认为LDH可作为诊断PLL和判断预后的指标.
PLL为单发病灶(60%), 也可为多发(35%), 极少为肝内浸润性(4%)[8]. 大体病理特点可分为单发肿块型, 多发结节型和弥漫浸润型, 其中多数为单发肿块型, 而弥漫浸润型很少见[10]. 免疫组化检查显示PLL分型79%是B细胞型并且在PLL中真性组织细胞性淋巴瘤发生率数较其他结外淋巴瘤为高. PLL患者的骨髓像检查一般无特殊异常, 最终诊断依赖于手术后的病理诊断, 免疫组化检查对于明确PLL的表型和鉴别诊断具有重要价值.
由于PLL临床少见, 临床尚缺少统一的治疗方案. 多数学者认为手术切除仍是目前PLL最主要和最有效的治疗方法[13]. 其不但可切除肿瘤, 且可明确诊断, 确定肿瘤分期以指导下一步的治疗, 并判断预后.
关于手术与手术加化疗的疗效比较已有报道, Lei et al[2]报道了10例PLL单纯根治性手术, 平均生存期22 mo. Avlonieis et al[14]报道了14例PLL手术加化疗, 平均生存期为20.7 mo, 结果显示, 单纯手术组与手术加化疗组的生存率比较, 差异均无统计学意义. 本研究在PLL手术加化疗治疗的基础上, 采用生物治疗与化疗合并使用, 即生物化学治疗(biothemothrapy). 生物治疗是以DC回输治疗为主, 辅助以CIK细胞和IL-2, INF-α, GM-CSF等免疫治疗. 本组7例PLL术后的患者中, 4例术后加化疗组, 生存时间平均为9.5 mo; 3例术后加生物化疗, 平均生存时间为23.0 mo. 本研究发现, PLL可能具有人群差异, 我国PLL患者与文献报道的白种PLL患者其生物学行为不同, 我国人群PLL以B症状为显著表现, 呈现高度侵袭性临床过程, 对局部和系统性治疗效果差, 生存期短.
虽然本组病例数有限, 未能进行统计比较, 但仍然显示, 对于PLL手术后采用生物化疗能够获得满意的效果. 并且在我们临床应用中, 患者对生物化疗具有良好的耐受性, 没有观察到明显的不良反应. 研究结果提示, 生物化疗对PLL的治疗有显著疗效.
原发性肝脏恶性淋巴瘤(PLL)发病率占肝脏恶性肿瘤的0.1%, 占结外淋巴瘤的0.4%. 按照结外淋巴瘤的定义, PLL是指病变局限于肝内, 早期无淋巴结及肝外扩散具有淋巴细胞标记的恶性肿瘤. 其病因学和发病机制尚不清楚, 无特异临床症状, 术前误诊率高, 往往误诊为原发性肝癌或肝转移性肿瘤. 目前, PLL标准的治疗方法尚未确定.
孙殿兴, 主任医师, 白求恩国际和平医院肝病科
原发性肝淋巴瘤临床罕见, 自从Ata于1965年首次报道以来, 至今英语文献仅251例. 其病因和发病机制尚不清楚.
Aozasa et al在所研究的69例PLL患者中HBV阳性检出率为20%, 在PLL发病之前有9.6%-44%的患者有慢性肝病. Ohsawa et al首次报道了在PLL病例的淋巴瘤细胞中检测到HCV基因组, HCV的直接形式通过感染肝细胞引起外源性抗原刺激参与PLL发生有关.
首选手术切除联合生物化疗的治疗模式; 能够延长患者的生存时间.
原发性肝脏淋巴瘤在临床上十分罕见, 文献报道也较少. 本文报道了7例该病患者, 对其各种临床资料进行了分析, 研究内容重要, 提供了许多有意义的信息.
编辑: 史景红 电编:吴鹏朕
| 1. | Page RD, Romaguera JE, Osborne B, Medeiros LJ, Rodriguez J, North L, Sanz-Rodriguez C, Cabanillas F. Primary hepatic lymphoma: favorable outcome after combination chemotherapy. Cancer. 2001;92:2023-2029. [PubMed] [DOI] |
| 2. | Eom DW, Huh JR, Kang YK, Lee YS, Yu E. Clinicopathological features of eight Korean cases of primary hepatic lymphoma. Pathol Int. 2004;54:830-836. [PubMed] [DOI] |
| 3. | Fernandez MP, Redvanly RD. Primary hepatic malignant neoplasms. Radiol Clin North Am. 1998;36:333-348. [PubMed] [DOI] |
| 4. | Ohsawa M, Tomita Y, Hashimoto M, Kanno H, Aozasa K. Hepatitis C viral genome in a subset of primary hepatic lymphomas. Mod Pathol. 1998;11:471-478. [PubMed] |
| 5. | Santos ES, Raez LE, Salvatierra J, Morgensztern D, Shanmugan N, Neff GW. Primary hepatic non-Hodgkin's lymphomas: case report and review of the literature. Am J Gastroenterol. 2003;98:2789-2793. [PubMed] [DOI] |
| 6. | Bronowicki JP, Bineau C, Feugier P, Hermine O, Brousse N, Oberti F, Rousselet MC, Dharancy S, Gaulard P, Flejou JF. Primary lymphoma of the liver: clinical-pathological features and relationship with HCV infection in French patients. Hepatology. 2003;37:781-787. [PubMed] [DOI] |
| 7. | Aozasa K, Mishima K, Ohsawa M. Primary malignant lymphoma of the liver. Leuk Lymphoma. 1993;10:353-357. [PubMed] [DOI] |
| 8. | Ohsawa M, Aozasa K, Horiuchi K, Kataoka M, Hida J, Shimada H, Oka K, Wakata Y. Malignant lymphoma of the liver. Report of five cases and review of the literature. Dig Dis Sci. 1992;37:1105-1109. [PubMed] [DOI] |
| 9. | DeMent SH, Mann RB, Staal SP, Kuhajda FP, Boitnott JK. Primary lymphomas of the liver. Report of six cases and review of the literature. Am J Clin Pathol. 1987;88:255-263. [PubMed] [DOI] |
| 10. | Baschinsky DY, Weidner N, Baker PB, Frankel WL. Primary hepatic anaplastic large-cell lymphoma of T-cell phenotype in acquired immunodeficiency syndrome: a report of an autopsy case and review of the literature. Am J Gastroenterol. 2001;96:227-232. [PubMed] [DOI] |
| 11. | Maher MM, McDermott SR, Fenlon HM, Conroy D, O'Keane JC, Carney DN, Stack JP. Imaging of primary non-Hodgkin's lymphoma of the liver. Clin Radiol. 2001;56:295-301. [PubMed] [DOI] |
| 12. | Lei KI. Primary non-Hodgkin's lymphoma of the liver. Leuk Lymphoma. 1998;29:293-299. [PubMed] [DOI] |
| 13. | Scoazec JY, Degott C, Brousse N, Barge J, Molas G, Potet F, Benhamou JP. Non-Hodgkin's lymphoma presenting as a primary tumor of the liver: presentation, diagnosis and outcome in eight patients. Hepatology. 1991;13:870-875. [PubMed] [DOI] |
| 14. | Avlonitis VS, Linos D. Primary hepatic lymphoma: a review. Eur J Surg. 1999;165:725-729. [PubMed] [DOI] |