修回日期: 2009-02-27
接受日期: 2009-03-02
在线出版日期: 2009-03-28
目的: 探讨JAK/STAT信号通路在胰弹性蛋白酶(elastase)诱导Kupffer细胞分泌IL-18中的作用机制.
方法: 采用酶消化法及密度梯度离心法将提取的肝脏Kupffer细胞分为4组, A组: 生理盐水组(正常对照组); B组: 脂多糖(LPS)处理组; C组: LPS和elastase处理组; D组: AG490预处理组. 采用酶免疫吸附(ELISA)法检测Kupffer细胞上清液中IL-18含量; 细胞免疫荧光染色技术和Western blot法检测细胞总蛋白中JAK2的表达.
结果: 与A组比较, B组在给予LPS刺激后, JAK2蛋白的表达以及上清液中IL-18含量均明显增加(IL-18: 312.23±20.5 ng/L vs 13.50±2.18 ng/L, P<0.01); C组在同时给予LPS和elastase刺激后, JAK2的表达显著升高, 上清液中IL-18含量与B组比较也显著增加(P<0.01); 而D组在预先给予AG490处理后, JAK2表达明显下降, 上清液中IL-18含量也有不同程度降低, 与C组比较差异有统计学意义(317.31±25.24 ng/L vs 438.86±21.32 ng/L, P<0.01), 但与B组比较, 各值仅有轻微变化, 差异无统计学意义.
结论: 抑制JAK/STAT通路的活化可下调elastase诱导Kupffer细胞分泌促炎症因子IL-18的表达, 这可能有助于减轻急性胰腺炎时炎症反应和肝损伤.
引文著录: 李敏利, 朱人敏, 张晓华, 史薇, 杨妙芳, 季洪赞, 郭婧芸. JAK/STAT信号通路在胰弹性蛋白酶诱导大鼠Kupffer细胞分泌IL-18中的作用. 世界华人消化杂志 2009; 17(9): 877-881
Revised: February 27, 2009
Accepted: March 2, 2009
Published online: March 28, 2009
AIM: To investigate the role of JAK/STAT signaling pathway in secretion of interleukin-18 (IL-18) by Kupffer cells in experimental acute pancreatitis with liver injury.
METHODS: Hepatic Kupffer cells extracted through enzymatic digestion and density gradient centrifugation were divided into four groups. Group A (normal saline group) served as control group; Group B was lipopolysaccharide (LPS) treatment group; Group C was LPS plus pancreatic elastase treatment group; Group D was AG490 treatment group. The concentrations (IL-18) in Kupffer cell supernatant were determined by ELISA, and the expression of JAK2 protein was determined by immunofluorescence and Western blot.
RESULTS: The concentrations of IL-18 in the supernatant and JAK2 protein in group B had increased significantly compared with those in group A (IL-18: 312.23 ± 20.5 ng/L vs 13.50 ± 2.18 ng/L, P < 0.01). The same result was seen when group C was compared with group B (P < 0.01). The concentrations of IL-18 and JAK2 protein in group D decreased significantly compared with those in group C (317.31 ± 25.24 ng/L vs 438.86 ± 21.32 ng/L, P < 0.01), but just only slightly increased compared with those in group B.
CONCLUSION: Inhibition of JAK/STAT signaling pathway activation may reduce pancreatic elastase-induced expression of proinflammatory cytokines IL-18 in rat Kupffer cells, which may help alleviate liver injury induced by acute pancreatitis.
- Citation: Li ML, Zhu RM, Zhang XH, Shi W, Yang MF, Ji HZ, Guo JY. Role of JAK/STAT signaling pathway in pancreatic elastase-induced secretion of interleukin-18 within rat Kupffer cells. Shijie Huaren Xiaohua Zazhi 2009; 17(9): 877-881
- URL: https://www.wjgnet.com/1009-3079/full/v17/i9/877.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i9.877
关于急性胰腺炎(acute pancreatitis, AP)发病机制以及合并胰腺外器官损伤的研究, 国内外取得了不少进展, 近年来, 炎症细胞过度激活学说更成为一大研究热点. AP时, 炎症胰腺组织释放大量的炎症介质, 并通过一序列生物学级联放大效应, 进一步释放大量促炎症因子, 其中包括近年新发现的一种重要的炎症因子IL-18, 这些炎症介质在AP发生、发展过程中起重要调节作用, 是导致AP病情加重的关键因素[1]. 肝脏拥有全身最大的巨噬细胞群, 即枯否细胞(kupffer cell, KC), 他具有强大的分泌各种细胞因子的功能, 对AP的病情严重程度及胰腺外器官损伤起重要作用[2]. Janus激活/信号转导和转录激活子(janus kinase/signal transducer and activator of transcription, JAK/STAT)信号通路是细胞因子信号转导的重要途径, 但AP时, JAK/STAT通路介导肝脏分泌IL-18作用的研究目前尚无报道. 本研究旨在通过培养原代大鼠KC, 观察AP时KC中JAK2蛋白表达情况及IL-18含量, 明确JAK/STAT通路在AP时KC分泌IL-18的作用机制, 以探讨减少AP引起急性炎症反应的有效途径.
Percoll分离液购自Pharmacia公司; AG490购自Biosource公司; Hepes、PMSF均购自Amresco公司; RPMI 1640干粉培养液购自Gibco公司; 胰弹性蛋白酶购自Chemicon公司; IL-18试剂盒购自ADL公司; 辣根过氧化物酶标记的羊抗鼠JAK2-IgG购自Cell Signal公司; 兔抗大鼠β-actin购自博士德公司; 细胞裂解液购自碧云天公司; 其他常用试剂均为国产分析纯试剂. PVDF膜为美国Millipore公司产品; 酶标仪、PAGE凝胶电泳仪、垂直电泳槽、电泳凝胶图像分析系统均购自Bio-Rad公司.
1.2.1 枯否细胞的分离、纯化和培养: 健康♂SD大鼠24只(200-250 g), 购自中国人民解放军南京军区南京总医院实验动物中心. 按文献[3]的改进方法采用酶消化法、密度梯度离心以及选择贴壁法提取KC. 将提取的KC接种于6孔板中(1×109/L), 1 h后去除培养基, 用温PBS清洗2遍, 去除未贴壁细胞, 贴壁细胞即为实验所需的高纯度KC. 细胞活性测定采用苔盼蓝拒染实验, 细胞性质测定采用吞噬墨汁实验.
1.2.2 枯否细胞分组和处理: 本实验参照Murr et al[4-5]的方法, 并根据本实验要求作一定改进. 将上述获得的KC用含100 mL/L FCS的RPMI-1640培养基培养24 h后分成4组(n = 6). A组(正常对照组): 在培养基上清液中加入生理盐水(30 mL/L); B组: 上清液中加入脂多糖(LPS, 50 μg/L); C组: 上清液中加入LPS(50 μg/L)和胰弹性蛋白酶(elastase, 1 U/mL); D组: 上清液中加入AG490(30 μmol/L)预先刺激0.5 h后, 再用LPS(50 μg/L)和elastase(l U/mL)处理.
1.2.3 细胞上清液收集: KC在加入刺激因子作用后12 h收集培养基, 4℃, 10 000 g离心10 min, 取上清液并立即置于-70℃保存.
1.2.4 细胞上清液中IL-18含量测定: ELISA法检测细胞上清液中IL-18的含量, 具体步骤严格按试剂盒使用说明书进行操作, 通过绘制标准曲线得出样品中相应细胞因子含量. 该方法检测IL-18的灵敏度为1 ng/L.
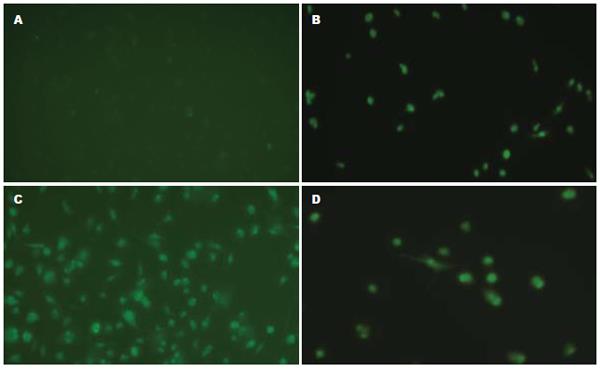
1.2.5 细胞免疫荧光染色: 各实验组KC经爬片后用100 g/L多聚甲醛固定30 min, PBS冲洗15 min, 0.1% Triton X-100通透10 min, PBS震荡冲洗15 min, 10% BSA-PBST封闭30 min; 各加一抗(JAK2单克隆抗体1:50稀释)4℃孵育过夜, PBS冲洗5 min×3, 二抗(1:100稀释), 37℃暗盒孵育1.5 h, PBS洗5 min×3, 抗荧光焠灭封片液封片. JAK2阳性主要定位于细胞质, 细胞质发荧光为阳性细胞. 阴性对照不加一抗, 其余步骤相同. Olympus荧光显微镜观察并摄片.
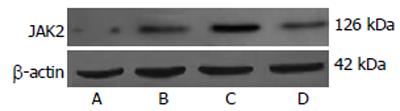
1.2.6 细胞总蛋白中JAK2表达的检测: 各实验组分别在添加刺激因子继续培养12 h后收集细胞, 同期收集对照组细胞, 用RIPA细胞裂解液裂解细胞, 提取总蛋白. 所提取的蛋白均采用Bradford法行总蛋白定量, 各取100 μg/孔, 行100 mL/L SDS-聚丙烯酰胺凝胶电泳分离(2 h). 待电泳结束后, 将蛋白(低温条件下湿转3 h)转至PVDF膜上, 膜按常规封闭. 加入兔抗鼠JAK2单克隆抗体(1:1000稀释), 4℃过夜, 用TBST洗膜5次, 每次6 min, 再加入辣根过氧化物酶标记的羊抗兔二抗(1:2000稀释), 室温摇床上反应4 h, 再用TBST洗膜5次, 每次6 min. 洗膜后ECL法化学发光, X线底片曝光显影, 以β-actin作为内参照. 用Bio-Rad图像分析系统照相, 用Image-Pro软件分析, 以相应条带灰度值表示相对蛋白含量.
统计学处理 所有数据采用SPSS13.0统计软件进行分析, 计量资料以mean±SD表示, 多组均数间比较采用单因素方差分析, 两组均数间比较采用t检验, P<0.05表明差异有统计学意义.
经酶消化法、Percoll密度梯度离心和选择性贴壁法提取肝脏KC, 每只大鼠KC获得(2.40±0.16)×107个, 细胞贴壁率为42.7%, 采用台盼蓝拒染法鉴定细胞活力为95%以上; 吞噬墨汁实验鉴定细胞纯度达92%以上.
与A组比较, B组IL-18含量显著增加(P<0.01); 与B组比较, C组IL-18含量增加更明显(P<0.01); 与C组比较, D组IL-18含量明显减少(P<0.01), 但与B组比较仅有轻微变化, 差异无统计学意义(P>0.05, 表1).
| 分组 | IL-18 |
| 正常对照组 | 13.50±2.18 |
| LPS组 | 312.23±20.5a |
| LPS+elastase共同处理组 | 438.86±21.32ab |
| AG490治疗组 | 317.31±25.24ad |
2.3.1 细胞免疫荧光: 荧光显微镜下观察细胞发绿色荧光情况. 未作处理的KC未检测到荧光染色的细胞(图1A); B组可见JAK2表达微弱(图1B); 给与LPS和elastase处理后, JAK2表达上调, 与B组比较差异显著(图1C, P<0.01); D组给与AG490预处理后, JAK2表达明显下调, 与C组比较明显减弱差异显著(P<0.01), 但和B组比较无显著性差异(P>0.05, 图1D).
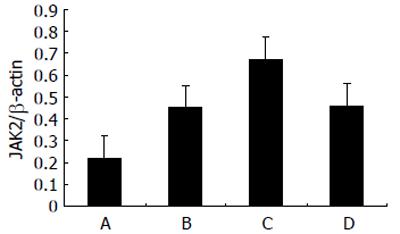
2.3.2 细胞中JAK2蛋白表达检测: 各实验组和对照组KC中均有JAK2表达(图2). 给予LPS刺激后, KC中JAK2蛋白表达比对照组明显增加(P<0.01); 同时给予LPS和elastase刺激后, JAK2表达进一步增加(P<0.01); 预先给予AG490处理后在给予LPS和elastase刺激, JAK2表达和C组比较明显降低(P<0.01), 但与B组比较仅略有增加(P>0.05, 图3).
KC是定居于肝窦内的巨噬细胞, 是体内最大的固定型巨噬细胞群, 约占巨噬细胞总数的80%-90%, 是产生炎症因子的主要效应细胞. AP时, 由于胰腺腺泡细胞大量坏死和凋亡, 促使胰酶异常激活并释放入血, 同时炎症胰腺组织释放大量的炎症介质, 经门静脉到达肝脏. 这些促炎症因子通过刺激并激活KC内信号转导通路, 通过一序列生物学反应后引起连锁和放大效应, 释放大量细胞因子, 如IL-18、TNF-α、IL-6等, 这些细胞因子均参与AP并发肝损伤的发生和发展[6-9]. AP时, 肝脏是机体炎症反应最为活跃及免疫细胞聚集的重要器官, 对AP的严重程度、疾病进展及预后均有重要监测作用.
JAK/STAT信号通路是细胞因子信号转导的重要途径之一, 近年来备受关注, 他代表的是一条信号从细胞膜到细胞核的信号转导途径, 涉及免疫、细胞增殖分化、细胞凋亡、炎症等多种生理和病理反应的调节作用. 目前已发现多种细胞因子, 主要有IL-18、TNF-α、IL-6、IL-1β等, 他们均可通过激活JAK/STAT信号转导通路, 在炎症反应的发生、发展过程中发挥重要作用, 因此推测针对性阻断JAK/STAT信号通路将可能达到改善AP并发肝损伤病理过程的目的[10-11].
IL-18是一种新发现的促炎症因子, 主要由肝脏枯否细胞以及肝外巨噬细胞产生. IL-18有许多生物学活性, 他可诱导机体产生大量γ-干扰素、TNF-α、IL-1β等细胞因子, 并通过这些细胞因子介导组织、器官的炎症坏死, 同时加强FasL介导的细胞凋亡途径导致细胞损伤, 最终导致全身性组织损害[12-13]. 近年来多项研究发现, AP时IL-18呈高水平表达, 而当合并局部胰腺坏死及远处器官功能衰竭等并发症时, IL-18表达增高更为显著, 他反映了AP的严重程度, 可以作为AP的病情预测指标[14-15]. AG490是一种人工合成的苯丙亚甲基丙二腈脂类衍生物, 为JAK2特异性抑制剂, 可以与受体酪氨酸激酶竞争结合位点, 阻断其下游激酶活化, 进而抑制细胞因子介导的生物、病理效应. 研究发现AG490能抑制IL-18诱导JAK/STAT信号通路的活化[16]. 因此, 本实验重点通过体外培养KC, 模拟体外AP模型, 观察在给予AG490处理后KC上清液中IL-18表达情况和KC中JAK2表达情况, 探讨AP肝损伤机制中, IL-18和AP肝损伤之间的关系, 以及IL-18介导JAK/STAT信号通路参与AP发病及发展的过程.
本研究发现, 正常KC上清液中IL-18有极少量表达, 给予LPS刺激后, KC上清液中IL-18表达显著上调, 同时给予LPS和elastase刺激后, IL-18表达增加更为显著, 而预先给予AG490处理后IL-18表达则明显低于AP肝损伤组. 由此可见, LPS和elastase通过协同作用, 使KC产生的生物学效应得以放大, 从而正性上调KC IL-18蛋白的表达, 而AG490则有效降低了KC上清液中IL-18的表达. 另外, 我们又通过细胞免疫荧光的方法和Western blot法检测JAK2蛋白的表达情况, 发现KC细胞质中JAK2荧光量、荧光强度以及总蛋白含量变化与IL-18表达在动态变化上基本一致. 因此推测, KC中可能存在JAK/STAT信号通路结合位点, AP肝损伤时, elastase刺激KC后激活JAK2, 通过JAK2/STAT信号通路诱导IL-18的大量分泌和活化; 但阻断JAK2活化后, 由于抑制了其下游信号活化, 进而减少了IL-18的分泌. 这进一步提示AP时, 可能通过激活KC中的JAK/STAT信号通路, 介导IL-18表达上调, 进而在AP肝损伤中发挥重要作用. 总之, 上述研究提示在AP诱发急性炎症反应和并发肝损伤的发生、发展过程中, JAK/STAT信号通路起到重要调节作用; 通抑制JAK/STAT信号通路的信号转导途径, 可有效减轻AP炎症反应, 进而达到减轻肝损伤的作用. 因此, 在参考基础实验的基础上, 还应再进行深入完全的临床研究, 以更好地掌握AP并发肝损伤的发病机制, 寻找出潜在的新的预防性和治疗方法.
急性胰腺炎(AP)是临床常见急腹症之一, 其特点是起病急, 进展快, 并发症多, 住院患者死亡率高达25%. AP并发胰腺外器官损伤时死亡率极高. 因此, 对于早期控制AP症状和并发症对其预后至关重要, JAK/STAT信号通路作为一条重要的炎症反应性通路, 参与多种炎症介质介导的信号转到过程, 他在AP发生、发展过程中起到重要调节作用.
刘连新, 教授, 哈尔滨医科大学第一临床医学院普通外科
AP合并肝损伤作为评价AP疗效和预后的重要指标, 其复杂的致病机制是目前AP一大研究热点及难点. 随着分子生物学的发展, 有关AP发病以及并发胰腺外器官损伤各机制中, 炎症细胞过度激活学说成为一大研究热点.
研究发现, AP肝损伤进展、严重程度与炎症因子作用有关, 但有关AP肝损伤机制中具体作用途径还不清楚.
本文用ELISA法检测枯否细胞上清液中IL-18含量; 细胞免疫荧光染色和Western blot方法直接检测KC中JAK2表达量的变化, 分析其与AP肝损伤的可能关系.
本文主要研究在KC各条信号通路中的一条重要信号通路JAK/STAT信号通路在AP肝损伤中表达的变化情况, 可为AP治疗提供新的思路.
脂多糖(LPS): 革兰氏阴性细菌细胞壁上的特有结构, 其化学成分主要有O特异性链、核心多糖和类脂A3部分组成. 当机体受到创伤、烧伤、感染等外界损伤时, 他可突破机体黏膜屏障, 进而导致严重反应的发生、发展, 在机体严重反应过程中有重要促进作用.
本研究选题较为新颖, 研究方法选择适当, 结果准确, 结论可靠, 有一定的创新性和临床价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | Jaffray C, Yang J, Norman J. Elastase mimics pancreatitis-induced hepatic injury via inflammatory mediators. J Surg Res. 2000;90:95-101. [PubMed] [DOI] |
| 2. | Pastor CM, Vonlaufen A, Georgi F, Hadengue A, Morel P, Frossard JL. Neutrophil depletion--but not prevention of Kupffer cell activation--decreases the severity of cerulein-induced acute pancreatitis. World J Gastroenterol. 2006;12:1219-1224. [PubMed] [DOI] |
| 3. | Liu H, Cao H, Wu ZY. Isolation of Kupffer cells and their suppressive effects on T lymphocyte growth in rat orthotopic liver transplantation. World J Gastroenterol. 2007;13:3133-3136. [PubMed] |
| 4. | Murr MM, Yang J, Fier A, Kaylor P, Mastorides S, Norman JG. Pancreatic elastase induces liver injury by activating cytokine production within Kupffer cells via nuclear factor-Kappa B. J Gastrointest Surg. 2002;6:474-480. [PubMed] [DOI] |
| 6. | Ueda T, Takeyama Y, Yasuda T, Matsumura N, Sawa H, Nakajima T, Ajiki T, Fujino Y, Suzuki Y, Kuroda Y. Significant elevation of serum interleukin-18 levels in patients with acute pancreatitis. J Gastroenterol. 2006;41:158-165. [PubMed] [DOI] |
| 7. | Malleo G, Mazzon E, Siriwardena AK, Cuzzocrea S. TNF-alpha as a therapeutic target in acute pancreatitis--lessons from experimental models. ScientificWorldJournal. 2007;7:431-448. [PubMed] [DOI] |
| 8. | Stimac D, Fisić E, Milić S, Bilić-Zulle L, Perić R. Prognostic values of IL-6, IL-8, and IL-10 in acute pancreatitis. J Clin Gastroenterol. 2006;40:209-212. [PubMed] [DOI] |
| 9. | Jee SH, Chu CY, Chiu HC, Huang YL, Tsai WL, Liao YH, Kuo ML. Interleukin-6 induced basic fibroblast growth factor-dependent angiogenesis in basal cell carcinoma cell line via JAK/STAT3 and PI3-kinase/Akt pathways. J Invest Dermatol. 2004;123:1169-1175. [PubMed] [DOI] |
| 10. | Lee C, Lim HK, Sakong J, Lee YS, Kim JR, Baek SH. Janus kinase-signal transducer and activator of transcription mediates phosphatidic acid-induced interleukin (IL)-1beta and IL-6 production. Mol Pharmacol. 2006;69:1041-1047. [PubMed] |
| 11. | Sugimoto N, Nakahira M, Ahn HJ, Micallef M, Hamaoka T, Kurimoto M, Fujiwara H. Differential requirements for JAK2 and TYK2 in T cell proliferation and IFN-gamma production induced by IL-12 alone or together with IL-18. Eur J Immunol. 2003;33:243-251. [PubMed] [DOI] |
| 12. | Tsutsui H, Matsui K, Okamura H, Nakanishi K. Pathophysiological roles of interleukin-18 in inflammatory liver diseases. Immunol Rev. 2000;174:192-209. [PubMed] [DOI] |
| 13. | Takeuchi D, Yoshidome H, Kato A, Ito H, Kimura F, Shimizu H, Ohtsuka M, Morita Y, Miyazaki M. Interleukin 18 causes hepatic ischemia/reperfusion injury by suppressing anti-inflammatory cytokine expression in mice. Hepatology. 2004;39:699-710. [PubMed] [DOI] |
| 14. | Rau B, Baumgart K, Paszkowski AS, Mayer JM, Beger HG. Clinical relevance of caspase-1 activated cytokines in acute pancreatitis: high correlation of serum interleukin-18 with pancreatic necrosis and systemic complications. Crit Care Med. 2001;29:1556-1562. [PubMed] [DOI] |
| 15. | Endo S, Inoue Y, Fujino Y, Wakabayashi G, Inada K, Sato S. Interleukin 18 levels reflect the severity of acute pancreatitis. Res Commun Mol Pathol Pharmacol. 2001;110:285-291. [PubMed] |
| 16. | Kalina U, Kauschat D, Koyama N, Nuernberger H, Ballas K, Koschmieder S, Bug G, Hofmann WK, Hoelzer D, Ottmann OG. IL-18 activates STAT3 in the natural killer cell line 92, augments cytotoxic activity, and mediates IFN-gamma production by the stress kinase p38 and by the extracellular regulated kinases p44erk-1 and p42erk-21. J Immunol. 2000;165:1307-1313. [PubMed] [DOI] |