修回日期: 2009-03-20
接受日期: 2009-03-23
在线出版日期: 2009-03-28
目的: 研究CDK11p58基因对大鼠胰岛瘤细胞INS-1增殖及周期的影响.
方法: INS-1细胞分为3组: 实验组转染pcDNA3.0-CDK11p58质粒; 空载体组转染pcDNA3.0空载体; 空白对照组不加任何干扰. 48 h后, Western blot检测细胞中CDK11p58基因表达水平; MTT法检测转染CDK11p58基因对细胞增殖的影响; 流式细胞仪检测转染CDK11p58基因后细胞周期的变化.
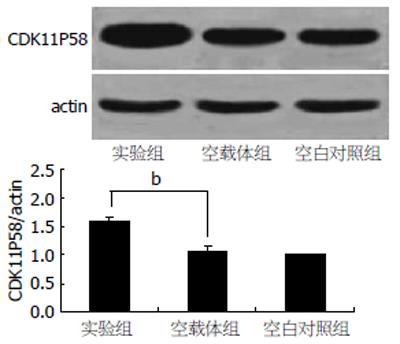
结果: 转染48 h后, 与空载体组相比, 实验组CDK11p58基因的表达水平显著升高(P<0.01), INS-1细胞存活率下降(P<0.05), G1期细胞比例显著上升(69.87%±1.77% vs 63.03%±2.66%, P<0.01), 细胞出现G1期阻滞.
结论: CDK11p58基因与INS-1细胞增殖相关, 其高表达引起的细胞增殖速度放缓的作用机制可能与其所致的细胞G1期延长有关.
引文著录: 刘洋, 杨红旺, 孟雁. CDK11p58基因过表达抑制INS-1细胞的增殖. 世界华人消化杂志 2009; 17(9): 873-876
Revised: March 20, 2009
Accepted: March 23, 2009
Published online: March 28, 2009
AIM: To observe the influences of CDK11p58 gene on the proliferation and cell cycle of rat insulinoma cell line INS-1.
METHODS: Rat insulinoma INS-1 cells were divided into three groups: the experimental group transfected with plasmid pcDNA3.0-CDK11p58; empty vector group transfected with pcDNA3.0; blank control group without any interference. After 48 hours, the expression of CDK11p58 was detected by Western blot. The proliferation activities of the INS-1 cells cells were assessed by the MTT assay. Cell cycle was analyzed by flow cytometry.
RESULTS: In comparison with that in the empty vector group, the expression of CDK11p58 gene were significantly up-regulated in the experimental group after 48-h transfection (P < 0.01). Over-expression of CDK11p58 gene suppressed the growth of INS-1 cells (P < 0.05), and increased the G1-phase cell proportion significantly (69.87% ± 1.77% vs 63.03% ± 2.66%, P < 0.01). INS-1 cells were partly blocked at G1 phase.
CONCLUSION: CDK11p58 gene is involved in the proliferation activity of INS-1 cells. Over-expression of CDK11p58 gene may suppress INS-1 cell growth and the mechanisms may be due to the G1 phase arrest.
- Citation: Liu Y, Yang HW, Meng Y. Over-expression of CDK11p58 gene suppresses the proliferation of rat insulinoma cell line INS-1. Shijie Huaren Xiaohua Zazhi 2009; 17(9): 873-876
- URL: https://www.wjgnet.com/1009-3079/full/v17/i9/873.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i9.873
CDK11(cyclin-dependent kinase 11)也称为CDC2L2(cell division cycle 2-like 2)是近年报道的一个中国人2型糖尿病易感基因, 定位于人1号染色体的1p36.33区, 其编码蛋白为CDK11P110和CDK11P58[1]. Tsutsui et al研究发现, CDK11基因功能包括参与细胞周期调控、mRNA转录和凋亡信号传导等[2-3]. 其中CDK11 P58主要在G2/M期表达, 其功能为参与细胞周期调控和凋亡相关事件等. 在有丝分裂中, CDK11P58可以使姐妹染色单体聚合, 促进中心粒成熟, 促进纺锤丝的聚集和双极纺锤丝的形成等[4-6]. 目前有关该基因在胰岛β细胞增殖及周期中是否发挥的作用未见报道. 本实验我们在高糖培养条件下, 在大鼠胰岛瘤细胞INS-1中过表达CDK11p58基因, 观察其对INS-1细胞增殖和细胞周期的影响, 探讨CDK11p58基因与胰岛细胞增殖之间的关系.
RPMI 1640细胞培养基(钮因公司), 胎牛血清(HyClone公司), Lipofectamine 2000(Invitrogen公司), 蛋白酶和磷酸酶抑制剂(Roche公司), CDK11P58抗体(Santa Cruz公司), 二抗(中杉金桥公司), PVDF膜(Millipore公司), ECL显色试剂盒(Pierce公司), MTT(华美公司), 碘化丙啶(鼎国公司), 其余试剂均为国产分析纯. 大鼠胰岛瘤INS-1细胞由中日友好医院临床医学研究所娄晋宁教授惠赠.
1.2.1 细胞培养: INS-1细胞快速解冻后分装入60 mm培养皿中, 加入含100 mL/L胎牛血清RPMI 1640完全培养基(含青霉素100 kU/L, 链霉素100 mg/L, 50 μmol/L巯基乙醇, 10 mmol/L葡萄糖), 单层培养和孵化于50 mL/L CO2培养箱中, 37℃, 950 mL/L湿度条件下培养. 高糖培养葡萄糖浓度为20 mmol/L.
1.2.2 分组及转染: INS-1细胞分为3组: 实验组、空载体组和空白对照组. 实验组细胞转染pcDNA3.0-CDK11p58质粒, 空载体组转染pcDNA3.0空载体, 空白对照组不加任何干扰. 在细胞融合率达到70%-80%时进行转染, 转染前24 h将培养基换为无抗生素培养基, 转染步骤按照Lipofectamine 2000说明书进行.
1.2.3 蛋白表达检测: 上述各组INS-1细胞转染48 h后, 用PBS清洗, 离心收集细胞, 加入新鲜配制的细胞裂解液, 离心后收集上清, 测定蛋白含量. 取等量总蛋白与上样缓冲液混合, 变性后上样, SDS-PAGE电泳, 转移蛋白至PVDF膜上. 用含50 g/L脱脂奶粉的PBST溶液封闭, 兔抗鼠CDK11P58多克隆抗体(1:1000)孵育过夜, 辣根过氧化物酶标记的羊抗兔抗体(1:2000)室温孵育1 h, ECL发光显色.
1.2.4 细胞存活率检测: 取对数生长期细胞, 接种于96孔板, 细胞贴壁后转染pcDNA3.0-CDK11p58质粒及pcDNA3.0空载体. 设空白对照组, 另设培养液对照孔, 加150 μL培养液作为调零孔. 分别培养24、48和72 h后, 每孔加20 μL MTT(5 g/L), 在CO2培养箱中避光培养3 h. 弃培养液, 每孔加入150 μL的DMSO, 室温下避光振荡10 min, 使结晶物充分融解. 用酶标仪在490 nm处测定吸光度值. 记录结果, 绘制细胞生长曲线.
1.2.5 细胞周期检测: 上述各组细胞经转染48 h后, 终止培养. 消化成单细胞悬液, 离心10 min后弃上清, PBS洗涤2次, 用4℃预冷的700 mL/L乙醇4℃固定24 h. 固定后经PBS洗涤2次, 加入RNaseA至终浓度50 mg/L, 37℃水浴30 min, 然后加入PI至终浓度为50 mg/L, 避光染色10 min. 尼龙网过滤, 在流式细胞仪上检测细胞周期分布.
统计学处理 采用SPSS11.5统计软件, 计量资料均采用mean±SD表示, 采用t检验进行统计分析, P<0.05认为具有统计学意义.
Western blot结果显示, 转染CDK11p58基因48 h后, 与空载体组相比, 实验组INS-1细胞中CDK11P58蛋白表达水平显著升高(P<0.01), 约为空载体组的1.6倍(图1).
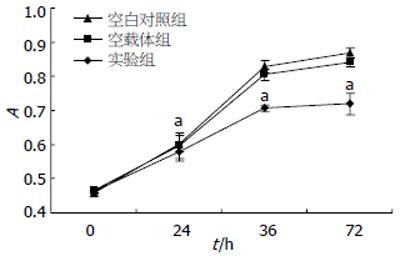
转染CDK11p58基因24 h后, 与空载体组相比, 实验组INS-1细胞的凋亡率显著增加、存活化在率明显减少(P<0.05), 至72 h, 上述变两组间仍存在显著性差异(P<0.05, 图2).
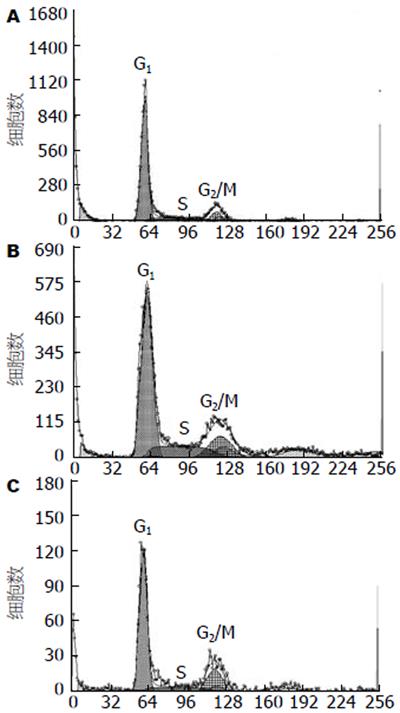
流式细胞仪检测结果显示, 转染48 h后, 实验组INS-1细胞G1期细胞比例(69.87±1.77)上升, 与空载体组(63.03±2.66)相比存在显著差异(P<0.01); 而空载体组G1期细胞比例与空白对照组(63.63±2.02)相比无显著差异(表1, 图3).
| 分组 | 细胞周期 | ||
| G1 | S | G2/M | |
| 实验组 | 69.87±1.77b | 18.50±1.64 | 11.63±2.50 |
| 空载体组 | 63.03±2.66 | 18.90±1.83 | 18.03±4.50 |
| 空白对照组 | 63.63±2.02 | 23.33±1.99 | 14.00±2.43 |
2型糖尿病已成为严重威胁人类健康的重大疾病之一, 其发病的主要原因是肥胖、脂质代谢紊乱和炎症等因素引起的机体组织对胰岛素不敏感所致的胰岛素抵抗和胰岛β细胞凋亡引起的胰岛功能受损. 目前在2型糖尿病的研究中, β细胞凋亡的机制受到越来越广泛的重视.
细胞增殖与凋亡密切相关, 细胞周期阻滞后, 机体可通过诱导细胞凋亡来清除体内损伤的细胞, 同时, 细胞凋亡也常伴有细胞生长阻滞. CDK11(CDC2L2)是新近发现的中国北方汉族人群2型糖尿病的易感基因, 其与老龄人群2型糖尿病发病的易感性关系密切[7]. 研究表明, 采用高糖条件培养INS-1细胞可引起细胞内糖毒性, 致使β细胞出现功能异常, 模拟病理情况[8-9]. CDK11p58基因已被证实参与细胞凋亡事件, 我们在前期的研究中已表明, 过表达CDK11p58基因可以引起INS-1细胞的凋亡, 但是其与参与INS-1细胞周期及细胞增殖的调控情况尚不清楚. 本实验我们采用高糖培养大鼠胰岛瘤细胞INS-1, 过表达CDK11p58基因, 利用MTT及流式细胞仪检测等方法观察CDK11p58基因对INS-1细胞细胞周期及增殖的影响.
研究结果显示, 转染48 h后, 与空载体组和空白对照组相比, 实验组INS-1细胞中CDK11p58基因表达水平明显升高, 细胞的凋亡率增加、存活率显著下降, 同时, 细胞的增殖速度放缓, G1期的细胞比例显著上升, 即部分细胞被阻滞于G1期.
以上结果表明, CDK11p58基因的过表达可导致INS-1细胞周期的异常, 从而引起INS-1细胞的生长受阻、凋亡增加和存活率降低. 其作用机制可能是: 过表达的CDK11p58基因影响了INS-1细胞内某些细胞周期调控因子的合成, 从而导致相应的细胞周期相关蛋白表达异常, 使部分INS-1细胞的生长被阻滞于G1期, 不能继续完成正常的分裂过程, 进而使进入S期的细胞数目减少, DNA复制合成受阻, 细胞增殖速度放缓, 从而引起细胞的凋亡和存活率下降. 至于CDK11p58基因的过表达能引起INS-1细胞中何种细胞周期调控因子的异常表达还需进一步的实验证明.
本实验的研究结果为进一步探讨CDK11p58基因在诱导胰岛β细胞凋亡及在2型糖尿病发生发展中的作用提供了重要的实验基础.
CDK11是新近发现的中国人2型糖尿病的易感基因, CDK11p58基因功能为参与细胞周期调控和凋亡相关事件等. 本研究组发现CDK11p58基因与胰岛β细胞增殖相关, 其高表达引起的细胞增殖速度放缓机制可能与其所致的细胞G1期延长有关.
樊红, 副教授, 东南大学医学院发育与疾病相关基因教育部重点实验室
2型糖尿病是严重威胁人类健康的重大疾病之一, 目前在2型糖尿病的研究中, 胰岛β细胞凋亡的机制得到广泛的重视. 研究清楚CDK11p58基因在影响胰岛β细胞增殖及凋亡中发挥的作用, 将为研究2型糖尿病发生发展提供了重要的实验基础.
国内外有关报道提示CDK11p58基因参与细胞凋亡相关事件, 本实验室前期的研究证明其过表达与胰岛β细胞凋亡相关, 但引起胰岛β细胞凋亡的具体机制尚缺乏研究报道.
本实验的研究结果为进一步探讨CDK11p58基因在诱导β细胞凋亡及在2型糖尿病发生发展中的作用提供了重要的实验基础.
本文立题有一定的创新性, 设计方法尚可, 结果可信, 但讨论不够深入.
编辑: 李军亮 电编:吴鹏朕
| 1. | Gururajan R, Grenet J, Lahti JM, Kidd VJ. Isolation and characterization of two novel metalloproteinase genes linked to the Cdc2L locus on human chromosome 1p36.3. Genomics. 1998;52:101-106. [PubMed] [DOI] |
| 2. | Tsutsui T, Umemura H, Tanaka A, Mizuki F, Hirose Y, Ohkuma Y. Human mediator kinase subunit CDK11 plays a negative role in viral activator VP16-dependent transcriptional regulation. Genes Cells. 2008;13:817-826. [PubMed] [DOI] |
| 3. | Yun X, Wu Y, Yao L, Zong H, Hong Y, Jiang J, Yang J, Zhang Z, Gu J. CDK11(p58) protein kinase activity is associated with Bcl-2 down-regulation in pro-apoptosis pathway. Mol Cell Biochem. 2007;304:213-218. [PubMed] [DOI] |
| 4. | Hu D, Valentine M, Kidd VJ, Lahti JM. CDK11(p58) is required for the maintenance of sister chromatid cohesion. J Cell Sci. 2007;120:2424-2434. [PubMed] [DOI] |
| 5. | Yokoyama H, Gruss OJ, Rybina S, Caudron M, Schelder M, Wilm M, Mattaj IW, Karsenti E. Cdk11 is a RanGTP-dependent microtubule stabilization factor that regulates spindle assembly rate. J Cell Biol. 2008;180:867-875. [PubMed] [DOI] |
| 6. | Petretti C, Savoian M, Montembault E, Glover DM, Prigent C, Giet R. The PITSLRE/CDK11p58 protein kinase promotes centrosome maturation and bipolar spindle formation. EMBO Rep. 2006;7:418-424. [PubMed] [DOI] |
| 7. | Li Y, Wu G, Zuo J, Gao J, Chang Y, Fang FD. Genetic variations of the CDC2L2 gene are associated with type 2 diabetes in a Han Chinese cohort. Diabetes Metab Res Rev. 2007;23:455-461. [PubMed] [DOI] |
| 8. | Collier JJ, Zhang P, Pedersen KB, Burke SJ, Haycock JW, Scott DK. c-Myc and ChREBP regulate glucose-mediated expression of the L-type pyruvate kinase gene in INS-1-derived 832/13 cells. Am J Physiol Endocrinol Metab. 2007;293:E48-E56. [PubMed] [DOI] |
| 9. | Ubeda M, Rukstalis JM, Habener JF. Inhibition of cyclin-dependent kinase 5 activity protects pancreatic beta cells from glucotoxicity. J Biol Chem. 2006;281:28858-28864. [PubMed] [DOI] |