修回日期: 2009-01-19
接受日期: 2009-02-09
在线出版日期: 2009-03-18
目的: 设计和构建Skp2特异性的siRNA真核表达载体, 观察Skp2siRNA重组体对人大肠癌HCT116细胞株生物学特性的影响.
方法: 人工合成Skp2基因干扰序列并定向插入到RNAi真核表达载体pRNAT-U6.1/Neo, 通过测序鉴定. 用脂质体介导的基因转染方法转入HCT116细胞, 经G418筛选出稳定转染的细胞系, 半定量RT-PCR方法检测靶基因的表达. 流式细胞技术分析细胞周期分布, MTT比色法检测细胞的生长抑制率.
结果: 测序表明Skp2干扰序列完全正确. RT-PCR结果显示2条Skp2siRNA真核表达质粒均能有效抑制核干细胞因子mRNA的转录表达(P<0.05). MTT比色法检测显示, 与阴性对照组及未转染组细胞比较, 干扰组细胞增殖率明显下降(29.21%±1.40%, 30.10%±1.50% vs 49.05%±4.50%, 53.03%±4.92%, 均P<0.05). 流式细胞术检测结果显示转染后G0/G1期细胞数占生长周期细胞数的比例增多, 即表现为G1期阻滞, S期细胞的比例降低.
结论: 成功构建了Skp2干扰真核表达载体, siRNA重组体能有效抑制人大肠癌细胞Skp2mRNA表达, 细胞增殖能力减弱, 为大肠癌基因治疗的可行性提供了有力的证据.
引文著录: 解方为, 彭永海, 张霞, 欧阳学农. 靶向Skp2基因siRNA对大肠癌细胞生物学特性的影响. 世界华人消化杂志 2009; 17(8): 775-779
Revised: January 19, 2009
Accepted: February 9, 2009
Published online: March 18, 2009
AIM: To design and construct the RNAi eukaryotic vector of Skp2 gene and to study its interfering effect on characteristics of human colorectal carcinoma cell line HCT116.
METHODS: DNA oligonucleotide for small interfering RNA expression targeting Skp2 gene was synthesized and inserted into pRNAT-U6.1/Neo plasmid after annealing. The inserted sequences were verified by DNA sequencing, and transfected into HCT116 cells with liposome-mediated transfection. The positive transfected cell clones were screened with G418 and the expression of Skp2 mRNA was detected by semi-quantitive RT-PCR. Distribution of cell cycle was assessed by flow cytometry. The cell growth suppression was analyzed by MTT assay.
RESULTS: The sequence of specific siRNA was correct by sequence analysis. Compared with the negative control cells, RT-PCR showed the expression of Skp2 mRNA was down-regulated in the transfected cells (P < 0.05). The subcloned recombinant plasmid expressing shRNA effectively inhibited HCT116 cell growth and proliferation while empty plasmid had no such specific effect. Decreased cellular proliferation activity was observed by MTT (29.21% ± 1.40%, 30.10% ± 1.50% vs 49.05% ± 4.50%, 53.03% ± 4.92%, all P < 0.05). Flow cytometry revealed significant G1 arrest in cell cycle.
CONCLUSION: The siRNA eukaryotic expression vector of Skp2 gene was constructed successfully which effectively down-regulate the expression of Skp2 in HCT116 cell line, and inhibit the cellular proliferation. It provides a powerful evidence for colorectal carcinoma gene therapy.
- Citation: Xie FW, Peng YH, Zhang X, Ouyang XN. Influence of Skp2-targeted siRNA on characteristics of human colorectal cancer cell line. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 775-779
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/775.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.775
泛素蛋白酶体途径(ubiquitin proteasome pathway)是真核细胞中的一种蛋白降解途径, 主要降解胞内泛素化的蛋白质[1]. Skp2作为泛素化降解过程中的一种F-box蛋白, 在泛素化降解中起着特异性的底物识别和关键性的速率限制作用. 近年来, 在实体瘤的研究中发现Skp2具有原癌基因蛋白功能, 能促进癌细胞的细胞周期进展, 与多种恶性肿瘤的发生和发展过程密切相关[2]. RNA干扰是一种序列特异性的转录后基因沉默现象, 他由与靶基因序列同源的双链RNA所诱导[3], 目前已被广泛应用于功能基因组和基因治疗的研究. 本实验拟使用这种技术, 对人大肠癌HCT116细胞株的Skp2基因进行下调, 并检测下调后细胞的生物学行为的改变, 为大肠癌的基因治疗提供实验基础和理论依据.
人大肠癌HCT116细胞株购自中国医学科学院基础医学研究所细胞中心. 细胞培养于含100 mL/L灭活小牛血清, 1×105 U/L青霉素, 100 mg/L链霉素的1640培养液中, 于37℃、50 mL/L CO2的培养箱中培养, 取对数生长期细胞用于实验. pRNAT-U6.1/Neo质粒本室保存, BamHⅠ、HindⅢ限制性内切酶购自美国Promega公司, 1640培养基、标准小牛血清购自美国Hyclone公司, 阳离子脂质体试剂(LipofectamineTM2000)购自Invitrogen公司, 四氮唑蓝购于Sino-American Biotechnology公司, RT-PCR试剂盒为大连TaKaRa生物公司产品, DL2000核酸分子质量标准、柱离心式质粒抽提试剂盒、柱离心式胶回收试剂盒均购自美国Promega公司. 流式细胞仪(库尔特ESP公司, 美国), 荧光显微镜(Leica, 德国), 酶标仪(B&D公司, 美国), 2700型PCR扩增仪(Perkin Elmer, 美国), DU-640型紫外分光光度仪(Bio-Rad公司, 美国), Gel Doc 2000凝胶图像分析系统(Bio-Rad公司, 美国).
1.2.1 siRNA合成和真核表达载体的构建: 根据Skp2基因序列(GenBank NM_005983)siRNA设计规则通过http://www.genscript.com网站在线siRNA设计工具设计二对siRNA, 设计基因靶点分别于NS基因的第1117、877位点, 靶序列分别为: Skp2Ⅰ: TTGTCCATCTAGACTTAAGTG; Skp2Ⅱ: TAGTGCGACTTAACCTTTCTG; 另设计一对阴性对照siRNA: TTCTCCGAACGT GTCACGT, 经BLAST软件分析, 同任何基因序列均无同源性, 由上海生物工程技术有限公司合成. 模板链两端分别设计BamHⅠ和HindⅢ酶切位点, 对应的两段寡核苷酸分别以去离子水溶解(浓度为1 g/L), 各取5 μL加入90 μL去离子水, 煮沸5 min, 自然冷却, 寡核苷酸退火. 用BamHⅠ和HindⅢ双酶切pRNAT-U6.1/Neo质粒, 37℃, 3 h. 对酶切产物进行琼脂糖电泳, 紫外灯下切下线性化的条带, 应用琼脂糖DNA回收试剂盒, 回收线性化载体. 进行连接反应, 体系如下: 退火的寡核苷酸1 μL, 双酶切的pRNAT-U6.1/Neo 3 μL, 去离子水4 μL, 10×T4 DNA Ligase Buffer 1 μL, T4 DNA Ligase 0.33 μL, 4℃过夜. 连接产物分别命名为: RNAi -1、RNAi -2和RNAi-N(阴性对照质粒).
1.2.2 细胞的转染及荧光显微镜观察: 将细胞种植于24孔板, 待细胞融合率达70%时, 将0.8 μg干扰质粒和2 μL LipofectamineTM2000分别加至50 μL无血清1640中, 轻微震荡摇匀, 5 min后将两者混匀, 室温放置25 min后, 将其加入无血清HCT116细胞, 边加边轻轻混合, 转染细胞培养液总体积为500 μL. 将转染后的细胞置37℃孵箱孵育6 h后, 弃去转染液,加入含100 mL/L胎牛血清的1640培养基继续培养, 转染24 h后将转染的细胞按1:10稀释, 将其种植于另一培养板, 再经过24 h后, 向培养液中加入600 mg/L的G418进行抗性筛选, 14 d后荧光显微镜下可见细胞克隆发出荧光, 对阳性克隆进行有限稀释, 扩大培养后获得稳定表达的细胞株.
1.2.3 RT-PCR检测Skp2 mRNA表达水平: 提取细胞总RNA行RT-PCR检测, 按TRIzol的操作说明提取总RNA, 各取1 μg, 按反转录试剂盒操作方法获得单链cDNA, 以此为底物用PCR检测NS的表达, PCR产物经15 g/L琼脂糖凝胶电泳, BioRad 2000凝胶成像仪采集图像, 以Quantity one软件进行分析, 测定各条带的吸光度值, 以目的基因吸光度值与对应样品内参基因吸光度值的比值作为该样品中目的基因的相对转录量, 最后以目的基因的相对转录量为参数进行统计分析. Skp2 mRNA表达抑制率(%)的计算方法为(1-RNAi组Skp2 mRNA/RNAi-N组Skp2 mRNA)×100%. PCR条件为: 94℃预变性3 min, 94℃变性30 s; 58℃(Skp2为58℃, β-actin为60℃)退火30 s, 72℃延伸1 min, 30个循环: 72℃ 8 min, 4℃孵育. PCR产物经15 g/L琼脂糖凝胶电泳, BioRad 2000凝胶成像仪采集图像. 各基因的引物序列见表1.
| 基因 | 序列 | 大小(bp) | 退火温度(℃) |
| β-actin | 446 | 58 | |
| 正义 | GTTGCGTTACACCCTTTCTTGACA | ||
| 反义 | GCACGAAGGCTCATCATTCAAAA | ||
| Skp2 | 221 | 60 | |
| 正义 | AATTGCTCCCATTTCACCAC | ||
| 反义 | ATGAAGGCAAAGGGAAAACC |
1.2.4 MTT法检测细胞生长曲线: 采用四甲基偶氮唑蓝(MTT)法, 将转染后的干扰组、阴性对照组细胞和未转染组分别接种于6块96孔板, 接种密度为1×104/孔, 每天取1板进行MTT反应, 测定490 nm吸光度值, 取平均值. 连续测定6 d, 绘制细胞生长曲线, 比较干扰组细胞与阴性对照组细胞和未转染组的生长增殖.
1.2.5 流式细胞仪检测细胞周期: 收集转染后扩增的干扰组细胞、阴性对照组细胞和未转染组各1×106个, 700 mL/L冰乙醇固定, 碘化丙啶(PI)染色, 上流式细胞仪测定细胞周期情况.
统计学处理 应用SPSS10.0统计软件包, 计量资料采用mean±SD表示, 组间比较单因素方差Dunnett test分析, P<0.05为统计学有差异.
通过大连宝生物测序结果表明, 所获得的重组干扰质粒目的片段与预期完全相符. 表明退火形成的干扰寡核苷酸成功连接入pRNAT-U6.1/Neo载体. 由于pRNAT-U6.1/Neo载体带有绿色荧光报告基因, 因此, 阴性对照干扰载体、干扰载体H1、H2转染成功的细胞会发出绿色荧光, 表明细胞中有转染的外源基因表达.
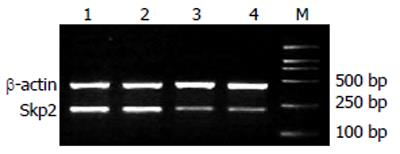
未转染组、RNAi-N、RNAi-1和RNAi-2的Skp2/β-actin值分别为: 0.85±0.036、0.88±0.038、0.28±0.056和0.30±0.041. RNAi-1、RNAi-2转染组的Skp2 mRNA表达明显低于转染RNAi-N和未转染组, 其抑制效率分别为: 68%、66%(图1).
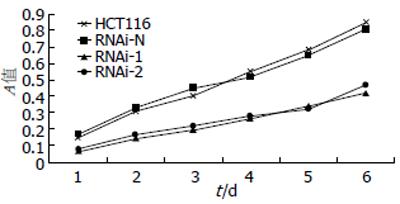
细胞生长曲线检测: 以时间为横轴, A值(波长为490 nm, 代表活细胞的数量)为纵轴, 分别绘制RNAi-1、RNAi-2、RNAi-N、HCT116细胞的生长曲线. HCT116与阴性对照组RNAi-N细胞相比, 生长速度基本一致. 而干扰组RNAi-1、RNAi-2细胞生长速度减缓(图2).
细胞周期的检测: 根据增殖指数(PI) = (S+G2M)/(G0/G1+S+G2/M)算出HCT116细胞、RNAi-N细胞、RNAi-1和RNAi-2细胞PI值, 分别为53.03%±4.92%、49.05%±4.50%、30.10%±1.50%和29.21%±1.40%. 以上结果提示Skp2的RNA干扰可以使HCT116细胞停滞于G0/G1期, 明显抑制HCT116细胞的增殖(P<0.05, 表2).
| G0/G1 | S | G2/M | PI(%) | |
| HCT116细胞 | 46.25±4.68 | 12.45±4.55 | 41.28±4.49 | 53.03±4.92 |
| RNAi-N | 52.11±5.32 | 11.30±4.75 | 37.60±4.40 | 49.05±4.50 |
| RNAi-1 | 68.20±3.54 | 4.35±1.70 | 25.78±1.45 | 30.10±1.50 |
| RNAi-2 | 70.19±1.61 | 5.44±0.88 | 24.28±2.55 | 29.21±1.40 |
肿瘤的发生是正常细胞染色体多重损伤的复杂过程, 包括抑癌基因的失活, 原癌基因的异常激活, DNA转录失控, DNA损伤等. 不论何种原因造成的细胞转化, 其最终表现均为细胞周期调控机制紊乱, 导致细胞失控性生长. 细胞周期是由细胞周期蛋白(Cyclin)和细胞周期蛋白依赖性激酶(CDK)进行正调节, 由细胞周期蛋白依赖性激酶抑制剂(CKI)进行负调节. 细胞S期激酶相关蛋白2(S-phase kinase associated protein 2, Skp2) 因能降解一种主要的CKI-p27kip1, 参与了细胞增殖与凋亡的调控, 与肿瘤的发生发展有着密切的关系[4-5]. 泛素蛋白酶体途径主要降解胞内泛素化的蛋白质. 泛素经过泛素活化酶E1、泛素结合酶E2及泛素连接酶E3等一系列催化步骤结合底物蛋白, 形成泛素-底物蛋白复合体, 使底物进入26S蛋白酶体内实现泛素化降解. 泛素连接酶复合物SCF(Skp1-Cullin-F-box)的F-box亚基能特异性识别底物并与之结合, 使之进入泛素化降解. Skp2正是F-box蛋白家庭成员之一[6]. F-box蛋白Skp2行使特异性识别底物功能, 决定SCF复合体的特异性[7-8].
Skp2是第一个通过基因敲除进行研究的F-box蛋白, 具有原癌基因蛋白功能. 1995年, Zhang et al[9]在变异的细胞中发现三种蛋白能与Cyclin-CDK2相互作用, 分别命名为p9, p19, p45, 即现在所知的人Cks1(或Cks2)、Skp1和Skp2. 通过向细胞内注射p45抗体或反义寡核苷酸能阻断p45的功能, 使细胞不能进入S期, 故认为p45 的表达增加与变异细胞的细胞周期的调控改变有关. 由于p45主要存在于S期, 且与CyclinA相互作用, 故命名为S期激酶相关蛋白2, 即Skp2. 其基因定位于人5号染色体短臂上(5p13), 分子质量约47 kDa[10].
大量研究显示Skp2的表达水平同组织的恶性程度呈正相关. Latres et al[11]为了评价在体内Skp2对肿瘤的诱导生长情况, 通过对转基因鼠的研究发现, 导入Skp2基因鼠的生存期缩短, 肿瘤的发生率增加. Li et al[12]发现Skp2在大肠的正常黏膜-腺瘤-原发性大肠癌轴的转变过中, Skp2表达显著增加. 国内的孙立春 et al[13]报道Skp2高表达的大肠癌患者生存期短, 而Skp2低表达的生存期较长, 且认为Skp2高表达与大肠癌高侵袭性有关, 可作为大肠癌的预后指标和治疗的新靶点.
RNAi是一种序列特异的双链RNA分子在mRNA水平关闭相应序列基因的表达或使其沉默的过程. 他主要是通过(外源或内源性的)双链RNA(double-stranded RNA, dsRNA)被核酸酶切割成21-23 nt大小的RNA双链复合物, 即siRNA介导识别并靶向切割同源性靶mRNA分子而实现[14]. 本研究根据在线siRNA设计工具设计2条21 nt的Skp2序列作为靶位点, 利用基因重组技术在体外构建Skp2siRNA表达载体, 然后转染高表达Skp2的大肠癌HCT116细胞株, 并使其在细胞中稳定表达. 转染Skp2siRNA后, HCT116细胞的Skp2 mRNA表达均明显减弱, Skp2 mRNA相对β-actin表达量分别为0.85±0.036、0.88±0.038、0.28±0.056、0.30±0.041, 干扰组与阴性对照组和未转染组比较, 有统计学意义(P<0.05). 说明构建的两条真核表达载体Skp2 siRNA均具有特异性封闭Skp2表达的作用, 同时应用MTT和流式细胞技术分析细胞的生长曲线和周期分布, 发现Skp2 siRNA能够使细胞增殖速度减慢, 且使HCT116细胞停滞于G0/G1期, 证实Skp2 siRNA能特异性抑制细胞分裂增殖.
总之, 本研究通过使用靶向Skp2的siRNA, 不仅有效抑制了Skp2基因在转录水平的表达, 还能在体外特异性抑制大肠癌细胞的分裂增殖, 该结果证实了靶向Skp2的RNA干扰技术有望成为一种有效的大肠癌基因治疗手段, 并为大肠癌的联合治疗提供新的靶点和思路.
泛素蛋白酶体途径是真核细胞中的一种蛋白降解途径, 主要降解胞内泛素化的蛋白质. Skp2作为泛素化降解过程中的一种F-box蛋白, 在泛素化降解中起着特异性的底物识别和关键性的速率限制作用, 且具有原癌基因蛋白功能, 能促进癌细胞的细胞周期进展, 与多种恶性肿瘤的发生和发展过程密切相关.
熊斌, 教授, 武汉大学中南医院肿瘤科
本研究利用RNAi技术对人大肠癌HCT116细胞株的Skp2基因进行下调, 并检测下调后细胞的生物学行为的改变, 揭示其作用机制, 为大肠癌治疗提供新的靶点及技术, 国内外尚未见相关报道.
本文以Skp2为靶基因设计的siRNA表达框架构建siRNA表达载体, 转染后可通过抑制结肠癌细胞增殖而发挥抗肿瘤作用. 设计合成2对靶向Skp2的siRNA, 2对均具有高效性, 寻找到了高效阻断Skp2表达的基因序列.
本文具有一定的科学性、创新性和可读性, 较好地反映我国或国际胃肠病学临床和基础研究的先进水平.
编辑: 李军亮 电编:吴鹏朕
| 1. | Lima CD. Bridging the gap between SCF and ubiquitin transfer. Structure. 2002;10:741-742. [PubMed] [DOI] |
| 2. | Yokoi S, Yasui K, Saito-Ohara F, Koshikawa K, Iizasa T, Fujisawa T, Terasaki T, Horii A, Takahashi T, Hirohashi S. A novel target gene, SKP2, within the 5p13 amplicon that is frequently detected in small cell lung cancers. Am J Pathol. 2002;161:207-216. [PubMed] [DOI] |
| 3. | Fire A, Xu S, Montgomery MK, Kostas SA, Driver SE, Mello CC. Potent and specific genetic interference by double-stranded RNA in Caenorhabditis elegans. Nature. 1998;391:806-811. [PubMed] [DOI] |
| 4. | Yamasaki L, Pagano M. Cell cycle, proteolysis and cancer. Curr Opin Cell Biol. 2004;16:623-628. [PubMed] [DOI] |
| 5. | Lin DI, Diehl JA. Mechanism of cell-cycle control: ligating the ligase. Trends Biochem Sci. 2004;29:453-455. [PubMed] [DOI] |
| 6. | Yeh KH, Kondo T, Zheng J, Tsvetkov LM, Blair J, Zhang H. The F-box protein SKP2 binds to the phosphorylated threonine 380 in cyclin E and regulates ubiquitin-dependent degradation of cyclin E. Biochem Biophys Res Commun. 2001;281:884-890. [PubMed] [DOI] |
| 7. | Kornitzer D, Ciechanover A. Modes of regulation of ubiquitin-mediated protein degradation. J Cell Physiol. 2000;182:1-11. [PubMed] [DOI] |
| 8. | DeSalle LM, Pagano M. Regulation of the G1 to S transition by the ubiquitin pathway. FEBS Lett. 2001;490:179-189. [PubMed] [DOI] |
| 9. | Zhang H, Kobayashi R, Galaktionov K, Beach D. p19Skp1 and p45Skp2 are essential elements of the cyclin A-CDK2 S phase kinase. Cell. 1995;82:915-925. [PubMed] [DOI] |
| 10. | Demetrick DJ, Zhang H, Beach DH. Chromosomal mapping of the genes for the human CDK2/cyclin A-associated proteins p19 (SKP1A and SKP1B) and p45 (SKP2). Cytogenet Cell Genet. 1996;73:104-107. [PubMed] [DOI] |
| 11. | Latres E, Chiarle R, Schulman BA, Pavletich NP, Pellicer A, Inghirami G, Pagano M. Role of the F-box protein Skp2 in lymphomagenesis. Proc Natl Acad Sci U S A. 2001;98:2515-2520. [PubMed] [DOI] |
| 12. | Li JQ, Wu F, Masaki T, Kubo A, Fujita J, Dixon DA, Beauchamp RD, Ishida T, Kuriyama S, Imaida K. Correlation of Skp2 with carcinogenesis, invasion, metastasis, and prognosis in colorectal tumors. Int J Oncol. 2004;25:87-95. [PubMed] [DOI] |
| 14. | Scherr M, Eder M. Gene silencing by small regulatory RNAs in mammalian cells. Cell Cycle. 2007;6:444-449. [PubMed] [DOI] |