修回日期: 2009-02-15
接受日期: 2009-02-23
在线出版日期: 2009-03-18
目的: 观察非酒精性脂肪肝大鼠下丘脑STAT3蛋白表达和组成性激活的改变, 以及中药降脂颗粒对其干预作用.
方法: 高脂饲料制备非酒精性脂肪肝大鼠模型, 待造模成功后将大鼠随机分为模型对照组(n = 10)、辛伐他汀组(n = 10)、降脂颗粒组(n = 10), 每日进行ig药物干预, 4 wk, 并设空白对照组(n = 8). 比色法检测血清TG、TC; HE染色观察观察肝组织脂肪变和炎症; Western blot检测下丘脑磷酸化STAT3蛋白表达, EMSA检测下丘脑STAT3的组成性激活状态.
结果: 磷酸化STAT3蛋白表达及其组成性激活在非酒精性脂肪肝大鼠均明显降低, 降脂颗粒用药组及辛伐他汀组能下调大鼠血清TG(0.54±0.09 mmol/L, 0.68±0.08 mmol/L vs 0.84±0.09 mmol/L, 均P<0.05)、TC(1.85±0.31 mmol/L, 2.08±0.30 mmol/L vs 2.84±0.30 mmol/L, 均P<0.05)水平, 减轻肝脂肪变(2.26±0.52, 2.57±0.67 vs 3.10±0.57, 均P<0.05)和炎症程度(0.68±0.67, 0.95±0.6 vs 1.52±0.71, 均P<0.05); 上调下丘脑组织磷酸化STAT3蛋白表达及其组成性激活.
结论: STAT3在非酒精性脂肪肝大鼠下丘脑组织表达和激活明显下降, 中药降脂颗粒对非酒精性脂肪肝有很好的治疗作用, 并可上调STAT3的表达和组成性激活.
引文著录: 郑培永, 张莉, 柳涛, 王淼, 邢练军, 季光. 下丘脑STAT3在非酒精性脂肪性肝病大鼠发病中的作用及降脂颗粒的干预. 世界华人消化杂志 2009; 17(8): 753-757
Revised: February 15, 2009
Accepted: February 23, 2009
Published online: March 18, 2009
AIM: To observe the expression and activation of hypothalamus STAT3 on rats with nonalcoholic fatty liver disease (NAFLD), and to study therapeutically effect of Jiangzhi granule on it.
METHODS: High fat-induced NAFLD rats were randomly divided into 3 groups: model group (n = 10); Jiangzhi granule group (n = 10); simvastatin group (n = 10). Blank group were fed with chow food (n = 8). Four weeks later, all rats were sacrificed. Liver tissue samples were then collected for pathologic analysis. Liver index, serum TG and TC were detected using colorimetry. Phosphorylated STAT3 protein expression of hypothalamus was determined by Western blot while the activated STAT3 expression by EMSA.
RESULTS: Phosphorylated STAT3 protein and activated STAT3 expression in hypothalamus were significantly lower in rats with NAFLD. Jiangzhi granule and simvastatin significantly lowered serum levels of TG (0.54 ± 0.09 mmol/L, 0.68 ± 0.08 mmol/L vs 0.84 ± 0.09 mmol/L, both P < 0.05), TC (1.85 ± 0.31 mmol/L, 2.08 ± 0.30 mmol/L vs 2.84 ± 0.30 mmol/L, both P < 0.05), improved steotosis (2.26 ± 0.52, 2.57 ± 0.67 vs 3.10 ± 0.57, both P < 0.05) and relieved inflammation (0.68 ± 0.67, 0.95 ± 0.6 vs 1.52 ± 0.71, both P < 0.05), and up-regulated the phosphorylated and activated STAT3 expression.
CONCLUSION: Hypothalamus STAT3 is involved in the mechanism of NAFLD, Jiangzhi granule can effectively improve liver function and steatosis, and up-regulate the expression of STAT3 in hypothalamus.
- Citation: Zheng PY, Zhang L, Liu T, Wang M, Xing LJ, Ji G. Effect of Jiangzhi granule on STAT3 expression in hypothalamus of rats with nonalcoholic fatty liver disease. Shijie Huaren Xiaohua Zazhi 2009; 17(8): 753-757
- URL: https://www.wjgnet.com/1009-3079/full/v17/i8/753.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i8.753
非酒精性脂肪性肝病(nonalcoholic fatty liver disease, NAFLD)是一种无过量饮酒史, 以肝细胞脂肪变性和脂质贮积为特征的临床病理综合征, 其发病率有逐年升高的趋势. 其病理变化随病程的进展而表现有单纯性脂肪肝、脂肪性肝炎、脂肪性肝纤维化和肝硬化. NAFLD病变机制复杂, 多种调节因子可以作用于其病变过程, 但其具体发病机制尚处于探索阶段. 瘦素是机体脂肪代谢的关键调节激素, 研究发现瘦素主要是通过其位于下丘脑的受体进而激活信号转导及转录激活子(signaling transducer and activator of transcription, STAT3)发挥效应[1]. NAFLD属代谢性疾病, 中药降脂颗粒长期应用于临床治疗NAFLD, 安全而有效. 我们通过高脂饮食诱导NAFLD大鼠模型, 观察下丘脑STAT3在NAFLD大鼠的变化规律和降脂颗粒对其干预作用, 探讨NAFLD的发病机制以及中药降脂颗粒作用机制.
胆固醇, 购于国药集团化学试剂有限公司; 三酰甘油(TG)、总胆固醇(TC)试剂盒购于南京建成工程研究所; p-STAT3抗体, Santa Cruz Biotechnology; 非放射性STAT3-EMSA Kit: Viagene公司; 胞质-核蛋白抽提试剂盒: Viagene公司Cat: SINP001; BCA蛋白浓度测定试剂盒: 碧云天生物公司Cat: P0012; 电泳仪Bio-rad power/PAC 200; 紫外交联仪(Stratgen公司). 降脂颗粒, 上海龙华医院制剂室提供; 辛伐他汀, 广州南新制药有限公司, 批号: SST02207.♂SD大鼠42只, SPF级, 体质量180±10 g, 购于上海斯莱克实验动物有限责任公司(动物生产许可证号: SYXK(沪)2005-0002), 饲养于上海龙华医院动物房, 适应性饲养1 wk后进入实验.
1.2.1 造模及分组给药: 参照文献[2]给大鼠饲喂高脂饲料(88%基础饲料+10%猪油+2%胆固醇)造模, 第2、4、6、8周各处死造模组1只大鼠观察造模情况. 模型成功后将动物随机分为3组: 辛伐他汀组(n = 10): 辛伐他汀分散片溶于双蒸水, 浓度0.8 g/L, 再ig 5 mL/(kg·d), 降脂颗粒组(n = 10): 降脂颗粒以19 g/L的浓度溶于双蒸水, ig 5 mL/(kg·d), 相当于ig原生药材0.475 g/(kg·d)和模型对照组(n = 10): 生理盐水ig 5 mL/(kg·d). 空白对照组(普通饲料饲喂): ig生理盐水5 mL/(kg·d), 观察大鼠的一般情况. 持续用药4 wk后戊巴比妥钠麻醉下腹主动脉取血, 3000 r/min, 15 min离心分离血清, -20℃保存以备检测TG, TC指标; 将肝脏取下后迅速称质量, 随后取肝脏右叶最厚部一份40 g/L的甲醛溶液固定, 脱水、透明、石蜡包埋做HE病理染色. 光镜下观察肝脂肪变性和炎症程度. 肝细胞脂肪变性程度判断标准参照Diehl法[3], 炎症活动度计分标准参考1981年Knodell提出的慢性肝炎组织学活动指数(HAI)[4], 并结合王泰龄 et al[5]提出的慢性肝炎炎症活动度计分方案. 血清TG、TC严格按照试剂盒说明书操作.
1.2.2 下丘脑磷酸化STAT3(p-STAT3)蛋白表达测定: 100 mg下丘脑组织剪碎, 置于1 mL冰Western细胞裂解液中充分匀浆. 将组织匀浆在4℃下以12 000 r/min离心20 min, 采用紫外分光光度计进行蛋白质定量. 取总蛋白50 μg, 加等量SDS凝胶加样缓冲液, 100℃变性3 min, 100 g/L十二烷基硫酸钠一聚丙烯酰胺(SDS-PAGE)凝胶电泳后, 采用半干式电转移仪(Bio-Rad公司), 参照厂家提供程序进行转膜. 转移结束后, 室温下用含50 g/L脱脂奶粉的PBS封闭2 h, 然后分别加入鼠抗人P-STAT3 mAb(购自Santa Cruz公司, 工作浓度1:1000)室温下振荡1 h, 再加入1:5000稀释的二抗(HRP-GAMG购自Bio-Rad公司)室温下孵育1 h, 放射自显影: 曝光5 min, 用密度扫描仪进行密度扫描, 测得其灰度值, 与相应的β-actin灰度之比表示其蛋白含量.
1.2.3 下丘脑STAT3蛋白组成性激活测定: 下丘脑取材组织称质量匀浆后抽提核蛋白, 步骤按试剂盒说明书, 以BCA法测定抽得的蛋白浓度. 制备60 g/L非变性聚丙烯酰胺凝胶. 按照EMSA试剂盒说明书, 每孔取抽提的核蛋白9.0 mg, 与缓冲液及探针混匀, 室温孵育20 min后, 上样电泳, 100 V, 1.5-2 h, 半干电转移(280 V, 1.5-2样电泳, 100将蛋白转至带阳性电荷的尼龙膜, 紫外灯交联后化学发光显色.
统计学处理 计量资料以mean±SD表示, 组间比较采用方差分析; 等级资料采用秩和检验, 用SPSS12.0软件包进行数据统计.
空白组大鼠精神充沛, 灵活好动, 皮毛整洁; 模型组大鼠精神萎靡, 性情较温顺, 不喜动, 皮毛凌乱欠光泽, 辛伐他汀组和降脂颗粒组大鼠活动均有不同程度的减少, 饮食减少, 皮毛欠光泽.
高脂饮食可诱导大鼠NAFLD模型, 表现为模型大鼠肝重量增加, 肝脏指数明显升高; 各用药组均可以降低脂肪肝大鼠的肝指数, 与模型组比较有显著差异(P<0.05, 表1).
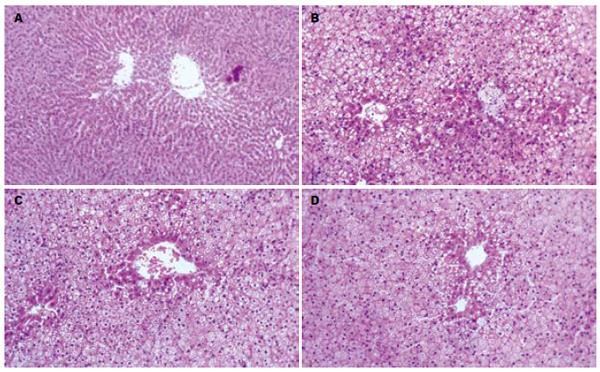
空白对照组肝脏肉眼观察呈鲜红色, 边缘锐利, 表面光滑. 模型组肉眼见肝脏体积增大, 包膜紧张, 边缘变钝, 颜色呈土黄色, 质软, 与周围组织有粘连, 切面油腻状. 给药组部分肝脏表面呈浅黄色, 油腻状减轻, 指压有弹性. 肝组织切片HE染色可见正常对照组肝细胞条索排列整齐, 肝窦正常, 胞核清晰; 模型组则可见弥漫性肝细胞脂肪变性, 主要为大泡性也有部分小泡性脂肪变, 同时肝小叶内和汇管区有以大量单个核细胞为主的炎性细胞浸润; 降脂颗粒组肝组织脂肪变程度明显减轻, 肝内脂肪滴减少, 散在分布, 炎细胞浸润减少. 在改善脂肪变和抗炎方面均显著优于辛伐他汀组(图1, 表1).
模型组大鼠血清TG、TC数值明显升高, 降脂颗粒可明显下调血清TG、TC水平(P<0.05), 并显著优于辛伐他汀组(P<0.05, 表2).
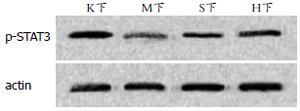
正常组大鼠下丘脑p-STAT3蛋白表达为1.03±0.02, 模型组大鼠下丘脑组织p-STAT3蛋白表达明显减少(0.49±0.07), 辛伐他汀和降脂颗粒均可上调p-STAT3蛋白表达(0.62±0.06, 0.83±0.08, P<0.05), 且降脂颗粒组优于辛伐他汀组(P<0.05, 图2).
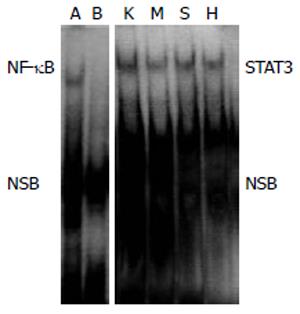
模型组大鼠下丘脑组织STAT3结合形式表达明显降低, 辛伐他汀及降脂颗粒均能不同程度的上调其表达(图3).
NAFLD是遗传和环境共同影响的疾病, 其发病的确切机制尚不清楚. 目前多数学者倾向于用"二次打击"学说来解释NAFLD. "二次打击"学说认为胰岛素抵抗引起的脂肪在肝细胞沉积是NAFLD形成中的第一次打击, 第二次打击则是在脂肪沉积的基础上的脂质过氧化、氧化应激和异常的细胞因子等参与的炎症反应形成脂肪性肝炎.
NAFLD作为代谢性疾病, 受到多种因素的调节. 瘦素是由脂肪组织主要是脂肪细胞分泌的多肽类激素, 他能将机体脂肪累积的信号传达至大脑, 控制食欲和能量的消耗从而调节机体能量代谢[6-7]. 研究表明, 瘦素瘦素通过调节摄食和能量代谢在NAFLD的发病中发挥重要作用.
瘦素与其相应的受体(OB-R)结合发挥效应, OB-R属于Ⅰ类细胞因子受体家族, 现已发现OB-R的6种亚型: OB-Ra、OB-Rb、OB-Rc、OB-Rd、OB-Re、OB-Rf, 其所有亚型都是由同一受体基因经mRNA交替剪接和/或蛋白酶解加工而成[8]. 其中主要分布于下丘脑弓状核和腹内侧核的OB-Rb亚型在胞内段结构最长, 是最主要的功能受体[9]. 但瘦素受体本身不具备蛋白酪氨酸激酶的活性, 通过激活Janus家族酪氨酸激酶/信号转导与转录激活因子(JAK/STAT), 其中最主要是JAK2/STAT3途径产生生物学效应, 发挥其控制食物摄入和调节能量代谢的作用[10-11]. OB-Rb与瘦素结合激活JAK2/STAT3信号通路, 进而使STAT3发生磷酸化, 形成二聚体穿过胞膜转位到胞核内, 启动特定基因的表达, 转录和翻译特定的蛋白, 发挥调节机体代谢的效应[12].
在瘦素信号转导过程中STAT3的活化是瘦素效应发挥的关键环节. 刘倩琦 et al[13]用重组瘦素干预原代培养的新生大鼠下丘脑神经元, 发现其磷酸化STAT3蛋白的表达增加, 活性增强. Hosoi et al[14]将小鼠小丘脑神经核团的STAT3敲除后, 观察小鼠发现其进食量增加, 对瘦素的反应降低. 而STAT3基因缺失或变异的小鼠均表现为病态肥胖[15].
降脂颗粒全方由茵陈、虎杖、丹参、绞股蓝、干荷叶等5味中药组成. 方中茵陈, 味苦, 性微寒, 归脾胃肝胆经, 清利湿热, 退黄疸, 虎杖味苦性寒, 归肝胆肺经, 活血定痛, 清热利湿, 解毒化痰, 二者相合共为君, 针对本病湿热痰瘀相互胶着的病机, 可谓切中要害; 臣以三七, 味甘微苦, 性温, 归肝胃经, 具化瘀止血, 活血定痛之功, 因其性温可防诸药凉遏之弊, 与君药共奏澄本清源之力; 绞股蓝, 味甘、苦, 性寒, 归脾、肺经, 功效益气健脾, 化痰, 清热解毒为佐; 干荷叶, 味苦, 性平, 归肝、脾、胃经为使, 功能清热解暑, 升发清阳, 凉血止血,《本草纲目》载:"荷叶服之令人瘦劣", 诸药合用针对脂肪肝湿热痰瘀互结于肝的病机, 合奏清热利湿化痰、活血祛瘀之功, 故能取得较好的疗效. 以往对其研究发现降脂颗粒对非酒精性脂肪肝大鼠肝脏脂质有较好的治疗作用, 并能通过增加肝脏瘦素受体mRNA表达及P-STAT3蛋白含量改善其瘦素抵抗状态[16].
我们采用高脂饮食饲喂♂SD大鼠, 观察其病理表现成功制备NAFLD大鼠模型后, 检测TG、TC的改变, 发现模型组明显高于正常组, 与组织学改变一致. 用药组与模型组相比明显数值降低, 降脂颗粒组效果更明显; 组织病理学的观察也表明药物可以改善肝脏脂肪变, 改善炎症细胞浸润. 血清学和组织学的观察都表明降脂颗粒对NAFLD有很好的治疗效果.
瘦素是脂代谢的关键调节因子之一, 我们推测瘦素参与NAFLD可能机制. 因此我们测定了下丘脑P-STAT3蛋白表达情况以及STAT3组成性激活的改变, 以证实我们假说的合理性. 结果表明模型组大鼠下丘脑P-STAT3蛋白表达明显下调. 药物干预后其表达均有不同程度的上调, 尤以降脂颗粒组为显著. 为了研究下丘脑STAT3组成性激活的改变我们采用EMSA用于检测. EMSA是一种研究DNA结合蛋白和其相关DNA结合序列相互作用的技术. 蛋白质可以与末端标记的核酸探针结合, 电泳时这种复合物比无蛋白结合的探针在凝胶中的泳动速度慢, 表现为相对滞后, 利用这个原理, 我们检测转录因子STAT3的组成性激活. 结果表明模型组STAT3条带灰度显著降低, 即STAT3的激活减少; 而用药组与模型组相比灰度增强. 说明STAT3参与了NAFLD形成过程, 而中药降脂颗粒则可通过增加STAT3的激活干预NAFLD.
近年来, 随着对中医药研究的深入, 中医药防治NAFLD的优越性逐渐被人们认识, 但是由于NAFLD机制的不明确以及中药复方的复杂性, 使得研究面临很大的困难. 在前期大量研究的基础上, 我们试图通过一个崭新的视角去探讨NAFLD的发病机制以及中药可能的干预位点. 但对其确切的机制还有待于进一步深入的研究.
NAFLD是一种代谢性疾病, 发病率有逐年增高的趋势. 其病因复杂, 发病机制不明确, 多种调节因子可以作用于其病变过程, 机体脂肪代谢的关键调节激素瘦素, 通过其位于下丘脑的受体而激活STAT3发挥效应从而参与NAFLD的病变过程.
范建高, 教授, 上海交通大学医学院附属新华医院消化内科
瘦素是近年来的研究热点, 其在多种疾病, 尤其是代谢性疾病中发挥重要的作用. 瘦素的信号通路上相关分子蛋白是众多研究的靶点, 并逐渐形成了瘦素抵抗的学说. 瘦素成为NAFLD研究探索的新思路, 但其具体机制还亟待解决.
应用降脂颗粒治疗脂肪肝既有临床报道也有基础研究, 有关瘦素的研究多集中在肥胖病症, 在瘦素与NAFLD发病的研究中, 有学者检测到降脂颗粒可以上调肝组织中磷酸化STAT3蛋白表达, 从而发挥其治疗效应.
本文主要基于降脂颗粒对NAFLD的改善效应, 探讨下丘脑组织中STAT3在NAFLD发病中的作用. 下丘脑存在摄食中枢, 调节食欲和代谢, 瘦素通过位于下丘脑信号分子将效应传达至靶器官, 但也有报道认为许多其他分子也参与这一过程.
本研究证实瘦素通路蛋白STAT3在NAFLD的发病中发挥关键作用, 而中药降脂颗粒可以调节STAT3蛋白. 从而为NAFLD的机制研究提供一个新的研究思路, 并为中药降脂颗粒的效应位点作出了新的探索.
本研究设计合理, 方法先进, 统计正确, 结果可信, 学术价值较好.
编辑: 李军亮 电编:何基才
| 1. | Sahu A. Leptin signaling in the hypothalamus: emphasis on energy homeostasis and leptin resistance. Front Neuroendocrinol. 2003;24:225-253. [PubMed] [DOI] |
| 3. | Diehl AM, Goodman Z, Ishak KG. Alcohollike liver disease in nonalcoholics. A clinical and histologic comparison with alcohol-induced liver injury. Gastroenterology. 1988;95:1056-1062. [PubMed] [DOI] |
| 4. | Knodell RG, Ishak KG, Black WC, Chen TS, Craig R, Kaplowitz N, Kiernan TW, Wollman J. Formulation and application of a numerical scoring system for assessing histological activity in asymptomatic chronic active hepatitis. Hepatology. 1981;1:431-435. [PubMed] [DOI] |
| 6. | Huo L, Maeng L, Bjørbaek C, Grill HJ. Leptin and the control of food intake: neurons in the nucleus of the solitary tract are activated by both gastric distension and leptin. Endocrinology. 2007;148:2189-2197. [PubMed] [DOI] |
| 7. | Peters JH, Simasko SM, Ritter RC. Leptin analog antagonizes leptin effects on food intake and body weight but mimics leptin-induced vagal afferent activation. Endocrinology. 2007;148:2878-2885. [PubMed] [DOI] |
| 8. | Wang MY, Zhou YT, Newgard CB, Unger RH. A novel leptin receptor isoform in rat. FEBS Lett. 1996;392:87-90. [PubMed] [DOI] |
| 9. | Friedman JM, Halaas JL. Leptin and the regulation of body weight in mammals. Nature. 1998;395:763-770. [PubMed] [DOI] |
| 10. | Saxena NK, Vertino PM, Anania FA, Sharma D. leptin-induced growth stimulation of breast cancer cells involves recruitment of histone acetyltransferases and mediator complex to CYCLIN D1 promoter via activation of Stat3. J Biol Chem. 2007;282:13316-13325. [PubMed] [DOI] |
| 11. | Ben-Eliezer M, Phillip M, Gat-Yablonski G. Leptin regulates chondrogenic differentiation in ATDC5 cell-line through JAK/STAT and MAPK pathways. Endocrine. 2007;32:235-244. [PubMed] [DOI] |
| 12. | Bahrenberg G, Behrmann I, Barthel A, Hekerman P, Heinrich PC, Joost HG, Becker W. Identification of the critical sequence elements in the cytoplasmic domain of leptin receptor isoforms required for Janus kinase/signal transducer and activator of transcription activation by receptor heterodimers. Mol Endocrinol. 2002;16:859-872. [PubMed] [DOI] |
| 13. | 刘 倩琦, 陈 荣华, 郭 锡熔, 潘 晓勤. 重组Leptin干预对新生鼠下丘脑中STAT3磷酸化蛋白表达的影响. 南京医科大学学报(自然科学版). 2006;26:86-89. |
| 14. | Hosoi T, Okuma Y, Ono A, Nomura Y. Alteration of leptin-induced STAT3 activation in the brain of senescence-accelerated mouse (SAM) P8. Biol Pharm Bull. 2005;28:1514-1516. [PubMed] [DOI] |
| 15. | Gao Q, Wolfgang MJ, Neschen S, Morino K, Horvath TL, Shulman GI, Fu XY. Disruption of neural signal transducer and activator of transcription 3 causes obesity, diabetes, infertility, and thermal dysregulation. Proc Natl Acad Sci U S A. 2004;101:4661-4666. [PubMed] [DOI] |