修回日期: 2009-01-15
接受日期: 2009-02-09
在线出版日期: 2009-03-08
目的: 探讨葛根素对酒精性肝炎的作用机制.
方法: 21只Wistar大鼠, 随机分为3组, 正常对照组(n = 7)用玉米油+500 g/L葡萄糖20 mL/(kg•d)灌胃, 模型组(n = 7)用400 mL/L乙醇按8 g/(kg•d)+玉米油灌胃, 葛根素组(n = 6): 葛根素+酒精, 按葛根素5 mg/(kg•d)腹腔注射给药. 采用比色法测定血清AST, ALT及GST, 放免法测定血浆PGE2, TNF及IL-6, Western blot方法检测肝组织COX-2表达, 并通过光镜观察肝组织病理变化.
结果: 血浆ALT, AST及GST模型组与正常对照组比较有明显升高(107.5±6.81 vs 33.20±10.55, 138.29±9.72 vs 47.86±14.3, 3.57±0.53 vs 1.43±0.43, 均P<0.01); 与模型组比较, 葛根素组血浆ALT及AST水平(52.33±13.19, 63.33±7.03)有明显下降(P<0.01). GST有下降趋势, 但无明显著意义; 模型组与正常对照组比较血浆PGE2, TNF及IL-6明显上升(274.13±26.15 vs 193.84 ±23.97, 1.85±0.11 vs 0.90±0.18, 68.07±12.64 vs 40.50±5.09, 均P<0.01); 与模型组比较, 葛根素组血浆PGE2, TNF及IL-6明显下降(227.05±21.55, 1.35±0.19, 53.16±5.62, 均P<0.01), COX-2正常对照组呈弱表达, 模型组显著高表达, 与正常对照组比较差别显著(P<0.01), 葛根素组COX-2表达下调, 与模型组相比有明显下调(F = 27.94, P<0.01).
结论: 葛根素通过抑制肝脏COX-2的表达, 从而减少炎症介质PGE2、TNF及IL-6的生成, 最终减轻酒精对肝脏的损伤作用.
引文著录: 曲智威, 温春阳, 王爱平, 鞠文博, 任爱华, 刘卯阳, 周艳. 葛根素对大鼠酒精性肝炎的影响及其机制. 世界华人消化杂志 2009; 17(7): 657-661
Revised: January 15, 2009
Accepted: February 9, 2009
Published online: March 8, 2009
AIM: To investigate mechanism of puerarin on alcoholic hepatitis in rats.
METHODS: Twenty-one Wistar rats were divided into three groups randomly, with intragastric administration of the control group by corn oil + 500 g/L glucose 20 mL/(kg•d); intragastric administration of the model group by 400 mL/L alcohol 8 g/(kg•d)+ corn oil; peritoneal injection of the puerarin group by puerarin 5 mg/(kg•d); After thirty days. Serum and liver tissue samples were prepared, and the levels of alanine transaminase (ALT), aspartate transaminase (AST), and γ-glutamyltranspeptidase (GST) were determined by chromatometry, serum PGE2, TNF-α and IL-6 by radioimmunity method, and COX-2 expression on the hepatic tissue by Western blot. Pathological changes on hepatic tissue was determined by light microscopy.
RESULTS: The serum ALT, AST and GST was significantly higher in model group than in control group (107.5 ± 6.81 vs 33.20 ± 10.55, 138.29 ± 9.72 vs 47.86 ± 14.3, 3.57 ± 0.53 vs 1.43 ± 0.43, all P < 0.01). The serum ALT and AST was significantly lower in puerarin group than in model group (52.33 ± 13.19, 63.33 ± 7.03, P < 0.01). The serum GST level was lower, but not significantly. The levels of serum PGE2, TNF-α and IL-6 were significantly higher in model group than in control group (274.13 ± 26.15 vs 193.84 ± 23.97, 1.85 ± 0.11 vs 0.90±0.18, 68.07 ± 12.64 vs 40.50 ± 5.09, all P < 0.01), and the levels of the serum PGE2, TNF-α and IL-6 were significantly lower in puerarin group than in model group (227.05 ± 21.55, 1.35 ± 0.19, 53.16 ± 5.62, all P < 0.01). Expression of COX-2, was weak, but had high expression in model group(P < 0.01). The expression of COX-2 in puerarin group was down regulated, compared with model group (P < 0.01).
CONCLUSION: Puerarin has effects on hepatic injury in alcoholic hepatitis.
- Citation: Qu ZW, Wen CY, Wang AP, Ju WB, Ren AH, Liu MY, Zhou Y. Protective effect of puerarin on rats with alcoholic hepatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(7): 657-661
- URL: https://www.wjgnet.com/1009-3079/full/v17/i7/657.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i7.657
酒精性肝炎(alcohotic hepatitis, AL)为常见病及多发病, 严重者发展为肝坏死或肝功能衰竭, 进一步发展为肝硬化、肝癌、肝昏迷等合并症[1-2]. 目前尚无特效的治疗药物. 目前应用于临床试验研究的药物有糖皮质激素, 已酮可可碱, 抗氧化剂, 抗TNF-α抗体等[2]. 从中医中药角度为治疗酒精性肝炎提供了新途径, 葛根素(puerarin)是从豆科植物野葛的干燥根中提取的一种化学成分, 其化学名为8-β-D葡萄吡喃糖-4', 7二羟基异黄酮[3-6]. 葛根素药理实验研究表明, 其具有抗酒精中枢抑制作用, 对心肌的保护作用, 对肾的保护作用, 抗氧化作用抗缺血再灌注损伤作用, 抗酒精中枢抑制作用, 降血糖, 防治糖尿病及其并发症, 改善血液流变学指标, 改善微循环和抗血小板聚集的作用. 临床上有报道用葛根素治疗酒精性肝炎冠心病等[9-12], 但对酒精性肝炎的实验研究国内外未见报道.
兔抗鼠COX-2多克隆抗体(美国Cayman公司); 小鼠抗大鼠, β-actin mAb(美国Sigma公司); 生物素标记的羊抗兔二抗(英国KPL公司), 辣根过氧化物酶标记羊抗兔及羊抗鼠二抗、化学发光剂ECL北京中山生物技术有限公司), PGE2, TNF及IL-6放免试剂盒(北京北方生物技术研究所). 葛根素注射液为北京协和药厂生产(批号国药准字H2003122), 硝酸纤维素膜(北京鼎国生物技术有限责任公司), 其他试剂均为分析纯.
1.2.1 分组: 21只Wistar大鼠, ♂, 体质量170-220 g, 购于吉林大学动物部(许可证号SCXK 2003-007), 随机分为3组, 对照组(n = 7)用玉米油2 g/(kg·d)+500 g/L葡萄糖20 mL/(kg·d)灌胃, 模型组(n = 7)用400 g/L乙醇按8 g/(kg·d)+玉米油2 g/(kg·d)灌胃, 葛根素组(n = 7): 葛根素+酒精, 葛根素0.05 g/dL, 按葛根素5 mg/kg ig给药, 处死大鼠取血清及肝脏. 给药30 d造模结束后, 采用巴比妥钠麻醉、腹主动脉釆血后处死大鼠, 共剩余对照组7只, 模型组7只, 葛根素组6只. 各取全血约4-5 mL, 4000 r/min, 10 min离心后收集上清分装-70℃保存. 取肝右叶生理盐水洗净, 滤纸吸干盐水后分成数份, 1份于100 g/L中性甲醛溶液中固定, 其他于液氮速冻数分钟后-70℃保存.
1.2.2 血清AST, ALT, GST的测定: 采用比色法, 用日立7170全自动生化分析仪检测.
1.2.3 血清PGE2, TNF及IL-6的测定: 采用125I标记放射免法测定, 按试剂盒说明书进行. 所用仪器为FJ-2008PSγ计数器. 3000 r/min, 3 s离心, -70℃保存待检, 检测前40℃ 3500 r/min, 离心15 min, 取上清液分别检测.
1.2.4 肝组织病理学检查: 光镜观察肝组织, 100 g/L甲醛固定标本, 乙醇梯度脱水, 二甲苯透明.
1.2.5 COX-2表达检测: 使用Western blot方法检测肝组织COX-2表达, 冷冻的肝组织称质量后按1∶10比例用三去污蛋白裂解液裂解, 离心10 000 r/min, 5 min, 2次, 取上清. 用考马斯亮蓝(G250)测定蛋白含量. 以每样品总蛋白为150 μg上样, 用不连续100 g/L SDS聚丙烯酰胺凝胶电泳, 半干转转蛋白至硝酸纤维素膜: 100 g/L脱脂奶粉封闭; 一抗4℃过夜; TBS洗膜; 辣根过氧化物酶标记二抗37℃ 2 h, TBST洗膜, ECL作用后X胶片曝光, 经显影、定影等处理后观察结果. 并用Bandscan软件作灰度扫描分析, 用COX-2与内参(β-actin)灰度值比值表示各样本COX-2表达强度, 并作统计学处理.
统计学处理 数据以mean±SD表示, 用SPSS13.5统计软件处理数据, 采用方差分析和最小显著法检验, P<0.05或0.01具有显著性差异.
实验过程中乙醇灌胃组有1只大鼠死亡, 死因为灌胃误入气管. 正常对照组存活大鼠初始体质量各组相比没有显著性差异. 实验中, 大鼠的一般表现: 正常对照组被毛光滑, 精神状态好, 食欲佳, 体质量增加. 模型组大鼠精神萎靡, 活动减少, 食欲减退, 消瘦, 皮毛无光泽, 有脱毛现象, 体质量较前有所下降. 给药组大鼠精神、食欲及活动介于正常组与模型组之间.
2.2.1 肉眼观: 正常大鼠肝脏被膜光滑, 呈红褐色, 明亮有光泽. 模型组大鼠肝脏体积明显增大, 包膜紧张, 边缘圆钝, 颜色浅黄或土黄色, 与周围组织有粘连, 可见局灶性黄白色变性灶, 切面油腻, 无光泽. 给药组肝脏变化介于正常组与模型组之间, 颜色较正常组浅, 较模型组深, 无局灶黄白色变性灶, 切面无明显油腻感, 尚有光泽.
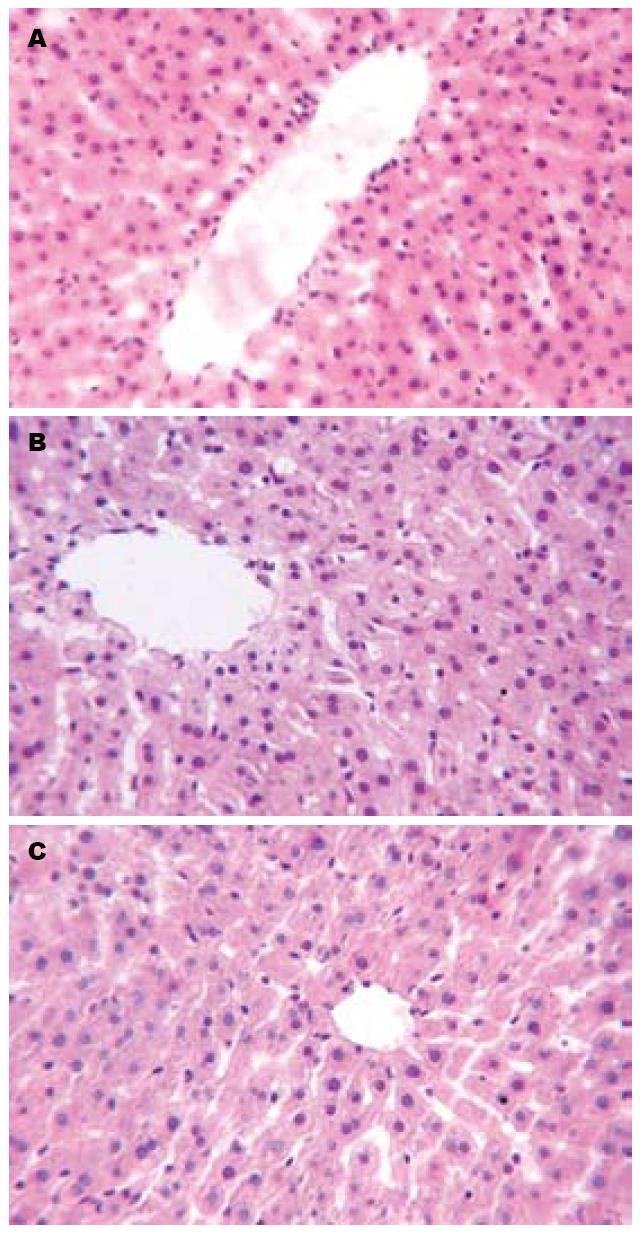
2.2.2 HE染色: 正常对照组, 大鼠肝细胞以中央静脉为中心呈放射状排列, 细胞形态正常, 小叶结构正常(图1A); 模型组有细胞肿胀, 细胞内轻度气球样变, 有小叶结构紊乱, 但无明显肝细胞坏死、炎症细胞浸润及明显脂肪肝改变(图1B); 葛根素组肝细胞亦有轻度细胞肿胀, 几乎无气球样变, 小叶结构基本正常(图1C).
由表1所见血浆ALT, AST及GST模型组与正常对照组比较有明显升高, 差别均有显著性意义(P<0.01); 葛根素组与模型组比较血浆ALT, AST及与正常对照组比较有明显下降, 差别均有显著性意义(P<0.01), GST与模型组比较有下降趋势, 但无显著意义(P>0.05), 葛根素具有保护肝细胞损伤作用.
由表2所见模型组血清PGE2, TNF及IL-6与正常对照组比较有明显升高, 差别均有显著性意义(P<0.01); 葛根素组与模型组比较血清PGE2, TNF及IL-6明显下降, 差别均有显著性意义(P<0.05), 葛根素具有减少炎症介质PGE2, TNF及IL-6作用.
正常对照组呈弱表达, 模型组显著高表达, 与对照组比较差别显著(P<0.01, 图2). 葛根素组COX-2表达下调, 与模型组相比有明显下调(P<0.01), F = 27.94. 经计算机Bandscan软件分析其灰度值, COX-2灰度值与β-actin灰度值比值为: 对照组(n = 7)为0.196±0.079, 模型组(n = 7)为0.421±0.033, 葛根素组(n = 6)为0.281±0.046.
COX是前列腺素类(prostaglandins, PGs)物质合成过程中的一个限速酶. COX-2是他的一个亚型, 他在正常组织中不表达或低表达, 但在炎症、肿瘤等病理状态下, 可受众多因素的刺激, 使其表达明显升高[13-15]. 己经有实验证实, 在酒精性肝炎中, 肝脏COX-2表达明显升高, 使其合成产物PGE2升高, 加重酒精性肝炎的各种病理损伤. 本实验通过建立酒精性肝损伤的大鼠模型, 观察葛根素对大鼠酒精肝损伤的影响, 同时测定肝组织COX-2的表达, 以明确COX-2与肝损伤的关系, 探索葛根素及选择性COX-2抑制剂对酒精性肝损伤的影响. 本实验表明对照组呈弱表达, 模型组显著高表达, 与对照组比较差别显著. 葛根素组COX-2表达下调, 与模型组相比有明显下调, 与Bykov et al报道一致[16].
酒精性肝损伤时, 首先损害线粒体, 因肝细胞内线粒体AST浓度大大超过肝窦血液中的浓度, 即使肝细胞无明显坏死, 而仅有肝细胞膜的通透性增加时, 血中AST的浓度就可明显升高[17-20], 故他是酒精性肝损伤的敏感指标而血清ALT则在酒精性肝炎时可正常或轻微升高. 本实验中, 虽然肝组织学改变没有达到明显脂肪肝、酒精性肝纤维化的程度, 但仍明显存在肝细胞损伤, 故其血清ALT、AST在模型组中较对照组均有明显升高. 而经葛根素组, 其AST、ALT较肝损伤组均有降低, 提示葛根素可以减轻酒精所致大鼠肝细胞损伤. GST主要存在于细胞膜和微粒体上, 参与谷胱甘肽的代谢, 当肝细胞损伤时, 即释放到血液中[21]. 本实验结果显示, 在酒精性肝损伤的模型组中, 血浆GST活性升高, 模型组与对照组相比均有显著性意义, 其同时出现的血清AST、ALT升高也说明了这一点[22-24]. 在使用葛根素血浆GST有下降趋势, 但无统计学意义, 表明葛根素可以减轻酒精所致大鼠肝细胞损伤.
急性酒精性肝炎的病理学特点是伴有肝细胞损伤的炎症性改变, 其机制为炎症因子释放,过氧化物打击, 内毒素的释放, Kupffer的侵润等, 炎症因子有PGE2, TNF, TGF及IL-6等, PGE2为COX-2的代谢产物, Bykov et al报道酒精性肝病PGE2及TNF升高, 而用COX-2抑制剂Celecoxib可以显著改善酒精性肝病的肝损害[16], 我们的结果表明模型组血清PGE2, TNF及IL-6与对照组比较有明显升高, 差别均有显著性意义; 葛根素组与模型组比较血清PGE2, TNF及IL-6明显下降, 差别均有显著性意义, 葛根素具有减少炎症介质PGE2, TNF及IL-6作用.
以上结果表明, 在酒精性肝损伤过程中, 早期的肝组织化学性炎症改变即可刺激其COX表达, 进而导至炎症介质PGE2, TNF及IL-6的释放. 而使用葛根素可以拮抗上述变化, 从而减轻酒精导致的肝组织损伤.
铂类配合物是临床上广泛应用的抗肿瘤药物, 其中最常用的有顺铂、卡铂、奥沙利铂. 这些药物均有一定的毒副作用, 抗肿瘤谱窄, 易产生耐药性; 而且, 分子量小, 仅能识别2-3个碱基, 特异性不高, 易损伤正常细胞的DNA. 另外, 他们与靶分子的结合作用弱, 与DNA单加合后, 会引起DNA结构的改变, 从而导致药效的降低. 因此, 研究与经典铂类配合物结构不同的非经典的配合物, 克服现有的铂类配合物的缺点, 增加疗效, 是目前研究的重点和热点.
李军祥, 教授, 北京中医药大学附属东方医院消化内科
目前研究铂类配合物的重点和热点是对现有的经典结构的改造, 如将单核的铂类配合物改为双核或多核, 增加特异性和疗效; 增加空间阻位, 防止耐药性的发生; 引入新的极性离子, 增加可溶性; 增加脂溶性, 来改变用药途径, 等等. 以此达到高效、低毒、水溶性好、选择性高、与顺铂无交叉耐药性、可口服的新型铂类.
国外已有报道FHIT基因过表达能增加胰腺癌细胞系对外源性凋亡诱导剂的敏感性. 体内实验结果显示FHIT基因的转导能阻止肿瘤的生长, 延长模型小鼠的生存时间, 抑制暴露致癌环境下小鼠体内肿瘤的产生.
CCP是我国学者自行合成的超分子铂类配合物, 已经申请专利. CCP是一种笼状结构, 以卡铂作为主体分子, 以柠檬酸作为客体分子, 即以柠檬酸的3个-COOH中的2个结合成分子内氢键, 生成超分子的CCP, 以第三个COOH增加分子的极性, 进而增加可溶性. 同时, 这种结构起到保护中心铂原子的作用. 整个分子将增加稳定性、溶解性、极性、特异性和增加对肿瘤的毒性. 本文是关于CCP的体外和动物体内的药效学研究.
CCP的研究已经得到国家科技部"863"创新药物重大专项资助. 本文是有关药效学研究的部分内容. 经研究已明确, CCP在动物体外和体内均有杀伤肿瘤细胞的作用, 疗效高于卡铂, 副作用小, 有望进入正式的临床实验.
1 超分子化学: 多个分子间以非共价键紧密结合形成的分子聚合体, 具有新的选择、识别、信息传递、能量转移等一系列特定功能和性质; 他包括诸如"主-客体化学"、"超分子器件"、"超分子开关"等一系列全新的科学概念.2 超分子药物: 是由主体药物分子和特别的客体分子在一定的条件下, 通过分子间的非共价键力, 组装成结构稳定的超分子, 他们改进了药物的稳定性和在人体内的运输机制.
本文研究具有科学性, 实验手段先进, 结果结论可信.
编辑: 李军亮 电编:吴鹏朕
| 1. | David AB. Sigmund S. pathogenesis of alcoholic hepatitis. J Gastroenterol Hepatol. 2004;19:S229-S235. [DOI] |
| 2. | Reuben A. Alcohol and the liver. Curr Opin Gastroenterol. 2007;23:283-291. [PubMed] [DOI] |
| 3. | Irie M, Suzuki N, Sohda T, Anan A, Iwata K, Takeyama Y, Watanabe H, Fischer P, Scherberich JE, Sakisaka S. Hepatic expression of gamma-glutamyltranspeptidase in the human liver of patients with alcoholic liver disease. Hepatol Res. 2007;37:966-973. [PubMed] [DOI] |
| 4. | Day CP. Treatment of alcoholic liver disease. Liver Transpl. 2007;13:S69-S75. [PubMed] [DOI] |
| 5. | Nagata K, Suzuki H, Sakaguchi S. Common pathogenic mechanism in development progression of liver injury caused by non-alcoholic or alcoholic steatohepatitis. J Toxicol Sci. 2007;32:453-468. [PubMed] [DOI] |
| 6. | Tome S, Lucey MR. Review article: current management of alcoholic liver disease. Aliment Pharmacol Ther. 2004;19:707-714. [PubMed] [DOI] |
| 7. | Zhang SY, Chen G, Wei PF, Huang XS, Dai Y, Shen YJ, Chen SL, Sun-Chi CA, Xu HX. The effect of puerarin on serum nitric oxide concentration and myocardial eNOS expression in rats with myocardial infarction. J Asian Nat Prod Res. 2008;10:373-381. [PubMed] [DOI] |
| 8. | Ding MP, Feng F, Hu HT. [Effects of puerarin on expression of nuclear factor kappaB after cerebral ischemia/reperfusion in rats]. Zhongguo Zhongyao Zazhi. 2007;32:2515-2518. [PubMed] |
| 9. | Tan Y, Liu M, Wu B. Puerarin for acute ischaemic stroke. Cochrane Database Syst Rev. 2008;CD004955. [PubMed] [DOI] |
| 10. | Liu R, Meng F, Bai H, Liu Y, Tang CW, Liu BW. [Inhibitory effect of quercetin, rutin and puerarin on LDL oxidation induced by Cu2+]. Zhongguo Zhongyao Zazhi. 2007;32:2058-2062. [PubMed] |
| 11. | Hwang YP, Choi CY, Chung YC, Jeon SS, Jeong HG. Protective effects of puerarin on carbon tetrachloride-induced hepatotoxicity. Arch Pharm Res. 2007;30:1309-1317. [PubMed] [DOI] |
| 12. | Singh AK, Jiang Y, Benlhabib E, Gupta S. Herbal mixtures consisting of puerarin and either polyenylphosphatidylcholine or curcumin provide comprehensive protection against alcohol-related disorders in P rats receiving free choice water and 15% ethanol in pure water. J Med Food. 2007;10:526-542. [PubMed] [DOI] |
| 13. | Samaka RM, Abdou AG, Abd El-Wahed MM, Kandil MA, El-Kady NM. Cyclooxygenase-2 expression in chronic gastritis and gastric carcinoma, correlation with prognostic parameters. J Egypt Natl Canc Inst. 2006;18:363-374. [PubMed] |
| 14. | Harada N, Okajima K, Uchiba M, Kushimoto S, Isobe H. Antithrombin reduces ischemia/reperfusion-induced liver injury in rats by activation of cyclooxygenase-1. Thromb Haemost. 2004;92:550-558. [PubMed] |
| 15. | Warford-Woolgar L, Peng CY, Shuhyta J, Wakefield A, Sankaran D, Ogborn M, Aukema HM. Selectivity of cyclooxygenase isoform activity and prostanoid production in normal and diseased Han:SPRD-cy rat kidneys. Am J Physiol Renal Physiol. 2006;290:F897-F904. [PubMed] [DOI] |
| 16. | Bykov IL, Palmen M, Rainsford KD, Lindros KO. Chronic effects of celecoxib, a cyclooxygenase-2 inhibitor, cause enhanced alcohol-induced liver steatosis in rats. Inflammopharmacology. 2006;14:36-41. [PubMed] [DOI] |
| 17. | Nanji AA, Jokelainen K, Lau GK, Rahemtulla A, Tipoe GL, Polavarapu R, Lalani EN. Arginine reverses ethanol-induced inflammatory and fibrotic changes in liver despite continued ethanol administration. J Pharmacol Exp Ther. 2001;299:832-839. [PubMed] |
| 18. | Senthilkumar R, Nalini N. Effect of glycine on tissue fatty acid composition in an experimental model of alcohol-induced hepatotoxicity. Clin Exp Pharmacol Physiol. 2004;31:456-461. [PubMed] [DOI] |
| 19. | Saravanan N, Nalini N. Antioxidant effect of Hemidesmus indicus on ethanol-induced hepatotoxicity in rats. J Med Food. 2007;10:675-682. [PubMed] [DOI] |
| 20. | Tipoe GL, Liong EC, Casey CA, Donohue TM Jr, Eagon PK, So H, Leung TM, Fogt F, Nanji AA. A voluntary oral ethanol- feeding rat model associated with necroinflammatory liver injury. Alcohol Clin Exp Res. 2008;32:669-682. [PubMed] [DOI] |
| 21. | Irie M, Suzuki N, Sohda T, Anan A, Iwata K, Takeyama Y, Watanabe H, Fischer P, Scherberich JE, Sakisaka S. Hepatic expression of gamma-glutamyltranspeptidase in the human liver of patients with alcoholic liver disease. Hepatol Res. 2007;37:966-973. [PubMed] [DOI] |
| 22. | Izu H, Shobayashi M, Manabe Y, Goto K, Iefuji H. Sake yeast suppresses acute alcohol-induced liver injury in mice. Biosci Biotechnol Biochem. 2006;70:2488-2493. [PubMed] [DOI] |
| 23. | Cui JW, Hu YY, Fang ZH, Wang XN, Cheng Y, Jing-Hua P, Feng Q, Hui Z. Intervention effects of Jianpi Liqi Huoxue Decoction on lipid peroxidative liver injury induced by alcohol. Chin J Integr Med. 2006;12:281-286. [PubMed] [DOI] |
| 24. | Pari L, Karthikesan K. Protective role of caffeic acid against alcohol-induced biochemical changes in rats. Fundam Clin Pharmacol. 2007;21:355-361. [PubMed] [DOI] |