修回日期: 2009-01-12
接受日期: 2009-01-19
在线出版日期: 2009-02-18
目的: 研究体外c-myc反义寡核苷酸(ASODN)对人结肠癌HT-29细胞增殖、凋亡及化疗敏感性的影响.
方法: 利用脂质体LipofectamineTM2000介导将c-myc ASODN转染入大肠癌HT-29细胞中, 逆转录多聚酶链反应(RT-PCR)、Western blot方法检测c-myc基因mRNA及蛋白的表达, MTT、流式细胞仪(FCM)检测c-myc ASODN对人结肠癌HT-29细胞增殖抑制及其对奥沙利铂敏感性影响.
结果: 转染c-myc ASODN后, HT-29细胞内c-myc mRNA水平显著降低(0.464±0.029 vs 0.974±0.027, 0.945±0.012, 均P<0.01). 在HT-29细胞中存在分子质量62 kDa的特异性条带, 与c-myc分子质量相符, ASODN组在PVDF膜上的特异性条带明显弱于对照组; MTT结果显示转染c-myc ASODN 48 h后的HT-29细胞的增殖速度较对照组细胞明显减慢. FCM显示c-myc ASODN转染后72 h后, 奥沙利铂+c-myc ASODN组细胞凋亡率显著高于对照组(P<0.05).
结论: 体外c-myc ASODN可抑制c-myc mRNA及蛋白的表达, 阻断c-myc可抑制HT-29细胞增殖并增强其对奥沙利铂的敏感性, 可能为大肠癌的基因治疗提供新的靶点.
引文著录: 邵国利, 吴爱国, 焦得闯, 纪术峰. c-myc反义寡核苷酸对结肠癌HT-29细胞增殖、凋亡及化疗敏感性的影响. 世界华人消化杂志 2009; 17(5): 459-463
Revised: January 12, 2009
Accepted: January 19, 2009
Published online: February 18, 2009
AIM: To investigate the effects of c-myc antisense oligodeoxynucleotides (ASODN) on the proliferation, apoptosis and chemosensitivity to human colorectal cancer cell line HT-29 in vitro.
METHODS: c-myc ASODN and scrambled oligodeoxynueleotide (SODN) were transfected with lipofectamineTM 2000 into human colorectal cancer cell line HT-29. The expression of c-myc mRNA and protein in human colorectal cancer cell line HT-29 was detected by semi quantitive reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively. The effects of the c-myc ASODN on the proliferation and sensitivity to oxaliplatin of HT-29 cell line were studied by MTT assay and flow cytometry (FCM).
RESULTS: The expression of c-myc mRNA level in HT-29 was down-regulated remarkably between the antisense group and control group (0.464 ± 0.029 vs 0.974 ± 0.027, 0.945 ± 0.012, both P < 0.01). Protein expression of c-myc in HT-29 cells was confirmed and it was clear that specific band on PVDF membrane in ASODN group was significantly weakened than those in control groups; MTT and FCM showed the proliferation of HT-29 transfected with c-myc ASODN was retarded obviously in contrast to control groups after 48 hours' transfection (P < 0.05). Compared with the control groups after 72 hours' transfection, the percentage of the survival cells significantly decreased in the presence of both oxaliplatin and c-myc ASODNs (P < 0.05).
CONCLUSION: The c-myc ASODN can inhibit c-myc expression and inhibit the proliferation of colonic cancer HT-29 cells. Combination of c-myc ASODN and oxaliplatin might improve the treatment outcome of colorectal carcinoma. c-myc may be a potential target of gene therapy for human colorectal cancer.
- Citation: Shao GL, Wu AG, Jiao DC, Ji SF. Effect of c-myc antisense oligodeoxynucleotides on proliferation, apoptosis and chemosensitivity of colorectal cancer cell line HT-29. Shijie Huaren Xiaohua Zazhi 2009; 17(5): 459-463
- URL: https://www.wjgnet.com/1009-3079/full/v17/i5/459.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i5.459
大肠癌是最常见的恶性肿瘤之一, 在我国的发病率以4.2%的平均速度递增[1]. 目前的治疗方法以手术切除为主, 辅以化疗等综合治疗, 但化疗最大的障碍是肿瘤细胞的多耐药性, 使得化疗效果明显低于其他肿瘤[2]. 近年来经细胞凋亡机制的研究证实, 抗细胞凋亡因子在肿瘤细胞的生长及耐药性产生中起着重要作用[3]. c-myc的表达活性与细胞生长、分裂速度密切相关, 而且也是细胞凋亡的潜在诱导因子[4]. 反义寡核苷酸(antisense oligonucleartides, ASODN)技术, 是用一段人工合成的能与RNA或DNA互补结合的寡核苷酸链抑制基因的表达, 国内外已经有利用c-myc ASODN对大肠癌[5-8]、乳腺癌等的相关研究, 且反义寡核苷酸有增强化疗敏感性的作用[9-10], 本研究利用脂质体介导法将c-myc ASODN转染人结肠癌HT-29细胞系, 观察其对c-myc mRNA、蛋白以及细胞增殖和凋亡的影响, 并将ASODN与奥沙利铂等化疗药物同时应用于大肠癌细胞, 实现抑制大肠癌细胞增殖和扩散, 促进其凋亡的目的. 因此, 反义寡核苷酸抑制增殖及对化疗的增敏是肿瘤治疗研究的重要课题.
人大肠癌HT-29细胞株由广东省人民医院细胞室惠赠; RPMI 1640购自Gibico公司. RT-PCR试剂盒l购自晶美生物工程有限公司; 小鼠抗人mAb及羊抗小鼠IgG为Santa Cruz公司产品; LipofectamineTM2000购自Invitrogen公司; Annexin V-FITC/PI细胞凋亡检测试剂盒购自Biovision公司; 利用Primer3在线引物设计软件设计引物, 上游引物5'-ATCAAGCGCTTCGAGCAGAA-3', 下游引物5'-TGGTCGGTCTTTCAGGTCAAT-3'; 针对c-myc基因第2、3外显子序列, 设计反义、正义、错配寡核苷酸链. 反义链序列为: 5'-AACGTTGAGGGGCAT-3', 正义链序列为: 5'-ATGCCCCTCAACGTT-3'; 错配链序列为5'-TACGGGGTTGAGCAA-3'; 两端经硫代修饰. 引物合成、DNA测序及c-myc ASODN的合成均由上海生工完成.
1.2.1 细胞培养、脂质体转染及实验分组: HT-29细胞在37℃, 50 mL/L CO2, 含100 mL/L胎牛血清的RPMI 1640培养基中(含青霉素和链霉素浓度均为1×105 U/L)培养, 所有实验均取对数生长期细胞, 用无血清培养基洗涤细胞3次, 按LipofectamineTM2000说明书进行转染. c-myc ASODN转染浓度设定: 400、800、1200 nmol/L, 转染时间24、48、72、96 h, 对照组错配寡核苷酸终浓度为800 nmol/L.
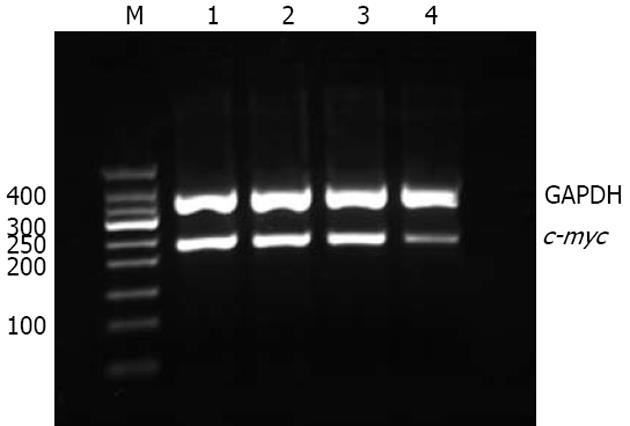
1.2.2 RT-PCR检测c-myc mRNA表达: 按TRIzol试剂说明书步骤提取总RNA, 检测RNA质量及测浓度后, 按照逆转录试剂盒说明合成cDNA, 取2 mg逆转录产物进行PCR扩增. 反应条件为: 94℃变性3 min; 94℃ 30 s, 60.6℃ 30 s, 72℃ 30 s, 36个循环; 72℃延伸3 min. 以GAPDH做内参照, 扩增产物以20 g/L琼脂糖凝胶电泳观察拍照, 凝胶图像分析系统扫描各电泳条带的灰度值, 以c-myc/GAPDH的比值代表c-myc mRNA的半定量水平.
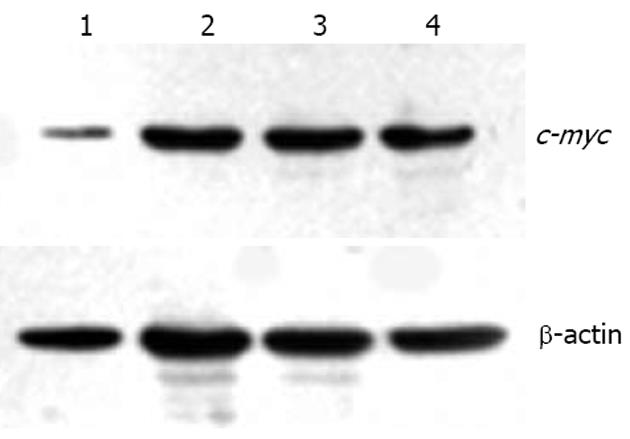
1.2.3 Western blot检测c-myc蛋白的表达: 将各对照组、实验组细胞培养48、72 h后, 收集6×106个细胞, PBS漂洗3次后按文献[8]的方法提取总蛋白进行检测: Bradford法测定蛋白浓度, 常规SDS电泳、封闭、加入抗体、漂洗、发光、X线暗室曝光、显影定影. 以BioRad图像分析系统进行图像分析, 用蛋白条带的平均光强度值表示c-myc蛋白表达的相对强度.
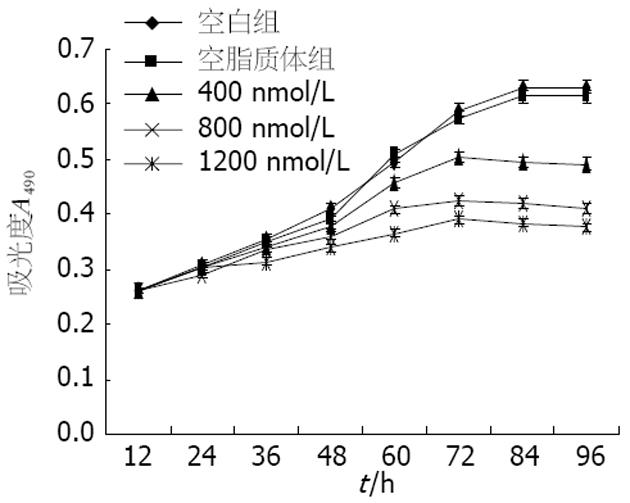
1.2.4 MTT法检测人结肠癌细胞系HT-29增殖抑制率: 采用96孔板, 细胞经2.5 g/L的胰酶消化后每孔植入1×104个细胞, 培养24 h, 转染结束后继续培养24、48、72、96 h后终止培养, 终止反应时加入1 g/L MTT 20 mL, 继续培养4 h终止, 弃去培养液, 每孔加入150 mL DMSO, 震荡10 min. 在酶联免疫检测仪(波长490 nm)上测定各孔吸光值(A). 按公式抑制率(%) = (1-A实验/A对照)×100%计算细胞生长抑制率, 以时间为横轴, 吸光度为纵轴绘制生长抑制曲线.
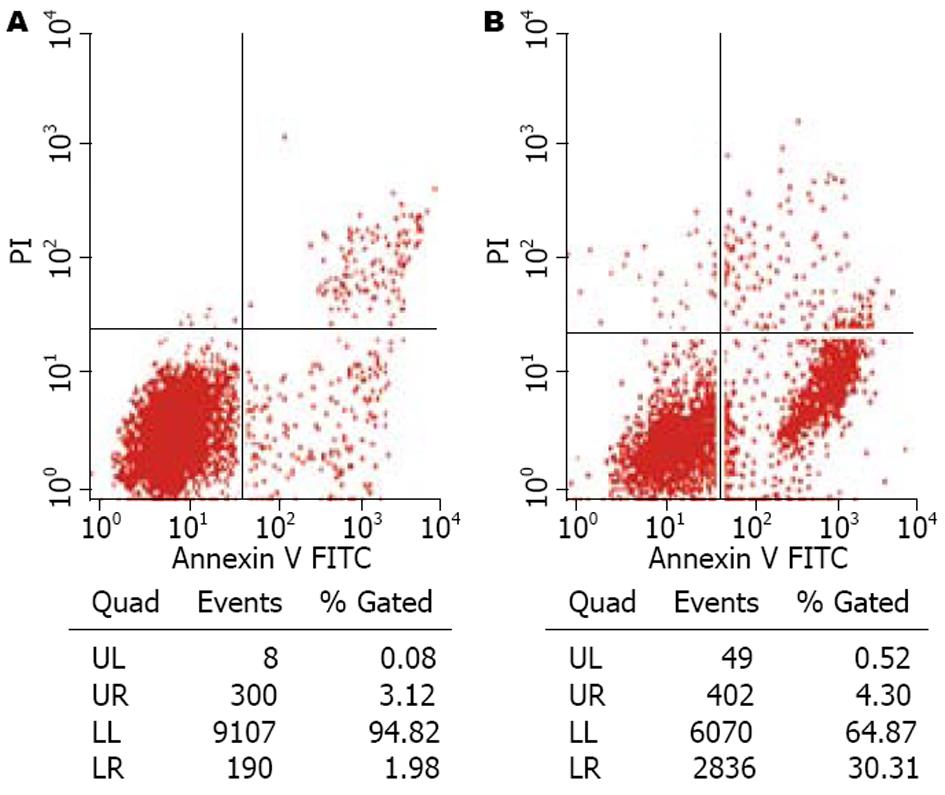
1.2.5 Annexin V-FITC/PI双染色法流式细胞仪(FCM)测定转染细胞凋亡: HT-29细胞经1200 nmol/L c-myc ASODN作用后, 用2.5 g/L胰酶消化收集各组细胞, 冷PBS洗涤2次, 1×Annexin V缓冲液悬浮细胞, 调整细胞浓度为1×109/L, 取100 mL细胞悬液加入5 mL Annexin V-FITC和5 mL PI, 混匀, 于暗处室温孵育15 min. 每管加入400 mL 1×Annexin V缓冲液, 过滤后在1 h内进行流式细胞仪检测. 实验重复5次[6].
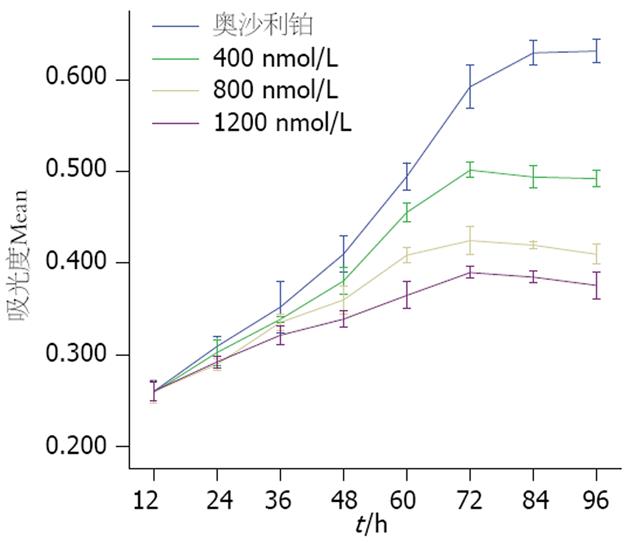
1.2.6 c-myc反义寡核苷酸对大肠癌细胞化疗敏感性的影响: 取HT-29细胞株接种于24孔培养板上, 每孔接种5×104细胞. 设组: 奥沙利铂组、奥沙利铂+低浓度ASODN组及奥沙利铂+高浓度ASODN组. 每组设3个平行组, 贴壁生长至50%-60%亚混合状态时, 分别加入浓度为400、800、1200 nmol/L ASODN, 24 h后弃上清液, 加入奥沙利铂与培养液配成的以血浆峰浓度(PPC)的1/10 PPC为终浓度的化疗药物作用体系[12], 再培养24 h, (奥沙利铂的血浆峰浓度是10 mg/L). 温育24 h, 加入10 μL MTT(5 g/L), 4 h后小心移出上清液, 加入二甲亚砜100 μL, 震荡溶解, 490 nm测A值, 算生长抑制率.
统计学处理 所有数据均用mean±SD表示, 精确到两位小数, 采用SPSS13.0软件进行单因素方差分析, P<0.05为差异有显著性.
脂质体对照组、SODN组和ASODN组成功扩增出相应目的基因的PCR产物, 条带与Marker比较证实扩增的目的片段大小完全吻合. 电泳条带经凝胶电泳图像扫描仪扫描, 测各条带的灰度值, 经同一标本的GAPDH条带的灰度值校正后进行比较. ADODN组(0.464±0.029)对HT-29细胞c-myc mRNA的表达有明显的抑制作用, 与脂质体对照组(0.974±0.027)和SODN组(0.945±0.012)比较有统计学意义(P<0.01). 脂质体对照组与SODN组之间无显著差异(P>0.05, 图1).
Western blot显示转染反义c-myc ASODN后蛋白质表达水平也比未转染组、正义组、错配组显著下降, 相对吸光度值显示下降了57%, 而正义组、错配组在蛋白表达水平与未转染组差异均无统计学意义(图2).
MTT法测定结果显示, 转染c-myc ASODN组HT-29细胞增殖速度明显减慢, 与对照组比较差异有统计学意义, 转染空白脂质体组与未转染组相比差异无统计学意义. 结果证明c-myc表达水平的下降可以导致细胞增殖速度明显减慢(图3).
HT-29细胞经c-myc ASODN处理后, 凋亡率为30.31%, 与未转染对照组相比差异有统计学意义(P<0.05, 图4).
奥沙利铂+c-myc反义核酸对HT-29大肠癌细胞具有明显的抑制作用, 抑制率高达43%, ASODN高浓度组明显高于单独奥沙利铂组和奥沙利铂+低浓度ASODN组, 差异有统计学意义(P<0.05, 图5).
c-myc基因是myc基因家族的成员之一, 属核内转录因子, 定位于人类第8号染色体q24.1, c-myc基因主要通过扩增和染色体易位重排的方式激活, 与某些组织肿瘤的发生、发展和演变转归有重要关系. 刘庭波 et al[11]研究证实c-myc基因不但参与细胞的增殖分化和凋亡过程, 而且与肿瘤的形成和演进有关. c-myc基因可刺激细胞增生, 并且与突变型P53一起在肿瘤发生中协同发挥作用[12]. c-myc癌基因属核蛋白基因, 具有转化细胞的能力, 并具有与染色体DNA结合的特性, 在调节细胞生长、分化及恶性转化中发挥作用[13]. 在不同的人体肿瘤细胞系中已发现c-myc扩增, 在人结肠癌细胞系中也观察到c-myc基因的扩增, 近年来经细胞凋亡机制的研究证实, 抗细胞凋亡因子在肿瘤细胞的生长及耐药性产生中起着重要作用[3]. c-myc也是细胞凋亡的潜在诱导因子, 与肿瘤耐药的形成有密切关系. 国内外已经有利用c-myc ASODN对心血管疾病、大肠癌[6,14]、乳腺癌、骨肉瘤、卵巢癌、肝癌、肺癌、肾癌等的相关研究, 但是对结直肠癌的相关研究还比较少. 王桂龙 et al[15]研究表明, 反义c-myc寡核苷酸可抑制骨肉瘤MG-63细胞的增殖, 并能促进细胞的凋亡. 于如同 et al[16]研究发现, c-myc反义寡核苷酸可明显抑制鼠脑胶质瘤的生长, 并能下调VEGF, 使肿瘤血管生成减少或停滞, 肿瘤细胞凋亡, 这可能是c-myc ASODN抑制肿瘤生长的机制之一.
本研究应用反义核酸技术, 成功设计并合成c-myc反义寡核苷酸序列, 采用脂质体介导将c-myc ASODN转染HT-29细胞, 用于探讨c-myc ASODN用于治疗大肠癌的可能性, 同时为进一步研究c-myc在大肠癌中的作用奠定了实验基础. 结果显示c-myc ASODN能明显下调c-myc mRNA及蛋白的表达水平, 这可能与以下原因有关: (1)抑制基因转录、加工、RNA的翻译; (2)诱导RNA酶H介导的RNA降解作用, 这可能是反义抑制作用的最主要的机制, 与Russo et al[5]得出的结论相符. 同时将c-myc ASODN转染入HT-29细胞后, 抑制人结肠癌HT-29细胞的增殖并诱导细胞凋亡.
目前对反义核酸技术的研究已进入一个新的高潮, 反义核酸技术是癌症治疗的生物学工具, 利用反义寡核苷酸抑制异常表达的靶基因可以有效抑制癌细胞的增殖[19]. 反义治疗的优点[17]: (1)靶点明确; (2)可用于治疗传统药物不能治愈的基因疾病; (3)反义治疗更为安全有效, 不良反应少; (4)费用低廉. 能灵活地联合多种化学修饰, 调节药学性质, 而不影响疾病相关基因的相互作用, 可以针对一些新靶点分子设计一点反义寡核苷酸来观察其抗肿瘤生长及转移的作用, 还可以将其与化疗药物联合应用, 研究去增效减毒的作用, 将ASODN与5-FU、奥沙利铂等化疗药物同时应用于大肠癌细胞, 这就使两种抗肿瘤机制有机结合, 实现抑制大肠癌细胞增殖和扩散, 促进其凋亡的目的, 孙迎春 et al[9]的研究表明c-myc ASODN可通过下调卵巢癌c-myc的表达, 逆转卵巢癌对DDP耐药, 提高其对DDP的敏感性. Nita et al[10]应用针对Bcl-xL的ASODN能提高结肠癌对5-FU化疗的敏感性. 本研究将ASODN和化疗药物有机结合, 研究发现转染c-myc ASODN后, c-myc mRNA表达显著降低, 相对积分吸光度值显示下降了50.4%, 且c-myc ASODN能够提高结直肠癌对奥沙利铂化疗的敏感性, 对细胞的抑制率高达53%. 反义治疗因其具有高特异性, 在肿瘤治疗学研究中颇受重视, 经不断改进和完善, 己逐步进入临床, 并将显示出辉煌的应用前景[18].
c-myc基因是myc基因家族的成员之一, 主要通过扩增和染色体易位重排的方式激活, 具有转化细胞的能力, 在调节细胞生长、分化及恶性转化中发挥作用, c-myc也是细胞凋亡的潜在诱导因子, 与肿瘤耐药的形成有密切关系.
周士胜, 教授, 大连大学医学院医学研究中心
目前肿瘤基因治疗的研究热点主要是有效靶基因的选择、如何提高药物的靶向性、载体的选择和制备等几个方面.
Pastorino et al研究表明, 将c-myc反义寡核苷酸转染到恶性黑素瘤细胞内, 可特异性地抑制c-myc的表达, 抑制肿瘤细胞的生长, 促进肿瘤细胞的凋亡.
本文将c-myc ASODN利用脂质体转染到HT-29细胞中, 探讨c-myc ASODN对HT-29细胞增、凋亡的影响, 并将反义核酸技术和化疗有机结合在一起, 使化疗药物更充分发挥其抗癌作用.
本文主题明确, 思路清晰, 方法可靠, 但创新性略有不足.
编辑: 李军亮 电编:吴鹏朕
| 2. | 李 啸峰, 迟 宝荣, 马 琳. 大肠癌多药耐药研究进展. 吉林大学学报(医学版). 2003;29:700-702. |
| 3. | Notarbartolo M, Cervello M, Dusonchet L, Cusimano A, D'Alessandro N. Resistance to diverse apoptotic triggers in multidrug resistant HL60 cells and its possible relationship to the expression of P-glycoprotein, Fas and of the novel anti-apoptosis factors IAP (inhibitory of apoptosis proteins). Cancer Lett. 2002;180:91-101. [PubMed] [DOI] |
| 4. | Eskelinen MJ, Haglund UH. Prognosis of human pancreatic adenocarcinoma: review of clinical and histopathological variables and possible uses of new molecular methods. Eur J Surg. 1999;165:292-306. [PubMed] [DOI] |
| 5. | Russo P, Arzani D, Trombino S, Falugi C. c-myc down-regulation induces apoptosis in human cancer cell lines exposed to RPR-115135 (C31H29NO4), a non-peptidomimetic farnesyltransferase inhibitor. J Pharmacol Exp Ther. 2003;304:37-47. [PubMed] [DOI] |
| 6. | Zheng JG, Tan TZ. Antisense imaging of colon cancer-bearing nude mice with liposome-entrapped 99m-technetium-labeled antisense oligonucleotides of c-myc mRNA. World J Gastroenterol. 2004;10:2563-2566. [PubMed] |
| 7. | Devi GR, Beer TM, Corless CL, Arora V, Weller DL, Iversen PL. In vivo bioavailability and pharmacokinetics of a c-MYC antisense phosphorodiamidate morpholino oligomer, AVI-4126, in solid tumors. Clin Cancer Res. 2005;11:3930-3938. [PubMed] [DOI] |
| 8. | Ruffels J, Griffin M, Dickenson JM. Activation of ERK1/2, JNK and PKB by hydrogen peroxide in human SH-SY5Y neuroblastoma cells: role of ERK1/2 in H2O2-induced cell death. Eur J Pharmacol. 2004;483:163-173. [PubMed] [DOI] |
| 9. | 孙 迎春, 张 晓慧, 张 爱荣, 陈 官萍, 付 建武. c-myc反义寡核苷酸对卵巢癌细胞COC1/DDP顺铂耐药的逆转作用. 中国肿瘤生物治疗杂志. 2007;14:269-274. |
| 10. | Nita ME, Ono-Nita SK, Tsuno N, Tominaga O, Takenoue T, Sunami E, Kitayama J, Nakamura Y, Nagawa H. Bcl-X(L) antisense sensitizes human colon cancer cell line to 5-fluorouracil. Jpn J Cancer Res. 2000;91:825-832. [PubMed] |
| 12. | Jiang XH, Wong BC, Yuen ST, Jiang SH, Cho CH, Lai KC, Lin MC, Kung HF, Lam SK. Arsenic trioxide induces apoptosis in human gastric cancer cells through up-regulation of p53 and activation of caspase-3. Int J Cancer. 2001;91:173-179. [PubMed] [DOI] |
| 13. | Chana JS, Grover R, Tulley P, Lohrer H, Sanders R, Grobbelaar AO, Wilson GD. The c-myc oncogene: use of a biological prognostic marker as a potential target for gene therapy in melanoma. Br J Plast Surg. 2002;55:623-627. [PubMed] [DOI] |
| 14. | Nieminen AI, Partanen JI, Hau A, Klefstrom J. c-Myc primed mitochondria determine cellular sensitivity to TRAIL-induced apoptosis. EMBO J. 2007;26:1055-1067. [PubMed] [DOI] |
| 19. | Abaza MS, Al-Attiyah RJ, Al-Saffar AM, Al-Sawan SM, Moussa NM. Antisense oligodeoxynucleotide directed against c-myb has anticancer activity and potentiates the antiproliferative effect of conventional anticancer drugs acting by different mechanisms in human colorectal cancer cells. Tumour Biol. 2003;24:241-257. [PubMed] [DOI] |