修回日期: 2009-08-26
接受日期: 2009-10-12
在线出版日期: 2009-11-08
目的: 通过短期小剂量双氯酚酸口服制备大鼠NSAID相关小肠损伤模型, 探讨不同药物干预对大鼠NSAID相关小肠损伤的影响.
方法: 48只♂SD大鼠随机分为空白组、实验对照组、药物干预组, 其中药物干预组又分为替普瑞酮组、埃索美拉唑组、吉法酯组及甲硝唑组, 每组8只. 采用双氯芬酸0.78 mg/(kg•d), 共5 d灌胃制备大鼠小肠损伤模型; 替普瑞酮、埃索美拉唑、吉法酯、甲硝唑组分别以15.63、4.17、31.25、156.25 mg/(kg•d), 于造模前1 d起灌胃, 每天1次, 共6 d. 实验期间大鼠正常饮食饮水. 5 d后处死所有大鼠, 观察小肠黏膜的大体及组织学损伤情况.
结果: 实验对照组大鼠大体评分及组织学评分均较空白组明显升高(4.38±1.41, 4.00±1.85 vs 0, 均P<0.05); 与实验对照组比较, 替普瑞酮、埃索美拉唑、吉法酯、甲硝唑组大体评分均明显降低(2.38±1.69、2.00±2.27、1.13±1.36、2.00±1.60 vs 4.38±1.41, 均P<0.05), 组织学评分除替普瑞酮组外, 其余各组均有显著下降(2.25±1.39、1.88±1.25、1.75±0.71、2.00±1.07 vs 4.00±1.85, 均P<0.05); 各药物干预组间比较, 差异无统计学意义(均P>0.05).
结论: 短期小剂量双氯芬酸口服即可致小肠黏膜损伤, 替普瑞酮、埃索美拉唑、吉法酯、甲硝唑对大鼠NSAID相关小肠损伤具有保护作用, 可有效减轻大鼠小肠损伤.
引文著录: 方莉, 吕宾, 孟立娜, 张烁, 吴炜烽. 不同药物干预防治大鼠NSAID相关小肠损伤的观察. 世界华人消化杂志 2009; 17(31): 3244-3248
Revised: August 26, 2009
Accepted: October 12, 2009
Published online: November 8, 2009
AIM: To compare the preventive effects of different drugs on diclofenac sodium-induced intestinal injury in rats.
METHODS: Forty-eight male Sprague-Dawley rats were randomly and equally divided into six groups: normal control group, receiving distilled water 1 mL/(100 g•d) for 5 d; model control group, receiving diclofenac sodium 7.8 mg/(kg•d) for 5 d; and five treatment groups, receiving teprenone 15.63 mg/(kg•d), esomeprazole 4.17 mg/(kg•d), gefarnate 31.25 mg/(kg•d) and metronidazole 156.25 mg/(kg•d) for six days, respectively, beginning from the day before dclofenac sodium was given as the model control group. Intestinal mucosal samples were taken 24 h after the last drug administration to observe and compare morphological and histological changes.
RESULTS: Compared with the normal control group, the morphological and histological scores increased significantly in the model control group (4.38 ± 1.41 and 4.00 ± 1.85 vs 0, respectively; both P < 0.05). The morphological scores were much lower in all treatment groups than in the model control group (2.38 ± 1.69, 2.00 ± 2.27, 1.13 ± 1.36 and 2.00 ± 1.60 vs 4.38 ± 1.41, respectively; all P < 0.05). The histological scores were also significantly lower in the esomeprazole treatment group, gefarnate treatment group and metronidazole treatment group than in the model control group (1.88 ± 1.25, 1.75 ± 0.71 and 2.00 ± 1.07 vs 4.00 ± 1.85, respectively; all P < 0.05). There was no significant differences in the morphological and histological scores among each treatment group (all P > 0.05).
CONCLUSION: Teprenone, esomeprazole, gefarnate and metronidazole can exert protective effects on intestinal injury induced by non-steroidal anti-inflammatory drugs in rats.
- Citation: Fang L, Lv B, Meng LN, Zhang S, Wu WF. Preventive effects of different drugs on intestinal damage induced by non-steroidal anti-inflammatory drugs in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(31): 3244-3248
- URL: https://www.wjgnet.com/1009-3079/full/v17/i31/3244.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i31.3244
非甾体类抗炎药(non-steroidal anti-inflammatory drug, NSAID)通过抑制环氧合酶(cyclooxygenase, COX)减少前列腺素(prostaglandins, PGs)合成而起到解热、镇痛、抗炎、抗风湿和抗血小板聚集等作用, 其临床疗效得到公认. 目前NSAID是处方药和非处方药中用量最大的药物之一, 广泛用于内、外、妇、儿科疾病[1]. 然而, NSAID广泛应用的同时, 其不良反应报道日益增多, 涉及多个系统和器官. 据美国FDA资料显示, NSAID所致不良事件约占药物不良反应的1/3[2], 其中对胃肠损害的研究与报道最多. 虽然NSAID胃肠不良事件相当普遍, 其临床价值仍无可替代, 积极寻找防治NSAID相关胃肠损伤的理想药物仍是当前研究的重点. 本研究选择了消化系不同类药物替普瑞酮、埃索美拉唑、吉法酯、甲硝唑, 观察其对大鼠NSAID相关小肠损伤是否具有预防保护作用, 以期为临床防治工作提供实验依据.
健康♂SPF级SD大鼠48只, 8-9周龄, 体质量220-260 g(浙江中医药大学动物实验中心提供). 双氯芬酸缓释片(北京诺华制药有限公司), 国药准字H10980297; 替普瑞酮(日本卫材株式会社制造), 国药准字号J20030052; 埃索美拉唑(阿斯利康制药有限公司), 国药准字H20046379; 吉法酯(日本生晃荣养药品株式会社), 进口药品注册证号H20040173; 甲硝唑片(浙江医药股份有限公司新昌制药厂), 国药准字H33020249.
1.2.1 分组: 48只♂SD大鼠采用随机抽签法随机分成6组, 分别为空白组、实验对照组、替普瑞酮组、埃索美拉唑组、吉法酯组、甲硝唑组, 每组8只.
1.2.2 模型制备: 参照文献[3]及预实验结果, 设定双氯芬酸造模剂量为7.8 mg/(kg·d). 将双氯芬酸溶于生理盐水中, 配置成浓度为0.78 g/L双氯酚酸溶液. 造模前1 d, 施维舒组、耐信组、惠加强组、甲硝唑组分别予15.63、4.17、31.25、156.25 mg/(kg·d)(人类日常规口服剂量折算而成)灌胃1次. 造模当日起, 空白组予1 mL/100 g体质量生理盐水灌胃1次, 共5 d; 实验对照组予7.8 mg/kg双氯芬酸溶液灌胃1次, 共5 d; 各药物干预组于各药物相应剂量灌胃1 h后再予造模剂量双氯芬酸灌胃1次, 共5 d. 造模期间大鼠正常饮食饮水.
1.2.3 标本处理: 末次给药24 h后, 以3%戊巴比妥钠0.15 mL/100 mg腹腔注射麻醉处死所有大鼠, 打开腹腔, 观察腹腔情况, 分离肠系膜, 距回盲部40 cm近侧端取空肠1 cm, 用冰生理盐水冲洗干净后, 将标本肠黏膜层向上平铺于硬纸板上, 大头针固定, 置于40 g/L甲醛液中固定, 常规石蜡包埋切片, 苏木精-伊红(HE)染色, 镜下观察并进行组织学损伤评分. 将剩余小肠肠腔剪开, 放大镜观察全小肠大体损伤情况.
1.2.4 肠黏膜损伤评分: 肠黏膜损伤大体形态评分按下列标准进行[4]: 0分: 无损伤; 1分: 局部充血、水肿但未出现溃疡; 2分: 有溃疡, 但不伴黏膜明显充血水肿等炎性表现; 3分: 有溃疡, 且伴一处黏膜炎症; 4 分: 有多处溃疡和炎症, 溃疡<1 cm; 5分: 有多处溃疡和炎症, 且至少一处溃疡>1 cm.
1.2.5 肠黏膜组织学损伤评分: 光镜下观察病理变化, 按Chiu et al[5]氏法分6级: 0分: 肠黏膜绒毛正常; 1分: 绒毛顶端上皮下出现囊状间隙, 并伴有毛细血管充血; 2分: 上皮下间隙扩大, 中度固有层水肿, 中央乳糜管扩张; 3分: 固有层明显水肿, 肠黏膜上皮层细胞变性、坏死, 少数绒毛顶端脱落; 4分: 上皮细胞层变性坏死、脱落, 部分绒毛脱落、固有层裸露, 毛细血管扩张、充血; 5分: 绒毛脱落, 固有层崩解, 出血或溃疡形成. 每个样本随机计数20个视野, 对每个视野按标准进行单独评分, 取20个视野最后平均数为最终病理评分.
统计学处理 实验结果均采用mean±SD表示, 运用SPSS10.0统计软件包分析. 两组间比较采用秩和检验, 统计量采用Mann-Whitney U检验, 以P<0.05为差异有统计学意义.
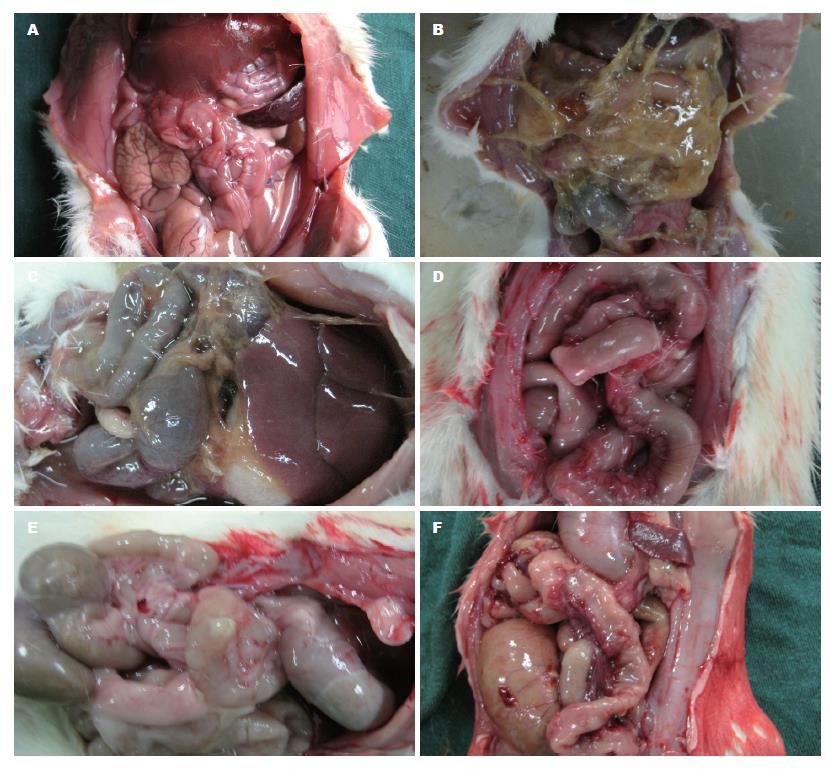
造模第1天大鼠食欲良好, 大便成形; 造模第3天开始实验对照组大鼠有摄食减少, 懒动拱背, 毛发枯黄, 缺乏光泽, 大便减少, 部分大鼠消瘦, 腹壁毛发湿透, 有腹水形成; 造模第4天实验对照组大鼠死亡2只, 解剖发现死亡大鼠腹腔恶臭, 小肠肠管有明显扩张及出血. 造模第5天实验对照组大鼠濒死3只, 施维舒组大鼠死亡1只, 解剖发现均有腹腔肠道出血穿孔, 中到大量恶臭腹水, 部分覆黄色脓稠苔.
空白组大鼠无肉眼可见损伤. 实验对照组存活3只大鼠均有小肠黏膜充血红斑, 可见黏膜局部结节样增厚及溃疡形成, 部分肠管发生出血、坏死; 5只死亡大鼠均有肠粘连, 有肠管扩张及肠腔狭窄, 小肠壁多发溃疡灶, 圆形或椭圆形, 沿肠管纵轴分布, 边缘黏膜水肿, 其中1只大鼠发生小肠节段性出血坏死, 1只大鼠并发肠穿孔; 部分小肠内见黑便积聚. 各药物干预组小肠黏膜损伤程度轻重不一, 多表现为黏膜局部充血水肿, 部分出现肠壁散发溃疡及肠壁局部结节样增厚. 比较各组大鼠小肠黏膜大体损伤情况, 死亡大鼠按最高级别评分. 实验对照组明显高于空白组(P<0.05), 差异有统计学意义. 各药物干预组小肠损伤则较实验对照组明显减轻(均P<0.05), 差异有统计学意义(表1, 图1).
肠黏膜HE切片示: 空白组小肠黏膜组织形态正常, 绒毛完整无脱落. 实验对照组小肠黏膜组织结构异常, 绒毛中心分离坏死、脱落, 固有层崩解, 出血伴溃疡形成, 黏膜下可见大量中性粒细胞浸润, 间质有充血、水肿, 组织学损伤评分较空白组明显升高(P<0.05). 各药物干预组小肠黏膜组织学改变程度不一, 可见轻中度炎性改变, 溃疡散发, 肉芽组织形成等, 除替普瑞酮组外, 其余各组组织学损伤评分均较实验对照组明显降低(均P<0.05), 而各干预药物组组间比较(均P>0.05), 差异无统计学意义(表1).
NSAID不良反应可涉及胃肠道、心血管、肾脏、肝脏、神经等器官或系统. 其中, 胃肠道刺激和组织损伤尤为常见, 轻者表现为黏膜充血、水肿、糜烂及一过性浅表溃疡, 重者可造成多发溃疡合并消化系出血、穿孔, 甚至危及生命[6]. 由于NSAID本身的镇痛作用, 其所致肠道损伤多表现为"无痛性"(即使已存在溃疡、出血)[7], 且无症状性溃疡更易并发出血、穿孔, 其中15%的患者可有呕血, 黑便发生率高达50%[8-9]. 我们的实验通过7.8 mg/(kg·d)剂量双氯芬酸灌胃5 d, 实验对照组大鼠死亡5只, 并可见肠腔中到大量恶臭腹水, 肠壁粘连, 多发溃疡、出血坏死、穿孔等, 提示小剂量双氯芬酸即可引起大鼠小肠黏膜受损, 肠屏障破坏. NSAID的严重不良事件大大限制了其临床应用.
肠道是人体与外界环境的最大通道, 肠腔内有大量的细菌和多种毒素. 正常情况下, 人们并不发生严重的感染或中毒性疾病. 这主要与肠黏膜屏障的存在有关, 他包括机械屏障、化学屏障、微生物屏障、免疫屏障等. 机械屏障由黏液层、黏膜上皮细胞以及细胞间紧密连接构成; 化学屏障也称"肠-肝轴", 主要由胃酸、胆汁、各种消化酶等化学物质构成; 微生物屏障即由肠道菌群构成的微生态平衡; 免疫屏障则由肠道免疫系统的细胞群构成. 正常情况下, 肠黏膜屏障能有效阻挡外来微生物和毒素的侵袭, 保证机体健康. 然而, 在多种应激情况下或肠黏膜局部受到破坏时, 这种屏障功能减弱, 肠黏膜通透性增加, 存在于肠腔中的致病性微生物和毒素便可跨过肠屏障, 进入淋巴系统和血循环, 导致细菌移位, 引起菌血症或毒血症, 甚至发生炎性级联反应, 最终导致多脏器功能损害. 如何尽可能减小NSAID药物的不良反应, 保护并维持肠屏障功能, 已成为目前关注的焦点.
我们的实验选择了常用于胃黏膜保护及胃溃疡治疗的不同药物: 替普瑞酮、埃索美拉唑、吉法酯、甲硝唑等对大鼠NSAID相关小肠损伤进行干预保护. 替普瑞酮为萜烯类衍生物, 对各种实验性溃疡及胃黏膜病变有较强的抗溃疡和改善胃黏膜病变作用[10-11], 其主要功能包括增加黏液和磷脂合成, 促进PGs合成, 促进上皮和腺体增生, 促进表皮生长因子(epidermal growth factor, EGF)及碱性成纤维细胞生长因子(basic fibroblast growth factor, bFGF)等生长因子表达, 诱导热休克蛋白(heat shock protein, HSP)生成提高细胞耐受性以及抑制黏膜炎症和过氧化反应, 增加胃黏膜血流. 已有研究报道, 替普瑞酮可改善NSAID引起的胃黏液减少, 并降低NSAID溃疡发生率[12]. 埃索美拉唑为奥美拉唑S异构体, 通过特异性靶向性作用机制, 即选择性抑制细胞膜H+-K+-ATP酶, 阻断胃酸分泌的最终步骤, 产生显著的抑酸分泌作用, 从而减轻胃肠黏膜损伤. 吉法酯主要成分为金合欢乙酸香叶醇酯, 可直接作用于胃肠黏膜上皮细胞, 加速细胞新陈代谢并促进PGs合成, 用于预防NSAID、激素、放化疗以及应激性因素、精神因素引起的胃黏膜损伤, 临床常用于防治NSAID胃病. 甲硝唑作为硝咪唑类抗生素, 除抗菌作用外, 还可降低细胞线粒体氧耗. NSAID的酸性部分可直接损伤膜磷脂, 并使氧化磷酸化解偶联而损伤线粒体, 导致细胞能量耗竭及大量自由基产生等, 结果导致细胞间完整性破坏, 小肠通透性增加, 肠腔细菌侵袭和中性粒细胞浸润等, 这种作用似乎可被甲硝唑所阻断, 可能与甲硝唑可降低线粒体氧耗有关[13]. 我们的研究发现甲硝唑也明显减轻肠道损伤, 具体机制尚需进一步研究证实.
我们的实验发现各药物干预组大鼠死亡率明显下降, 仅替普瑞酮组大鼠于造模第5天死亡1只, 死因为肠道出血穿孔, 剩余大鼠小肠黏膜损伤情况较实验对照组均有不同程度减轻, 其中溃疡发生率(5/31), 肠壁局限性增厚(5/31), 其余大鼠均未见明显溃疡发生或仅表现为局部黏膜发红. 统计分析亦发现除替普瑞酮组大鼠小肠组织学损伤评分与实验对照组比较无明显差异外, 其余各组大鼠小肠大体评分及组织学损伤评分均有明显下降, 提示替普瑞酮、埃索美拉唑、吉法酯、甲硝唑对NSAID相关小肠损伤具有保护作用, 可不同程度减轻小肠损伤. 因此, 我们推测其在有效保护胃黏膜, 预防胃溃疡的同时亦可积极应用于防治小肠疾病, 减轻肠道炎症, 从而减少NSAID相关胃肠不良事件的发生.
非甾体类抗炎药(NSAID)具有解热、镇痛、抗炎、抗风湿和抗血小板聚集等作用, 广泛用于内、外、妇、儿科疾病. 然而可引发胃肠道黏膜充血、水肿、糜烂及一过性浅表溃疡, 重者可造成多发溃疡合并消化系出血、穿孔, 甚至危及生命. NSAID的严重不良事件大大限制了其临床应用.
房静远, 教授, 上海交通大学医学院附属仁济医院, 上海市消化疾病研究所
NSAID不良反应可涉及胃肠道、心血管、肾脏、肝脏、神经等器官或系统. 其中, 胃肠道刺激和组织损伤尤为常见, 主要是因为肠黏膜屏障受到破坏. 如何尽可能减小NSAID药物的不良反应, 保护并维持肠屏障功能, 已成为目前关注的焦点.
Yanagawa et al报道, 替普瑞酮可改善NSAID引起的胃黏液减少, 并降低NSAID溃疡发生率.
本研究探讨不同药物干预对NSAID相关性大鼠小肠损伤的影响, 实用性强, 有一定的参考价值.
编辑: 李军亮 电编: 何基才
| 2. | Griffin MR. Epidemiology of nonsteroidal anti-inflammatory drug-associated gastrointestinal injury. Am J Med. 1998;104:23S-29S; discussion 41S-42S. [PubMed] |
| 3. | Yamada T, Deitch E, Specian RD, Perry MA, Sartor RB, Grisham MB. Mechanisms of acute and chronic intestinal inflammation induced by indomethacin. Inflammation. 1993;17:641-662. [PubMed] [DOI] |
| 4. | Zhu F, Qian J, Pan G. [The establishment of TNBS-induced experimental colitis]. Zhongguo Yixue Kexueyuan Xuebao. 1998;20:271-278. [PubMed] |
| 5. | Chiu CJ, McArdle AH, Brown R, Scott HJ, Gurd FN. Intestinal mucosal lesion in low-flow states. I. A morphological, hemodynamic, and metabolic reappraisal. Arch Surg. 1970;101:478-483. [PubMed] |
| 8. | Hawkey CJ. Nonsteroidal anti-inflammatory drug gastropathy. Gastroenterology. 2000;119:521-535. [PubMed] [DOI] |
| 9. | László A, Kelly JP, Kaufman DE, Sheehan JE, Rétsági G, Wiholm BE, Koff RS, Sundström A, Shapiro S. Clinical aspects of upper gastrointestinal bleeding associated with the use of nonsteroidal antiinflammatory drugs. Am J Gastroenterol. 1998;93:721-725. [PubMed] [DOI] |
| 10. | Ohta Y, Kobayashi T, Inui K, Yoshino J, Kitagawa A, Nakazawa S. Preventive effect of teprenone on acute gastric mucosal lesion progression in compound 48/80-treated rats. Eur J Pharmacol. 2004;487:223-232. [PubMed] [DOI] |
| 11. | Takano T, Tsutsumi S, Tomisato W, Hoshino T, Tsuchiya T, Mizushima T. Geranylgeranylacetone protects guinea pig gastric mucosal cells from gastric stressor-induced apoptosis. Dig Dis Sci. 2002;47:1546-1553. [PubMed] [DOI] |
| 12. | Yanagawa A, Endo T. Retrospective 10 years large scale evaluation of gastrointestinal lesion associated with NSAIDs in 9,084 patients with rheumatoid arthritis aud osteoarthritis and prophylactic efficary of teprenone against NSAIDs AGML. Inflamm Regen. 2001;21:149-153. [DOI] |
| 13. | Fortun PJ, Hawkey CJ. Nonsteroidal antiinflammatory drugs and the small intestine. Curr Opin Gastroenterol. 2005;21:169-175. [PubMed] [DOI] |