修回日期: 2009-09-26
接受日期: 2009-09-28
在线出版日期: 2009-10-28
目的: 探讨p15INK4B(p15)和p21WAF1(p21)基因联合转染对人食管鳞癌细胞系EC109细胞增殖和凋亡的影响.
方法: 脂质体介导pcDNA3.1(+)-p15和pcDNA3.1(+)-p21转染EC109细胞, 稳定筛选后用RT-PCR检测转染细胞p15与p21基因mRNA表达, Western blot检测转染细胞P15和P21蛋白的表达. 用MTT法和透射电镜检测p15和p21基因分别及联合转染对EC109细胞增殖与凋亡的影响, 流式细胞仪检测EC109细胞周期分布与凋亡率.
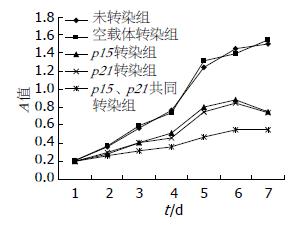
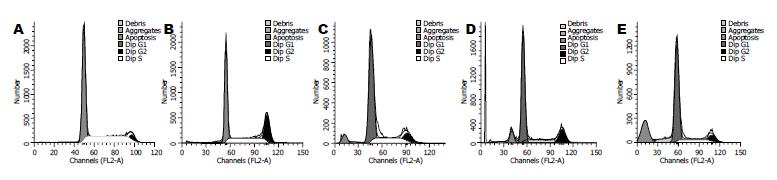
结果: p15和p21转染组EC109细胞生长速度低于空载体组与未转染组, 联合转染组与二者单独转染组相比, 亦明显抑制EC109细胞体外生长速度. p15和p21转染组EC109细胞发生G1/S阻滞, G1期细胞比例显著高于空载体组和未转染组, S期则显著降低(G1期: 60.52%±3.75%, 63.12%±2.89% vs 42.17%±5.30%, 41.38%±6.54%; S期: 22.67%±1.25%, 17.96%±2.03% vs 30.96%±3.33%, 36.05%±1.78%, 均P<0.01), 并出现凋亡峰, 透射电镜亦发现p15和p21转染组发生细胞凋亡, 联合转染组发生更为明显的G1/S阻滞, G1期比例显著升高、S期比例明显降低(G1期: 72.83%±2.31% vs 60.52%±3.75%, 63.12%±2.89%; S期: 13.59%±2.59% vs 22.67%±1.25%, 17.96%±2.03%, 均P<0.05), 凋亡率明显升高(21.21%±1.78% vs 4.32±1.74%, 10.83%±2.40%, 均P<0.01).
结论: p15和p21基因联合转染在体外可以进一步增强对人食管鳞癌EC109细胞的抑制与诱导凋亡作用.
引文著录: 张学彦, 刘志强, 景德怀, 关景明, 刘伟, 刘铁夫, 刘冰熔. p15INK4B和p21WAF1基因联合转染对人食管鳞癌细胞系EC109的协同抑制作用. 世界华人消化杂志 2009; 17(30): 3086-3091
Revised: September 26, 2009
Accepted: September 28, 2009
Published online: October 28, 2009
AIM: To investigate the synergistic effects of p15INK4B (p15) and p21WAF1 (p21) gene cotransfection on the proliferation and apoptosis of human esophageal squamous cell carcinoma EC109 cells.
METHODS: The recombinant plasmids pcDNA3.1(+)-p15 and pcDNA3.1(+)-p21 were introducted into EC109 cells by liposome-mediated transfection. The expression of p15 and p21 mRNA and protein was assayed by reverse transcription-polymerase chain reaction (RT-PCR) and Western blot, respectively. Cell proliferation was measured by methyl thiazol tetrazolium (MTT) assay. Apoptotic cells were observed using a transmission electron microscope. Cell cycle distribution and apoptosis rate were measured by flow cytometry.
RESULTS: The proliferation of EC109 cells transfected with either of the two recombinant plasmids was significantly inhibited when compared with untransfected cells or cells transfected with empty plasmid. The proliferation of cotransfected cells was more significantly inhibited than that of cells transfected with either of the two recombinant plasmids. The percentages of cells in G1 phase were significantly higher in cells transfected with either of the two recombinant plasmids than in cells transfected with empty plasmid and untransfected cells (60.52% ± 3.75% and 63.12% ± 2.89% vs 42.17% ± 5.30% and 41.38% ± 6.54%, respectively; all P < 0.01), while the percentages of cells in S phase were significantly lower in cells transfected with either of the two recombinant plasmids than in cells transfected with empty plasmid and untransfected cells (22.67% ± 1.25% and 17.96% ± 2.03% vs 30.96% ± 3.33% and 36.05% ± 1.78%, respectively; all P < 0.01). In cotransfected cells, the percentage of cells in G1 phase significantly increased (72.83% ± 2.31% vs 60.52% ± 3.75% and 63.12% ± 2.89%, respectively; both P < 0.05), the percentage of cells in S phase significantly decreased (13.59% ± 2.59% vs 22.67% ± 1.25% and 17.96% ± 2.03%, respectively; both P < 0.05), and apoptosis rate was significantly elevated (21.21% ± 1.78% vs 4.32% ± 1.74% and 10.83% ± 2.40%, respectively; both P < 0.01) when compared with cells transfected with either of the two recombinant plasmids.
CONCLUSION: Cotransfection of the p15 and p21 genes synergistically inhibits proliferation and promotes apoptosis in EC109 cells.
- Citation: Zhang XY, Liu ZQ, Jing DH, Guan JM, Liu W, Liu TF, Liu BR. Cotransfection of the p15INK4B and p21WAF1 genes synergistically inhibits proliferation and promotes apoptosis in human esophageal squamous cell carcinoma cell line EC109. Shijie Huaren Xiaohua Zazhi 2009; 17(30): 3086-3091
- URL: https://www.wjgnet.com/1009-3079/full/v17/i30/3086.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i30.3086
p15INK4B(简称p15)和p21WAF1(简称p21)是近年来发现的重要的细胞周期蛋白依赖性激酶抑制因子(cyclin-dependent kinase inhibitors, CKI), 都是食管鳞状细胞癌(esophageal squamous cell carcinoma, ESCC)中经常失活的抑癌基因. 二者作用机制不同, p15属于INK4家族, 能特异性地直接作用于CyclinD1/CDK4复合物, 负调细胞周期过程, p21属于Cip/Kip家族, 对所有的Cyclin-CDK复合体都有一定的抑制作用. 与细胞周期特异性和非特异性化疗药物联合应用增强抗癌效应的机制相似, 共转染此二基因可能有协同作用而增强对ESCC治疗效果. 因而我们采用脂质体介导, 将p15和p21基因分别及联合转染人ESCC细胞株EC109细胞, 探讨p15和p21联合转染提高抑癌疗效的可能性.
真核表达质粒pCMV5-p15由北京师范大学生命科学学院-教育部细胞增殖与调控重点实验室柳惠图教授惠赠, 我实验室将其亚克隆至有真核筛选标志新霉素抗性基因(neo)的pCDNA3.1(+)上, 称为pCDNA3.1(+)-p15, 经测序鉴定[1]. 委托上海生工公司全基因合成p21的插入片段, 克隆构建p21真核表达质粒pcDNA3.1(+)-p21, 经测序鉴定[2]. EC109细胞株购自中国科学院上海细胞所. Taq酶购自上海生工公司, 逆转录试剂盒、限制性内切酶、质粒中提试剂盒是Promega公司产品, p15、p21小鼠抗人单抗是Neo Markers公司产品, 辣根酶标山羊抗小鼠IgG为北京中杉公司产品, 脂质体Lipofectamine2000购于Invitrogen公司. 引物由上海生工公司合成. 上海生工公司进行质粒测序.
1.2.1 细胞培养: 人ESCC EC109细胞在37℃、50 mL/L CO2饱和湿度条件下, 用含100 mL/L胎牛血清的DMEM高糖培养基培养.
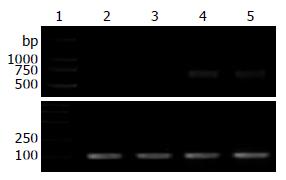
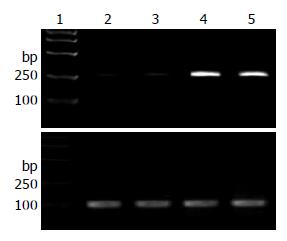
1.2.2 RT-PCR检测: 用TRIzol试剂盒提取细胞总RNA.逆转录cDNA第一链合成后行PCR, p15引物(退火58℃, 产物753 bp): 上游5'-CCAGAAGCAATCCAGGCGCG-3', 下游: 5'-CGTTGGCAG CCTTCATCG-3'. p21引物(退火56℃, 产物218 bp): 上游5'-TGTCCGTCAGAACCCATG-3', 下游: 5'-GTGGGAAGGTAGAGCTTGG-3'. β-actin引物(退火56℃, 产物100 bp): 上游: 5'-CCCAGCACAATGAAGATCAAGATCAT-3', 下游: 5'-ATCTGCTGGAAGGTGGACAGCGA-3'. 反应35个循环, 产物经12 g/L琼脂糖凝胶电泳, 照相.
1.2.3 基因转染:
1.2.3.1 分组: 根据转染质粒的不同和是否进行质粒转染分为5组. (1)未转染组: 不进行转染的同期培养的EC109细胞; (2)空载体转染组: 用pCDNA3.1(+)-neo质粒转染EC109细胞; (3)p15转染组: 用pCDNA3.1(+)-p15真核表达质粒转染; (4)p21转染组: 用pCDNA3.1(+)-p15真核表达质粒转染; (5)p15和p21共转染组: 用等量pCDNA3.1(+)-p15、pCDNA3.1(+)-p15共转染EC109细胞.
1.2.3.2 转染方法: 按照Lipofectamine2000说明书进行. 转染48 h后加入终浓度为400 mg/L G418的选择培养基. 每2-4 d更换培养基, 4 wk后挑选阳性克隆扩大培养.
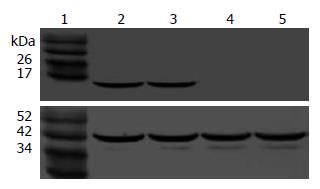
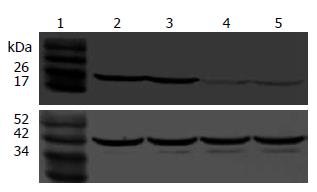
1.2.3.3 Western blot检测外源P15、P21蛋白: 提取细胞总蛋白, Bradford法定量. 5%积层胶、120 g/L SDS-聚丙烯酰胺凝胶电泳, 转膜, 进行一抗、酶标二抗孵育和显色, 照相.
1.2.4 生长曲线(MTT法): 取对数生长期细胞按3×103个细胞/孔接种96孔板, 每孔加5 g/L MTT溶液20 μL, 37℃孵育4 h, 每孔加180 μL二甲基亚砜, 振荡10 min, 选490 nm波长测定吸光度值, 每隔24 h测定1次, 连续测定7 d, 绘制细胞生长曲线.
1.2.5 流式细胞仪检测: 每组取1×106个细胞, 加入700 mL/L冷乙醇4℃固定24 h, 用50 mg/L RNA酶37℃处理30 min, 加100 mg/L碘化丙啶染色, 避光30 min, 进行测定.
1.2.6 透射电镜: 取各组细胞, 每组1×106个细胞, 1500 r/min离心10 min, 加入3%戊二醛固定1 wk, 送透射电镜检测.
统计学处理 数据以mean±SD表示, 用SPSS11.0统计软件, 采用单因素方差分析进行统计分析.
RT-PCR发现EC109细胞p15基因mRNA无表达, 证明其p15表达缺失, p15转染细胞和p15、p21共转染组有p15 mRNA高表达(图1); EC109细胞p21基因mRNA低表达, p21转染细胞和p15、p21共转染组有p21 mRNA高表达(图2).
Western blot证实空载体转染和未转染组无相对分子质量为15 kDa的P15蛋白目的条带, p15转染组和p15、p21共转染组的EC109细胞中有强的15 kDa目的条带, 可证明转染的pCDNA3.1(+)-p15质粒后, P15蛋白在EC109细胞中高表达(图3); 空载体转染和未转染组EC109细胞中有相对分子质量为21 kDa弱的P21蛋白目的条带, p21转染组和p15、p21共转染组有强的21 kDa目的条带, 可证明转染的pCDNA3.1(+)-p21质粒后, P21蛋白在EC109细胞中由弱表达变为高表达(图4).
自第3天开始p15、p21联合转染与二者单独转染对EC109细胞均有生长抑制作用, 联合转染的抑制作用则明显强于二者单独转染(图5).
p15和p21转染组EC109细胞发生G1/S阻滞, G1期细胞比例显著高于空载体组和未转染组(60.52%±3.75%, 63.12%±2.89% vs 42.17%±5.30%, 41.38%±6.54%, 均P<0.01), S期比例显著低于空载体组和未转染组(22.67%±1.25%, 17.96%±2.03% vs 30.96%±3.33%, 36.05%±1.78%, 均P<0.01), 并出现凋亡峰, 透射电镜亦发现p15和p21转染组发生细胞凋亡. p15和p21联合转染组发生更为明显G1/S阻滞, G1期比例显著升高(72.83%±2.31% vs 60.52%±3.75%, 63.12%±2.89%, 均P<0.05), S期比例明显降低(13.59±2.59 vs 22.67%±1.25%, 17.96%±2.03%, 均P<0.05), 凋亡率明显升高(21.21%±1.78% vs 4.32%±1.74%, 10.83±2.40%, 均P<0.01, 图6, 表1).
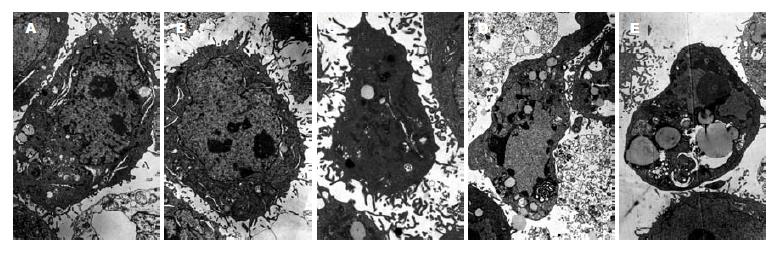
倒置显微镜可见细胞生长受到抑制, 细胞传代时间延长, 核分裂相对减少, 细胞数量相对较少, 可见部分细胞缩小、变圆, 自瓶壁脱落, 悬浮于培养液中, 未转染组和空载体转染组细胞相比无明显差别, 生长旺盛, 贴壁良好, 细胞密度相对较大. 透射电镜可见空白对照及空载体转染组细胞生长状态较好, 未见凋亡形态学改变, 核浆比例大, 圆形核仁多, 细胞表面绒毛密集排列, 双层核膜结构清晰, 胞质内有丰富的游离核蛋白体. p15、p21单独转染组: 可见部分细胞发生凋亡, 细胞表面绒毛消失, 细胞体积变小, 细胞核染色质形成高密度斑块, 染色质边集, 细胞质有大量脂滴堆积, 线粒体发生髓样变, 游离核糖体减少. p15、p21联合转染细胞: 凋亡细胞数量明显增多, 形态特征同上(图7).
食管癌是最常见的消化系恶性肿瘤之一, 我国是世界上食管癌发病率和死亡率最高的国家. 随着对肿瘤发病机制的深入研究, 人们逐渐认识到肿瘤是一类细胞周期异常性疾病. 在细胞周期中发挥重要作用的细胞周期素(cyclin)、细胞周期素依赖蛋白激酶(cyclin-dependent protein kinase, CDK)、CDK抑制因子(CKI)等越来越受到重视. 在肿瘤细胞中常伴随CKI的突变、缺失或表达降低现象, 因此CKI被看成一类抑癌基因.
p15是近年来发现的一类CKI分子, 定位于9号染色体9p21区, 这一区域易发生缺失、突变和甲基化, 从而导致恶性肿瘤发生[3]. p15的抑癌机制与细胞周期调控密切相关, 能特异地通过直接作用于CyclinD1/CDK4复合物中的CyclinD1, 从而影响CDK4激酶的活性, 并导致pRb磷酸化水平下降, 使细胞被阻滞在G1期, 负调细胞周期过程. 此外, p15是TGF-β诱导产生细胞生长阻滞的关键[4]. TGF-β对上皮细胞有生长抑制作用, p15失活可能使细胞对胞外信号不敏感而导致癌症发生.
p15基因在多种肿瘤存在表达缺失, 他是ESCC发生过程中经常失活的靶基因[5], 是引发ESCC的重要因素, 有关p15转染对ESCC乃至其他鳞癌引起增殖抑制的报道较少, 我们发现转染p15基因后, 食管癌EC109细胞增殖明显受抑制, 流式细胞仪检测发现亚G1凋亡峰, 透射电镜亦发现细胞凋亡[1].
p21也是近年来发现的一类CKI分子, 编码由164个氨基酸残基组成的蛋白质, 相对分子质量为21 kDa, 是非常重要的抑癌基因. p21结合并抑制CDK, 受p53调控, 可防止衰老细胞进入细胞周期. P21蛋白抑制DNA复制必需因子-增殖细胞核抗原(proliferating-cell nuclear antigen, PCNA), 并能广泛地抑制各种Cyclin-CDK复合物, 如CyclinD-CDK4、CyclinE-CDK2和CyclinA-CDK2, P21蛋白和PCNA结合形成p21.CyclinE.cdk2.PCNA四联复合物, 通过对CDK和PCNA的双重抑制作用, 使细胞有足够的时间进行DNA修复, 维持细胞遗传信息的稳定性[6], 使得增殖细胞在G1向S期过渡受阻, 抑制DNA的复制, 修复受损的DNA或最终导致细胞的凋亡.
p21表达降低在食管癌中多见[7], 食管癌局部浸润肿瘤中p21表达下调能反映肿瘤的进展[8]. 食管癌中p21高表达者预后较好[9]. P21蛋白的异常表达与ESCC的发生, 发展及组织学类型、淋巴结转移TNM分期密切相关, 说明p21基因在食管癌的调控机制中起负性调控作用[10]. 食管癌患者总生存率与p21阳性表达呈正相关[11]. p21基因与化放疗敏感性密切相关, p21阳性表达的食管癌高温化学放射治疗效果好[12]. 通过改变p21基因的表达可以起到调节肿瘤生长的作用, 如有报道发现肿瘤抑制基因ECRG1通过调节p21表达可促进食管癌细胞NIH3T3发生细胞周期阻滞[13], 此外有人发现抑制食管癌T-型通道后可通过p53依赖的p21途径抑制细胞增殖, 食管癌TE8细胞增殖抑制与p21表达上调有关[14]. 这些发现都提示可以考虑用p21基因转染抑制食管癌. 我们发现转染p21基因后, 食管癌EC109细胞增殖明显受抑制, 流式细胞仪检测发现亚G1凋亡峰, 透射电镜亦发现细胞凋亡.
恶性肿瘤的发生是一个多因素、多阶段的复杂过程, 单一基因治疗靶点比较单一, 效果有限, 为解决此问题, 我们采用抑癌基因p15、p21联合转染联合抑制ESCC, 一方面增加抑癌作用靶点, 另一方面二者作用机制不同, p15能特异地作用于CyclinD1/CDK4复合物, 导致pRb磷酸化水平下降, 使细胞阻滞在G1期. p21则对所有的Cyclin-CDK复合体都有一定的抑制作用, 共转染此二基因可能有协同作用而增强对ESCC的抑制效果. Quereda et al[15]描述p21和INK4通路的失活协同抑制体外细胞的老化过程. 二者均有突变的细胞具有不死性而且显示出对致癌基因细胞转化的高敏感性. INK4和p21通路均有突变的老鼠模型发生肉瘤的几率升高, 说明这两个细胞周期抑制剂家族在肿瘤抑制中有明显的协同作用[15]. Wall et al[16]证实p15和p21联合作用明显增强与纤维状胶原(fibrillar collagen, FC)接触生长的肿瘤细胞的细胞周期阻滞.
我们发现分别转染p15和p21基因后EC109细胞增殖受抑制, 流式细胞仪检测发现亚G1凋亡峰, 透射电镜亦发现细胞凋亡. 二者联合转染后, 生长抑制作用明显增强, 细胞周期阻滞作用更加明显, 并诱导更多细胞发生凋亡, 这证明p15和p21二基因有协同作用而增强对ESCC的抑制效果. 本实验是ESCC治疗的一种新的思路和模式.
p15和p21是细胞周期蛋白依赖性激酶抑制因子(CKI)家族成员, 是食管鳞状细胞癌(ESCC)中经常失活的基因, 与ESCC的发生, 发展密切相关, 二者通过不同机制使增殖细胞在G1期向S期的过渡受阻.
欧希龙, 副教授, 东南大学中大医院消化科
针对细胞周期进行的抗肿瘤治疗是研究热点, 基因治疗是抗肿瘤治疗的发展方向, 亟待研究的问题是选择何种恰当、有效的基因, 以何种安全、方便、有效的方式导入受体.
本研究将作用机制不同的2种CKI, 即p15和p21转染到人ESCC细胞系EC109中, 研究其对ESCC细胞生长的影响, 探讨共转染此2基因是否有协同作用, 而增强对ESCC治疗效果, 这可能是ESCC基因治疗的一种新途径.
p15和p21二基因有协同作用而增强对ESCC的抑制效果, 这是ESCC治疗的一种新的思路和模式, 且p15和p21转染的优点是其片段长度小, 克隆和转染操作比较方便, 是基因治疗很好的靶基因.
本文研究了p15INK4B和p21WAF1基因联合转染对人食管鳞癌细胞系EC109的协同作用, 设计严谨, 方法科学, 具有一定的可读性.
编辑: 李军亮 电编:吴鹏朕
| 3. | Cheung AL, Si HX, Wang LD, An JY, Tsao SW. Loss of heterozygosity analyses of esophageal squamous cell carcinoma and precursor lesions from a high incidence area in China. Cancer Lett. 2005; May 6. [Epub ahead of print]. [PubMed] |
| 4. | Feng XH, Lin X, Derynck R. Smad2, Smad3 and Smad4 cooperate with Sp1 to induce p15(Ink4B) transcription in response to TGF-beta. EMBO J. 2000;19:5178-5193. [PubMed] [DOI] |
| 5. | Metzger R, Schneider PM, Warnecke-Eberz U, Brabender J, Hölscher AH. Molecular biology of esophageal cancer. Onkologie. 2004;27:200-206. [PubMed] [DOI] |
| 6. | Datta K, Babbar P, Srivastava T, Sinha S, Chattopadhyay P. p53 dependent apoptosis in glioma cell lines in response to hydrogen peroxide induced oxidative stress. Int J Biochem Cell Biol. 2002;34:148-157. [PubMed] [DOI] |
| 7. | Zhang H, Jin Y, Chen X, Jin C, Law S, Tsao SW, Kwong YL. Papillomavirus type 16 E6/E7 and human telomerase reverse transcriptase in esophageal cell immortalization and early transformation. Cancer Lett. 2007;245:184-194. [PubMed] [DOI] |
| 8. | Masuda N, Kato H, Nakajima T, Sano T, Kashiwabara K, Oyama T, Kuwano H. Synergistic decline in expressions of p73 and p21 with invasion in esophageal cancers. Cancer Sci. 2003;94:612-617. [PubMed] [DOI] |
| 9. | Güner D, Sturm I, Hemmati P, Hermann S, Hauptmann S, Wurm R, Budach V, Dörken B, Lorenz M, Daniel PT. Multigene analysis of Rb pathway and apoptosis control in esophageal squamous cell carcinoma identifies patients with good prognosis. Int J Cancer. 2003;103:445-454. [PubMed] [DOI] |
| 11. | Bahnassy AA, Zekri AR, Abdallah S, El-Shehaby AM, Sherif GM. Human papillomavirus infection in Egyptian esophageal carcinoma: correlation with p53, p21, mdm2, C-erbB2 and impact on survival. Pathol Int. 2005;55:53-62. [PubMed] [DOI] |
| 12. | Ishida M, Morita M, Saeki H, Ohga T, Sadanaga N, Watanabe M, Kakeji Y, Maehara Y. Expression of p53 and p21 and the clinical response for hyperthermochemoradiotherapy in patients with squamous cell carcinoma of the esophagus. Anticancer Res. 2007;27:3501-3506. [PubMed] |
| 13. | Zhao N, Huang G, Guo L, Lu SH. ECRG1, a novel candidate of tumor suppressor gene in the esophageal carcinoma, triggers a senescent program in NIH3T3 cells. Exp Biol Med (Maywood). 2006;231:84-90. [PubMed] |
| 14. | Lu F, Chen H, Zhou C, Liu S, Guo M, Chen P, Zhuang H, Xie D, Wu S. T-type Ca2+ channel expression in human esophageal carcinomas: a functional role in proliferation. Cell Calcium. 2008;43:49-58. [PubMed] [DOI] |
| 15. | Quereda V, Martinalbo J, Dubus P, Carnero A, Malumbres M. Genetic cooperation between p21Cip1 and INK4 inhibitors in cellular senescence and tumor suppression. Oncogene. 2007;26:7665-7674. [PubMed] [DOI] |
| 16. | Wall SJ, Zhong ZD, DeClerck YA. The cyclin-dependent kinase inhibitors p15INK4B and p21CIP1 are critical regulators of fibrillar collagen-induced tumor cell cycle arrest. J Biol Chem. 2007;282:24471-24476. [PubMed] [DOI] |