修回日期: 2009-09-16
接受日期: 2009-09-28
在线出版日期: 2009-10-18
目的: 探讨经PTD-HBcAg融合蛋白体内诱导的特异性细胞毒T淋巴细胞(CTL)对HBV转基因小鼠病毒的抑制作用.
方法: 20只HBV转基因小鼠随机分组, 融合蛋白PTD-HBcAg及对照蛋白HBcAg经皮下免疫小鼠, 每周1次, 共3次. 流式细胞仪检测脾细胞中胞内细胞因子水平; 微粒子酶免疫分析法(MEIA)检测血清中乙型肝炎表面抗原(HBsAg)水平; 荧光定量聚合酶链反应(PCR)检测HBV DNA水平; 肝脏HE染色及免疫组织化学方法检测HBsAg表达.
结果: PTD-HBcAg融合蛋白免疫转基因小鼠后, 能有效上调特异性CTL数量, 肝组织中炎性细胞的数量明显增多, 同时对小鼠血清中HBsAg及HBV DNA水平有明显的抑制作用. 肝组织HBsAg免疫组织化学蛋白平均吸光度分析显示, 50 µg和100 µg PTD-HBcAg融合蛋白组中平均吸光度值与空白组和50 µg HBcAg组相比明显降低(127.77±4.92, 117.71±5.18 vs 156.84±4.94, 138.70±5.92, 均P<0.05), 且组间比较差异有统计学意义.
结论: PTD-HBcAg融合蛋白免疫HBV转基因小鼠后能增加特异性CTL数量, 显著降低血清中HBsAg及HBV DNA水平, 同时抑制肝脏中HBsAg的表达, 在HBV免疫治疗中具有抗病毒作用.
引文著录: 陈小华, 潘庆春, 汤正好, 余永胜, 臧国庆. PTD-HBcAg融合蛋白诱导特异性CTL抑制转基因小鼠HBV复制. 世界华人消化杂志 2009; 17(29): 2972-2977
Revised: September 16, 2009
Accepted: September 28, 2009
Published online: October 18, 2009
AIM: To investigate the effect of protein transduction domain-hepatitis B virus core antigen (PTD-HBcAg) fusion protein-induced specific cytotoxic T lymphocyte (CTL) response on hepatitis B virus (HBV) replication in HBV-transgenic mice.
METHODS: Twenty HBV-transgenic mice were randomly divided into two groups: mice subcutaneously immunized with PTD-HBcAg fusion protein (PTD-HbcAg group) and those immunized with HBcAg (HBcAg group). The immunizations were given once a week for three weeks. Cytokine expression in splenocytes was analyzed by flow cytometry. Serum HBsAg and HBV DNA levels were determined by microparticle enzyme immunoassay and real-time fluorescent PCR assay, respectively. The expression of HBsAg in hepatic tissue was detected by immunohistochemistry.
RESULTS: Following immunization with PTD-HBcAg fusion protein, the proportions of CTLs in the spleen and inflammatory cells in hepatic tissue of HBV transgenic mice were upregulated remarkably. Serum HBsAg and HBV DNA levels in the PTD-HbcAg group were significantly lower than those in the HBcAg group. The mean absorbance values of HBsAg staining in hepatic tissue in the PTD-HBcAg group (50 µg: 127.77 ± 4.92; 100 µg: 117.71 ± 5.18) were significantly lower than those in the blank control group (156.84 ± 4.94) and HBcAg group (50 µg: 138.70 ± 5.92)(all P < 0.05).
CONCLUSION: Immunization with PTD-HBcAg fusion protein significantly increases the number of specific CTLs in the spleen, decreases serum HBsAg and HBV DNA levels, and downregulates HbsAg expression in hepatic tissue in HBV-transgenic mice, suggesting that PTD-HBcAg fusion protein has anti-HBV activity.
- Citation: Chen XH, Pan QC, Tang ZH, Yu YS, Zang GQ. Protein transduction domain-hepatitis B virus core antigen fusion protein-induced specific cytotoxic T lymphocyte response inhibits hepatitis B virus replication in hepatitis B virus-transgenic mice. Shijie Huaren Xiaohua Zazhi 2009; 17(29): 2972-2977
- URL: https://www.wjgnet.com/1009-3079/full/v17/i29/2972.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i29.2972
乙型肝炎病毒(hepatitis B virus, HBV)体内清除很大程度上依赖于活化表位肽特异性CD8+细胞毒性T淋巴细胞(cytotoxic T lymphocytes, CTL), CTL通过T细胞受体(T cell receptor, TCR)特异性识别病毒肽段并通过MHC-Ⅰ类分子提呈引起感染细胞融解, 是宿主清除HBV的关键[1-3]. 研究表明, 急性HBV感染者大多表现出较强烈的MHC-Ⅰ类限制性CTL反应, 而慢性患者此类反应则大多较弱甚至检不出, 较弱的CTL反应对HBV清除不彻底可能是导致HBV感染慢性化的主要原因[4-9]. 蛋白转导域(protein transduction domain, PTD)是人免疫缺陷病毒(human immunodeficiency virus, HIV)转录活化因子(human immunodeficiency virus transactivator of transcription, HIV-Tat)蛋白行使跨膜功能的核心片段, 包含该区段的蛋白具备穿透细胞膜的功能. 诸多研究证实, PTD及其衍生体能够有效穿透细胞膜, 高效携带外源性抗原进入细胞内部, 实现细胞亚定位, 通过MHC-Ⅰ类分子途径提呈, 诱导特异性CTL, 从而发挥抗肿瘤、抗病毒作用[10-13]. 我们已成功构建PTD-HBcAg融合基因表达质粒并进行重组蛋白的纯化和鉴定, 同时体外实验检测该融合蛋白具有穿透功能及诱导特异性CTL能力[14-15]. 本研究主要通过PTD-HBcAg融合蛋白免疫HBV转基因小鼠, 检测其在体内诱导特异性CTL及抑制HBV复制的能力, 为慢性乙型肝炎患者的免疫治疗提供新的思路.
Balb/c-HBV转基因小鼠, 周龄6-8 wk, ♀, 22-26 g, SPF级, 由中国人民解放军第458医院全军肝病中心提供, 在本院动物实验中心清洁级25-27℃条件下饲养. 融合蛋白MBP-PTD-HBcAg(M-PTD-HBcAg)及MBP-HBcAg(M-HBcAg)由本课题组表达并纯化[14]. 佛波脂、离子霉素和莫能霉素购自Sigma公司, 细胞固定剂和破膜剂BD公司产品. FITC标记抗小鼠CD8α抗体、PE标记抗小鼠IFN-γ mAb及同型对照均购自eBioscience公司. 羊抗HBsAg多克隆抗体(美国Novus Biologicals公司), SABC免疫组织化学试剂盒(武汉博士德公司). 实时定量荧光PCR检测HBV DNA水平的试剂盒购自深圳匹基公司. HBsAg检测采用美国雅培公司提供的AXSYM全自动免疫分析仪, 试剂盒为雅培公司产品. 红细胞裂解液购自北京索莱宝科技有限公司. 流式细胞分析仪(COULTER EPICS XL Flow Cytometer)为Beckman公司产品.
1.2.1 分组: 实验动物随机分为4组: 空白组(生理盐水)、50 μg M-HBcAg组、50及100 μg M-PTD-HBcAg组, 每组5只, 每只小鼠予50 μL总剂量皮下注射, 每周1次, 连续3 wk. 于最后1次免疫7 d后收集血清标本, 处死动物后取脾脏及肝脏备用.
1.2.2 体内血清HBsAg和HBV DNA水平检测: 收集上述各组标本血清, 采用美国雅培公司提供的AXSYM全自动免疫分析仪检测HBsAg水平(S/N值), HBV DNA水平检测参照深圳匹基公司荧光定量PCR试剂盒.
1.2.3 胞内细胞因子检测: 转基因小鼠处死后无菌条件下分离新鲜脾脏, PBS洗涤2次后, 用完全RPMI 1640培养液调整细胞浓度为1×109/L, 25 mg/L佛波脂、1 mg/L离子霉素和1.7 mg/L莫能霉素加入培养液中37℃、50 mL/L CO2孵育6 h后, PBS洗涤2次后收集细胞, 按试剂说明书用饱和浓度的FITC标记的anti-CD8α mAb, 室温避光20 min. 加入细胞固定剂及破膜剂孵育20 min, 收集细胞PBS洗涤后, 加入PE标记的anti-IFN-γ mAb, 室温避光孵育20 min. PBS洗涤2次后, 流式细胞分析仪对细胞荧光进行检测并用Expo32-ADC软件进行分析.
1.2.4 肝组织常规HE染色: 肝组织经40 g/L中性甲醛固定后石蜡包埋, 制作4 μm切片作常规HE染色, 普通光镜下观察肝组织病理学改变.
1.2.5 HBsAg免疫组织化学染色及结果分析: 采用SABC法. 第一抗体(羊抗HBsAg多克隆抗体)用1:100稀释, 阴性对照以磷酸盐缓冲液(PBS)代替第一抗体. 具体操作为: 参照有关试剂产品说明书进行. 石蜡切片脱蜡至水, 滴加30 mL/L H2O2, 10 min去除内源性过氧化氢酶, 抗原修复液(柠檬酸缓冲液)中95℃、15 min, 依次加入正常血清封闭液30 min, 一抗4℃过夜, 兔抗羊二抗37℃、30 min, 1:100稀释SABC 37℃、30 min. 每步之后均用PBS洗涤3次, 每次5 min, DAB显色, 苏木精复染, 烘干, 中性树胶封片. 阳性细胞为胞质染色成棕黄色. 在高倍镜下(×400), 每张切片选取四周及中央5个视野, 用Image-Pro Plus 6.0图像分析软件进行半定量分析, 测得积分吸光度(IA)与每一视野面积(Area)相除即为平均吸光度, 进行统计学处理.
统计学处理 采用SPSS11.5统计软件, 实验所得数据以mean±SD表示, 2组间均数比较采用t检验, 多组间均数比较采用单因素方差分析, P<0.05为差异有统计学意义.
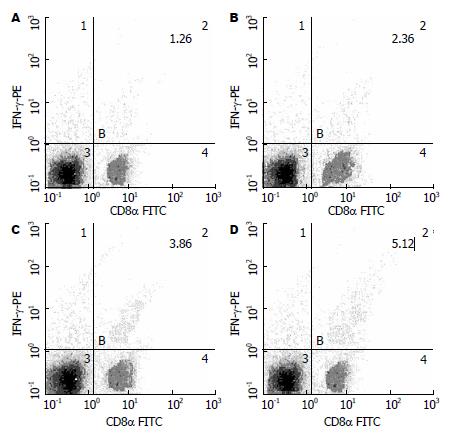
为了解融合蛋白免疫转基因小鼠后对脾细胞中TC1数量的影响, 采用流式细胞计数术对细胞进行CD8α和INF-γ双标检测. CD8α和INF-γ双阳性的细胞即为TC1. 经50和100 μg M-PTD-HBcAg融合蛋白免疫后的脾细胞中TC1的数量明显高于50 μg M-HBcAg免疫组(t = 6.8292, 14.407, 均P<0.05), 而后者对脾细胞的诱导能力还是强于空白组(t = 4.716, P<0.05, 图1).
融合蛋白诱导的特异性CTL能否有效抑制HBV转基因小鼠中HBV的复制, 需进行HBsAg及HBV DNA水平的检测(表1). 免疫3 wk后, 与空白组相比, 50和100 μg M-PTD-HBcAg组小鼠血清中HBsAg水平明显降低(t= 9.4709,11.2399, 均P<0.05), 也同时低于M-HBcAg组中HBsAg水平(t = 4.2187, 5.4794, 均P<0.05). 50和100 μg M-PTD-HBcAg组小鼠血清中HBV DNA水平相比空白组明显减少(t = 23.5691, 36.4132, 均P<0.05), 也低于M-HBcAg组中HBV DNA水平(t = 13.4952, 22.3201, 均P<0.05). 上述结果证明M-PTD-HBcAg融合蛋白对HBV转基因小鼠中HBV有一定的抑制作用, 强于M-HBcAg的免疫作用.
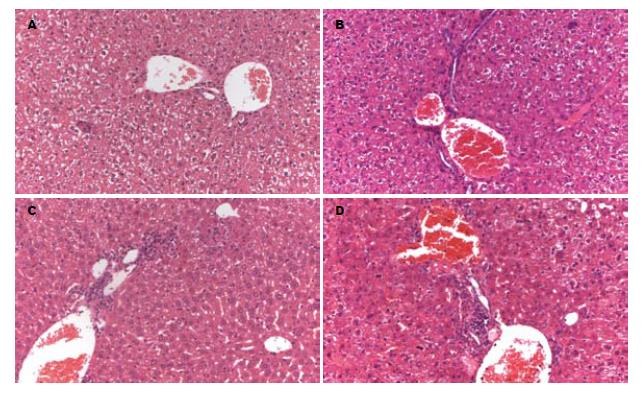
融合蛋白及空白对照免疫HBV转基因小鼠3 wk后肝脏病理改变见图2, 空白组肝组织呈正常肝细胞形态, 小叶结构完整清晰, 中央静脉周围及汇管区可见少量炎性浸润; M-HBcAg免疫小鼠后出现汇管区及中央静脉周围炎性细胞逐渐增多, 同时还有少量的肝细胞点状坏死; 而在100 μg M-PTD-HBcAg免疫小鼠肝脏中炎性细胞的浸润最为明显, 汇管区内出现了大量炎性细胞, 同时肝细胞点状坏死也增多. 提示M-PTD-HBcAg融合蛋白免疫HBV转基因小鼠后能诱导特异性CTL, 增强抗HBV感染的能力.
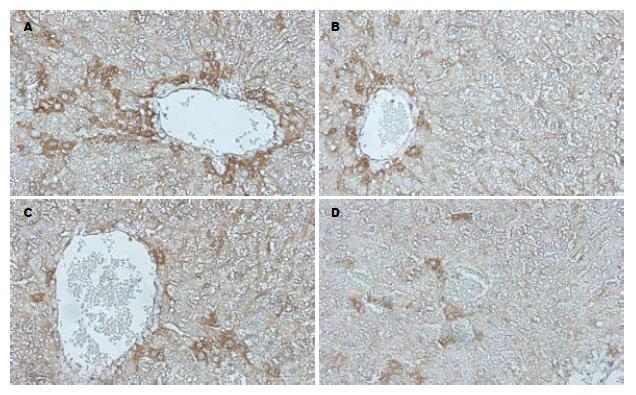
融合蛋白及空白对照免疫HBV转基因小鼠3 wk后, 取新鲜肝脏组织对HBsAg进行免疫组织化学检测并对其图像进行分析(表1, 图3). 空白组中小鼠肝脏中HBsAg蛋白呈弥漫性分布, 而经过M-HBcAg及M-PTD-HBcAg融合蛋白免疫后, HBsAg数量及强度出现逐渐减少. 50和100 μg M-PTD-HBcAg组中HBsAg平均吸光度值明显低于空白组(t = 17.8870, 24.8102, 均P<0.05).
HBV感染是严重的公共卫生问题, 全球约20亿人曾感染HBV, 其中3.5-4亿人为慢性HBV感染, 全球每年约100万人死于与HBV感染相关的肝病[16]. 我国属乙型肝炎高发区, 约1.1亿人为慢性HBV感染. 决定慢性乙型肝炎转归的一个主要因素是机体的免疫反应能力, 尤其是CTL的反应水平, 因此活化特异性CTL反应是清除体内HBV感染的关键. 理论上, MHC-Ⅰ类分子提呈的抗原肽大多数来源于胞质中合成的蛋白, 将外源性抗原肽导入抗原提呈细胞(antigen presenting cells, APC)胞质, 可望相应增强抗原肽被MHC-Ⅰ类分子呈递的效率. 而如何有效将病毒抗原导入APCs, 经MHC-Ⅰ类途径进而提呈于细胞表面产生特异性CTL, 成为新型免疫疫苗抗病毒的重要手段. 近来研究证实, PTD在融合各种全长和截短蛋白后具有很强的蛋白转导特性, 与PTD融合的蛋白可以穿透树突状细胞(dendritic cells, DCs)胞膜进入细胞, 经MHC-Ⅰ类抗原提呈诱导CTL, 有效提高机体抗肿瘤及抗病毒的免疫能力[17].
前期研究中, 我们已经成功构建PTD-HBcAg融合基因质粒, 融合蛋白表达纯化后证明其具有胞膜穿透能力并有效定位于胞质, 同时体外实验也证实该融合蛋白能刺激DC成熟及诱导特异性CTL反应并设计对照蛋白M-PTD以消除其免疫功能[15]. 在此基础上, 为进一步证实该融合蛋白诱导特异性CTL抑制HBV复制功能, 我们进行了HBV转基因小鼠的体内实验. 我们的实验显示, 经融合蛋白M-PTD-HBcAg免疫后, 诱导特异性CTL数量明显高于空白组及对照组M-HBcAg, 同时剂量增加也能增强小鼠免疫反应. 在小鼠肝脏组织病理检测中发现, 融合蛋白免疫的小鼠肝脏汇管区及中央静脉周围炎性细胞数量明显增多并出现肝细胞点状坏死, 而空白组未出现明显的炎性细胞浸润及肝细胞坏死, 与流式细胞仪对脾细胞中能分泌细胞因子INF-γ的CTL数量的检测结果相符合. 上述结果提示, M-PTD-HBcAg融合蛋白免疫HBV转基因小鼠后能有效诱导特异性CTL生成, 增强小鼠的抗HBV免疫能力. 融合蛋白M-PTD-HBcAg免疫小鼠后血清中HBsAg及HBV DNA水平也明显低于空白组及M-HBcAg组, 100 μg M-PTD-HBcAg在抑制病毒中作用最强. 对肝脏中HBsAg进行免疫组织化学及图像分析显示空白组小鼠肝脏分泌的HBsAg水平较高, 平均吸光度值为156.84±4.94, 而50 μg和100 μg M-PTD-HBcAg组平均吸光度显著下降, 分别为127.77±4.92和117.71±5.18, 说明经M-PTD-HBcAg融合蛋白免疫后转基因小鼠肝脏中HBsAg表达受到明显的抑制.
HBcAg含有丰富的体液和细胞免疫抗原表位, 能产生很强的细胞免疫反应, 是杀伤性T细胞识别并消除HBV感染细胞的靶抗原, 能刺激机体产生以Th1为主的细胞免疫[18]. 周福元 et al[19]证明HBcAg诱导特异性CTL对感染HBV的淋巴细胞的杀伤作用. 王莉et al[20]通过CPP Tat49-57携带H-2Kb限制性CTL表位OVA257-264进入MHC-Ⅰ类抗原提呈途径的机制研究, 证实了该融合蛋白能明显增加CTL的生成, 与我们报道的结果基本一致. 国外文献报道了PTD能跨膜转运抗原蛋白并增强抗原免疫性以抑制病毒复制及肿瘤的生长[21-22]. 基于本实验的研究成果, PTD-HBcAg融合蛋白免疫HBV转基因小鼠后能有效诱导特异性CTL生成, 同时能在体内抑制HBV复制, 进一步证实PTD-HBcAg融合蛋白的免疫功能, 为PTD作为载运工具携带抗原有效诱导特异性CTL增强机体免疫提供了理论依据, 同时也为抗HBV感染疫苗开发提供新的思路.
HBV感染是严重的公共卫生问题,全球约20亿人曾感染HBV, 其中3.5-4亿人为慢性HBV感染, 全球每年约100万人死于与HBV感染相关的肝病. 我国属乙型肝炎高发区, 约1.1亿人为慢性HBV感染.
孙殿兴, 主任医师, 白求恩国际和平医院肝病科.
HBV体内清除很大程度上依赖于活化表位肽特异性CTL, CTL通过T细胞受体特异性识别病毒肽段并通过MHC-Ⅰ类分子提呈引起感染细胞融解, 是宿主清除HBV的关键.
周福元 et al证明HBcAg诱导特异性CTL对感染HBV的淋巴细胞的杀伤作用. 王莉 et al通过CPP Tat49-57携带H-2Kb限制性CTL表位OVA257-264进入MHC-Ⅰ类抗原提呈途径的机制研究, 证实了该融合蛋白能明显增加CTL的生成.
本研究主要通过PTD-HBcAg融合蛋白免疫HBV转基因小鼠, 检测其在体内诱导特异性CTL及抑制HBV复制的能力, 为慢性乙型肝炎患者的免疫治疗提供新的思路.
本研究证实PTD-HBcAg融合蛋白免疫HBV转基因小鼠后能有效诱导特异性CTL生成, 同时能在体内抑制HBV复制, 进一步证实PTD-HBcAg融合蛋白的免疫功能, 为PTD作为载运工具携带抗原有效诱导特异性CTL增强机体免疫提供了理论依据, 同时也为抗HBV感染疫苗开发提供新的思路.
本研究内容是当前研究的热点, 为该领域提供了充足的有意义的信息, 创新性较强.
编辑: 李军亮 电编:吴鹏朕
| 1. | Penna A, Chisari FV, Bertoletti A, Missale G, Fowler P, Giuberti T, Fiaccadori F, Ferrari C. Cytotoxic T lymphocytes recognize an HLA-A2-restricted epitope within the hepatitis B virus nucleocapsid antigen. J Exp Med. 1991;174:1565-1570. [PubMed] [DOI] |
| 2. | Seeger C, Mason WS. Hepatitis B virus biology. Microbiol Mol Biol Rev. 2000;64:51-68. [PubMed] [DOI] |
| 3. | Yang SH, Lee CG, Park SH, Im SJ, Kim YM, Son JM, Wang JS, Yoon SK, Song MK, Ambrozaitis A. Correlation of antiviral T-cell responses with suppression of viral rebound in chronic hepatitis B carriers: a proof-of-concept study. Gene Ther. 2006;13:1110-1117. [PubMed] [DOI] |
| 4. | Thio CL, Thomas DL, Carrington M. Chronic viral hepatitis and the human genome. Hepatology. 2000;31:819-827. [PubMed] [DOI] |
| 5. | Reignat S, Webster GJ, Brown D, Ogg GS, King A, Seneviratne SL, Dusheiko G, Williams R, Maini MK, Bertoletti A. Escaping high viral load exhaustion: CD8 cells with altered tetramer binding in chronic hepatitis B virus infection. J Exp Med. 2002;195:1089-1101. [PubMed] [DOI] |
| 6. | Bertoletti A, Ferrari C. Kinetics of the immune response during HBV and HCV infection. Hepatology. 2003;38:4-13. [PubMed] [DOI] |
| 7. | Guidotti LG, Chisari FV. Noncytolytic control of viral infections by the innate and adaptive immune response. Annu Rev Immunol. 2001;19:65-91. [PubMed] [DOI] |
| 8. | Duan XZ, Wang M, Li HW, Zhuang H, Xu D, Wang FS. Decreased frequency and function of circulating plasmocytoid dendritic cells (pDC) in hepatitis B virus infected humans. J Clin Immunol. 2004;24:637-646. [PubMed] [DOI] |
| 9. | Beckebaum S, Cicinnati VR, Zhang X, Ferencik S, Frilling A, Grosse-Wilde H, Broelsch CE, Gerken G. Hepatitis B virus-induced defect of monocyte-derived dendritic cells leads to impaired T helper type 1 response in vitro: mechanisms for viral immune escape. Immunology. 2003;109:487-495. [PubMed] [DOI] |
| 10. | Kim D, Jeon C, Kim JH, Kim MS, Yoon CH, Choi IS, Kim SH, Bae YS. Cytoplasmic transduction peptide (CTP): new approach for the delivery of biomolecules into cytoplasm in vitro and in vivo. Exp Cell Res. 2006;312:1277-1288. [PubMed] [DOI] |
| 11. | Schirmbeck R, Riedl P, Zurbriggen R, Akira S, Reimann J. Antigenic epitopes fused to cationic peptide bound to oligonucleotides facilitate Toll-like receptor 9-dependent, but CD4+ T cell help-independent, priming of CD8+ T cells. J Immunol. 2003;171:5198-5207. [PubMed] |
| 12. | Ho A, Schwarze SR, Mermelstein SJ, Waksman G, Dowdy SF. Synthetic protein transduction domains: enhanced transduction potential in vitro and in vivo. Cancer Res. 2001;61:474-477. [PubMed] |
| 13. | Caron NJ, Torrente Y, Camirand G, Bujold M, Chapdelaine P, Leriche K, Bresolin N, Tremblay JP. Intracellular delivery of a Tat-eGFP fusion protein into muscle cells. Mol Ther. 2001;3:310-318. [PubMed] [DOI] |
| 15. | Chen X, Yu Y, Pan Q, Tang Z, Han J, Zang G. Enhancement of cytotoxic T lymphocyte activity by dendritic cells loaded with Tat-protein transduction domain-fused hepatitis B virus core antigen. Acta Biochim Biophys Sin (Shanghai). 2008;40:996-1004. [PubMed] [DOI] |
| 16. | Lok AS, McMahon BJ. Chronic hepatitis B: update of recommendations. Hepatology. 2004;39:857-861. [PubMed] [DOI] |
| 17. | Ho A, Schwarze SR, Mermelstein SJ, Waksman G, Dowdy SF. Synthetic protein transduction domains: enhanced transduction potential in vitro and in vivo. Cancer Res. 2001;61:474-477. [PubMed] |
| 18. | Cao T, Lazdina U, Desombere I, Vanlandschoot P, Milich DR, Sällberg M, Leroux-Roels G. Hepatitis B virus core antigen binds and activates naive human B cells in vivo: studies with a human PBL-NOD/SCID mouse model. J Virol. 2001;75:6359-6366. [PubMed] [DOI] |
| 20. | 王 莉, 孟 刚, 牛 微, 杨 曌, 徐 文岳, 赵 婷婷, 唐 艳, 赵 建平, 吴 玉章. CPP Tat49-57促进外源CTL表位进入MHC-Ⅰ类抗原呈递途径的机制研究. 免疫学杂志. 2006;22:247-251. |
| 21. | Chauhan A, Tikoo A, Kapur AK, Singh M. The taming of the cell penetrating domain of the HIV Tat: myths and realities. J Control Release. 2007;117:148-162. [PubMed] [DOI] |
| 22. | Muthumani K, Lambert VM, Shanmugam M, Thieu KP, Choo AY, Chung JC, Satishchandran A, Kim JJ, Weiner DB, Ugen KE. Anti-tumor activity mediated by protein and peptide transduction of HIV viral protein R (Vpr). Cancer Biol Ther. 2009;8:180-187. [PubMed] |