修回日期: 2009-09-09
接受日期: 2009-09-15
在线出版日期: 2009-10-08
目的: 研究在人胃癌细胞中, 细胞外信号调节蛋白激酶(extracellular signal-regulated kinase, ERK)通路对人胃癌细胞顺铂敏感性的影响.
方法: 采用MTT法测定顺铂对两种胃癌细胞MGC-803、BGC-823的增殖抑制影响, 测定PD98059作用BGC-823细胞后顺铂对细胞的增殖抑制影响. Western blot方法检测MGC-803、BGC-823细胞中谷胱甘肽-S-转移酶π(glutathione S-transferases π, GST-π)蛋白的表达; 及PD98059作用BGC-823细胞24 h后BGC-823细胞中p-ERK、GST-π蛋白的表达.
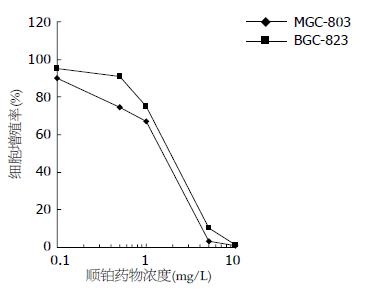
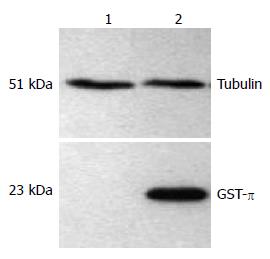
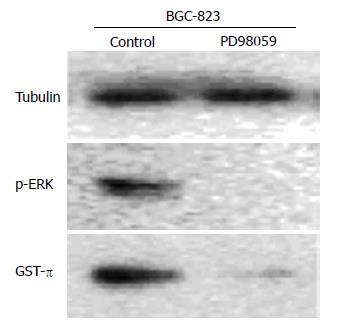
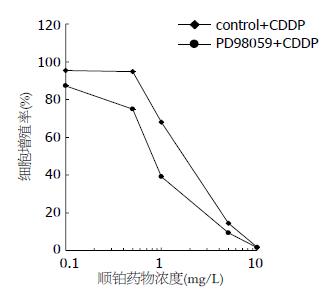
结果: 顺铂作用两种胃癌细胞72 h后, MGC-803, BGC-823细胞的IC50值分别为0.71和1.21 mg/L, 且MGC-803细胞的增殖率明显低于BGC-823细胞的增殖率(P<0.05). MGC-803细胞顺铂的敏感性高于BGC-823细胞. MGC-803细胞不表达GST-π蛋白, BGC-823细胞强表达GST-π蛋白. 20 μmol/L PD98059作用BGC-823细胞24 h后, p-ERK蛋白表达明显下调, GST-π蛋白表达亦明显下调. 20 μmol/L PD98059作用BGC-823细胞24 h后, 加入顺铂培养48 h, BGC-823+PD98059组增殖率明显低于对照组, BGC-823细胞对顺铂的敏感性明显增强.
结论: 下调胃癌细胞GST-π蛋白的表达可增强其对顺铂的敏感性; 抑制胃癌细胞中ERK通路的活化, 可以降低其细胞内GST-π蛋白表达; ERK通路通过调节人胃癌细胞GST-π基因表达影响其对顺铂的敏感性.
引文著录: 荆薇, 张晔, 刘云鹏, 侯柯佐. ERK通路对胃癌细胞顺铂敏感性的调节作用. 世界华人消化杂志 2009; 17(28): 2931-2935
Revised: September 9, 2009
Accepted: September 15, 2009
Published online: October 8, 2009
AIM: To investigate the regulatory role of the extracellular signal-regulated kinase (ERK) signaling pathway in sensitivity of gastric cancer cells to cis-platinum (CDDP).
METHODS: Gastric cancer cells (MGC-803 and BGC-823) were first treated with CDDP for 72 hours. Twenty-four hours after culture with PD98059, cells were treated with CDDP for 48 hours. Cell proliferation was then measured by methyl thiazolyl tetrazolium (MTT) assay. The expression of glutathione S-transferases π (GST-π) and p-ERK was detected by Western blot.
RESULTS: The half maximal inhibitory concentration (IC50) of CDDP for 72 hours in MGC-803 and BGC-823 cells were 0.71 and 1.21 mg/L, respectively. The proliferation rate of MGC-803 cells was significantly lower than that of BGC-823 cells (P < 0.05). MGC-803 cells did not express GST-π, while BGC-823 cells highly expressed GST-π. After PD98059 treatment for 24 h, the expression levels of p-ERK and GST-π significantly decreased in BGC-823 cells, and BGC-823 cells became more sensitive to CDDP.
CONCLUSION: Inhibition of the ERK signaling pathway may enhance the sensitivity of gastric cancer cells to CDDP, which is induced by downregulation of GST-π expression.
- Citation: Jing W, Zhang Y, Liu YP, Hou KZ. Regulatory role of the extracellular signal-regulated kinase signaling pathway in sensitivity of gastric cancer cells to cis-platinum. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2931-2935
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2931.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2931
胃癌是我国常见的恶性肿瘤之一, 死亡率高达29.31/10万. 临床发现病例多以进展期为主[1]. 因此在其综合治疗中, 除根治性手术外, 化疗亦占有重要的地位. 目前胃癌化疗方案多以氟尿嘧啶、铂类、阿霉素类等药物联合为主, 但由于胃癌原发或继发的多药耐药的存在, 严重影响了化疗的疗效及患者预后. 谷胱甘肽-S-转移酶π(glutathione S-transferases π, GST-π)作为Ⅱ相代谢酶家族的主要成员, 在胃癌中呈现高表达. 以往的研究显示, GST-π一方面可以作为肿瘤标志物提示肿瘤负荷[2]. 另一方面GST-π还与胃癌的原发或继发的多药耐药相关[3]. 细胞外信号调节激酶(extracellular signal-regulated kinase, ERK)是丝裂原活化蛋白激酶(mitogen-activated protein kinase, MAPK)家族的一员, 与细胞增殖、分化、细胞形态维持、细胞凋亡和细胞的恶变等多种生物学反应有关[4]. 其可通过抑制凋亡促进细胞生长. 本研究旨在分子水平探讨影响人胃癌细胞顺铂敏感性的因素, 以期为临床胃癌患者个体化治疗提供基础支持.
RPMI 1640购于Gibco公司, 胎牛血清购于中国医学科学院血液研究所; GST-π抗体(兔抗人, 武汉博士德), p-ERK抗体(Promega), 二抗(山羊抗兔, 中杉公司), 顺铂(齐鲁制药).
1.2.1 细胞培养: 胃癌MGC-803、BGC-823细胞株生长于含有100 mL/L, 56℃, 30 min灭活胎牛血清, 12 kU/L庆大霉素的RPMI 1640培养液中. 于37℃, 50 mL/L CO2饱和湿度的培养箱内传代培养.
1.2.2 MTT法测定铂类对细胞的增殖抑制作用: 取对数生长期细胞, 调整细胞浓度为4×107个/L, 接种于96孔培养板内, 每孔180 μL, 培养24 h后加药, 实验组加作用药物顺铂, 终浓度分别为0.1, 0.5, 1, 5, 10 mg/L. 对照组不加任何处理因素. 空白组为等体积RPMI 1640培养液. 每组设3个平行孔, 培养72 h. PD98059(20 μmol/L)作用BGC-823细胞24 h后, 方法同上培养接种于96孔板, 加入顺铂后, 培养48 h. 各孔加入20 μL MTT(5 g/L), 孵育4 h后弃上清, 加100 μL DMSO混匀震荡15 min后, 用酶联免疫测定仪于570 nm波长条件下测定各孔的吸光度值(A值). 算出3孔平均值, 并按公式计算细胞增殖率, 画出细胞生存曲线, 求出IC50, 以上实验重复3次. 细胞生长的增殖率(%) = (实验组A均值-空白组A均值)/(对照组A均值-空白组A均值)×100%.
1.2.3 Western blot方法检测p-ERK、GST-π蛋白的表达: 收集4℃预冷PBS洗涤MGC-803, BGC-823, PD98059(20 μmol/L)作用24 h后的BGC-823细胞, 裂解于100 μL含有蛋白酶抑制剂的RIPA裂解液中, 超声粉碎后4℃裂解40 min, 4℃ 15 000 r/min, 离心30 min取上清. 以上步骤均于冰上操作. 采用Lowry法进行总蛋白定量. 以1:2比例与3×样品缓冲液混匀, 煮沸5 min. 将样品在12% SDS-聚丙烯凝胶中进行电泳2 h. 后通过半干式转印(恒流60 mA, 20 min, 后120 mA, 15 min)转印到硝酸纤维素膜上, 50 g/L脱脂奶粉封闭2 h, 按预染Marker标记的分子量剪裁转印膜, 一抗(兔抗人GST-π 1:500; p-ERK 1:250), 4℃过夜, 二抗(山羊抗兔1:800)室温孵育30 min, 显色, 图像采集及分析处理.
统计学处理 所有的实验均重复3次, 采用SPSS11.0软件进行统计学分析, 差异的显著性采用t检验, P<0.05有统计学意义.
0.1-10 mg/L的顺铂(cis-platinum, CDDP)处理2种胃癌细胞72 h, CDDP以剂量依赖方式抑制胃癌细胞增殖, 将所得结果绘制细胞增殖抑制曲线, 示MGC-803组增殖率明显低于BGC-823组(图1), 且2组间差异有统计学意义(P<0.05). MGC-803, BGC-823细胞72 h抑制细胞增殖50%的药物浓度IC50分别为0.71、1.21 mg/L.
在2种胃癌细胞系中GST-π蛋白表达存在差异. MGC-803细胞无GST-π蛋白表达, BGC-823细胞GST-π呈强表达(图2).
20 μmol/L PD98059处理BGC-823细胞24 h后, 明显下调了p-ERK的表达, 通过抑制ERK的磷酸化, 从而抑制ERK通路的传导. 同时出现GST-π蛋白表达的下调(图3).
PD98059(20 μmol/L)作用BGC-823细胞24 h后, 0.1-10 mg/L CDDP处理48 h, 实验组细胞增殖率明显低于对照组(图4), 对顺铂的敏感性明显增加.
胃癌是我国常见的消化系统恶性肿瘤之一, 目前主要以包含手术和化疗的综合治疗为主. 进展期胃癌患者化疗临床反应性差异导致肿瘤复发及总生存缩短. 研究表明肿瘤原发性及继发性耐药在其中发挥重要的作用. 尤其是肿瘤的多药耐药(multidrug resistance, MDR), 严重影响了化疗的疗效及患者预后[5].
铂类药物具有广泛的抗癌活性, 已成为癌症化疗中不可缺少的药物. 药理学特性为以DNA为靶点, 与DNA链上的G共价结合并可能形成链间交联从而阻断DNA的复制及转录. 顺铂为第一代铂类药物, 在肺癌、食管癌、卵巢癌、胃肠道肿瘤中成为推荐用药. 在临床上胃癌的治疗中多采用以铂类和氟尿嘧啶类药物联合方案, 但大部分患者存在原发耐药, 从而导致化疗失败, 疾病复发.
GST-π是一种酸性蛋白质, 包含2个亚基, 每个亚基由209个氨基酸构成, 在除大部分的前列腺癌外, 在如结肠癌、胃癌、膀胱癌、食管癌、肺癌等多种恶性肿瘤组织中高表达[6]. Doğru-Abbasoğlu et al的研究显示, GST-π在胃癌组织及血清中的表达明显高于正常患者[7]. 但目前的研究表明其与肿瘤耐药亦具有重要的相关性. 作为谷胱甘肽转硫酶(glutathione S-transferases, GSTs)Ⅱ相代谢酶家族的重要成员之一, GST-π一方面能够催化谷胱甘肽与抗肿瘤药物结合促进这些药物的排出, 最新的研究证实其还能够通过蛋白-蛋白相互作用, 调节丝裂原活化的蛋白激酶信号通路(MAPK), 从而影响细胞生长及细胞凋亡[8-9]. Townsend et al研究结果显示GST-π的高表达导致肿瘤对如顺铂、阿霉素等多种化疗药物耐药, 并提示GST-π在肿瘤的原发及继发耐药中发挥重要的作用[10]. 针对GST-π的耐药作用机制, 临床出现了多种如GST-π抑制剂-谷胱甘肽类似物TER199、谷胱甘肽转硫酶抑制剂等靶向治疗方法. 部分已试验性应用于临床治疗, 提高了化疗药物的细胞毒性作用. 另外RNA干扰技术可通过基因沉默作用, 根本上抑制GSTP1基因蛋白水平的表达, 从而有望成为未来靶向治疗的发展方向[11]. 目前有关GST-π与化疗药物耐药报道多集中于卵巢癌、肺癌、前列腺癌和消化系等肿瘤. 然而国内在GST-π与胃癌耐药的关系研究上多局限于对患者的病理组织表达量的评价与其可能存在耐药的推测上. 本研究中以不同浓度的顺铂作用于两种胃癌细胞系72 h, CDDP组中发现MGC-803细胞IC50值低于BGC-823细胞系, 分别为0.71、1.21 mg/L. MGC-803细胞对顺铂的敏感性高于BGC-823组. 进行两组增殖率配对t检验分析P<0.05, 具有统计学意义. 同时对多药耐药相关蛋白进行检测发现BGC-823细胞GST-π蛋白强表达, 这与免疫组化研究中所得的胃癌GST-π强表达的结果相一致[12]. 而人胃癌细胞MGC-803的GST-π蛋白表达缺失. 两种胃癌细胞对顺铂的敏感性与其GST-π蛋白水平的差异表现相关. 经本实验室利用RT-PCR方法检测两种细胞GST-π的mRNA的表达情况, 证实其与蛋白表达水平一致(数据未显示). 这与Wang et al[13], Chan et al[14]报道的GST-π蛋白的表达在转录水平受到调控的结果一致.
ERK是MAPK家族的一员, 控制着细胞增殖与分化、细胞形态维持、细胞凋亡和细胞的恶变等多种生物学反应[4]. 在人类的许多恶性肿瘤中都可发现ERK的过度激活. 其一方面接受生长因子、丝裂原、环境刺激等信号; 另一方面通过ERK信号级联反应激活后由胞质转位入胞核, 作用于核转录因子如转录因子AP-1(activator protein 1, AP-1)、核转录因子-κB(nuclear factor kappa B, NF-κB)等调控基因表达. 由此广大研究者将ERK通路视为肿瘤的治疗的新靶点[15-16]. Kim et al提出在氧化应激条件下, 肿瘤细胞启动细胞保护机制, 通过ERK通路的活化使转录因子NF-E2相关因子2(Nuclear factor-E2 related factor2, Nrf2)磷酸化, 导致其与胞质蛋白伴侣分子Keap1 (kelch-like ECH associating protein 1, Keap1)蛋白的解离, 进入细胞核内与Maf家族蛋白形成杂二聚体与抗氧化剂反应元件(antioxidant response element, ARE)结合从而促进GSTP1基因的转录[17]. 另外Tsai et al研究发现大蒜有机硫化物通过活化ERK通路, 增强AP-1与GSTP1基因的结合诱导Colon 9细胞中GST-π蛋白的表达. 抑制ERK活性后, 下调了Colon 9细胞中GST-π蛋白表达[18]. 本实验中采用MEK/ERK抑制剂PD98059作用BGC-823细胞24 h, 与对照组相比p-ERK的表达明显下调, ERK磷酸化明显降低, 同时伴随GST-π蛋白表达的下调. 提示胃癌细胞BGC-823中, PD98059作为ERK上游激酶MEK1(mitogen-activated protein kinase kinase-1)的抑制剂, 通过抑制ERK信号通路活化下调的GST-π蛋白的表达. 其可能是通过抑制ERK信号通路活化, 降低Nrf2磷酸化, 降低其与抗氧化剂反应元件(ARE)结合, 及降低AP-1与GSTP1基因的结合等途径来实现的.
本次研究发现, 人胃癌MGC-803细胞无GST-π蛋白表达, BGC-823细胞GST-π呈强表达, 同时伴有MGC-803细胞对顺铂敏感性强于BGC-823细胞. MEK/ERK抑制剂PD98059作用于BGC-823细胞24 h, ERK磷酸化水平明显降低, 同时伴随GST-π蛋白表达的下调. 我们发现阻断ERK通路活化, 可以实现对人胃癌细胞GST-π蛋白的表达的下调, 同时伴随对顺铂的敏感性增加. 本研究探讨了除GSTP1基因启动子甲基化及编码启动子区基因异常等其他影响GST-π蛋白表达的因素, 为解决胃癌患者顺铂、阿霉素、烷化剂类等化疗药物耐药问题提供进一步的理论依据, 并为解决胃癌耐药的靶向治疗提供新的靶点.
胃癌原发及继发性耐药是严重影响化疗疗效及患者预后的重要原因之一. 谷胱甘肽-S-转移酶π是一种多药耐药相关蛋白, 与肿瘤对铂类等化疗药物耐药相关. 下调谷胱甘肽-S-转移酶π的表达可以提高胃癌对铂类药物的敏感性.
王振宁, 教授, 中国医科大学附属第一医院肿瘤外科; 刘冰熔, 教授, 黑龙江省哈尔滨医科大学附属第二临床医院消化内科
肿瘤的多药耐药是目前肿瘤化疗领域的研究热点. 本研究通过阻断ERK通路活化, 下调人胃癌细胞中GST-π蛋白的表达, 增强胃癌细胞对顺铂的敏感性. 为解决胃癌患者铂类等化疗药物耐药提供理论依据.
Tsai et al研究发现大蒜有机硫化物通过活化ERK通路, 诱导Colon 9细胞中GST-π蛋白的表达. 抑制ERK活性后, 可下调细胞中GST-π蛋白表达. Kim et al提出在氧化应激条件下, 肿瘤细胞通过ERK通路的活化使Nrf2进入细胞核内与Maf形成杂二聚体与抗氧化剂反应元件结合促进GSTP1基因的转录.
本研究探讨了除GSTP1基因启动子甲基化及编码启动子区基因异常等外其他影响GST-π蛋白表达的因素, 为解决胃癌耐药的靶向治疗提供新的靶点.
通过利用ERK上游激酶MEK1的抑制剂PD98059, 抑制ERK信号通路活化, 下调GST-π蛋白表达, 增强胃癌细胞对顺铂的敏感性, 为进一步解决肿瘤耐药提供了方法及途径, 具有重要的临床实践意义.
本实验试图研究ERK信号通路对人胃癌细胞顺铂敏感性的影响, 设计较为严谨, 研究方法得当, 研究结果具有一定的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Sun XD, Mu R, Zhou YS, Dai XD, Zhang SW, Huangfu XM, Sun J, Li LD, Lu FZ, Qiao YL. [Analysis of mortality rate of stomach cancer and its trend in twenty years in China]. Zhonghua Zhongliu Zazhi. 2004;26:4-9. [PubMed] |
| 2. | Kim B, Bang S, Lee S, Kim S, Jung Y, Lee C, Choi K, Lee SG, Lee K, Lee Y. Expression profiling and subtype-specific expression of stomach cancer. Cancer Res. 2003;63:8248-8255. [PubMed] |
| 3. | Townsend DM, Findlay VL, Tew KD. Glutathione S-transferases as regulators of kinase pathways and anticancer drug targets. Methods Enzymol. 2005;401:287-307. [PubMed] |
| 4. | Ramos JW. The regulation of extracellular signal-regulated kinase (ERK) in mammalian cells. Int J Biochem Cell Biol. 2008;40:2707-2719. [PubMed] |
| 5. | Kwon HC, Roh MS, Oh SY, Kim SH, Kim MC, Kim JS, Kim HJ. Prognostic value of expression of ERCC1, thymidylate synthase, and glutathione S-transferase P1 for 5-fluorouracil/oxaliplatin chemotherapy in advanced gastric cancer. Ann Oncol. 2007;18:504-509. [PubMed] |
| 6. | McCarver DG, Hines RN. The ontogeny of human drug-metabolizing enzymes: phase II conjugation enzymes and regulatory mechanisms. J Pharmacol Exp Ther. 2002;300:361-366. [PubMed] |
| 7. | Doğru-Abbasoğlu S, Mutlu-Türkoğlu U, Türkoğlu S, Erbil Y, Barbaros U, Uysal M, Aykaç-Toker G. Glutathione S- transferase-pi in malignant tissues and plasma of human colorectal and gastric cancers. J Cancer Res Clin Oncol. 2002;128:91-95. [PubMed] |
| 8. | Ruscoe JE, Rosario LA, Wang T, Gaté L, Arifoglu P, Wolf CR, Henderson CJ, Ronai Z, Tew KD. Pharmacologic or genetic manipulation of glutathione S-transferase P1-1 (GSTpi) influences cell proliferation pathways. J Pharmacol Exp Ther. 2001;298:339-345. [PubMed] |
| 9. | Wang T, Arifoglu P, Ronai Z, Tew KD. Glutathione S-transferase P1-1 (GSTP1-1) inhibits c-Jun N-terminal kinase (JNK1) signaling through interaction with the C terminus. J Biol Chem. 2001;276:20999-21003. [PubMed] |
| 10. | Townsend DM, Tew KD. The role of glutathione-S-transferase in anti-cancer drug resistance. Oncogene. 2003;22:7369-7375. [PubMed] |
| 11. | Turella P, Cerella C, Filomeni G, Bullo A, De Maria F, Ghibelli L, Ciriolo MR, Cianfriglia M, Mattei M, Federici G. Proapoptotic activity of new glutathione S-transferase inhibitors. Cancer Res. 2005;65:3751-3761. [PubMed] |
| 13. | Wang YY, Teicher BA, Shea TC, Holden SA, Rosbe KW, al-Achi A, Henner WD. Cross-resistance and glutathione-S- transferase-pi levels among four human melanoma cell lines selected for alkylating agent resistance. Cancer Res. 1989;49:6185-6192. [PubMed] |
| 14. | Chan QK, Khoo US, Chan KY, Ngan HY, Li SS, Chiu PM, Man LS, Ip PP, Xue WC, Cheung AN. Promoter methylation and differential expression of pi-class glutathione S-transferase in endometrial carcinoma. J Mol Diagn. 2005;7:8-16. [PubMed] |
| 15. | Roberts PJ, Der CJ. Targeting the Raf-MEK-ERK mitogen-activated protein kinase cascade for the treatment of cancer. Oncogene. 2007;26:3291-3310. [PubMed] |
| 16. | Wong KK. Recent developments in anti-cancer agents targeting the Ras/Raf/ MEK/ERK pathway. Recent Pat Anticancer. Drug Discov. 2009;4:28-35. [PubMed] |
| 17. | Kim SG, Lee SJ. PI3K, RSK, and mTOR signal networks for the GST gene regulation. Toxicol Sci. 2007;96:206-213. [PubMed] |
| 18. | Tsai CW, Chen HW, Yang JJ, Sheen LY, Lii CK. Diallyl disulfide and diallyl trisulfide up-regulate the expression of the pi class of glutathione S-transferase via an AP-1-dependent pathway. J Agric Food Chem. 2007;55:1019-1026. [PubMed] |