修回日期: 2009-09-25
接受日期: 2009-09-28
在线出版日期: 2009-10-08
目的: 检测喜树碱活性代谢产物SN-38载药纳米微球(SN-38-np)的各项特征, 比较该载药纳米微球与裸药抗人胃癌肿瘤细胞BGC-823的效果.
方法: 用溶剂分散法制备SN-38/PCL-PEG纳米微球. 原子力显微镜和透射电子显微镜观察纳米微球形态, 采用高效液相色谱法(HPLC)测定SN-38浓度并计算该载药微球载药量、包封率及描绘其体外释放曲线. 采用MTT法观察该微球对人胃癌细胞株BGC-823的生长抑制效果, 荧光显微镜检测细胞内活性氧(ROS)水平.
结果: 微球为不规则的圆形, 平均粒径小于100 nm. 载药量11%左右, 包封率80%左右; SN-38纳米微球可稳定溶解于水中且具有良好的缓释特性; MTT结果显示, 较低浓度的SN-38载药纳米微球在72 h抑制肿瘤效果明显优于SN-38裸药, 同时计算IC50发现SN-38载药纳米微球在24 h和72 h的IC50明显低于SN-38裸药(P<0.05), 两者48 h时间点的IC50相当; 细胞内活性氧(ROS)检测结果显示: 裸药和载药微球均可明显诱导ROS产生, 在较低作用浓度时, SN-38载药纳米微球可比裸药诱导产生更多的细胞内ROS产物.
结论: SN-38载药纳米微球可使细胞内达到并维持有效药物浓度, 即使在较低作用浓度下亦可持续有效的抑制肿瘤细胞生长, 效果明显优于相同浓度下SN-38裸药.
引文著录: 孙国庆, 胡勇, 李晓林, 孙昊. SN-38载药纳米微球对人胃癌细胞BGC-823的抑制作用. 世界华人消化杂志 2009; 17(28): 2871-2876
Revised: September 25, 2009
Accepted: September 28, 2009
Published online: October 8, 2009
AIM: To investigate the characteristics of SN-38-loaded polymeric micelles and compare their inhibitory effect on human gastric adenocarcinoma BGC-823 cells with that of free SN-38.
METHODS: SN-38/PCL-PEG nanoparticles (SN-38-NP) were synthesized by solvent diffusion method. The morphology of nanoparticles were detected by atomic force microscopy and transmission electron microscopy. The drug loading content, encapsulation efficiency, and in vitro release of SN-38-NP were evaluated by ultraviolet spectrophotometry and high-performance liquid chromatography (HPLC). The effects of SN-38-NP on the proliferation of BGC-823 cells were examined by methyl thiazolyl tetrazolium (MTT) assay. The level of reactive oxygen species (ROS) was detected by dichlorofluorescein (DCF) assay.
RESULTS: The average diameter of drug-loaded nanoparticles was less than 100 nm. The drug-loaded nanoparticles had higher drug loading content (about 11%) and encapsulation efficiency (about 80%) than free SN-38. SN-38 could be effectively incorporated into nanoparticles with core-shell structure to act as a water-soluble controlled release drug delivery system. The results of MTT assay showed that the half maximal inhibitory concentration (IC50) of SN-38-NP was obviously lower than that of free SN-38 at 24 and 72 h after treatment (P < 0.05) though there was no significant difference at 48 h. Although both free SN-38 and SN-38 nanoparticles could increase ROS production, the SN-38-NP induced more ROS at low concentrations (P < 0.05).
CONCLUSION: SN-38-NP could be effectively incorporated into core-shell nanoparticles to act as a water-soluble controlled release drug delivery system. SN-38-NP is superior to free SN-38 in restraining the growth of tumor cells even at low concentrations.
- Citation: Sun GQ, Hu Y, Li XL, Sun H. SN-38-loaded polymeric micelles can inhibit the growth of human gastric adenocarcinoma BGC-823 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(28): 2871-2876
- URL: https://www.wjgnet.com/1009-3079/full/v17/i28/2871.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i28.2871
丙喜树碱(camptothecin, CPT)是一种从珙桐科植物喜树中分离得到的细胞毒性生物碱, 因其对哺乳细胞中DNA和RNA的合成有明显的抑制作用而获得临床的广泛重视[1]. 大规模临床试验均证实了其对消化系恶性肿瘤, 如胃癌, 肠癌等以及急慢性粒细胞白血病、膀胱癌等有较好的疗效[2-3]. 但由于他能引起骨髓抑制、呕吐、腹泻和严重出血等不良反应限制其在临床的进一步应用[4]. 羟基喜树碱(7-乙基, 10-羟基喜树碱, hydroxycamptothecin, HCPT)的活性代谢产物SN-38, 是喜树碱经化学结构改进而制得的衍生物, 具有抗癌作用强、抗癌活性高, 在多种人肿瘤移植细胞中显示出潜在的活性, 可与多种抗肿瘤药物配伍产生协同作用且无交叉耐药等特点[5], 其作用机制主要是通过抑制DNA拓扑异构酶Ⅰ(TopoⅠ)抑制细胞分裂, 同时诱导细胞内活性氧产物增多诱导多个凋亡相关途径[6]. 由于SN-38存在E-内酯环闭环结构而极难溶于水, 目前临床使用的SN-38是经过碱化开环后溶于水的羧酸盐注射液, 但是其质量不稳定、开环后活性降低、体内半衰期短、代谢较快等缺陷严重影响疗效. 为了提高SN-38及其他喜树碱衍生物的水溶性并延长其体内半衰期, 学者已开始对其剂型进行改造[7]. 近年来, 两亲嵌段共聚物(amphiphilic block polymer)微球药物剂型逐渐成为生物医学工程以及药物、基因[8]等领域研究较多的材料之一, 尤其是在药物的控释、缓释、靶向以及智能药物缓释系统中的应用受到了广泛的关注[9]. 他由亲水和疏水链节组成球形芯-壳微球结构. 疏水嵌段组成的微球的芯可以用为微药库, 而围绕芯核的亲水嵌段构成水合性外壳可保护内核逃避肝脏吞噬细胞的吞噬, 其粒径小, 可在体内缓释, 延长药物的体内半衰期并产生独特分布[10-11]. 因此, 本实验选用美国FDA批准可用于人体的聚己内酯-聚乙二醇(PCL-PEG)作为载体高分子材料制备SN-38纳米微球, 并对其性能, 表征以及体外抑瘤效果等进行了考察.
SN-38, 聚己内酯(使用前用CaH2干燥后减压蒸馏), 单甲氧基聚乙二醇(mPEG, 相对分子质量为4000 Da), MTT试剂, 2, 7二氯二氢荧光素乙酰乙酸(DCFDA)均购自美国Sigma公司; 人胃癌BGC-823细胞株购自中国科学院上海细胞生物所; RPMI 1640培养基、胎牛血清(FBS)购自美国Invitrogen公司; 其他试剂为进口或国产分析纯. 激光粒径测定仪(美国Brookheaven公司), 红外测定仪(美国Brookheaven公司), 原子力显微镜(日本Seiko公司), 透射电子显微镜(美国Brookheaven公司), 荧光显微镜(日本Nikon公司).
1.2.1 载体材料的合成以及SN-38纳米微球的制备: 用开环聚合法制备PCL-PEG二嵌段共聚物[12], 其中PCL为相对分子质量20000 Da, PEG为相对分子质量4000 Da. 采用溶剂分散法制备SN-38微球: 将一定量的SN-38与PCL-PEG溶于丙酮, 将得到的溶液滴入正在搅拌的水中, 透析除去其中所含的丙酮即得到SN-38纳米微球. 空白纳米微球的制备采用相同的方法但只不加SN-38.
1.2.2 SN-38纳米微球的形态观察以及粒径分布: 用原子力显微镜和透射电子显微镜观察SN-38纳米微球的形态, 并用动态光散射仪测定纳米微球的粒径.
1.2.3 SN-38纳米微球的载药量以及包封率的测定: 取出一定量的载药微球的分散液在40℃下真空干燥, 残留物经准确称质量后溶解于一定量的流动相, 高效液相色谱(HPLC)测定微球中SN-38的含量[13]. SN-38流动相为磷酸二氢钠(pH3.1, 25 mmol/L)和乙腈胺50:50体积比配制. 在紫外波长微265 nm处测定吸光度, 根据标准曲线求出溶液中的SN-38含量, 进而根据以下公式得出载药量(loading capacity)和包封率(encapsulation efficiency): 载药量 = 载药纳米微球中所含的药物量(MSN-38)/微球的总质量(MSN-38+MPEG-PBLG)×100%; 包封率 = 载药纳米微球中所含的药物量(MSN-38)/投入的总药量(MSN-38投药量)×100%.
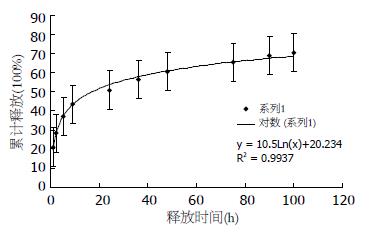
1.2.4 SN-38纳米微球的体外释放实验: 将一定量的SN-38微球溶液放入透析袋中(Cut-off相对分子质量为12 000 Da), 然后将透析袋完全浸入0.01 mol/L PBS, pH7.4, 整个释放实验于37℃下进行. 分别于1、2、5、9、24、36、48、75、90、100 h时间点取出外液, 并加入新的等量PBS. 所得到的不同时间点的外液用HPLC法测定SN-38浓度, 并描绘体外累积释放特征. 色谱测定方法同上.
1.2.5 SN-38纳米微球作用的细胞增殖实验: 细胞在含100 mL/L胎牛血清的RPMI 1640培养液中培养. 在96孔板中每孔接种细胞103/100 μL, 37℃, 50 mL/L CO2, 连续培养24 h后吸弃上清液, 加入含不同浓度SN-38的培养基每孔100 μL, 继续培养至不同时间点, 逐孔中加入MTT溶液(5 g/L)20 μL, 4 h后去上清, 加入150 μL DMSO振荡10 min后比色, 选择 490 nm波长处测定吸光值(酶标仪, Bio-Rad680, 美国). 计算SN-38的半数抑制浓度IC50值.
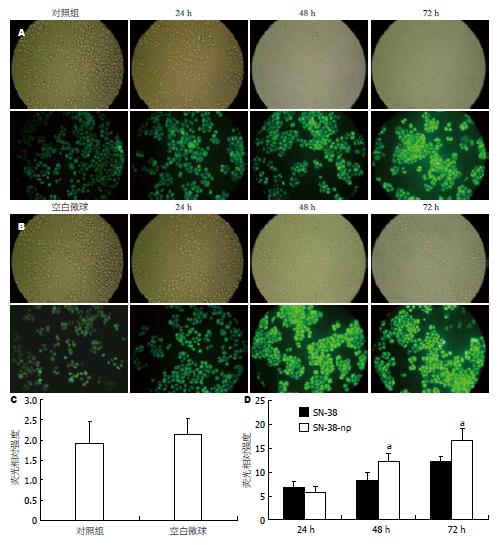
1.2.6 SN-38纳米微球对细胞内活性氧(ROS)水平的影响: 采用荧光探针2, 7-二氯二氢荧光素乙酰乙酸(DCFDA)检测细胞内活性氧的含量. 设置SN-38裸药组, SN-38微球组及相应的对照组. 转种人胃癌细胞株BGC-823细胞于6孔培养板中, 待细胞生长至70%汇合时更换培养液, 加入SN-38裸药与SN-38纳米微球(剂量均对应于SN-38裸药, 15 µg/L)干预相应时间, 于实验结束前30 min加入4 µmol/L DCFDA, 继续37℃孵育30 min, PBS洗2次, 应用荧光显微镜检测荧光(激发光492 nm, 发射光530 nm), 于培养板不同位置随机选择6处成像, 荧光图片通过Image-Pro Plus version 6.0软件分析细胞内荧光强度, 荧光强度与ROS产物水平成正相关.
统计学处理 所有统计分析均通过SPSS11.5统计软件完成. 正态分布的资料应用t检验和方差分析比较差异. 数据均用mean±SD表示. P<0.05为有统计学意义.
可见所得到的微球为不规则的圆形, 表面光滑, 其平均粒径小于100 nm. 通过调整投料比, 从初始投药比5:1, 提高到10:4, 所测的载药量在11%左右, 包封率则在80%左右(图1, 表1).
| 微球 | 粒径(nm) | 多分散性 | 载药量(%) | 包封率(%) |
| 空白微球 | 78.3±0.9 | 0.14±0.04 | NA | NA |
| SN-38微球 | 90.1±2.5 | 0.15±0.06 | 11.5±2.2 | 80±6.5 |
SN-38纳米微球具有良好的体外突释-缓释特性, 在最初的6 h内, 大约有35%的SN-38释放, 而在随后的3 d内, 总共释放出了62%左右的SN-38(图2). 由此可以发现SN-38被载入纳米微球后, 可以达到一个长时释放的效果, 同时由于两亲嵌段高分子共聚物的特性, 即一端疏水, 一端亲水, 使得SN-38在开始的几小时内有一个突释效应, 随后则表现为缓释的特点. 这样使得该微球在体内发挥疗效时可以通过最初的突释来达到一个较高的血药浓度, 而随后的长时释放则为保持一定的有效浓度提供了保证, 从而达到了长效缓释的抗肿瘤效果.
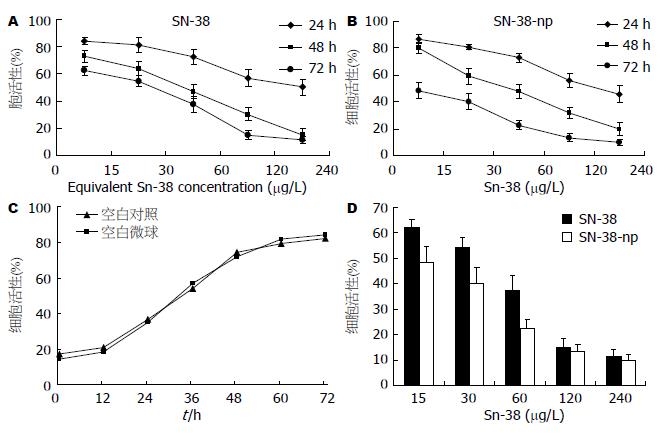
对于人胃癌细胞株BGC-823细胞, SN-38纳米微球与SN-38裸药都具有明显的杀伤作用, 且都具有浓度以及时间依赖性(图3A-B); 空白载药微球则对细胞生长基本无毒性(图3C); 较低浓度的SN-38载药纳米微球在72 h抑制肿瘤效果明显优于SN-38裸药(图3D); 同时计算IC50发现SN-38载药纳米微球在24 h和72 h的IC50明显低于SN-38裸药, 两者48 h的IC50相当(表2).
| IC50(μg/L) | 24 h | 48 h | 72 h |
| SN-38裸药 | 245.08±11.34 | 49.09±7.62 | 30.27±4.41 |
| SN-38微球 | 198.83±6.88 | 54.07±10.04 | 12.88±4.57 |
SN-38引起ROS增多是SN-38作用下的早期变化之一, 而细胞内ROS的增多则提示细胞凋亡的发生. 由于SN-38可以显著诱导产生大量ROS, 在高浓度药物干预下可能会湮没差异, 因此我们通过文献[6]及预实验结果, 选择15 μg/L这个轻微抑制肿瘤生长的浓度作为ROS检测的干预浓度. 结果显示: 载药微球组和裸药组细胞内ROS水平均明显升高(与对照组比较, P<0.05)并呈现时间依赖性特征(图4A-B); 而纳米材料对细胞内ROS水平并没有影响(图4C); 24 h时, 载药微球组细胞内ROS水平与裸药组无明显差异, 但随着时间的进行, 我们发现载药微球于48、72 h诱导产生的ROS产物显著高于裸药(P<0.05, 图4D), 进一步说明SN-38载药纳米微球良好的缓释特性.
本研究选用聚己内酯与聚乙二醇合成的二嵌段共聚物(PCL-PEG)作为药物载体制备纳米级的SN-38载药微球, 聚己内酯与聚乙二醇均为美国FDA批准医用的材料, 具有可生物降解性的特点. 载药两亲嵌段共聚物纳米微球是一种新型的药物缓释系统, 聚己内酯作为疏水端, 可以使脂溶性的药物更容易被载入微球; 聚乙二醇作为亲水端在水中自组装成较小粒径的纳米粒子, 有研究表明聚乙二醇修饰的微球能够减少网状内皮系统(RES)对于微球的摄取从而使微球在体内能存留更长的时间, 避免其在血清中迅速代谢, 更容易达到肿瘤组织发挥药效[14]; 同时药物被高分子材料负载成为载药纳米粒子具有裸药所不能比拟的低毒性, 这为在以后的使用中增加药物的使用剂量而不引起毒性反应提供了依据[15-16]. 为临床提供高效低毒的抗肿瘤药物新载体奠定了基础.
本实验中二嵌段共聚物(PCL-PEG)作为载体进行物理包埋获得了不错的载药效率, 所制备的SN-38纳米微球的载药量达到了11%左右, 包封率达到80%左右.
细胞活力实验和ROS水平检测结果证实通过载药纳米微球的改造, 使得SN-38具有良好的水溶性和缓释作用, 并且可以使药物的使用浓度降低, 同时能够较长时间保持在有效杀伤肿瘤细胞的水平, 继而达到了优于裸药的效果. 纳米改造后的SN-38在较低的药物浓度下即可诱导产生大量的细胞内ROS产物, 一方面与纳米微球的缓释特性有关, 另一方面与纳米微球进入细胞方式有关: 细胞通过高效的胞吞作用摄取纳米微球药物[17], 从而在低浓度作用时也能达到比较高的胞内药物浓度, 从而高效持续的诱导细胞内活性氧产生参与细胞的凋亡或死亡.
比较SN-38纳米改造前后, SN-38纳米微球药物性质更稳定, 杀伤肿瘤细胞的效果更佳. 这些优势为SN-38载药纳米微球未来临床应用提供了支持, 同时特异性肿瘤靶向的纳米载体将是我们今后努力的方向.
羟基喜树碱活性代谢产物SN-38, 是喜树碱经化学结构改进而制得的衍生物, 具有抗癌作用强、活性高等特点. 为了提高SN-38及其他喜树碱衍生物的水溶性并延长其体内半衰期, 学者已开始对其剂型进行改造.
李军祥, 教授, 北京中医药大学附属东方医院消化内科
近年来, 两亲嵌段共聚物微球逐渐成为生物医学工程以及药物、基因等领域研究较多的材料之一, 聚己内酯-聚乙二醇(PCL-PEG)作为载体高分子材料制备SN-38纳米微球, 具有良好的水溶性和缓释作用, 并且可以使药物的使用浓度降低.
有研究表明, 聚乙二醇修饰的微球能够减少网状内皮系统(RES)对于微球的摄取从而使微球在体内能存留更长的时间, 避免其在血清中迅速代谢, 更容易达到肿瘤组织发挥药效; 同时药物被高分子材料负载成为载药纳米粒子具有裸药所不能比拟的低毒性.
通过剂型改造, SN-38纳米微球药物性质更稳定, 杀伤肿瘤细胞的效果更佳. 这些优势为SN-38载药纳米微球未来临床应用提供了支持, 同时特异性肿瘤靶向的纳米载体将是我们今后努力的方向.
本研究设计合理, 方法先进, 具有较好的实用性.
编辑: 李军亮 电编:吴鹏朕
| 1. | Cook CE, Whichard LP, Turner B, Wall ME, Egley GH. Germination of Witchweed (Striga lutea Lour.): Isolation and Properties of a Potent Stimulant. Science. 1966;154:1189-1190. [PubMed] |
| 2. | Kaneda N, Hosokawa Y, Yokokura T, Awazu S. Plasma pharmacokinetics of 7-ethyl-10-hydroxycamptothecin (SN-38) after intravenous administration of SN-38 and irinotecan (CPT-11) to rats. Biol Pharm Bull. 1997;20:992-996. [PubMed] |
| 3. | 孙 元珏, 赵 晖, 郭 跃武, 林 峰, 蔡 讯, 唐 晓春, 汤 丽娜, 姚 阳. 草酸铂及羟基喜树碱联合亚叶酸钙和氟尿嘧啶治疗进展期结直肠癌的比较. 世界华人消化杂志. 2006;14:1889-1894. [DOI] |
| 4. | Moertel CG, Schutt AJ, Reitemeier RJ, Hahn RG. Phase II study of camptothecin (NSC-100880) in the treatment of advanced gastrointestinal cancer. Cancer Chemother Rep. 1972;56:95-101. [PubMed] |
| 5. | Lavergne O, Demarquay D, Bailly C, Lanco C, Rolland A, Huchet M, Coulomb H, Muller N, Baroggi N, Camara J. Topoisomerase I-mediated antiproliferative activity of enantiomerically pure fluorinated homocamptothecins. J Med Chem. 2000;43:2285-2289. [PubMed] |
| 6. | Kishida O, Miyazaki Y, Murayama Y, Ogasa M, Miyazaki T, Yamamoto T, Watabe K, Tsutsui S, Kiyohara T, Shimomura I. Gefitinib ("Iressa", ZD1839) inhibits SN38-triggered EGF signals and IL-8 production in gastric cancer cells. Cancer Chemother Pharmacol. 2005;55:393-403. [PubMed] |
| 7. | Williams J, Lansdown R, Sweitzer R, Romanowski M, LaBell R, Ramaswami R, Unger E. Nanoparticle drug delivery system for intravenous delivery of topoisomerase inhibitors. J Control Release. 2003;91:167-172. [PubMed] |
| 8. | Ghobrial IM, Witzig TE, Adjei AA. Targeting apoptosis pathways in cancer therapy. CA Cancer J Clin. 2005;55:178-194. [PubMed] |
| 9. | Del Bufalo D, Biroccio A, Trisciuoglio D, Bruno T, Floridi A, Aquino A, Zupi G. Bcl-2 has differing effects on the sensitivity of breast cancer cells depending on the antineoplastic drug used. Eur J Cancer. 2002;38:2455-2462. [PubMed] |
| 10. | Romberg B, Hennink WE, Storm G. Sheddable coatings for long-circulating nanoparticles. Pharm Res. 2008;25:55-71. [PubMed] |
| 11. | Li Y, Taulier N, Rauth AM, Wu XY. Screening of lipid carriers and characterization of drug-polymer-lipid interactions for the rational design of polymer-lipid hybrid nanoparticles (PLN). Pharm Res. 2006;23:1877-1887. [PubMed] |
| 13. | Xuan T, Zhang JA, Ahmad I. HPLC method for determination of SN-38 content and SN-38 entrapment efficiency in a novel liposome-based formulation, LE-SN38. J Pharm Biomed Anal. 2006;41:582-588. [PubMed] |
| 14. | Lu X, Ji C, Xu H, Li X, Ding H, Ye M, Zhu Z, Ding D, Jiang X, Ding X. Resveratrol-loaded polymeric micelles protect cells from Abeta-induced oxidative stress. Int J Pharm. 2009;375:89-96. [PubMed] |
| 15. | Zheng D, Li X, Xu H, Lu X, Hu Y, Fan W. Study on docetaxel-loaded nanoparticles with high antitumor efficacy against malignant melanoma. Acta Biochim Biophys Sin (Shanghai). 2009;41:578-587. [PubMed] |
| 16. | Li X, Li R, Qian X, Ding Y, Tu Y, Guo R, Hu Y, Jiang X, Guo W, Liu B. Superior antitumor efficiency of cisplatin-loaded nanoparticles by intratumoral delivery with decreased tumor metabolism rate. Eur J Pharm Biopharm. 2008;70:726-734. [PubMed] |
| 17. | Liu B, Yang M, Li X, Qian X, Shen Z, Ding Y, Yu L. Enhanced efficiency of thermally targeted taxanes delivery in a human xenograft model of gastric cancer. J Pharm Sci. 2008;97:3170-3181. [PubMed] |