修回日期: 2009-09-05
接受日期: 2009-09-15
在线出版日期: 2009-09-28
目的: 建立乙型肝炎病毒(HBV)大S蛋白基因纵向研究方法, 并将其应用于疾病进程中HBV的准种动态研究.
方法: 以2例HBV感染者(对象A, 男, 38岁; 对象B, 女, 22岁. 对象A研究期间未经任何抗病毒治疗, B则1年持续接受ADV抗病毒药物治疗)体内不同时期的血清样本核酸提取物为模板, 通过特异性扩增获取病毒大S蛋白基因序列并克隆测序, 依据生物信息学方法对发生于序列结构不同区域的变异进行分析, 利用比对数据对不同样本HBV准种予以描述与评价.
结果: 所得24条HBV大S蛋白基因序列中2条源于对象B样本的基因序列PreS2编码区存在30 nt的缺失, 其余22条序列大小均为1203 bp; 24条序列的HBV基因型均为C型. 对象A大S蛋白基因序列分散值DA、DB、DC分别为: 0.29、0.16、0.23, 对象B则为0.80、2.30、1.82. 来自对象A的全部10条HBV大S蛋白基因序列内部的"a"决定簇与参考基因完全一致; 对象B的14条序列期初有2条(29%)期终有6条(86%)存在G145R突变, 期终序列中有1条序列"a"决定簇内发现4个位点的突变.
结论: 人体内感染HBV以准种形式存在且可以用分散值DA、DB、DC对其进行描述, 并应用于HBV准种动态的纵向研究. 而抗病毒药物ADV的1年期治疗可使本例HBV准种分散性增高, 可能增加本例耐药性突变出现的风险, 同时增加本例"a"决定簇的变异出现.
引文著录: 余南, 崔进, 周国宝, 张云娇, 陈晶砺. 乙型肝炎病毒大S蛋白基因纵向研究方法及应用. 世界华人消化杂志 2009; 17(27): 2840-2845
Revised: September 5, 2009
Accepted: September 15, 2009
Published online: September 28, 2009
AIM: To develop a method for longitudinal study of variations in the large surface protein gene of hepatitis B virus (HBV) in vivo and apply it to the investigation of the dynamics of HBV quasispecies.
METHODS: Two HBV carriers were included in the study. Patient 1 was a 38-year-old male who received no anti-virus therapy before and during the longitudinal study, while patient 2 was a 22-year-old female who received continuous adefovir dipivoxil (ADV) therapy during the one-year longitudinal study. Serum samples were collected from the two patients over the longitudinal period. Nucleic acids were extracted from the serum samples and used as templates to amplify the HBV large surface protein gene. The resulting PCR products were cloned into the pMD18-T vector and sequenced. Variation analysis was performed using sequence alignment tools to characterize and evaluate the dynamic changes of HBV quasispecies.
RESULTS: Of 24 large surface protein gene sequences (10 from patient 1 and 14 from patient 2) analyzed, two from patient 2 contained a 30-nt deletion in PreS2 coding region. Online HBV genotype analysis showed that all the 24 sequences belonged to genotype C. The divergence values (DA, DB and DC) of HBV large surface protein gene from patient 1 were 0.29, 0.16 and 0.23, respectively, while those from patient 2 were 0.80, 2.30 and 1.82, respectively. The 'a' determinant region was perfectly identical among the 10 sequences from patient 1. In patient 2, G145R mutation was found in two sequences (29%) at the beginning and in six sequences (86%) at the end of the study. Four point mutations also were noted in the 'a' determinant region of one sequence from patient 2 at the end of the study.
CONCLUSION: Our results support the quasispecies distribution of HBV inside human hosts. It is feasible to use divergence values DA, DB and DC to characterize and evaluate the dynamic changes of HBV quasispecies. ADV therapy may increase the diversity of HBV quasispecies and thereby raise the risk of developing drug resistance.
- Citation: Yu N, Cui J, Zhou GB, Zhang YJ, Chen JL. Variations in the large surface protein gene of hepatitis B virus in vivo: a longitudinal study and application. Shijie Huaren Xiaohua Zazhi 2009; 17(27): 2840-2845
- URL: https://www.wjgnet.com/1009-3079/full/v17/i27/2840.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i27.2840
乙型肝炎是乙型肝炎病毒(hepatitis B virus, HBV)感染导致的传染病, 我国属高流行区. 因HBV长期感染可发展为肝硬化和肝癌, 故其严重威胁患者健康. HBV基因组全长约3215 bp, 部分双链, 由4个开放读码框(open reading frame, ORF)即S、C、P、X组成[1]. 其中大S蛋白基因由PreS1, PreS2和表面抗原主蛋白S编码区组成, 编码的HBsAg是病毒感染的重要标志物, 也是诱导机体产生保护性抗体的重要抗原, 在临床检测和疫苗设计中应用广泛. HBV的一些序列变异已经被发现与肝细胞癌(hepatocellular carcinoma, HCC)相关联[2], 其中S基因的变异研究对于乙型肝炎的诊断、预防和治疗均具有重要意义. 本研究以慢性乙型肝炎患者疾病进程不同时期的血清样本核酸提取物为模板, 通过特异性扩增获取大S蛋白基因序列并克隆测序, 进行比较与分析, 以建立HBV大S蛋白基因变异追踪方法, 应用于疾病进程中HBV的变异动态研究.
本院传染科长期治疗/检查的HBV感染者2例. 对象A, 男, 38岁; 对象B, 女, 22岁. 分别于期初与期终采集空腹血3 mL分离血清. 所有血清标本室温放置不超过4 h, 4℃保存不超过10 d; 需长期保存的期初血清标本置-70℃保存. HBV核酸扩增荧光定量检测试剂盒为中山大学达安基因股份有限公司产品(Cat: DA-BL051). HBV血清学标志物检测采用ELISA法, 试剂为北京万泰公司产品(京). 丙氨酸氨基转移酶(ALT)试剂盒及天门冬氨酸氨基转移酶(AST)试剂盒为上海科华产品(沪食药监械准字2007第2400378号和沪食药监械准字2007第2400380号). TAQ酶、pMD18-T载体为TaKaRa公司产品. DNA胶纯化试剂盒(QIAquick Gel Extraction Kit)为QIAGEN公司产品. 大肠埃希菌JM109为本实验室保存, 感受态自行制备. 荧光定量PCR仪瑞士罗氏公司产品LightCycler, 运行计算机软件Roche Molecular Biochemicals LightCycler Software (Version 3.5.3). 普通热循环仪ABI2700(美国). 全自动酶标仪为哈米顿STAR 8 ch加样系统和FAME 24/20分析系统(瑞士). 全自动生化仪为日立7060(日本).
1.2.1 乙肝五项检测: 采取ELISA法.
1.2.2 肝功能检测: ALT和AST在全自动生化仪上完成, 分别采用紫外-乳酸脱氢酶法和紫外-苹果酸脱氢酶法.
1.2.3 HBV DNA定量检测: 采用荧光定量法[3]按标准操作程序进行. 主要包括: (1)血清标本制备核酸模板: 取100 μL血清标本浓缩后12 000 r/min离心10 min; 沉淀加DNA提取液于100℃处理10 min, 12 000 r/min离心5 min, 上清用作模板. (2)扩增: 扩增反应条件为93℃预变性3 min; 进行40个循环(93℃ 5 s, 57℃ 45 s); 回到37℃. 采用样点拟合法进行定量分析.
1.2.4 大S蛋白基因的扩增: 通过GenBank数据库所获得HBV的序列进行分析和引物设计. 上游引物bs1: 5'-TAGGTACCATGGGAGGTTGGTCTTC-3', 下游引物bs2: 5'-TCGGAGCTCTTAAATGTATACCCAAAG-3'. 扩增反应条件: 95℃预变性10 min, 95℃ 45 s, 58℃ 30 s, 72℃ 45 s, 共32个循环; 72℃延伸5 min. 以上述1.3.3所获得模板溶液12 000 r/min离心5 min后, 小心取1 μL上清进行扩增, 扩增产物10 g/L琼脂糖凝胶电泳, 将符合设计产物相对分子质量大小的电泳条带小心切割后, 按QIAquick Gel Extraction Kit说明书的要求纯化.
1.2.5 克隆测序: 根据pMD18-T产品说明书的要求连接目的DNA片段与T载体(16℃ 30 min). 连接产物转化到大肠埃希菌JM109感受态细胞中(42℃热激), 加890 μL 37℃预热的SOC培养基, 37℃ 150 r/min培养60 min, 涂布于含有20 mg/L氨苄青霉素的LB平板上, 37℃培养过夜. 次日挑取阳性菌落进行PCR鉴定, 取阳性菌测序.
1.2.6 序列分析: 采用DNAStar及BLAST等在线工具软件进行序列分析. 基因分型采用在线工具(http://www.ncbi.nlm.nih.gov/projects/genotyping/formpage.cgi)进行. 血清型推断通过参考基因比对进行[4]. 变异参数计算公式: DA = (∑D(a))/Cn2, 其中a = N(1,Cn2), n = 期初样本克隆数; DB = (∑D(b))/Cm2, 其中b = N(1,Cm2), m = 期终样本克隆数; DC = (∑D(a, b))/(n×m). D(a)为期初样本n个条序列间的分散值(divergence, D)(%), D(b)为期终样本m个条序列间的分散值(%), D(a, b)为期初样本n个条序列与期终样本m个条序列之间的分散值(%).
对象A在本研究前及期间1年内均未接受任何抗病毒化学药物治疗, 仅在肝功能异常时接受1-2 mo"甘草酸"或"五酯"类药物护肝; 期初与期终肝功能均正常, HBV DNA分别为4.26E+7拷贝/mL和1.61E+9拷贝/mL, 乙肝五项期初与期终均为1、3阳性. 对象B初诊血清HBV DNA高于107拷贝/mL伴肝功异常, 临床给予"五酯"类药物护肝治疗, 本研究期初起用核苷类抗病毒化学药物阿德福韦酯(adefovir, ADV)10 mg/d治疗至本研究期终, 持续1年, 期间治疗依从性好; 期初与期终肝功能均正常, HBV DNA分别为3.27E+9拷贝/mL和3.58E+7拷贝/mL, 乙肝五项期初与期终均为1、3、5阳性.
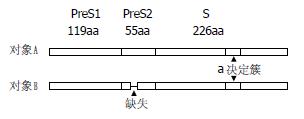
4个样品通过特异性扩增均得到大小约1200 nt的目的序列, 克隆到T载体培养过夜后挑取阳性菌落送测序. 对象A的期初及期终血清样品中得到共10条大S蛋白基因序列, 大小均为1203 nt. 对象B的期初及期终血清样品中得到大小为1203 nt的大S蛋白基因序列12条, 大小为1173 nt的大S蛋白基因序列2条, 该2序列在PreS2编码区缺失30 nt, 相应的编码蛋白发生10aa的缺失(图1). 将测序所得大S蛋白基因序列进行基因型分析的结果, 24条序列均为C型, C型为中国最常见的2种HBV基因型之一.
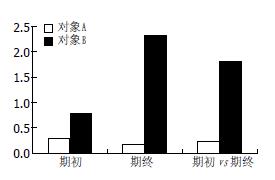
对象A之2个样本共10个克隆的大S蛋白编码基因序列在13位点存在变异, 包括位于PreS1编码区的6个位点、PreS2编码区的1个位点及小S蛋白编码区的6个位点; 氨基酸序列7个位点存在变异, PreS1、PreS2及小S蛋白编码区的位点数分别为3、2、1. 对象B之14个克隆的大S蛋白编码基因序列除2序列于PreS2编码区的30 nt缺失外, 还在59位点存在变异, 包括位于PreS1编码区的22个位点、PreS2编码区的12个位点及小S蛋白编码区的25个位点; 氨基酸残基34个位点存在变异, PreS1、PreS2及小S蛋白编码区的位点数分别为11、9、14. 序列碱基比对基础上得到对象A及对象B的D(a), D(b)及D(a, b)值见图2. 经计算对象A分散值DA、DB、DC分别为0.29、0.16、0.23, 对象B则为0.80、2.30、1.82(图3).
24条大S蛋白基因序列的"a"决定簇编码区序列与adr血清型HBV参考基因(D00630)的相应区域高度同源, adr型是我国大多数C型HBV的血清型. 对象A的大S蛋白基因序列中"a"决定簇编码区内仅2个位点出现碱基置换, 均为同义突变. 对象B的大S蛋白基因序列中"a"决定簇编码区内发生7个位点碱基置换, 4处可使编码氨基酸残基改变. 对象A样本10个克隆(100%)及对象B样本4个克隆(29%)所得序列"a"决定簇编码区编码的氨基酸残基序列与参考基因完全一致. 对象B的期初样本2个克隆(29%)及期终样本6个克隆(86%)所得8条序列均发生了G145R, 对象B期终样本的1条序列同时发生了T131A、S132F、F134S及G145R突变(表1).
| 参考序列 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 对象A | ||||||||||||||||||||||||||
| 期初1 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初2 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初3 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初4 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初5 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期终1 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期终2 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期终3 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期终4 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期终5 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 对象B | ||||||||||||||||||||||||||
| 期初1 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初2 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初3 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | R | N |
| 期初4 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初5 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初6 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | G | N |
| 期初7 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | R | N |
| 期终1 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | R | N |
| 期终2 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | L | D | R | N |
| 期终3 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | R | N |
| 期终4 | C | K | T | C | T | I | P | A | Q | G | T | S | M | V | P | S | C | C | C | T | K | P | S | D | G | N |
| 期终5 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | R | N |
| 期终6 | C | K | T | C | T | I | P | A | Q | G | A | F | M | S | P | S | C | C | C | T | K | P | S | D | R | N |
| 期终7 | C | K | T | C | T | I | P | A | Q | G | T | S | M | F | P | S | C | C | C | T | K | P | S | D | R | N |
《慢性乙型肝炎防治指南》[1]明确建议抗病毒治疗是慢性乙型肝炎的根本治疗方法. 目前抗病毒治疗以核苷类似物和干扰素为主, 临床抗病毒用药中主要的核苷类似物有LAM和ADV等. LAM由于耐药问题越来越严重, ADV在临床的应用相对增多. 了解体内抗病毒药物持续存在的选择压力下HBV的分子演化发生哪些变化及变化意义如何, 对于乙型肝炎的诊断、预防、治疗都有十分重要的意义. 国内2003年已经有报道1例慢性乙型肝炎患者LAM治疗前及病情急性恶化后HBV结构基因组的对比分析[4]由于没有将HBV准种特征予以考虑, 其比较的意义可能受限. 准种最初发现于RNA病毒, 近年发现HBV也存在此现象. 在一些HBV研究报道中出现序列分析与临床关系相互不一致的结果[5], 可能可以通过准种的特征加以解释. 迄今为止, 国内外HBV变异纵向研究的报道[4,6-9]仍然十分少, 其原因一定程度上可能与时间跨度长、对患者及样本管理难度大、数据处理复杂程度高有关. 本研究建立HBV大S蛋白基因变异纵向研究方法, 在探讨更为系统地进行HBV纵向研究模式的尝试中, 报道其中2例的研究结果.
本研究以1年为期, 分别获取2例HBV携带者在期初与期终的HBV核酸样本, 通过克隆测序技术对HBV准种特征进行研究. 在多重比对数据分散D值的基础上进行计算分析. 通过样本内DA和DB表征研究对象期初与期终的HBV准种数值特征, 通过样本间D值参数DC表征研究对象期初与期终之间HBV准种动态变化, 使HBV准种除了描述性分析外, 还可通过量化的数值予以评价. 本研究结果显示, 对象A(未接受抗病毒治疗)的大S蛋白基因变异率在期初和期终均较低(0.29和0.16), 而对象B(持续ADV抗病毒治疗)期初值0.80, ADV治疗1年后上升至近3倍(2.30), DC达1.82(对象A仅为0.23). 这提示, 本例抗病毒药物ADV的持续作用可能使体内HBV变异更为频繁, 准种的分散性升高. 已经有实验[10]证实病毒准种分散性与病毒致病力正相关. HBV准种分散性上升的结果也可能导致耐药性突变出现的风险更大. 事实上, 体外耐药的研究[6]也已经提示抗病毒药物ADV长期治疗会伴随药物EC50上升、药物敏感性下降的现象. 长期抗病毒药物压力导致的HBV准种分散性提高的机制是什么, 该现象普遍性如何, 其他人工选择压力如疫苗和抗体治疗等是否也可引发同样的现象, 尚需进一步的研究方可阐明.
"a"决定簇编码区对药物选择压力敏感, 该区域变异可使HBV不能被中和抗体识别, 免疫球蛋白和乙肝疫苗难以阻断该突变株的传播而引起宫内感染[11], 也可致HBV血清学检测中无法检出HBsAg, 在HBV变异研究[12]中受到重视. 其中G145R变异常见于发生免疫逃避的HBV突变株[12-13], 与免疫逃避密切相关. 本研究中, 接受抗病毒治疗的HBV携带者体内HBV的"a"决定簇出现变异, 其中期初的2个克隆和和期终的6个克隆中出现了G145R变异, 而无抗病毒治疗对象却未发现变异. 提示这些变异的出现可能与药物压力有关.
由于HBV在人体中以准种(quasispecies)的形式存在[1,14], 尽管对象B多条序列的"a"决定簇编码区发生变异, 可表达正常HBsAg的HBV野生株数量仍具一定优势, 因而血清学检测显示期初与期终的样本HBsAg均为阳性. 对象B在期初样本中PreS2区缺失株和无缺失株并存, 与免疫逃避密切相关的"a"决定簇G145R变异株与野生株并存也都说明了HBV在宿主体内以准种形式存在的特点. 准种优势株的动态研究十分重要, 是解决日益严峻的HBV耐药、疫苗免疫失败等问题过程中无法回避的环节. 下一步, 本研究建立HBV大S蛋白基因纵向追踪的方法将应用于不同分组的患者和更长期更细致的动态追踪, 以期获得更丰富的HBV基因纵向研究结果.
HBV S基因的变异研究, 尤其体内抗病毒药物持续存在的选择压力下HBV的分子演化具有重要意义. HBV准种的特征使序列分析与临床关系的研究更为复杂. 由于HBV在体内以准种形式存在, HBV的一些相关研究的结果分析可能会受到影响, 因此应予以考虑.
刘勇钢, 副主任医师, 天津市传染病医院病理科.
HBV感染发生后一些患者未能清除机体病毒而形成长期感染, 伴随此过程中机体免疫和药物治疗等的影响, 病毒的变化、准种的变迁如何追踪具有重要意义. 准种优势株的研究是解决日益严峻HBV耐药、疫苗免疫失败等问题的关键.
Zhu et al 2007研究了一种通过克隆血清HBV准种进行体外药敏分析的方法, 使用该方法发现含rtA181V的病毒准种可使ADV的EC50上升2.9倍. Moriconi et al 2007的研究显示LAM治疗可促进ADV应答率受影响的HBV准种形成, 减低对其他核苷类似物的敏感性.
本研究对HBV感染者不同时期HBV大S蛋白基因进行动态追踪, 以1年为期, 获取患者期初与期终的HBV相应序列, 在多重比对得到序列分散值的基础上, 通过各期样本分散值参数DA和DB表征研究对象该时点的HBV准种数值特征; 采用不同时点间分散值参数DC表征研究对象不同时点间的HBV准种动态变化, 并通过量化的数值对患者体内HBV准种予以评价为临床研究提供了理论依据.
本研究对患者疾病进程中HBV的大S蛋白基因序列进行纵向追踪. 通过建立HBV准种特征的量化描述方法, 观察HBV的准种变迁, 为探讨其临床意义打下基础.
本文选题好, 研究内容较为重要, 有一定的新颖性.
编辑: 李军亮 电编:何基才
| 2. | Yang HI, Yeh SH, Chen PJ, Iloeje UH, Jen CL, Su J, Wang LY, Lu SN, You SL, Chen DS. Associations between hepatitis B virus genotype and mutants and the risk of hepatocellular carcinoma. J Natl Cancer Inst. 2008;100:1134-1143. [PubMed] [DOI] |
| 6. | Zhu Y, Curtis M, Snow-Lampart A, Yang H, Delaney W, Miller MD, Borroto-Esoda K. In vitro drug susceptibility analysis of hepatitis B virus clinical quasispecies populations. J Clin Microbiol. 2007;45:3335-3341. [PubMed] [DOI] |
| 7. | Moriconi F, Colombatto P, Coco B, Ciccorossi P, Oliveri F, Flichman D, Maina AM, Sacco R, Bonino F, Brunetto MR. Emergence of hepatitis B virus quasispecies with lower susceptibility to nucleos(t)ide analogues during lamivudine treatment. J Antimicrob Chemother. 2007;60:341-349. [PubMed] [DOI] |
| 8. | Wang F, Wang H, Shen H, Meng C, Weng X, Zhang W. Evolution of hepatitis B virus polymerase mutations in a patient with HBeAg-positive chronic hepatitis B virus treated with sequential monotherapy and add-on nucleoside/nucleotide analogues. Clin Ther. 2009;31:360-366. [PubMed] [DOI] |
| 9. | Baldick CJ, Eggers BJ, Fang J, Levine SM, Pokornowski KA, Rose RE, Yu CF, Tenney DJ, Colonno RJ. Hepatitis B virus quasispecies susceptibility to entecavir confirms the relationship between genotypic resistance and patient virologic response. J Hepatol. 2008;48:895-902. [PubMed] [DOI] |
| 10. | Vignuzzi M, Stone JK, Arnold JJ, Cameron CE, Andino R. Quasispecies diversity determines pathogenesis through cooperative interactions in a viral population. Nature. 2006;439:344-348. [PubMed] [DOI] |
| 11. | Velu V, Saravanan S, Nandakumar S, Dhevahi E, Shankar EM, Murugavel KG, Kumarasamy T, Thyagarajan SP. Transmission of "a]determinant variants of hepatitis B virus in immunized babies born to HBsAg carrier mothers. Jpn J Infect Dis. 2008;61:73-76. [PubMed] |
| 12. | Alexopoulou A, Baltayiannis G, Jammeh S, Waters J, Dourakis SP, Karayiannis P. Hepatitis B surface antigen variant with multiple mutations in the a determinant in an agammaglobulinemic patient. J Clin Microbiol. 2004;42:2861-2865. [PubMed] [DOI] |
| 13. | Theamboonlers A, Chongsrisawat V, Jantaradsamee P, Poovorawan Y. Variants within the "a]determinant of HBs gene in children and adolescents with and without hepatitis B vaccination as part of Thailand's Expanded Program on Immunization (EPI). Tohoku J Exp Med. 2001;193:197-205. [PubMed] [DOI] |