修回日期: 2009-09-07
接受日期: 2009-09-15
在线出版日期: 2009-09-18
目的: 观察靶向shRNA质粒表达载体(PGPU6/GFP/Neo-GRP78)对大肠癌RKO细胞系GRP78 mRNA及蛋白的作用.
方法: 采用免疫组织化学及半定量逆转录聚合酶链反应(RT-PCR)方法检测结直肠腺癌、腺瘤及正常黏膜组织中GRP78的表达; 使用脂质体2000将GRP78靶向shRNA质粒表达载体(PGPU6/GFP/Neo-GRP78)转染至RKO细胞内, 应用RT-PCR与Western blot法检测GRP78基因及蛋白的表达.
结果: GRP78在结直肠癌组织中的表达水平显著高于正常黏膜组织(9.470±0.754 vs 0.780±2.468, Z = -8.140, P<0.05), 腺瘤组织中其表达水平高于正常黏膜组织而低于癌组织, 差别有统计学意义(5.330±2.744 vs 1.000±0.840, 9.560±2.093, 均P<0.05). 然而在mRAN水平上, GRP78在3种组织中的表达无统计学意义; 靶向shRNA质粒表达载体PGPU6/GFP/Neo-GRP78能明显抑制RKO细胞中GRP78蛋白及mRNA的表达(F = 11.670, 271.860, 均P<0.05).
结论: 靶向shRNA质粒表达载体(PGPU6/GFP/Neo-GRP78)能明显抑制RKO细胞GRP78 mRNA及蛋白的表达, 为进一步明确GRP78在结直肠腺癌细胞增殖动力学中的作用奠定了实验基础.
引文著录: 邢晓明, 李玉军, 刘芳. 利用RNA干扰技术抑制糖调节蛋白78在大肠癌细胞系中的表达. 世界华人消化杂志 2009; 17(26): 2686-2691
Revised: September 7, 2009
Accepted: September 15, 2009
Published online: September 18, 2009
AIM: To investigate the expression of glucose-regulated protein 78 (GRP78) in human colorectal carcinoma and observe RNA interference-based silencing of GRP78 expression in human colorectal carcinoma cells (RKO) using a vector expressing small hairpin RNA (shRNA) specific for GRP78.
METHODS: Before transfection, reverse transcription-polymerase chain reaction (RT-PCR) and immunohistochemistry were used to detect the expression of GRP78 mRNA and protein in colorectal carcinoma, colorectal adenoma and normal colorectal mucosa, respectively. After the recombinant plasmid expressing GRP78-specific shRNA (PGPU6/GFP/Neo-GRP78) was introduced into RKO cells by liposome-mediated transfection, the expression of GRP78 mRNA and protein in RKO cells was detected by RT-PCR and Western blot, respectively.
RESULTS: Immunohistochemical analysis showed that the expression of GRP78 protein was higher in colorectal carcinoma than in normal colorectal mucosa (9.470 ± 0.754 vs 0.780 ± 2.468, Z = -8.140, P < 0.05). The expression of GRP78 protein in colorectal adenoma was significantly higher than that in normal colorectal mucosa but lower than that in colorectal carcinoma (5.330 ± 2.744 vs 1.000 ± 0.840 and 9.560 ± 2.093, respectively; both P < 0.05). No significant differences were detected in the relative mRNA expression levels of GRP78 among the three different types of specimens. Compared with control cells, the expression of GRP78 was significantly downregulated at both the mRNA and protein levels in cells transfected with the PGPU6/GFP/Neo-GRP78 plasmid (F = 11.670 and 271.860, respectively; both P < 0.05).
CONCLUSION: The eukaryotic expression vector expressing GRP78-specific shRNA (PGPU6/GFP/Neo-GRP78) can significantly inhibit the expression of GRP78 at both the protein and mRNA levels, and can therefore be used for future investigation of the role of GRP78 in the proliferation of colorectal carcinoma cells.
- Citation: Xing XM, Li YJ, Liu F. Downregulation of glucose-regulated protein 78 in human colorectal carcinoma cells using a vector expressing small hairpin RNA specific for glucose-regulated protein 78. Shijie Huaren Xiaohua Zazhi 2009; 17(26): 2686-2691
- URL: https://www.wjgnet.com/1009-3079/full/v17/i26/2686.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i26.2686
糖调节蛋白78(glucose-regulated protein 78, GRP78), 也叫免疫球蛋白重链结合蛋白, 因与热休克蛋白70(heat shock protein 70, Hsp70)家族具有高度同源性, 而被认为是Hsp70家族成员之一[1]. 该蛋白广泛存在于内质网内, 是内质网应激反应所诱导的主要内质网分子伴侣之一. 内质网应激是指错误折叠与未折叠蛋白在内质网腔内聚集及Ca2+平衡紊乱的状态[2]. 内质网应激对决定应激细胞的结局, 如抵抗、适应、损伤或凋亡有重要作用. 由于血液供应不足及营养条件较差等原因, 实体肿瘤组织内存在缺氧、酸中毒及低糖等应激微环境[3], 这种病理条件可以导致内质网应激并诱导GRP78的过度表达. GRP78的高表达可能是肿瘤细胞在不利条件下生存的一种防御机制. 近年来研究表明, GRP78在包括前列腺癌、乳腺癌、胃癌、脑肿瘤等多种肿瘤组织中高表达, 并在肿瘤增殖、血管生成及抗药性等方面起重要作用[4-9]. 在本研究中, 我们通过免疫组织化学及RT-PCR的方法检测GRP78在结直肠腺癌、腺瘤及正常黏膜组织中的表达, 探讨其在结直肠癌中表达改变的意义, 并在此基础之上, 构建GRP78靶向shRNA质粒表达载体(PGPU6/GFP/Neo-GRP78), 并采用脂质体2000转染到大肠癌RKO细胞中, 抑制其GRP78 mRNA及蛋白的表达, 以期为进一步分析GRP78在肿瘤发生发展中表达改变的机制奠定实验基础.
所有标本均取自青岛大学医学院附属医院病理科, 其中87例石蜡包埋结直肠腺癌组织及配对正常黏膜组织(其中18例伴发腺瘤)用于免疫组织化学分析; 53例新鲜结直肠癌组织及配对正常黏膜组织(其中12例伴发腺瘤)用于RT-PCR分析. 标本离体后, 立即放入液氮冷冻, -70℃贮存备用, 患者术前未接受任何治疗, 术后病理证实为结直肠腺癌/腺瘤. 人大肠癌细胞RKO细胞株由浙江大学医学院分子病理学实验室馈赠. 细胞培养于含100 mL/L(10%)胎牛血清的低糖DMEM培养液中, 置于50 mL/L CO2、饱和湿度和37℃细胞培养箱内培养. 低糖DMEM培养基、Opti-MEMI优化培养基及胎牛血清购自Gibco公司. 脂质体Lipofectamin2000及TRIzol试剂购自Invitrogen公司. Tris、SDS、过硫酸铵、丙烯酰胺、甲叉双丙烯酰胺、TEMED及PVDF膜均购自Bio-Rad公司. 山羊抗人GRP78单抗购自Santa Cruz公司. HRP标记的二抗为北京中杉生物制品公司产品. GRP78的shRNA质粒表达载体套装购自上海吉玛公司, 其RNA干扰的靶序列为5'-GCGCATTGATACTAGAAATGA-3', 命名为PGPU6/GFP/Neo-GRP78. 阳性对照质粒(PGPU6/GFP/Neo-shGAPDH, 已验证的可以有效抑制GAPDH基因的表达)和阴性对照质粒(PGPU6/GFP/Neo-shNC, 可以表达与GRP78基因序列无同源性的shRNA片段)均由试剂盒提供.
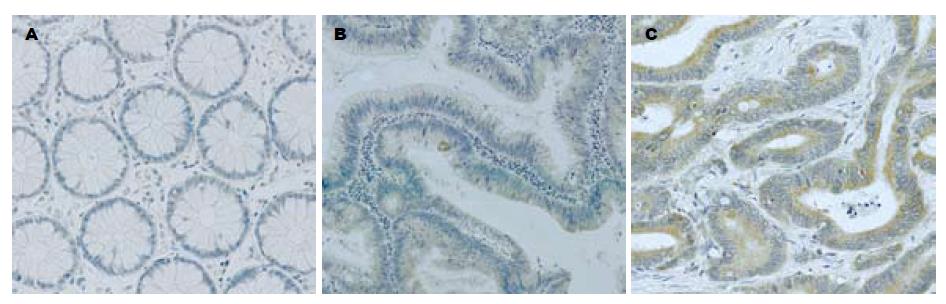
1.2.1 免疫组织化学染色: 4 µm石蜡切片脱蜡至水, 采用EDTA缓冲液高压修复抗原, 按PV-6003试剂盒说明书进行GRP78(1:250)免疫组织化学染色, 半定量分析染色结果. GRP78表达指数以染色强度分数×染色细胞比例分数表示[10]: 阳性细胞数<5%为0分, 5%-24%为1分, 25%-49%为2分, 50%-74%为3分, ≥75%为4分; 染色完全阴性为0分, 淡黄色为1分, 黄色为2分, 棕黄色为3分.
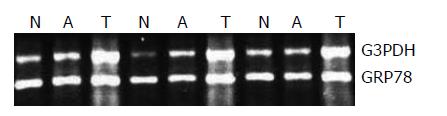
1.2.2 RT-PCR: 采用TRIzol一步法提取组织RNA, 常规合成cDNA; 以cDNA为模板扩增GRP78. GRP78引物序列: 上游5'-GACATCAAGTTCTTGCCGTT-3'; 下游5'-CTCATAACATTTAGGCCAGC-3'. 反应参数为94℃×5 min, 94℃×30 s, 58℃×30 s, 72℃×30 s, 40个循环; 72℃×5 min. 以G3PDH为内参, 其上游序列5'-ACCACAGTCCATGCCATCAC-3', 下游序列5'-TCCACCACCCTGTTGCTGTA-3', 扩增参数: 94℃×5 min; 94℃×30 s, 58℃×30 s, 72℃×30 s, 35个循环; 72℃×5 min. 取5 µL PCR产物在18 g/L琼脂糖凝胶上电泳(120 V×30 min), Kodak DC 290凝胶成像系统分析结果. Kodak1D3.5图像分析软件分析各标本的GRP78和G3PDH扩增产物带的净像素值, GRP78基因相对表达水平 = GRP78的净像素值/G3PDH的净像素值.
1.2.3 转染: 根据Lipofectamine 2000说明书进行实验, 利用脂质体将shRNA转染入RKO细胞中. RKO细胞分为实验组即转染PGPU6/GFP/Neo-GRP78组和对照组(包括阳性对照组, 阴性对照组, 转染试剂对照组和空白对照组).
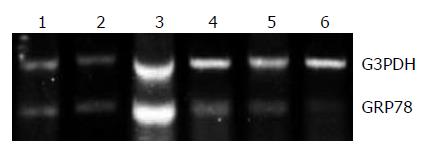
1.2.4 基因抑制效率的检测: 转染后24, 48, 72 h分别收集实验组及对照组细胞, 提取总RNA, 用RT-PCR方法检测GRP78基因的表达; 转染后48, 72, 96 h收集实验组及对照组细胞, 提取总蛋白, 以β-actin为内对照, 采用Western blot方法检测GRP78蛋白的表达, 具体如下: 将封闭好的PVDF膜放入有抗GRP78抗体或者抗β-actin抗体新鲜配制的封闭液中(稀释度分别1:250及1:1000), 温和震荡30 min后, 4℃冰箱过夜, TBST洗膜15 min×3次; 加相应辣根过氧化物酶标记的二抗(稀释度为1:500), 室温温和震荡3 h; 洗膜20 min×5次; ECL化学发光, X片曝光显影.
统计学处理 统计学分析采用SPSS13.0软件完成, 组织标本半定量RT-PCR及免疫组织化学结果采用Wilcoxon和Friedman配对秩和检验; 转染各组细胞的半定量RT-PCR及Western blot结果采用方差分析及LSD检验, P<0.05认为有显著性差异.
免疫组织化学检测发现, GRP78蛋白主要表达于癌细胞及腺瘤细胞的胞质内, 在正常黏膜组织中也可见少量的表达(图1). 经统计学分析发现, GRP78在87例结直肠癌组织中的表达水平显著高于正常黏膜组织(9.47±0.754vs 0.78±2.468; Z = -8.140, P<0.05). 18例腺瘤组织中其表达水平高于正常黏膜组织(5.33±2.744 vs 1.00±0.840), 而低于癌组织(9.56±2.093), 差别有统计学意义(χ2 = 34.111, P<0.05; 腺瘤 vs 正常组织, q = 4.5, P<0.05; 腺瘤 vs 腺癌, q= 8.24, P<0.05). 腺瘤组织中其表达水平高于正常黏膜组织而低于癌组织(χ2 = 34.111, P<0.05). 对53例结直肠癌、配对正常黏膜组织及12例伴发结直肠腺瘤组织半定量RT-PCR检测发现, GRP78 mRNA表达差异无显著性(Z = -0.320, χ2 = 3.167,P>0.05, 图2). 结直肠癌组织GRP78 mRNA水平与蛋白水平表达不一致, 提示可能存在翻译后修饰.
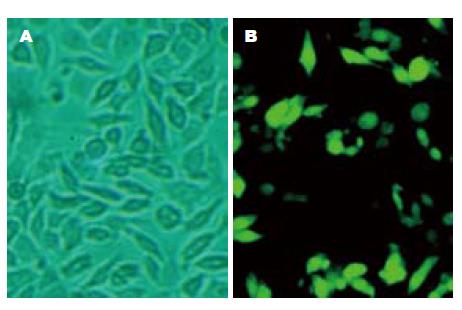
转染前及转染后24, 48, 72 h, 使用荧光显微镜观察细胞状态(图3); 以G3PDH为内对照, 半定量RT-PCR检测显示, 转染GPU6/GFP/Neo-GRP78后GRP78 mRNA的相对表达水平较转染前明显降低(F = 271.860, P<0.05); 转染后24, 48和72 h, 其在实验组中的表达逐渐降低, 且转染后48 h表达水平趋于稳定, 阴性对照组和转染试剂对照组与转染前相比, GRP78 mRNA的相对表达量均无显著性差异(图4, 表1); 以β-actin为内对照, Western blot检测显示, 转染GPU6/GFP/Neo-GRP78后GRP78蛋白的相对表达较转染前明显降低(F = 11.670, P<0.05); 转染后48, 72和96 h, 随着时间延长, 其在实验组中的表达逐渐降低, 且转染后72 h表达水平趋于稳定, 阴性对照组和转染试剂对照组与转染前相比, GRP78蛋白的相对表达量均无显著性差异(图5, 表1).
GRP78是一种高度保守的内质网驻留蛋白, 是Hsp70家族的成员之一, 存在于多种组织细胞中[1]. 在低糖、缺氧及低pH等应激条件下, GRP78的合成明显升高[3,11]. 另外某些影响蛋白质糖基化、折叠或运输的药物, 或影响细胞内Ca2+平衡稳态的药物均可诱导GRP78转录活性的提高[7]. GRP78表达升高的意义在于能促进错误与未折叠蛋白恢复正常构象、维持内质网、线粒体和胞质内Ca2+平衡并维持内质网内Ca2+依赖性蛋白修饰反应、对抗氧化应激, 从而有助于减轻内质网应激、保护细胞[12-13].
由于血管供应不足及营养条件差等原因, 实体肿瘤内存在缺氧、酸中毒及低糖等应激微环境[3], 这些病理条件均可引起GRP78的过度表达. 本研究利用RT-PCR及免疫组织化学的方法研究了GRP78在结直肠腺癌、腺瘤以及相应正常结直肠黏膜组织中的表达. 结果表明, 在3种组织中均可检测到GRP78的表达. 在mRNA表达水平上, 癌组织中GRP78的水平与腺瘤及相应的正常黏膜组织相比, 差别无显著性意义. 但免疫组织化学的结果表明, GRP78在正常黏膜, 腺瘤及癌组织中的表达呈现逐渐增高的趋势. 提示GRP78表达改变可能与结直肠癌的发生相关, 其高表达可能是结直肠癌进展的一个重要特征.
关于GRP78在癌组织中表达升高的具体机制尚未明确, 有研究认为其表达升高是未折叠蛋白反应(unfold protein response, UPR)的主要效应之一, 也有研究表明, 肿瘤细胞中GRP78的诱导表达并不完全依赖于UPR, 还涉及其他的信号传导通路的激活包括PKC, PKA, Akt及ERK[4,8-9]. 尽管存在争议, 但以往的研究均表明, 癌细胞内GRP78表达的改变是发生在转录水平上的. 然而在本实验中, 我们发现, 在结直肠癌组织中, GRP78转录水平没有发生改变, 其表达变化是发生在蛋白水平上的. 我们推测这种差异的原因可能是由于癌细胞的异质性, 不同的癌细胞在应对应激时激活的信号转导通路不同, 在结直肠肿瘤的发生过程中, 肿瘤细胞内可能存在另一条与GRP78表达改变相关的信号转导通路的激活. 因此, 为进一步明确GRP78在结直肠肿瘤细胞中表达升高的机制及意义, 本研究采用RAN干扰(RNAi)的方法抑制其在结直肠癌RKO细胞中的表达, 以期为今后的基础研究奠定基础.
RNAi是指外源性或内源性双链RNA (double-stranded RNA, dsRNA)在细胞内导致与其同源的mRNA分子发生特异性降解从而干扰相应基因的表达. RNAi主要由长dsRNA分子裂解形成的小干扰RNA(small interfering RNA, siRNA)分子介导, 是在RNA水平调节基因表达的一种方式, 因此也称为转录后基因沉默[14-15]. 2001年, Elbashir et al[16]首次发现了哺乳动物细胞也存在RNA干扰现象. 这一发现极大地推动了RNAi技术在疾病治疗领域的研究和应用, 同时也为RNAi技术广泛应用于基因治疗奠定了基础. 与传统的反义技术相比, RNAi抑制基因的表达不但具有高效性, 特异性, 稳定性, 可遗传性的分子生物学特征[17-18], 而且操作简便, 已被广泛应用于人类肿瘤的研究.
目前有多种合成siRNA分子方法[19], 如化学合成法、体外转录法、用RNA酶消化长片段双链RNA制备siRNA, 这些体外得到siRNA后再导入细胞内的方法有两方面缺点: siRNA进入细胞后容易被降解; 进入细胞siRNA的数量不受控制. 针对这种情况, 出现了以质粒为载体构建重组体来介导siRNA的体内表达. 本实验选用了含新霉素抗性基因和GFP绿色荧光标记的PGPU6/GFP/Neo载体, 将GRP78 RNAi靶序列的正义链和反义链以loop(7 nt)相连, 构成短发夹状RNA(short hairpin RNA, shRNA), 然后合成编码shRNA的DNA双链模板, 并连接到线性载体中, 此载体在真核细胞中转录出发夹状shRNA, shRNA的环状结构被酶切后, 产生siRNA, siRNA的反义链在细胞内与特定蛋白质结合形成RNA诱导沉默复合物(RNA-induced silencing complexes, RISCs), 并与GRP78 mRNA序列互补结合, 剪切GRP78 mRNA, 从而在细胞内产生GRP78的沉默效果. 与体外合成siRNA相比, shRNA表达载体是一种双链DNA结构, 所以操作过程简单方便, 实验稳定性强, 是用于RNAi长期研究的较好方法.
本实验中我们应用PGPU6/GFP/Neo-GRP78抑制GRP78在RKO细胞中的表达, 结果发现在转染后24 h, GRP78 mRNA表达明显抑制, 并随着时间的推移继续抑制, 在48 h时达到高峰, 到72 h时仍稳定存在; 在转染后48 h, GRP78蛋白表达明显抑制, 并随着时间的推移继续抑制, 在72 h时达到高峰, 到96 h时仍稳定存在. 对照组蛋白及mRNA表达水平均无明显改变. 表明本实验构建的靶向shRNA质粒表达载体(PGPU6/GFP/Neo-GRP78)能有效且稳定的抑制RKO细胞中GRP78 mRNA和蛋白的表达.
总之, 本研究发现, 结直肠腺瘤、腺癌组织中GRP78蛋白的表达呈升高的趋势, 表明GRP78在结直肠癌的发生中起一定的作用. 另外, 本实验构建的靶向shRNA质粒表达载体(PGPU6/GFP/Neo-GRP78)能有效且稳定的抑制RKO细胞中GRP78 mRNA和蛋白的表达, 为进一步明确GRP78在癌细胞增殖动力学中的作用奠定实验基础, 同时也为以GRP78为靶向的结直肠腺癌的基因治疗提供了新方法和新思路.
结直肠癌是消化系常见的恶性肿瘤之一, 其发生、发展是一个受多基因、多步骤调控的复杂过程. 近年来研究表明, GRP78在包括结直肠癌、胃癌等多种肿瘤组织中高表达. 本实验通过RNA干扰技术抑制结肠癌细胞GRP78表达, 明确了GRP78表达改变在结直肠癌发生、发展中的作用.
王正康, 教授, 北京中日友好医院普外科
GRP类在很多肿瘤细胞中都呈高表达趋势, 在肿瘤增殖、血管生成及抗药性等方面起重要作用. GRP78是GRP家族的重要成员, 以 其为靶点而开展的肿瘤基因治疗及免疫治疗已成为国内外研究的热点.
国内学者张新晨 et al证实GRP78在胃癌中呈过表达, 并与胃癌的多种生物学特性有关,在此基础上通过RNA干扰方法成功抑制了胃癌细胞中GRP78蛋白的表达, 为胃癌基因治疗提供了新思路.
本实验通过RNA干扰技术抑制结肠癌细胞中GRP78表达并获得成功, 国内外尚无相关报道.
本研究发现, 结直肠腺瘤、腺癌组织中GRP78蛋白的表达呈升高的趋势, 表明GRP78在结直肠癌的发生中起一定的作用. 另外, 本实验构建的靶向shRNA质粒表达载体能有效且稳定地抑制RKO细胞中GRP78 mRNA和蛋白的表达, 为进一步明确GRP78在癌细胞增殖动力学中的作用奠定实验基础, 同时也为以GRP78为靶向的结直肠腺癌的基因治疗提供了新方法和新思路.
本研究实验目的及结论明确, 论文写作及条理较清晰, 结论对明确结直肠癌的发生发展有一定的意义.
编辑: 李军亮 电编:何基才
| 1. | Munro S, Pelham HR. An Hsp70-like protein in the ER: identity with the 78 kd glucose-regulated protein and immunoglobulin heavy chain binding protein. Cell. 1986;46:291-300. [PubMed] |
| 3. | Brown JM, Giaccia AJ. The unique physiology of solid tumors: opportunities (and problems) for cancer therapy. Cancer Res. 1998;58:1408-1416. [PubMed] |
| 4. | Fu Y, Wey S, Wang M, Ye R, Liao CP, Roy-Burman P, Lee AS. Pten null prostate tumorigenesis and AKT activation are blocked by targeted knockout of ER chaperone GRP78/BiP in prostate epithelium. Proc Natl Acad Sci U S A. 2008;105:19444-19449. [PubMed] |
| 5. | Dong D, Ni M, Li J, Xiong S, Ye W, Virrey JJ, Mao C, Ye R, Wang M, Pen L. Critical role of the stress chaperone GRP78/BiP in tumor proliferation, survival, and tumor angiogenesis in transgene- induced mammary tumor development. Cancer Res. 2008;68:498-505. [PubMed] |
| 7. | Gazit G, Lu J, Lee AS. De-regulation of GRP stress protein expression in human breast cancer cell lines. Breast Cancer Res Treat. 1999;54:135-146. [PubMed] |
| 8. | Song MS, Park YK, Lee JH, Park K. Induction of glucose-regulated protein 78 by chronic hypoxia in human gastric tumor cells through a protein kinase C-epsilon/ERK/AP-1 signaling cascade. Cancer Res. 2001;61:8322-8330. [PubMed] |
| 9. | Chang WM, Chen KD, Chen LY, Lai MT, Lai YK. Mitochondrial calcium-mediated reactive oxygen species are essential for the rapid induction of the grp78 gene in 9L rat brain tumour cells. Cell Signal. 2003;15:57-64. [PubMed] |
| 10. | Xing X, Lai M, Wang Y, Xu E, Huang Q. Overexpression of glucose-regulated protein 78 in colon cancer. Clin Chim Acta. 2006;364:308-315. [PubMed] |
| 11. | Lee AS. The glucose-regulated proteins: stress induction and clinical applications. Trends Biochem Sci. 2001;26:504-510. [PubMed] |
| 13. | Miyake H, Hara I, Arakawa S, Kamidono S. Stress protein GRP78 prevents apoptosis induced by calcium ionophore, ionomycin, but not by glycosylation inhibitor, tunicamycin, in human prostate cancer cells. J Cell Biochem. 2000;77:396-408. [PubMed] |
| 14. | Hannon GJ, Rossi JJ. Unlocking the potential of the human genome with RNA interference. Nature. 2004;431:371-378. [PubMed] |
| 15. | Huppi K, Martin SE, Caplen NJ. Defining and assaying RNAi in mammalian cells. Mol Cell. 2005;17:1-10. [PubMed] |
| 16. | Elbashir SM, Harborth J, Lendeckel W, Yalcin A, Weber K, Tuschl T. Duplexes of 21-nucleotide RNAs mediate RNA interference in cultured mammalian cells. Nature. 2001;411:494-498. [PubMed] |
| 17. | Sijen T, Fleenor J, Simmer F, Thijssen KL, Parrish S, Timmons L, Plasterk RH, Fire A. On the role of RNA amplification in dsRNA-triggered gene silencing. Cell. 2001;107:465-476. [PubMed] |
| 18. | Kissler S, Van Parijs L. Exploring the genetic basis of disease using RNA interference. Expert Rev Mol Diagn. 2004;4:645-651. [PubMed] |
| 19. | Shen WG. RNA interference and its current application in mammals. Chin Med J (Engl). 2004;117:1084-1091. [PubMed] |