修回日期: 2009-08-26
接受日期: 2009-08-31
在线出版日期: 2009-09-18
目的: 观察过氧化物酶体增殖物活化受体γ(PPARγ)激动剂罗格列酮(ROSI)预处理后重症急性胰腺炎(SAP)大鼠胰腺组织中PPARγ与诱导型一氧化氮合酶(iNOS)的表达, 探讨ROSI对大鼠SAP的干预作用.
方法: 将72只♂SD大鼠随机分为假手术(SO)组、SAP组及ROSI组, 每组24只. 逆行胰胆管注射5%牛磺胆酸钠(1 mL/kg)制备SAP模型. ROSI组在制模前1 h腹腔注射1%罗格列酮(1 mL/kg), 然后制备SAP模型. 术后3、6、12 h经腹主动脉取血处死大鼠(每个时间点8只), 胰腺组织病理切片HE染色后评分, 留取胰腺组织检测髓过氧化物酶(MPO)、iNOS、NO含量, 逆转录聚合酶链反应(RT-PCR)检测胰腺组织中PPARγ和iNOS mRNA的表达水平.
结果: 与SAP组比较, ROSI组12 h点胰腺组织中MPO活性下降(2.09±0.36 U/g vs 2.67±0.58 U/g, P<0.01), 胰腺病理学评分改善(10.50±1.67 vs 12.50±1.77, P<0.05); ROSI组6、12 h点iNOS、NO活性低于同时间点SAP组(6 h点: 4.39±1.20 U/mgprotvs 6.44±1.73 U/mgprot; 22.58±5.49 mmol/gprot vs 36.90±7.28 mmol/gprot; 12 h点: 9.87±2.69 U/mgprot vs15.68±1.74 U/mgprot; 17.06±5.40 mmol/gprot vs 24.47±4.98 mmol/gprot, 均P<0.01); ROSI组胰腺组织中PPARγ mRNA表达在3 h点明显增加, 6 h点达最高峰, 单次剂量(10 mg/kg)至12 h点仍持续表达, 其表达水平分别为0.229±0.091, 0.394±0.081, 0.364±0.064. 与SAP组比较, 而6 h点与12 h点iNOS mRNA表达较同时段SAP组均有下降, 差异有统计学意义(0.197±0.049 vs 0.269±0.068; 0.266±0.067 vs 0.415±0.076, P<0.05或<0.01).
结论: 罗格列酮通过活化PPARγ途径, 抑制胰腺组织中iNOS mRNA表达, 减少iNOS和NO生成, 减轻中性粒细胞浸润, 从而减轻SAP时胰腺病理损害.
引文著录: 顾澄宇, 蔡兵, 吴鸣宇, 田斌, 陈季云, 李军成. 罗格列酮对大鼠重症急性胰腺炎的干预作用. 世界华人消化杂志 2009; 17(26): 2667-2672
Revised: August 26, 2009
Accepted: August 31, 2009
Published online: September 18, 2009
AIM: To determine changes in the expression of peroxisome proliferator-activated receptor γ (PPARγ) and inducible nitric oxide synthase (iNOS) mRNAs in rats with severe acute pancreatitis (SAP) and investigate the effect of rosiglitazone (a specific PPAR-γ ligand) pretreatment on the development of SAP.
METHODS: Seventy-two male Sprague-Dawley rats were randomly and equally allocated into sham operation group (SO group), model control group (SAP group) and rosiglitazone pretreatment group (ROSI group). SAP was induced in rats by retrograde injection of 5% sodium taurocholate (1 mL/kg) into the biliopancreatic duct. Rats in the ROSI group were administered 1% rosiglitazone (1 mL/kg) one hour before the operation. Rats were sacrificed by exsanguination from abdominal aorta at 3, 6 and 12 h after the operation. The pancreatic tissue samples were stained with hematoxylin and eosin for histological evaluation. Pancreatic myeloperoxidase (MPO), iNOS and NO activity was measured. Semiquantitative reverse transcription-polymerase chain reaction (RT-PCR) was used to detect the expression of PPARγ and iNOS mRNAs in the pancreatic tissue.
RESULTS: The expression of PPARγ mRNA in the pancreas was elevated in the rosiglitazone pretreatment group at 3 h after the operation, reaching the peak at 6 h and still maintaining a high level at 12 h (0.229 ± 0.091, 0.394 ± 0.081 and 0.364 ± 0.064, respectively). Compared with the SAP group at 6 h and 12 h after the operation, the expression of iNOS mRNA in the pancreas was significantly downregulated (0.197 ± 0.049 vs 0.269 ± 0.068 and 0.266 ± 0.067 vs 0.415 ± 0.076, respectively;P < 0.05 or P < 0.01), and the activity of iNOS and NO in the pancreas significantly decreased (6 h: 4.39 ± 1.20 U/mgprot vs6.44 ± 1.73 U/mgprot and 22.58 ± 5.49 mmol/gprot vs 36.90 ± 7.28 mmol/gprot; 12 h: 9.87 ± 2.69 U/mgprot vs 15.68 ± 1.74 U/mgprot and 17.06 ± 5.40 mmol/gprot vs 24.47 ± 4.98 mmol/gprot; all P < 0.01) in the ROSI group. Compared with the SAP group at 12 h, the activity of MPO also decreased (2.09 ± 0.36 U/g vs 2.67 ± 0.58 U/g, P < 0.01), and the pancreatic histological score was reduced (10.50 ± 1.67 vs 12.50 ± 1.77, P < 0.05) in the ROSI group.
CONCLUSION: Rosiglitazone pretreatment can activate the PPARγ pathway, suppress the expression of iNOS mRNA, reduce the activity of iNOS and NO, and decrease neutrophil infiltration in the pancreas, thereby attenuating pancreatic damage in rats with severe acute pancreatitis.
- Citation: Gu CY, Cai B, Wu MY, Tian B, Chen JY, Li JC. Rosiglitazone pretreatment reduces pancreatic damage in rats with severe acute pancreatitis. Shijie Huaren Xiaohua Zazhi 2009; 17(26): 2667-2672
- URL: https://www.wjgnet.com/1009-3079/full/v17/i26/2667.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i26.2667
过氧化物酶体增殖物活化受体γ(peroxisome proliferator-activated receptor-γ, PPARγ), 是一类由配体激活的核转录因子, 属Ⅱ型核受体超家族成员, 主要参与细胞的增殖、分化以及维持糖脂代谢的平衡[1]. 近年来, PPARγ在炎症调控中的有益作用逐渐引起人们的关注. 本实验采用以5%牛磺胆酸钠逆行胰胆管注射建立重症急性胰腺炎(severe acute pancreatitis, SAP)模型, 并用PPARγ激动剂罗格列酮(rosiglitazone, ROSI)进行预处理, 探讨ROSI对SAP大鼠胰腺组织中PPARγ mRNA和诱导型一氧化氮合酶(inducible nitric oxide synthase, iNOS)mRNA表达的影响, 探讨其对SAP的作用及机制, 为PPARγ配体临床用于治疗SAP提供理论基础和实验依据.
健康♂SD大鼠72只, 清洁级, 体质量260-300 g, 购自苏州大学实验动物中心; 牛磺胆酸钠购自美国Sigma公司; ROSI购自四川成都宇洋高科技发展公司; 髓过氧化物酶(myeloperoxidase, MPO)试剂盒、iNOS试剂盒、一氧化氮(nitric oxide, NO)试剂盒购自南京建成生物工程研究所; TRIzol RNA抽提试剂购自美国MRC公司; 第一链cDNA合成试剂盒和PCR试剂盒均购自美国MBI Fermentas公司. PPARγ上游引物: 5'-AAC CGG AAC AAA TGC CAG TA-3', 下游引物: 5'-TGG CAG CAG TGG AAG AAT CG-3', 扩增产物长489 bp; iNOS上游引物: 5'-AGC ATC ACC CCT GTG TTC CAC CC-3', 下游引物: 5'-TGG GGC AGT CTC CAT TGC CA-3', 扩增产物长388 bp. β-actin上游引物: 5'-TTG TAA CCA ACT GGG ACG ATA TGG-3', 下游引物: 5'-GAT CTT GAT CTT CAT GGT GCT AGG-3', 扩增产物长764 bp; 各引物均由上海生工生物工程公司合成.
1.2.1 分组与药物干预: 实验前大鼠禁食12 h, 按照完全随机法分为假手术组(SO组)、SAP组和ROSI组, 各24只. 参照Aho et al[2]的方法制备SAP模型, 逆行胰胆管注射5%牛磺胆酸钠(1 mL/kg), 注射时间1 min. SO组制模前1 h腹腔注射生理盐水(1 mL/kg), 开腹后翻动胰腺3次. ROSI组在制模前1 h腹腔注射1%罗格列酮(1 mL/kg), 再按SAP组的方法制模. 各组在制模后3、6、12 h经腹主动脉取血处死大鼠, 每个时间点8只大鼠. 切取胰腺组织100 mg左右, 即刻投入液氮中冷冻, 用于mRNA测定. 再取约100 mg组织, 液氮急速冷冻后-70℃冻存, 留待测定iNOS、NO含量. 取胰腺组织固定部位组织, 常规制成石蜡切片, HE染色, 行病理学检查.
1.2.2 胰腺组织病理学观察: 由病理科医师在光镜下观察胰腺组织学改变, 以Schmidt et al[3]标准进行胰腺组织镜下病理评分.
1.2.3 胰腺组织MPO含量检测: 中性粒细胞中存在MPO, 每个细胞所含酶的量是一定的, 约占细胞干质量的5%, 该酶具有使过氧化氢还原的能力, 且中性粒细胞的数目和MPO活性呈线性关系, 利用这一特点可以分析酶的活力, 并推断中性粒细胞的数目. 通过供氢体邻连茴香胺供氢后生成黄色化合物, 在460 nm处通过比色测定A产物的生成量, 从而推算出MPO的活力及H2O2减少的量和白细胞的数目. 每克组织湿质量在37℃的反应体系中H2O2被分解1 μmol为1个活力单位. 胰腺组织MPO测定按照试剂盒说明书进行操作和计算.
1.2.4 胰腺组织iNOS和NO含量检测: NOS催化L-精氨酸和分子氧反应生成NO, NO与亲核性物质生成有色化合物, 在530 nm波长下测定吸光度, 根据吸光度的大小可计算出NOS活力, 并分型测定iNOS活力. 每毫克组织蛋白每分钟生成1 nmol NO为一个酶活力单位. 胰腺组织iNOS按照试剂盒说明书进行操作和计算. NO在体内代谢为NO2-和NO3-, NO2-进一步转化为NO3-, 利用硝酸还原酶特异性将NO3-还原NO2-, 通过显色深浅测定其浓度高低, 以反映体内NO水平. 胰腺组织NO按照试剂盒说明书进行操作和计算.
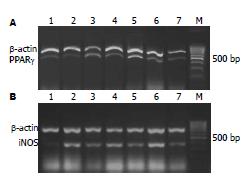
1.2.5 胰腺组织PPARγ和iNOS mRNA的检测: 将胰腺组织匀浆后, 按照TRIzol说明书提取总RNA, 取RNA于42℃逆转录, 将逆转录产物用于PCR扩增. PCR反应的变性、退火和延伸温度分别为: 94℃、58℃和72℃, 反应时间分别为30 s、30 s和1 min, 各循环35次. 取PCR扩增产物各12.5 μL, 在20 g/L琼脂糖凝胶上电泳, 溴乙锭染色. 凝胶图像分析系统进行电泳条带密度分析, 分别计算PPARγ和iNOS基因表达量与β-actin表达量的比值, 代表每个样本PPARγ和iNOS的表达水平.
统计学处理 实验数据以mean±SD表示, 各组间比较采用方差分析. 采用SPSS11.5统计软件包进行统计学处理, P<0.05认为差异有显著性.
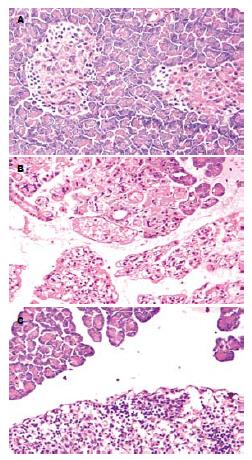
SO组各时间点胰腺组织镜下无明显病理改变, 胰腺小叶结构完整, 间质清晰; 胰岛分布均匀, 结构完整, 偶可见间质轻度充血水肿, 间质内炎症细胞浸润少见; SAP组胰腺结构被破坏, 腺泡水肿、出血坏死明显, 大量炎症细胞浸润, 随时间延长, 胰腺组织损伤逐渐加重, 各时间点病理评分较SO组升高(P<0.05). ROSI组3、6 h在胰腺腺泡坏死、出血、炎性细胞浸润与对应时间点SAP组比较有所改善, 以12 h时间点胰腺组织损伤改善最为明显(P<0.05, 表1, 图1).
| 分组 | 胰腺病理评分 | MPO(U/g) | iNOS(U/mgprot) | NO(μmol/gprot) |
| SO组 | ||||
| 3 h | 0.56±0.49 | 1.47±0.19 | 0.39±0.15 | 4.08±1.47 |
| 6 h | 0.93±0.49 | 1.45±0.18 | 0.42±0.18 | 3.22±1.24 |
| 12 h | 0.75±0.65 | 1.70±0.25 | 0.52±0.15 | 3.51±0.31 |
| SAP组 | ||||
| 3 h | 7.62±1.18b | 2.37±0.39b | 0.62±0.08 | 9.85±2.84b |
| 6 h | 9.88±2.12b | 2.45±0.33b | 6.44±1.73b | 36.90±7.28b |
| 12 h | 12.50±1.77b | 2.67±0.58b | 15.68±1.74b | 24.47±4.98b |
| ROSI组 | ||||
| 3 h | 6.50±1.38b | 1.98±0.45a | 0.51±0.14 | 8.30±1.99 |
| 6 h | 8.44±1.54b | 2.38±0.48b | 4.39±1.20bd | 22.58±5.49bd |
| 12 h | 10.50±1.67bc | 2.09±0.36ad | 9.87±2.69bd | 17.06±5.40bd |
3 h起SAP组胰腺组织中MPO活性明显升高, 至12 h达最高峰, ROSI组6 h和SAP组6 h比较无显著性差异(P>0.05). ROSI组12 h MPO活性显著下降, 与同时间点SAP组比较有显著性差异(P<0.01, 表1).
SAP组、ROSI组3 h胰腺组织中iNOS活性与SO组3 h比较无统计学意义. 6 h SAP组和ROSI组胰腺组织iNOS活性较SO组6 h均明显升高(P<0.01), ROSI组6、12 h iNOS活性低于同时间点SAP组(P<0.01, 表1). 胰腺组织中NO活性在SAP组6 h达到峰值, 但SAP组12 h NO活性下降较明显. ROSI组6、12 h胰腺组织中NO活性均较同时段SAP组降低(P<0.01, 表1).
SO组和SAP组各时段PPARγ mRNA表达微弱; ROSI组, PPARγ mRNA的活化明显增强, 术后6 h达高峰, 12 h持续表达. iNOS mRNA表达在SAP组3 h与SO组3 h比较无显著性差异(P>0.05), SAP组6 h可见到iNOS mRNA开始表达, 术后12 h达高峰. ROSI组6 h和12 h iNOS mRNA表达较同时段SAP组均有下降, 以ROSI组12 h最为显著(P<0.01, 表2, 图2).
AP可从局部炎症发展到全身炎症反应综合征, 最后导致多器官功能衰竭. 尽管AP的病理生理机制直至今日尚未完全阐明, 但大量研究表明, AP的严重程度与活化的炎症调节物质构成的复杂网络密切相关, 细胞因子、化学趋化因子、细胞黏附分子、蛋白酶、活性氧分子、iNOS等参与了胰腺局部损伤, 促使全身炎症反应向多器官功能不全发展[4].
PPARγ是一类由配体激活的核转录因子, 属Ⅱ型核受体超家族成员. 1990年首先由Issemann et al[5]从小鼠肝脏中克隆得到. PPARγ的天然配体是花生四烯酸经环氧合酶及部分脂氧合酶途径的代谢产物, 如15-脱氧前列腺素J2(15d-PGJ2)、13-羟十八碳二烯醇(13-HODE)、9-羟十八碳二烯醇(9-HODE). 噻唑烷二酮(thiazolidinedione, TZD)化合物是PPARγ的合成配体, 其中包括曲格列酮、吡格列酮、罗格列酮和环格列酮等, 这类化合物作为胰岛素增敏剂用于治疗2型糖尿病. 相对于大多数天然配体, TZDs化合物有着更强的PPARγ激动活性, 尤其是罗格列酮的活性已经达到纳摩尔级[6]. 随着研究不断地深入, 人们发现PPARs的作用非常广泛, 除涉及脂质代谢、糖代谢外, 还在细胞增殖分化、凋亡, 创伤愈合过程中发挥重要作用[7].
近年来, PPARγ在炎症调控中的有益作用逐渐引起人们的关注. 在炎症性肠病、缺血再灌注损伤和感染性休克动物模型中, TZDs可通过活化PPARγ途径调控NF-κB、信号转导和转录激活因子(signal transducer and activator of transcription, STAT)、活化蛋白-1(activated protein-1, AP-1)等信号转导通路, 抑制炎症相关基因如iNOS、TNF-α、IL-1β等的转录与表达, 抑制单核-巨噬细胞活化, 减轻炎症细胞浸润和减少炎症介质释放而发挥抗炎作用[8-9]. 2003年Hashimoto et al[10]在研究雨蛙素诱导的AP胰腺组织中发现PPARγ的表达增加, 干预性应用15d-PGJ2后, 胰腺组织病理改变明显减轻, 与抑制COX-2、ICAM-1的表达, 减少IL-6生成, 降低NF-κB活性有关. 第1次在动物实验中证明PPARγ可能是AP的治疗靶点. Konturek et al[11]研究发现, 在雨蛙素诱导的AP模型中, 给予吡格列酮干预, 可呈剂量依赖性地改善胰腺病理学评分, 显著降低血清脂肪酶活性、IL-1β水平及胰腺组织中IL-1β mRNA的表达, 并能改善胰腺微循环, 吡格列酮的这种保护作用与其抑制炎症细胞因子IL-1β的释放和热休克蛋白-70(heat shock protein, HSP-70)的过度表达有关. Rollins et al[12]用15d-PGJ2和曲格列酮干预雨蛙素诱导的小鼠AP模型, 结果显示曲格列酮预处理组的血清淀粉酶降低, 胰腺组织学损害及炎症减轻, 并和PPARγ激动剂呈剂量依赖性关系. 研究者认为尽管雨蛙素降低了胰腺PPARγ的表达, 但是在激动剂的预处理下, 保持了胰腺PPARγ的表达水平. 这种PPARγ逆转的表达方式与胰腺炎的严重程度和致炎细胞因子IL-6、TNF-α相关联. 这表明PPARγ对AP早期的炎症级联瀑布式反应起直接作用. 新近研究发现, 全氟辛酸和PPARγ激动剂ROSI在雨蛙素诱导的大鼠AP中具有抗炎作用. 全氟辛酸能活化PPARα、PPARγ两条信号通路, 显著减轻白细胞浸润, 减少前列腺素合成. ROSI通过PPARγ信号通路, 能显著减轻白细胞浸润, 但不能影响胰腺组织中前列腺素合成[13].
在过去的十余年人们已经逐步认识到NO在AP中具有双向调节作用. cNOS合成适量的NO, 可以扩张血管, 改善AP时胰腺内的血流, 同时NO还能阻断中性粒细胞在血管内皮表面的黏附, 抑制中性粒细胞合成超氧化物阴离子. 在AP后期, 炎症介质如TNF-α、IL-β大量生成激活了iNOS, 合成大量的NO, 使NO作为自由基的毒性作用充分表现出来, 加重胰腺组织损伤[14]. 有研究显示, 在内毒素诱导的大鼠急性肺损伤模型中, ROSI预处理能减少肺组织中iNOS mRNA的表达, 减少NO的过量生成, 从而减轻肺损伤[15]. 然而, 在AP模型中有关ROSI经PPARγ途径调控iNOS的相关研究尚少.
本实验结果表明, 在逆行胰胆管注射5%牛磺胆酸钠建立大鼠SAP模型中, 制模后3 h出现胰腺腺泡水肿坏死, 脂肪液化及出血, 炎症细胞浸润明显, 胰腺的正常结构遭到破坏, 6 h后SAP组胰腺组织中iNOS mRNA和NO水平明显升高, 我们的结果与Vaquero et al[16]、Ueno et al[17]的观测结果是一致的, 高水平的NO可直接引起组织损伤, 而较低水平的NO可通过提高胰腺血流量、改善胰腺微循环, 减轻炎症细胞在血管内皮的黏附和浸润发挥有益作用. 同时我们发现, 在SAP组12 h iNOS mRNA表达和iNOS分泌继续增加, 但胰腺组织中NO水平却较模型组6 h下降, 我们推测可能与NO合成的底物过度消耗有关. ROSI组胰腺组织中PPARγ mRNA表达在3 h明显增加, 6 h达最高值, 单次剂量至12 h仍持续表达. 制模前给予ROSI预处理, iNOS mRNA表达下降, 胰腺组织中MPO、iNOS和NO含量下降, 中性粒细胞浸润减少, 胰腺镜下病理评分改善, ROSI治疗后可显著降低脂质过氧化及硝基酪氨酸含量[18]. ROSI通过活化PPARγ途径, 抑制iNOS mRNA表达, 减少iNOS分泌, 降低胰腺组织中NO含量, 减轻中性粒细胞浸润, 从而减轻胰腺病理损害. ROSI有望成为临床治疗AP及预防ERCP术后AP的有效新方法, 然而, PPARγ在AP中的确切作用机制目前尚不十分清楚, 值得进一步深入研究.
AP可从局部炎症发展到全身炎症反应综合征, 最后导致多器官功能衰竭, 并发症多、死亡率高, 是临床上的一大难题. 过氧化物酶体增殖物活化受体(PPARs)除涉及脂质代谢、糖代谢外, 还在细胞增殖分化、凋亡, 创伤愈合过程中发挥重要作用, 在炎症的调控中具有有益作用.
樊晓明, 主任医师, 复旦大学附属金山医院消化科
ROSI通过活化PPARγ途径, 抑制iNOS mRNA表达, 减少iNOS分泌, 降低胰腺组织中NO含量, 减轻中性粒细胞浸润, 从而减轻胰腺病理损害. ROSI有望成为临床治疗AP及预防ERCP术后AP的有效新方法, 然而, PPARγ在AP中的确切作用机制目前尚不十分清楚, 值得进一步深入研究.
Konturek et al在雨蛙素诱导的AP模型中证实, 吡格列酮可呈剂量依赖性地改善胰腺病理学评分, 显著降低血清脂肪酶活性、IL-1β水平及胰腺组织中IL-1β mRNA的表达, 并能改善胰腺微循环.
本文通过测定胰腺组织中PPARγ和iNOS mRNA的表达情况, 从基因调控角度探讨SAP时胰腺损伤的机制, 并进一步揭示了罗格列酮防治AP发展及预防ERCP术后AP的可能作用机制.
本研究进一步阐述了NO、iNOS在SAP发病中的作用, 并探讨了罗格列酮可能的防治策略, 为临床上应用罗格列酮干预治疗AP提供理论依据.
过氧化物酶体增殖物活化受体(PPARs): 一类由配体激活的核转录因子, 属Ⅱ型核受体超家族成员. 两栖类、啮齿类动物及人类的PPARs均存在三种亚型, 即PPARα、PPARβ和PPARγ.
本文选题新颖, 设计合理, 结果可靠. 为PPARγ在急性胰腺炎发病机制中的作用和其激动剂在治疗中的可能作用提供了实验室依据.
编辑: 李军亮 电编:吴鹏朕
| 1. | Escriva H, Delaunay F, Laudet V. Ligand binding and nuclear receptor evolution. Bioessays. 2000;22:717-727. [PubMed] |
| 2. | Aho HJ, Koskensalo SM, Nevalainen TJ. Experimental pancreatitis in the rat. Sodium taurocholate-induced acute haemorrhagic pancreatitis. Scand J Gastroenterol. 1980;15:411-416. [PubMed] |
| 3. | Schmidt J, Rattner DW, Lewandrowski K, Compton CC, Mandavilli U, Knoefel WT, Warshaw AL. A better model of acute pancreatitis for evaluating therapy. Ann Surg. 1992;215:44-56. [PubMed] |
| 4. | Gaisano HY, Gorelick FS. New insights into the mechanisms of pancreatitis. Gastroenterology. 2009;136:2040-2044. [PubMed] |
| 5. | Issemann I, Green S. Activation of a member of the steroid hormone receptor superfamily by peroxisome proliferators. Nature. 1990;347:645-650. [PubMed] |
| 6. | Willson TM, Cobb JE, Cowan DJ, Wiethe RW, Correa ID, Prakash SR, Beck KD, Moore LB, Kliewer SA, Lehmann JM. The structure-activity relationship between peroxisome proliferator-activated receptor gamma agonism and the antihyperglycemic activity of thiazolidinediones. J Med Chem. 1996;39:665-668. [PubMed] |
| 7. | Gelman L, Michalik L, Desvergne B, Wahli W. Kinase signaling cascades that modulate peroxisome proliferator-activated receptors. Curr Opin Cell Biol. 2005;17:216-222. [PubMed] |
| 8. | Abdelrahman M, Sivarajah A, Thiemermann C. Beneficial effects of PPAR-gamma ligands in ischemia-reperfusion injury, inflammation and shock. Cardiovasc Res. 2005;65:772-781. [PubMed] |
| 9. | von Knethen A, Soller M, Brüne B. Peroxisome proliferator-activated receptor gamma (PPAR gamma) and sepsis. Arch Immunol Ther Exp (Warsz). 2007;55:19-25. [PubMed] |
| 10. | Hashimoto K, Ethridge RT, Saito H, Rajaraman S, Evers BM. The PPARgamma ligand, 15d-PGJ2, attenuates the severity of cerulein-induced acute pancreatitis. Pancreas. 2003;27:58-66. [PubMed] |
| 11. | Konturek PC, Dembinski A, Warzecha Z, Burnat G, Ceranowicz P, Hahn EG, Dembinski M, Tomaszewska R, Konturek SJ. Pioglitazone, a specific ligand of peroxisome proliferator-activated receptor-gamma, protects pancreas against acute cerulein-induced pancreatitis. World J Gastroenterol. 2005;11:6322-6329. [PubMed] |
| 12. | Rollins MD, Sudarshan S, Firpo MA, Etherington BH, Hart BJ, Jackson HH, Jackson JD, Emerson LL, Yang DT, Mulvihill SJ. Anti-inflammatory effects of PPAR-gamma agonists directly correlate with PPAR-gamma expression during acute pancreatitis. J Gastrointest Surg. 2006;10:1120-1130. [PubMed] |
| 13. | Griesbacher T, Pommer V, Schuligoi R, Tiran B, Peskar BA. Anti-inflammatory actions of perfluorooctanoic acid and peroxisome proliferator-activated receptors (PPAR) alpha and gamma in experimental acute pancreatitis. Int Immunopharmacol. 2008;8:325-329. [PubMed] |
| 14. | Algül H, Tando Y, Schneider G, Weidenbach H, Adler G, Schmid RM. Acute experimental pancreatitis and NF-kappaB/Rel activation. Pancreatology. 2002;2:503-509. [PubMed] |
| 15. | Liu D, Zeng BX, Zhang SH, Wang YL, Zeng L, Geng ZL, Zhang SF. Rosiglitazone, a peroxisome proliferator-activated receptor-gamma agonist, reduces acute lung injury in endotoxemic rats. Crit Care Med. 2005;33:2309-2316. [PubMed] |
| 16. | Vaquero E, Gukovsky I, Zaninovic V, Gukovskaya AS, Pandol SJ. Localized pancreatic NF-kappaB activation and inflammatory response in taurocholate-induced pancreatitis. Am J Physiol Gastrointest Liver Physiol. 2001;280:G1197-G1208. [PubMed] |
| 17. | Ueno N, Kashiwamura S, Ueda H, Okamura H, Tsuji NM, Hosohara K, Kotani J, Marukawa S. Role of interleukin 18 in nitric oxide production and pancreatic damage during acute pancreatitis. Shock. 2005;24:564-570. [PubMed] |
| 18. | Cuzzocrea S, Pisano B, Dugo L, Ianaro A, Britti D, Patel NS, Di Paola R, Genovese T, Di Rosa M, Caputi AP. Rosiglitazone, a ligand of the peroxisome proliferator-activated receptor-gamma, reduces acute pancreatitis induced by cerulein. Intensive Care Med. 2004;30:951-956. [PubMed] |