修回日期: 2009-08-03
接受日期: 2009-08-10
在线出版日期: 2009-09-18
目的: 构建核定位信号突变型P21基因的真核表达载体并初步探讨其功能.
方法: 采用基因定点诱变技术获得核定位信号突变型P21基因. 采用DNA重组技术, 将突变型P21基因亚克隆至pDsRed1-C1真核表达质粒中, 重组为pDsRed1-C1-P21NLS-. 酶切鉴定及DNA测序, 脂质体转染HepG2细胞, RT-PCR检测目的基因pDsRed1-C1-P21NLS-的表达, 荧光显微镜观测目的基因亚细胞定位, 台盼蓝拒染法检测质粒转染HepG2细胞生长曲线.
结果: 成功克隆了核定位信号野生型及突变型P21基因, 成功构建了pDsRed1-C1-P21WT及pDsRed1-C1-P21NLS-重组质粒, 酶切片段分别为4.7和0.5 kb, 酶切鉴定正确, 测序结果与GenBank核酸序列数据库比对表明, 核定位序列中共9个核苷酸发生变异, 由CGAAAACGG突变为GCGGCCGCG, 测序成功. 高效表达的红色融合蛋白, 野生型主要定位于细胞核; 而突变型主要定位于细胞质. 野生型P21抑制HepG2细胞的生长; 突变型促进HepG2细胞的生长, 二者差异具有统计学意义(P<0.01).
结论: P21的亚细胞定位, 对HepG2细胞增殖影响具有明显差异. 胞核P21抑制肿瘤生长, 而胞质P21促进肿瘤生长.
引文著录: 邱荣元, 何生松, 陈锋, 庞然, 杨凯凯. P21真核表达载体的构建及其对HepG2细胞增殖的影响. 世界华人消化杂志 2009; 17(26): 2662-2666
Revised: August 3, 2009
Accepted: August 10, 2009
Published online: September 18, 2009
AIM: To construct the eukaryotic expression vector of the P21 gene harboring mutated nuclear localization signal (NLS) and investigate the differential effect of subcellular localization of P21 protein on HepG2 cell proliferation.
METHODS: NLS-mutant P21 gene (P21 NLS-) was generated using site-directed mutagenesis. After wild-type and NLS-mutant P21 genes were directionally cloned into the eukaryotic expression plasmid pDsRed1-C1, the resulting expression vectors pDsRed1-C1-P21WT and pDsRed1-C1-P21NLS- were introduced into HepG2 cells by liposome-mediated transfection. The expression of P21WT and P21 NLS- genes was detected by reverse transcription-polymerase chain reaction (RT-PCR). Intracellular localization of P21 protein was analyzed using fluorescence microscopy. Cell proliferation was assayed by trypan blue exclusion staining.
RESULTS: Restriction enzyme digestion proved that both pDsRed1-C1-P21WT and pDsRed1-C1-P21NLS- expression vectors were successfully constructed. Sequence analysis indicated that the 9-nucleotide nuclear localization sequence of the P21 gene was mutated from CGAAAACGG to GCGGCCGCG. P21 NLS- protein was highly expressed in the cytoplasm, while wild-type P21 protein was mainly distributed in the nucleus. The expression of P21 NLS- protein significantly promoted the growth of HepG2 cells, whereas the expression of wild-type P21 protein significantly inhibited the growth of HepG2 cells (both P < 0.01).
CONCLUSION: Wild-type P21 protein inhibits the growth of HepG2 cells, while P21 NLS- protein promotes the growth of HepG2 cells.
- Citation: Qiu RY, He SS, Chen F, Pang R, Yang KK. Differential effect of subcellular localization of P21 protein on HepG2 cell growth. Shijie Huaren Xiaohua Zazhi 2009; 17(26): 2662-2666
- URL: https://www.wjgnet.com/1009-3079/full/v17/i26/2662.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i26.2662
P21又名细胞周期素依赖激酶抑制剂-1A(cyclin-dependent kinase inhibitor 1A, CDKN1A), 具有广泛的CDK抑制活性, 长久以来被认为具有肿瘤抑制功能, 并且与其胞核定位有关. 然而, 目前更进一步的深入研究显示, 当其定位于胞质时, 又具有促进细胞周期的运行、抗凋亡作用[1-3], 从而发挥促进肿瘤的发生、发展. 已经有临床病理结果显示, P21在原发性肝癌中其胞质表达率明显升高[4], 但胞质P21是否也具有促进肝癌的作用, 尚缺乏令人信服的实验依据. 本研究采用定点诱变技术, 突变其核定位信号序列, 构建主要在胞质表达的P21, 检测其对HepG2细胞增殖活性的影响, 明确P21的胞质定位对于原发性肝癌发生、发展的意义.
质粒和菌株E.coli DH5α感受态细胞购自北京全式金生物公司, 含人全长的P21 cDNA质粒(pc-WAF1-S)由美国Johns Hopkins大学肿瘤研究所Bert Vogelstein教授惠赠, pDsRed1-C1载体(含卡拉霉素、新霉素抗性基因和红色荧光蛋白筛选标记)购自BD Biosciences Clontech公司. QuikChange定点突变试剂盒购自Stratagene公司, 质粒纯化试剂盒、胶回收试剂盒、PCR产物纯化试剂盒、T4 DNA连接酶、EcoRⅠ、BamHⅠ、TRIzol mRNA提取试剂盒购自TaKaRa公司, 无内毒素质粒中提试剂盒购自Omega公司, DMEM高糖细胞培养液购自Gibco, TransLipid脂质体、DNA分子量标准(DNA Marker Ⅳ)购自北京全式金生物公司.
1.2.1 PCR引物设计: 参照Neus Agell教授方法,利用Primer Premier 5.0辅助设计, 由TaKaRa(大连)公司合成. (1)野生型P21: Sense: 5'-GTGGGAATTCGCATATGTCAGAACCGGCTGGG-3'; antisense: 5'-ACGAGGATCCAAGCTTTAGGGCTTCCTCTTGGA-3'; (2)突变型P21: Sense1: 5'-GGACCTGGAGACTCTCAGGGTGCGGCCGCGCGGCAGACCAGCATG-3'; Antisense 1: 5'- ACGAGGATCCAAGCTTTAGGGCTTCCTCTTGGA-3'; Sense 2: GTGGGAATTCGCATATGTCAGAACCGGCTGGG; Antisense 2: 以Sense 1及Antisense 1为引物合成的PCR产物; 引物中分别带有EcoRⅠ的酶切位点GAATTC及BamHⅠ的酶切位点GGATCC. 预期扩增目的基因cDNA全长, PCR产物长度为500 bp.
1.2.2 PCR反应体系: cDNA 10 μL; 5×PCR缓冲液10 μL; TaKaRa LA Taq酶0.25 μL; P21 cDNA上、下游引物各1.0 μL; 以无菌ddH2O补足体积为50 μL. PCR反应条件为: 95℃ 2 min, 95℃ 30 s, 54℃ 30 s, 72℃ 50 s, 30个循环, 最后72℃延伸 5 min. 取5.0 μL PCR产物进行10 g/L琼脂糖凝胶电泳(120 V, 25 min)鉴定.
1.2.3 pDsRed1-C1-P21的亚克隆: 将P21核定位信号野生型及突变型片段胶回收后通过TA末端连接到质粒pDsRed1-C1上, 转化感受态大肠杆菌DH5α, 利用前者带有卡拉霉素耐药基因, 经卡拉霉素筛选阳性菌株. 扩增后提取纯化质粒, 分别得到重组带有红色荧光蛋白的核定位信号野生型P21质粒(pDsRed1-C1-P21WT)、带有红色荧光蛋白的核定位信号突变型P21质粒(pDsRed1-C1-P21NLS-).
1.2.4 pDsRed1-C1-P21的酶切鉴定及DNA测序: 将上述纯化质粒, 分别予EcoRⅠ及BamHⅠ单、双酶切, 将插入了P21 cDNA目的片段的阳性克隆(菌液及质粒)送交上海英骏公司, 使用pDsRed1-C1通用引物对其进行测序.
1.2.5 脂质体转染HepG2细胞及筛选与鉴定: (1)分组: 转染实验共设4组, 即空白对照非转染组、空载体转染组、野生型转染组、突变型转染组. 非转染组为同期培养的HepG2细胞, 设为空白对照, 空载体转染组为转染不含P21基因的pDsRed1-C1载体, 野生型组为转染pDsRed1-C1-P21WT质粒, 突变型组为转染pDsRed1-C1-P21 NLS-质粒. 每组共设置4孔培养板. (2)转染方法: 生长良好的HepG2细胞在转染前1 d传代, 以含DMEM(高糖)完全培养液(100 mL/L胎牛血清)调整细胞浓度为3×108/L接种于24孔细胞培养板中, 每孔500 μL. HepG2细胞的转染按说明书进行: 取2 μL脂质体溶于50 μL无血清、无抗生素DMEM液中配为A液, 轻轻混匀后室温静置5 min; pDsRed1-C1-P21WT质粒和pDsRed1-C1-P21NLS-重组质粒DNA各0.8 μg, 溶于50 μL无血清、无抗生素DMEM液中配为B液; 将A、B两液轻轻混匀, 室温放置20 min后, 加至细胞培养板中, 37℃、50 mL/L CO2饱和湿度培养, 4 h后更换为完全培养液, 24 h后更换培养基并按1:3传代, 48 h后加入G418(600 mg/L), 每周换液2次. 扩增抗性克隆细胞: G418进行有限稀释法筛选单个细胞克隆后扩增培养, 维持G418(300 mg/L)选择压力, 每3 d换液、传代, 空载体组细胞命名为HepG2-P0, P21核定位信号野生型阳性重组细胞命名为HepG2-P21WT, P2核定位信号突变型阳性重组细胞命名为HepG2-P21 NLS-. (3)荧光显微镜观测: 转染24 h后, 荧光显微镜观测重组蛋白表达情况, 激发光波长为558 nm, 发射光波长为583 nm. (4)P21 mRNA检测: 采用TRIzol试剂分别提取稳定转染各组细胞的总RNA, 逆转录合成cDNA, 采用P21的上、下游引物扩增pDsRed1-C1-P21片段, 15 g/L琼脂糖凝胶电泳鉴定.
1.2.6 P21核定位信号突变型基因过表达对HepG2细胞增殖的影响: 分别收集稳定转染的对数生长期的细胞, 即空载体组HepG2细胞、野生型组HepG2-P21WT细胞、突变型组HepG2-P21 NLS-细胞, 调整细胞浓度为1×109/L后, 常规培养, 每天收集细胞, 生长曲线测定: 0.4%台盼蓝拒染法每天计数活细胞1次, 连续计数5 d, 观察3组细胞的增殖速度, 根据以下公式求细胞活力: 细胞增殖促进率(%) = 突变型组-空载体组/空载体组细胞总数×100%. 细胞增殖抑制率(%) = 空载体组-野生型组/空载体组细胞总数×100%.
统计学处理 所有数据均经SPSS11.0软件进行统计分析, 计量资料采用mean±SD表示; 两组均数的比较用t检验; 两组以上均数的比较用方差分析(ANVOA). 以α = 0.05为差异有统计学意义.
将PCR产物进行琼脂糖凝胶电泳, 在500 bp左右的位置可见1条清晰明亮的目的条带, 片段大小与GenBank中公布的片段大小相符, 而阴性对照无目的条带出现.
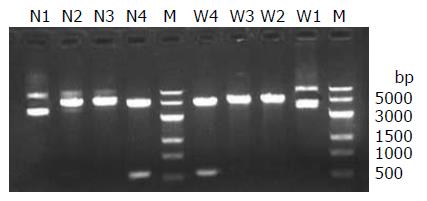
质粒电泳提示超螺旋质粒条带最亮, 接近3.0 kb, 其后有模糊的开环质粒及复制中间体.
将重组阳性克隆质粒酶切后15 g/L琼脂糖凝胶电泳, 单酶切得到5.2 kb产物, 双酶切分别得到4.7及0.5 kb大小产物, 未酶切的完整质粒其泳动速度快于单酶切组线状DNA(图1).
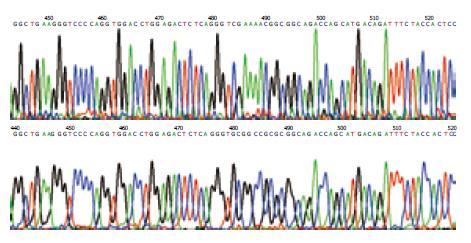
英骏公司测序结果(测序号分别为: CS090313677、CS090221623)显示: 野生型及突变型核苷酸序列比对, 在P21 cDNA第418-427(核定位序列)共9个核苷酸发生变异, 由CGAAAACGG突变为GCGGCCGCG, 对应为140到142位氨基酸突变, 其氨基酸由RKR突变为AAA(图2). P21蛋白的140-164氨基酸序列(突变): AAARQTSMTDFYHSKRRLIFSKRKP; P21蛋白的140-164氨基酸序列(野生): RKRRQTSMTDFYHSKRRLIFSKRKP.
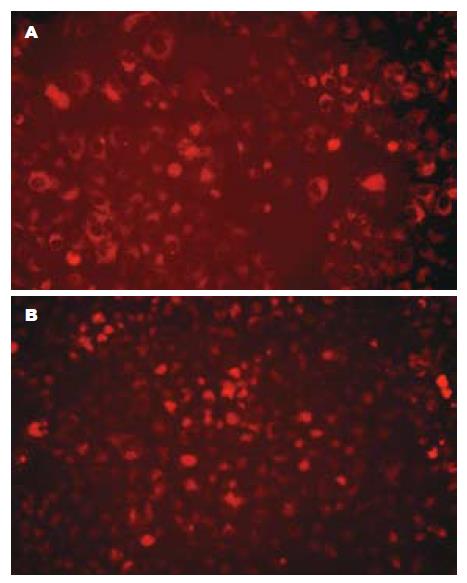
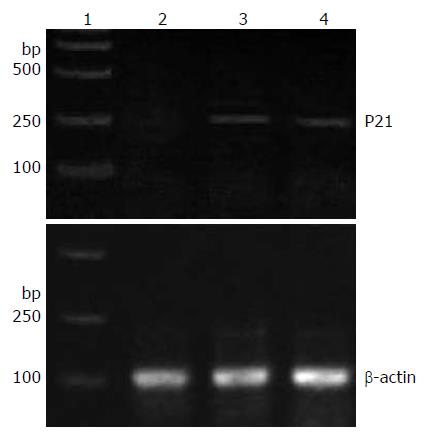
荧光倒置显微镜下观察, 转染后24 h空载体组、野生型组、突变型组有红色荧光蛋白的表达, 但空载体组红色荧光在细胞内呈弥散分布, 而野生型组、突变型组聚集成团块状. 随筛选时间延长, 2 wk后, 空白未转染对照组细胞全部死亡, 实验组始终都有红色荧光蛋白的稳定表达, 空载体组弥散分布, pDsRed1-C1-P21WT组其荧光主要定位于细胞核, 而pDsRed1-C1-P21 NLS-主要定位于胞质(图3). 从稳定筛选的HepG2-P21WT、HepG2-P21NLS-细胞中扩增出大小为250 bp的特异条带, 高丰度表达. 空载体组细胞中也有少量250 bp的特异条带, 属于HepG2细胞内源性表达(图4).
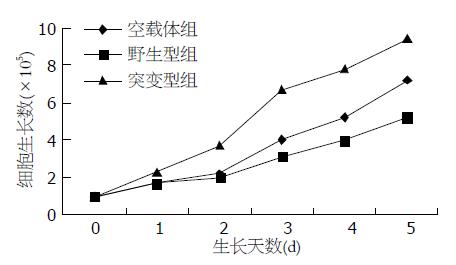
生长曲线显示, HepG2-P21NLS-细胞增殖速度最快, HepG2其次, 而HepG2-P21WT增殖最慢, 与空载体转染对照组相比, 野生型组细胞增殖抑制率最大达28%, 平均抑制率为16.8%; 与空载体转染对照组相比, 突变型组细胞增殖促进率最大达68%, 平均增殖促进率为50.4%, 差异具有统计学意义(P<0.01, 图5).
P21是el-Deiry于1993年发现的一种能够被P53转录激活的基因. 他位于染色体6p21.2, 由164个氨基酸组成, 编码一种相对分子质量为21 kDa的蛋白, 因此命名为P21[6]. P21功能的发挥主要通过直接的P21/蛋白相互作用以及P21的亚细胞定位来完成的[7]. P21具有众多蛋白质结合位点, 如P21可与Cyclin、CDK、PCNA、Procaspase 3、MAPK家族分子、Calmodulin、c-Myc等相互作用, 其中某些部位相互重叠, 导致某些蛋白之间具有可竞争的作用位点, 此外P21还有核定位信号、核输出信号, 从而影响其亚细胞定位[7].
P21的结构特点决定了他在细胞功能活动中具有广泛的作用, 如抑制细胞周期的运行, 促进细胞分化, 参与细胞老化, 这些抗增殖活性发挥依赖其胞核定位功能, 在胞核中P21与CDK[8]、PCNA[9-10]结合, 从而抑制DNA合成及细胞周期运行. 然而, 当P21定位于胞质, 与其他蛋白相互作用, 又具有促进细胞增殖、抗凋亡作用, 如与CDK4、CDK6结合, 促进与D型Cyclins的组装, 并介导及促进其核定位, 从而促进细胞周期的运行[11-12], 与Procaspase 3结合, 阻止Fas介导的凋亡途径[13-14], 并且通过抑制促凋亡激酶(apoptosis signal-regulating kinase 1, Ask1)而使抗凋亡效应进一步放大[15].
胞质P21蛋白对肿瘤发生发展有促进作用. 临床研究显示, 约75%的急性单核细胞性白血病(acute monocytic leukemia, AML), 可见胞质P21蛋白组成性表达, 在AML细胞中可检出P21与Ask1的复合体, 导致其对VP-16诱导的凋亡敏感性差[16]. 人乳腺癌组织中也有胞质P21的高表达, 是独立的预后不良指标, 与患者的总生存率及无病生存率负相关[17]. 类似的情况可见于上皮性肿瘤、鼻咽癌中.
在肝细胞癌中, 癌旁组织P21低表达, 主要定位于细胞核, 而在肝癌细胞中, P21高表达, 主要定位于细胞胞质, 而且胞质P21表达的细胞比例与肿瘤细胞的分化程度负相关, 即低分化的高度恶性肿瘤, 胞质P21表达更丰富[4-5]. 然而, 国内关于更多的报道仅仅局限于P21表达的阳性率(或缺失率)在正常肝组织或者癌旁组织与癌组织的比较, 缺乏对P21亚细胞定位的进一步分类比较分析, 因而难于明确P21与肝癌的关系[18-20].
为此, 我们采用基因定点诱变技术, 构建亚细胞定位不同的P21, 即胞质及胞核表达形式的P21, 以往采用截断法构建的胞质及胞核表达形式的P21, 由于核定位信号区同时与某些蛋白结合位点相互重叠, 所以核定位信号的缺失也导致了P21某些功能的丧失[21]. 质粒的凝胶电泳、酶切分析及基因测序结果与预期相一致, 与Neus Agell报道相符. 细胞转染结果也显示, 基因定点诱变改变了P21的亚细胞定位, P21主要定位于细胞质, 与野生型相比, 突变型胞质P21促进肿瘤的生长, 显示二者在肿瘤发生中具有明显差异, 可能与亚细胞定位改变后, P21与不同的功能蛋白质相互作用, 导致调控细胞周期运行及凋亡的功能分子活性的改变, 其进一步机制有待进一步探索. 其临床意义在于, 当将P21作为一有效的治疗靶点时, 必须考虑其亚细胞定位的差异.
感谢Bert Vogelstein教授惠赠P21 cDNA质粒, Neus Agell在构建核定位信号突变质粒方面给予的技术指导以及我院中心实验室董继华老师在细胞培养方面给予的帮助.
P21是细胞周期素依赖激酶抑制剂(CKI)家族成员, 其功能特性与其亚细胞定位密切相关. 当其定位于细胞核, 与CDK及PCNA结合, 导致细胞周期阻滞, 发挥抗细胞增殖活性; 当其定位于胞质时, 与CDK4、CDK6结合, 促进其向细胞核转运, 促进细胞周期运行, 与Procaspase 3、ASK1结合, 抗细胞凋亡, 从而促进细胞增殖. P21在原发性肝癌中, 胞质及胞核都有表达, 临床病理结果显示, P21在原发性肝癌中其胞质表达率明显升高.
杜祥, 教授, 复旦大学附属肿瘤医院病理科
以P21为靶点的抗肿瘤治疗疗效不一, P21亚细胞定位与功能关系的研究正成为目前研究热点, 特异性的针对P21亚细胞定位的生物治疗有望成为以后的发展方向. 在原发性肝癌中, 胞质及胞核P21的表达与肿瘤生长转移的关系亟待解决.
Neuss Agell体外实验证实, 其构建的突变型P21与野生型相比, P21突变后, 未改变其与PCNA、SET、CaM结合特性. Schoniger-Hekele研究显示, 在原发性肝癌中, 胞质P21表达升高, 并与肿瘤恶性程度正相关.
本研究采用基因定点诱变技术, 构建亚细胞定位不同的P21, 即胞质及胞核表达形式的P21, 转染HepG2细胞. 探讨不同亚细胞定位对肿瘤细胞增殖的影响, 这可能成为特异性P21靶点治疗新的发展方向.
本研究显示, 胞质P21促进HepG2细胞的增殖, 而胞核P21抑制HepG2细胞的增殖, 提示促进胞质P21的核转位或抑制胞核P21胞质移位, 可达到抗肿瘤作用.
本研究内容新颖, 设计合理, 数据可靠, 具有较好的学术价值.
编辑: 李军亮 电编:何基才
| 1. | Fan Y, Borowsky AD, Weiss RH. An antisense oligodeoxynucleotide to p21(Waf1/Cip1) causes apoptosis in human breast cancer cells. Mol Cancer Ther. 2003;2:773-782. [PubMed] |
| 2. | Gorospe M, Cirielli C, Wang X, Seth P, Capogrossi MC, Holbrook NJ. p21(Waf1/Cip1) protects against p53-mediated apoptosis of human melanoma cells. Oncogene. 1997;14:929-935. [PubMed] |
| 3. | Polyak K, Waldman T, He TC, Kinzler KW, Vogelstein B. Genetic determinants of p53-induced apoptosis and growth arrest. Genes Dev. 1996;10:1945-1952. [PubMed] |
| 4. | Schöniger-Hekele M, Hänel S, Wrba F, Müller C. Hepatocellular carcinoma--survival and clinical characteristics in relation to various histologic molecular markers in Western patients. Liver Int. 2005;25:62-69. [PubMed] |
| 5. | Wagayama H, Shiraki K, Sugimoto K, Ito T, Fujikawa K, Yamanaka T, Takase K, Nakano T. High expression of p21WAF1/CIP1 is correlated with human hepatocellular carcinoma in patients with hepatitis C virus-associated chronic liver diseases. Hum Pathol. 2002;33:429-434. [PubMed] |
| 6. | el-Deiry WS, Tokino T, Velculescu VE, Levy DB, Parsons R, Trent JM, Lin D, Mercer WE, Kinzler KW, Vogelstein B. WAF1, a potential mediator of p53 tumor suppression. Cell. 1993;75:817-825. [PubMed] |
| 7. | Child ES, Mann DJ. The intricacies of p21 phosphorylation: protein/protein interactions, subcellular localization and stability. Cell Cycle. 2006;5:1313-1319. [PubMed] |
| 8. | Chen J, Saha P, Kornbluth S, Dynlacht BD, Dutta A. Cyclin-binding motifs are essential for the function of p21CIP1. Mol Cell Biol. 1996;16:4673-4682. [PubMed] |
| 9. | Shivji MK, Grey SJ, Strausfeld UP, Wood RD, Blow JJ. Cip1 inhibits DNA replication but not PCNA-dependent nucleotide excision-repair. Curr Biol. 1994;4:1062-1068. [PubMed] |
| 10. | Nichols AF, Sancar A. Purification of PCNA as a nucleotide excision repair protein. Nucleic Acids Res. 1992;20:2441-2446. [PubMed] |
| 11. | Cheng M, Olivier P, Diehl JA, Fero M, Roussel MF, Roberts JM, Sherr CJ. The p21(Cip1) and p27(Kip1) CDK 'inhibitors' are essential activators of cyclin D-dependent kinases in murine fibroblasts. EMBO J. 1999;18:1571-1583. [PubMed] |
| 12. | LaBaer J, Garrett MD, Stevenson LF, Slingerland JM, Sandhu C, Chou HS, Fattaey A, Harlow E. New functional activities for the p21 family of CDK inhibitors. Genes Dev. 1997;11:847-862. [PubMed] |
| 13. | Suzuki A, Tsutomi Y, Akahane K, Araki T, Miura M. Resistance to Fas-mediated apoptosis: activation of caspase 3 is regulated by cell cycle regulator p21WAF1 and IAP gene family ILP. Oncogene. 1998;17:931-939. [PubMed] |
| 14. | Suzuki A, Tsutomi Y, Miura M, Akahane K. Caspase 3 inactivation to suppress Fas-mediated apoptosis: identification of binding domain with p21 and ILP and inactivation machinery by p21. Oncogene. 1999;18:1239-1244. [PubMed] |
| 15. | Asada M, Yamada T, Ichijo H, Delia D, Miyazono K, Fukumuro K, Mizutani S. Apoptosis inhibitory activity of cytoplasmic p21(Cip1/WAF1) in monocytic differentiation. EMBO J. 1999;18:1223-1234. [PubMed] |
| 16. | Schepers H, Geugien M, Eggen BJ, Vellenga E. Constitutive cytoplasmic localization of p21(Waf1/Cip1) affects the apoptotic process in monocytic leukaemia. Leukemia. 2003;17:2113-2121. [PubMed] |
| 17. | Pérez-Tenorio G, Berglund F, Esguerra Merca A, Nordenskjöld B, Rutqvist LE, Skoog L, Stål O. Cytoplasmic p21WAF1/CIP1 correlates with Akt activation and poor response to tamoxifen in breast cancer. Int J Oncol. 2006;28:1031-1042. [PubMed] |