修回日期: 2009-08-24
接受日期: 2009-08-31
在线出版日期: 2009-09-08
目的: 探讨功能性消化不良(FD)患者血清胃蛋白酶原(PG)Ⅰ、Ⅱ及胃泌素-17(G-17)的水平和意义.
方法: 根据罗马Ⅲ诊断标准, 229例FD患者纳入本研究. 均采用酶联免疫吸附试验(ELISA)定量测定血清PGⅠ、PGⅡ和G-17含量, 计算PGⅠ/Ⅱ比值(PGR), 血清幽门螺杆菌(H. pylori)抗体滴度大于等于35EIU为阳性.
结果: 以≤40岁、41-50岁、51-60岁和≥61岁进行年龄分组. FD组年龄≥61岁组PGR低于≤40岁组(P = 0.049). FD患者PGⅡ、G-17水平要明显高于对照组(P = 0.000, 0.000), PGⅠ没有明显变化(P = 0.067), 而PGR明显低于对照组(P = 0.000). 根据ROC曲线计算出诊断FD的PGII和G-17的最佳界值分别为13.2 μg/L(灵敏度51.5%, 特异度96.2%, 准确率65.5%), 6.84 μg/L(灵敏度52.8%, 特异度100%, 准确度67.5%). FD组男性在PGⅠ与PGⅡ水平均显著高于女性(P = 0.003, 0.004). FD组H. pylori抗体阳性率高于对照组(P = 0.028).
结论: FD患者血清PGⅡ与G-17水平增加, 胃窦与十二指肠近端黏膜可能存在功能学的改变, FD与H. pylori感染相关.
引文著录: 刘露, 姜敏. 血清胃蛋白酶原Ⅰ、Ⅱ和G-17在功能性消化不良患者中的表达及其意义. 世界华人消化杂志 2009; 17(25): 2625-2630
Revised: August 24, 2009
Accepted: August 31, 2009
Published online: September 8, 2009
AIM: To investigate the clinical significance of serum pepsinogen (PG) I and II and gastrin-17 (G-17) in patients with functional dyspepsia (FD).
METHODS: A case-control study was performed. Two hundreds and twenty-nine FD patients recruited were diagnosed according to Rome III criteria. Serum PG I and II and G-17 levels were measured by enzyme-linked immunosorbent assay (ELISA). The PG I/II ratio (PGR) was calculated. Serum IgG antibody against Helicobacter pylori (H. pylori) was determined by ELISA to evaluate H. pylori infection.
RESULTS: In FD patients, the PGR was lower in the ≥ 61 age group than in the ≤ 40 age group (P = 0.049). The levels of serum PG II and G-17 were significantly higher in FD patients than in normal controls (both P = 0.000), while the PGR was significantly lower in FD patients than in normal controls (P = 0.000). No significant difference was noted in serum PG I level between FD patients and normal controls (P = 0.067). The receiver operating characteristic (ROC) curve analysis showed that the optimal cut-off points of PG II and G-17 values for the diagnosis of FD were 13.2 μg/L (sensitivity 52.8%, specificity 100%, and accuracy 67.5%) and 6.84 μg/L (sensitivity 52.8%, specificity 100%, and accuracy 67.5%), respectively. The levels of serum PG I and PG II were significantly higher in male FD patients than in female ones (P = 0.003 and 0.004, respectively). The positive rate of serum IgG antibody against H. pylori was higher in FD patients than in normal controls (P = 0.028).
CONCLUSION: The levels of serum PGII and G-17 are elevated in FD patients, which may suggest functional changes in gastric sinus and proximal duodenal mucosa. There is an association between FD and H. pylori infection.
- Citation: Liu L, Jiang M. Clinical significance of serum pepsinogen I and II and gastrin-17 in patients with functional dyspepsia. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2625-2630
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2625.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2625
功能性消化不良(functional dyspepsia, FD)是常见的消化系统症候群, 消化不良占胃肠病门诊患者的30%, 而其中40-60%为FD[1]. 目前FD的诊断以罗马Ⅲ为标准, 即无可以解释症状的器质性疾病的证据(包括内镜), 诊断前症状至少出现6 mo, 近3 mo症状符合以下1点或以上: 餐后饱胀不适、早饱、上腹痛、上腹烧灼感[2]. FD的诊断是一排除性诊断, 需要行胃镜活检等其他检查, 操作复杂, 成本较高, 患者遭受一定的痛苦. 近年来, 胃蛋白酶原(pepsinogen, PG)与胃泌素在胃肠疾病中的关系一直受到人们的关注, 特别是在胃癌筛查方面[3-5]. 但至今没有研究显示胃蛋白酶原和胃泌素与功能性消化不良之间的联系, 我们研究的目的是探讨FD患者血清PGⅠ、PGⅡ、胃泌素-17(gastrin-17, G-17)水平及其意义, 为FD的诊断提供参考.
2008-09/2009-02我院门诊和住院FD患者229例, 根据罗马Ⅲ诊断, 其中男105例(45.85%), 女124例(54.15%), 年龄17-87(平均53.18)岁. 对照组104例, 其中男35例(33.65%), 女69例(66.35%), 年龄19-79(平均51.15)岁. 所有研究对象均签署知情同意书.
1.2.1 分组: 将FD患者与对照组均按年龄分为4组: A组(≤40岁)、B组(41-50岁)、C组(51-60岁)和D组(≥61岁).
1.2.2 血清胃蛋白酶原含量及G-17检测: 取受检者空腹静脉血5 mL, 分离血清后迅速冷冻, 存于-20℃冰箱中待测. 采用酶联免疫吸附试验(ELISA)方法检测血清PGⅠ、PGⅡ (μg/L)和G-17含量(μmol/L, ELISA试剂盒均购自芬兰Biohit公司), 计算PGⅠ/Ⅱ比值.
1.2.3 幽门螺杆菌(H. pylori)感染判定: 血清H. pylori-IgG抗体测定(抗体滴度≥35 EIU为阳性, H. pylori-IgG试剂盒购自芬兰Biohit公司), 进行H. pylori感染判定.
统计学处理 采用SPSS13.0软件包, 以Kolmogorov-Smirnov测定变量的分布. 偏态分布的计量资料用中位数表示.两组间比较采用Mann-Whitney U检验. 多组间比较采用Kruskal Wallis检验. 计数资料用χ2检验. 接受者操作特征曲线(receiver operating characteristic curve, ROC曲线)计算每个变量诊断FD的最佳界值. P<0.05为差异有统计学意义, P<0.01为差异有显著性.
任2个年龄组间, 除PGR外, PGⅠ、PGⅡ和G-17组间差异均无统计学意义. D组PGR低于与A组PGR(P<0.05). A、B、C、D组间, PGⅠ、PGⅡ、PGR和G-17差异均无统计学意义(均P>0.05, 表1).
4个年龄组PGR具有统计学差异(P<0.05), 而PGⅠ、PGⅡ与G-17在4组中无统计学差异(P = 0.604,P = 0.064, P = 0.725). PGⅠ检测值由A组到D组是逐渐降低的, 但是组间差异不具有统计学意义(P = 0.406, P = 0.290, P = 0.609). G-17各年龄组间差异无统计学意义. C组PGⅡ高于A组(P<0.05). PGR在C组(11.95 μg/L)与D组(13.50 μg/L)均低于A组(17.80 μg/L)(P<0.01; P<0.05), 虽然A、B、C组PGR逐渐降低, 但年龄组间无统计学意义(P = 0.123, P = 0.107, P = 0.488, 表2).
FD组PGⅡ和G-17水平明显高于对照组(P<0.01), PGR显著低于对照组(P<0.01), PGⅠ两组间没有明显差异 (P>0.05, 表3).
| 分组 | n | PGⅠ(μg/L) | PGⅡ(μg/L) | PGR | G-17(μmol/L) |
| FD组 | 229 | 112.80 | 13.70 | 8.60 | 7.60 |
| 对照组 | 104 | 95.70 | 7.50 | 13.60 | 1.75 |
| P值 | 0.067 | 0.000 | 0.000 | 0.000 |
将FD组进行按性别分组, PGⅠ和PGⅡ在男性中的水平要显著高于女性(P<0.01), PGR和G-17在2组中差异没有统计学意义 (P>0.05, 表4).
| n | PGⅠ(μg/L) | PGⅡ(μg/L) | PGR | G-17(μmol/L) | |
| 男性 | 105 | 126.50 | 17.30 | 7.65 | 4.45 |
| 女性 | 124 | 92.30 | 9.20 | 10.60 | 4.02 |
| P值 | 0.003 | 0.004 | 0.192 | 0.601 |
对照组按性别分类, PGⅠ在男性中水平显著高于女性(P<0.01), G-17水平男性显著低于女性(P<0.01), PGⅡ与PGR组间差异没有统计学意义(P>0.05, 表5).
| n | PGⅠ(μg/L) | PGⅡ(μg/L) | PGR | G-17(μmol/L) | |
| 男性 | 35 | 102.22 | 8.20 | 13.50 | 1.28 |
| 女性 | 69 | 90.10 | 6.30 | 14.00 | 2.40 |
| P值 | 0.009 | 0.214 | 0.992 | 0.009 |
将参与本研究所有人员进行性别分组, PGⅠ和PGⅡ水平男性均显著高于女性(P<0.01, P<0.01), PGR和G-17组间差异不具有统计学意义(P>0.05, 表6).
| n | PGⅠ(μg/L) | PGⅡ(μg/L) | PGR | G-17(μmol/L) | |
| 男性 | 140 | 117.05 | 11.95 | 9.95 | 4.45 |
| 女性 | 193 | 92.30 | 9.20 | 10.60 | 4.02 |
| P值 | 0.000 | 0.000 | 0.114 | 0.709 |
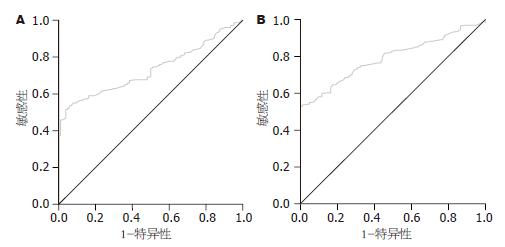
以FD作为病例组(229例), 做PGⅡ、PGR、G-17的ROC曲线. PGⅡ的曲线下面积AUCROC = 0.732(95%CI: 0.680-0.784), 根据ROC曲线计算最佳分界值为13.2 μg/L(灵敏度51.5%, 特异度96.2%, 准确率65.5%, 图1A).
PGR的曲线下面积AUCROC = 0.21(95%CI: 0.170-0.268). G-17 ROC曲线下面积AUCROC = 0.791(95%CI: 0.744-0.838). 根据ROC曲线计算最佳分界值为6.84 μg/L(灵敏度52.8%, 特异度100%, 准确度67.5%, 图1B).
FD组H. pylori抗体阳性者(102/229)44.5%, 对照组H. pylori抗体阳性者(16/104)15.4%, FD组H. pylori抗体阳性率高于对照组H. pylori抗体阳性率(P<0.05).
FD是一组持续或反复发作的, 经检查排除可引起这些症状的器质性疾病的一组临床综合征, 主要症状包括上腹痛或不适、上腹饱胀、早饱、嗳气、恶心、呕吐等. 根据症状群分为餐后不适综合征(postprandial distress syndrome, PDS)和上腹疼痛综合征(epigastric pain syndrome, EPS)[2]. 其发病机制尚未完全清楚, 目前认为与胃动力障碍、感觉过敏、精神社会因素、H. pylori感染相关. Sha et al[6-7]研究发现大多数的FD患者胃电图(electrogastrography, EGG)异常以及胃窦和十二指肠动力异常, 胃肌电活性及胃慢波协调性受损. Fruehauf et al[8]发现通过MRI直接测定胃耐受容积, FD患者胃耐受容积要明显低于正常人. 近年来一些大样本研究显示胃排空延迟与上腹胀、恶心、呕吐、胃容受性扩张不良与早饱、感觉过敏与上腹痛存在显著性关系. Aro et al[9]研究发现焦虑与FD类型中PDS较EPS更具有相关性. 最近有研究显示职业粉尘接触、高脂肪饮食以及不良习惯均与FD及其症状相关[10-12]. 但至今没有研究表明FD患者是否存在胃黏膜分泌功能上的改变.
血清PG是胃蛋白酶的前体, 反映主细胞的数量, 可在胃液、血清和24 h尿液中测量其含量. PG有Ⅰ型和Ⅱ型两种, 其中PGⅠ主要由胃底腺的主细胞和颈黏液细胞分泌, PGⅡ除来源于上述细胞外还来源于幽门腺及十二指肠腺. PG大部分分泌入胃腔, 一小部分酶原透过胃黏膜毛细血管入血[13-15]. 血清PG水平可反映胃蛋白酶分泌及胃黏膜的状态和功能[14,16-18]. 非萎缩性胃炎PGⅠ含量增加, 萎缩性胃炎者PGⅠ水平下降, 而PGⅡ含量在两者均增加. 对于大多数胃肠疾病, PGR都是降低的. 在疾病应激或低压低氧环境下, 胃黏膜将会出现缺血甚至坏死的变化. 马拉松运动后胃泌素含量增加而PGR下降[14]. 近年来, 许多临床研究将PG与G-17含量检测用于胃癌筛查. 但没有研究证明FD的PG与G-17水平是否有意义. 本研究即探讨功能性消化不良患者血清PGⅠ、PGⅡ、G-17水平及其意义. 人血清PG水平受种族、性别、年龄、胃黏膜病变和H. pylori感染因素影响[19], 本研究根据FD患者的性别、年龄进行分组, 评价不同亚组PG与G-17的水平以及意义. 本研究中, FD组年龄≥61岁组PGR水平明显低于≤40岁组, 虽然在4个年龄组中没有观察到动态变化, 但这提示在此年龄段的FD患者胃黏膜功能发生明显改变. 同时, 对照组≤40岁组的PGR水平均高于其他年龄组, 但没有观察到PGR随年龄的动态变化. 而大样本流行病学调查显示, 人群中PGR随年龄的增加而降低[19]. 这提示FD患者在年龄影响PGR情况下, 胃黏膜功能发生明显改变. 胃泌素是由胃窦及十二指肠近端黏膜中的G细胞分泌, 具有促进胃酸分泌、胃窦收缩和消化道黏膜再生等生理作用, 其中80%-90%是G-17, 由胃窦部G细胞分泌[20]. PG和G-17含量增加反映增生或黏膜肥大的功能性细胞团[13]. 本研究FD患者PGⅡ、G-17水平明显高于对照组, PGⅠ没有明显变化, 而PGR明显低于对照组. 前文提到胃黏膜存在炎症时PGⅠ明显升高, 这提示FD患者胃黏膜功能细胞团存在增生或肥大的改变, 但并非炎症改变, 此结果有助于活动性非萎缩性胃炎与FD之间的鉴别诊断. PGⅡ和G-17水平显著增高同时提示胃窦部与十二指肠近端可能存在黏膜功能学上的改变, 即功能细胞团的增生或肥大, 而非炎症改变. 升高的G-17水平可促进胃酸分泌增多[21], 而高胃酸导致上腹痛和上腹部不适等消化不良症状, 因此临床上应用抑酸药物治疗FD可使消化不良症状减轻[22-24]. 本研究的缺陷是收集病例时未作FD相关症状调查, 对于G-17和/或PGⅡ增高时与FD症状的关系未作分析. 这一问题可作为下一步研究方向. 同时由于血清PG水平受种族、年龄、饮食、检测方法等影响, 本研究的研究对象均选自中国北方地区, 因此研究结果是否适用于其他地区仍待进一步研究.
同时我们根据ROC曲线计算出诊断FD的PGⅡ、PGR和G-17的最佳界值, 三者ROC曲线下面积分别是0.732, 0.21, 0.791. 因此只有PGⅡ与G-17能够有助于提示FD患者胃黏膜存在形态和功能学上的改变, PGⅡROC曲线计算最佳分界值为13.2 μg/L(灵敏度51.5%, 特异度96.2%, 准确率65.5%), G-17 ROC曲线下面积AUCROC = 0.791(95%CI: 0.744-0.838). 根据ROC曲线计算最佳分界值为6.84 μg/L(灵敏度52.8%, 特异度100%, 准确度67.5%). FD组结果显示男性在PGⅠ与PGⅡ水平均显著高于女性, 而对照组结果显示男性在PGⅠ水平显著高于女性, 在G-17水平显著低于女性. 而本研究333例受试者整体研究显示, 男性PGⅠ与PGⅡ水平显著高于女性. 这与Sun et al[19]研究一致. 理论上, H. pylori感染在胃黏膜产生的炎症介质有可能影响胃的运动和感觉功能, 且其产生的尿素酶可水解胃内的尿素, 在正常体温下产生CO2, 参与腹胀与嗳气的形成[1]. 有研究结果显示FD患者根除H. pylori治疗后FD症状有显著改善[25-26]. 此外, H. pylori感染与血清PG含量之间存在相关性, H. pylori感染者血清PG值高于非感染者, 除菌后则显著下降[27-29]. 本研究结果显示FD组H. pylori-IgG抗体阳性率要明显高于对照组. 上述研究证明, H. pylori感染与FD发病密切相关.
总之, 本研究结果显示FD患者血清PGⅡ与G-17水平增加, 胃窦与十二指肠近端黏膜可能存在功能学改变, FD与H. pylori感染相关.
近年来研究发现大多数胃肠疾病均存在PG与G-17改变, 但在FD患者中PG与G-17是否存在改变尚未引起关注.
季国忠, 教授, 南京医科大学第二附属医院消化科.
本文提示FD患者PGⅡ、G-17改变, 但是PG、G-17与FD相关症状是否存在一定关系, 且本文研究范围仅在中国北方地区,其他地区、民族未包含在本研究内. 这些问题都值得进一步研究.
孙俪萍 et al研究显示胃黏膜炎性病变对血清PGⅠ含量影响较大,胃黏膜萎缩性病变对血清PGⅠ、PGⅡ含量均有影响.
胃镜检查为消化不良诊断的主要手段, 血清PG、G-17检测与胃镜检查相比, 具有简便、患者耐受性好等特点, 为FD的诊断提供参考.
本研究结果显示FD患者血清PGⅡ与G-17水平增加, 胃窦与十二指肠近端黏膜可能存在功能学改变, 对FD诊断具有辅助参考价值.
本文探讨了FD患者血清PGⅠ、PGⅡ、G-17的表达水平及意义, 指出FD患者血清PGⅡ与G-17表达水平增加, 对FD的诊断有一定的辅助参考价值.
编辑: 李军亮 电编:吴鹏朕
| 1. | 池 肇春, 亓 玉琴, 董 全江, 司 军利. 幽门螺杆菌感染及其相关疾病的诊断与治疗. 第1版. 北京: 军事医学科学出版社 2008; 215-216. |
| 2. | Drossman DA. The functional gastrointestinal disorders and the Rome III process. Gastroenterology. 2006;130:1377-1390. [PubMed] [DOI] |
| 3. | Haj-Sheykholeslami A, Rakhshani N, Amirzargar A, Rafiee R, Shahidi SM, Nikbin B, Khosravi F, Massarrat S. Serum pepsinogen I, pepsinogen II, and gastrin 17 in relatives of gastric cancer patients: comparative study with type and severity of gastritis. Clin Gastroenterol Hepatol. 2008;6:174-179. [PubMed] [DOI] |
| 4. | Iijima K, Abe Y, Kikuchi R, Koike T, Ohara S, Sipponen P, Shimosegawa T. Serum biomarker tests are useful in delineating between patients with gastric atrophy and normal, healthy stomach. World J Gastroenterol. 2009;15:853-859. [PubMed] [DOI] |
| 5. | Cao Q, Ran ZH, Xiao SD. Screening of atrophic gastritis and gastric cancer by serum pepsinogen, gastrin-17 and Helicobacter pylori immunoglobulin G antibodies. J Dig Dis. 2007;8:15-22. [PubMed] [DOI] |
| 6. | Sha W, Pasricha PJ, Chen JD. Correlations among electrogastrogram, gastric dysmotility, and duodenal dysmotility in patients with functional dyspepsia. J Clin Gastroenterol. 2009;43:716-722. [PubMed] [DOI] |
| 7. | Sha W, Pasricha PJ, Chen JD. Rhythmic and spatial abnormalities of gastric slow waves in patients with functional dyspepsia. J Clin Gastroenterol. 2009;43:123-129. [PubMed] [DOI] |
| 8. | Fruehauf H, Steingoetter A, Fox MR, Kwiatek MA, Boesiger P, Schwizer W, Fried M, Thumshirn M, Goetze O. Characterization of gastric volume responses and liquid emptying in functional dyspepsia and health by MRI or barostat and simultaneous C-acetate breath test. Neurogastroenterol Motil. 2009;21:697-e37. [PubMed] [DOI] |
| 9. | Aro P, Talley NJ, Ronkainen J, Storskrubb T, Vieth M, Johansson SE, Bolling-Sternevald E, Agréus L. Anxiety is associated with uninvestigated and functional dyspepsia (Rome III criteria) in a Swedish population-based study. Gastroenterology. 2009;137:94-100. [PubMed] [DOI] |
| 10. | Coppeta L, Pietroiusti A, Magrini A, Somma G, Bergamaschi A. Prevalence and characteristics of functional dyspepsia among workers exposed to cement dust. Scand J Work Environ Health. 2008;34:396-402. [PubMed] |
| 11. | Pilichiewicz AN, Feltrin KL, Horowitz M, Holtmann G, Wishart JM, Jones KL, Talley NJ, Feinle-Bisset C. Functional dyspepsia is associated with a greater symptomatic response to fat but not carbohydrate, increased fasting and postprandial CCK, and diminished PYY. Am J Gastroenterol. 2008;103:2613-2623. [PubMed] [DOI] |
| 12. | Geeraerts B, Van Oudenhove L, Fischler B, Vandenberghe J, Caenepeel P, Janssens J, Tack J. Influence of abuse history on gastric sensorimotor function in functional dyspepsia. Neurogastroenterol Motil. 2009;21:33-41. [PubMed] [DOI] |
| 13. | Korstanje A, den Hartog G, Biemond I, Lamers CB. The serological gastric biopsy: a non-endoscopical diagnostic approach in management of the dyspeptic patient: significance for primary care based on a survey of the literature. Scand J Gastroenterol Suppl. 2002;22-26. [PubMed] [DOI] |
| 14. | Gritti I, Banfi G, Roi GS. Pepsinogens: physiology, pharmacology pathophysiology and exercise. Pharmacol Res. 2000;41:265-281. [PubMed] [DOI] |
| 15. | Kageyama T. Pepsinogens, progastricsins, and prochymosins: structure, function, evolution, and development. Cell Mol Life Sci. 2002;59:288-306. [PubMed] [DOI] |
| 16. | Miki K, Morita M, Sasajima M, Hoshina R, Kanda E, Urita Y. Usefulness of gastric cancer screening using the serum pepsinogen test method. Am J Gastroenterol. 2003;98:735-739. [PubMed] [DOI] |
| 17. | Ley C, Mohar A, Guarner J, Herrera-Goepfert R, Figueroa LS, Halperin D, Parsonnet J. Screening markers for chronic atrophic gastritis in Chiapas, Mexico. Cancer Epidemiol Biomarkers Prev. 2001;10:107-112. [PubMed] |
| 18. | Dinis-Ribeiro M, da Costa-Pereira A, Lopes C, Barbosa J, Guilherme M, Moreira-Dias L, Lomba-Viana H, Silva R, Abreu N, Lomba-Viana R. Validity of serum pepsinogen I/II ratio for the diagnosis of gastric epithelial dysplasia and intestinal metaplasia during the follow-up of patients at risk for intestinal-type gastric adenocarcinoma. Neoplasia. 2004;6:449-456. [PubMed] [DOI] |
| 19. | Sun LP, Gong YH, Wang L, Yuan Y. Serum pepsinogen levels and their influencing factors: a population-based study in 6990 Chinese from North China. World J Gastroenterol. 2007;13:6562-6567. [PubMed] [DOI] |
| 22. | Bytzer P, Talley NJ. Current indications for acid suppressants in dyspepsia. Best Pract Res Clin Gastroenterol. 2001;15:385-400. [PubMed] [DOI] |
| 23. | Talley NJ, Meineche-Schmidt V, Paré P, Duckworth M, Räisänen P, Pap A, Kordecki H, Schmid V. Efficacy of omeprazole in functional dyspepsia: double-blind, randomized, placebo-controlled trials (the Bond and Opera studies). Aliment Pharmacol Ther. 1998;12:1055-1065. [PubMed] [DOI] |
| 24. | Blum AL, Arnold R, Stolte M, Fischer M, Koelz HR. Short course acid suppressive treatment for patients with functional dyspepsia: results depend on Helicobacter pylori status. The Frosch Study Group. Gut. 2000;47:473-480. [PubMed] [DOI] |
| 25. | de Artaza Varasa T, Valle Muñoz J, Pérez-Grueso MJ, García Vela A, Martín Escobedo R, Rodríguez Merlo R, Cuena Boy R, Carrobles Jiménez JM. [Effect of Helicobacter pylori eradication on patients with functional dyspepsia]. Rev Esp Enferm Dig. 2008;100:532-539. [PubMed] |
| 26. | Gwee KA, Teng L, Wong RK, Ho KY, Sutedja DS, Yeoh KG. The response of Asian patients with functional dyspepsia to eradication of Helicobacter pylori infection. Eur J Gastroenterol Hepatol. 2009;21:417-424. [PubMed] [DOI] |
| 27. | Watabe H, Mitsushima T, Yamaji Y, Okamoto M, Wada R, Kokubo T, Doi H, Yoshida H, Kawabe T, Omata M. Predicting the development of gastric cancer from combining Helicobacter pylori antibodies and serum pepsinogen status: a prospective endoscopic cohort study. Gut. 2005;54:764-768. [PubMed] [DOI] |
| 28. | Ricci C, Vakil N, Rugge M, Gatta L, Perna F, Osborn JF, Russo VM, Tampieri A, Bernabucci V, Miglioli M. Serological markers for gastric atrophy in asymptomatic patients infected with Helicobacter pylori. Am J Gastroenterol. 2004;99:1910-1915. [PubMed] [DOI] |
| 29. | Shirai N, Furuta T, Sugimoto M, Kanaoka S, Watanabe F, Takashima M, Yamada M, Futami H, Sato Y, Kubota H. Serum pepsinogens as an early diagnostic marker of H. pylori eradication. Hepatogastroenterology. 2008;55:486-490. [PubMed] |