修回日期: 2009-07-20
接受日期: 2009-08-03
在线出版日期: 2009-09-08
目的: 研究克氏螯虾壳聚糖抗菌的作用靶位, 探讨其抗菌机制.
方法: 用5(6)-羧-四甲基罗丹明-5-马来酰亚胺标记克氏螯虾壳聚糖, 应用标记克氏螯虾壳聚糖与大肠埃希菌及金黄色葡萄球菌在pH5.6, 37℃条件下220 r/min作用3.5 h, 观察作用前后上清液中的核酸和蛋白质含量变化, 并用激光共聚焦显微镜观察其对细菌的聚集部位.
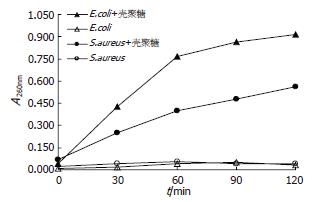
结果: 荧光标记克氏螯虾壳聚糖对大肠埃希菌作用前后的上清液中, 核酸和蛋白质的含量由作用前的0.00和0.22±0.01升高为1.13±0.06和1.49±0.05(P<0.01); 对金黄色葡萄球菌作用前后的上清液中, 核酸和蛋白质的含量由作用前的0.03±0.06和0.21±0.02升高为1.00±0.10和0.81±0.01(P<0.01); 并且荧光标记克氏螯虾壳聚糖浓度越高, 核酸及蛋白质含量也逐渐增高; 激光共聚焦显微镜下显示两种实验细菌由表及里的荧光强度逐渐增强.
结论: 克氏螯虾壳聚糖的抗菌作用靶位, 除部分作用于细菌细胞膜外, 主要是进入细菌内作用于细胞器.
引文著录: 郑铁生, 朱旭明, 张燕玲. 克氏螯虾壳聚糖抗菌的作用靶位. 世界华人消化杂志 2009; 17(25): 2585-2588
Revised: July 20, 2009
Accepted: August 3, 2009
Published online: September 8, 2009
AIM: To investigate the potential target site for the antibacterial action of chitosan from red swamp crayfish and explore its antibacterial mechanism.
METHODS: Chitosan from red swamp crayfish was labeled with 5(6)-carboxy-tetramethylrhodamine-5-maleimide. The labeled chitosan was then incubated with Escherichia coli (E.coli) and Staphylococcus aureus (S.aureus), respectively. The total protein (TP) and nucleic acid contents in cell-free supernatants of chitosan-treated E.coli and S.aureus were determined. Laser scanning confocal microscopy (LSCM) was used to observe the distribution of fluorescently labeled chitosan in bacteria.
RESULTS: Chitosan treatment significantly increased the nucleic acid and TP contents in cell-free supernatants of E.coli (1.13 ± 0.06 vs 0.00 and 1.49 ± 0.05 vs 0.22 ± 0.01, respectively; both P < 0.01) and S.aureus (1.00 ± 0.10 vs 0.03 ± 0.06 and 0.81 ± 0.01 vs 0.21 ± 0.02, respectively; both P < 0.01) in a concentration-dependent manner. LSCM showed that the fluorescent signal in the bacterial cytoplasm was stronger than that in the bacterial membrane.
CONCLUSION: Bacterial cytoplasm is the main target site for the antibacterial action of chitosan from red swamp crayfish.
- Citation: Zheng TS, Zhu XM, Zhang YL. Target site for the antibacterial action of chitosan from red swamp crayfish. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2585-2588
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2585.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2585
克氏螯虾壳聚糖(chitosan from redswamp crayfish)是从克氏螯虾的外壳中提取、制备的一种碱性氨基多糖[1], 具有降血脂[2]和调节血糖及糖耐量的作用[3]. 体外抗菌研究发现, 克氏螯虾壳聚糖对幽门螺杆菌和皮肤浅表真菌均具较强的杀抑作用, 临床应用前景较好[4-5], 但其抗菌的作用机制尚未见报道. 本研究采用荧光标记克氏螯虾壳聚糖与实验菌作用后, 测定其上清液中核酸和蛋白质的含量, 并用激光共聚焦显微镜观察荧光标记克氏螯虾壳聚糖在细菌中的聚集靶位, 以探讨克氏螯虾壳聚糖抗菌的作用机制.
克氏螯虾壳聚糖由按文献[1]方法从克氏螯虾的外壳中提取制备, 脱乙酰度为90%、平均相对分子质量5.5×105 Da. 大肠埃希菌(ATCC25922)及金黄色葡萄球菌(ATCC25923)质控菌株, 由江苏大学附属人民医院提供. 液体培养基中的蛋白栋、酵母提取物等成分, 购于Oxoid公司; 荧光试剂5(6)-羧-四甲基罗丹明-5-马来酰亚胺[5(6)-TAMRA-5-maleimide], 来自Biotium公司; 蛋白质检测试剂(双缩脲比色法), 由上海科华公司提供; 其余试剂均为分析纯级别. Biophotometer核酸紫外监测仪(德国Eppendoff公司), AU2700全自动生化分析仪(日本Olympus公司), LSM510激光共聚焦显微镜(德国Zeiss公司), Centrifuge 54172超速离心机(德国Eppendoff公司).
1.2.1 实验样品制备: 取10 000 mg/L克氏螯虾壳聚糖溶液与游离荧光试剂5(6)-羧-四甲基罗丹明-5-马来酰亚胺9:1(V/V)进行混合, 4℃过夜, 然后加1 mol/L氢氧化钠, 析出沉淀, 冲洗, 将洗净的沉淀烘干, 得荧光标记克氏螯虾壳聚糖. 取一定量上述荧光标记克氏螯虾壳聚糖溶于167 mmol/L醋酸, 得10 000 mg/L荧光标记克氏螯虾壳聚糖溶液, 再用二倍稀释法制成2500、625 mg/L的溶液, 并用1 mol/L氢氧化钠将各浓度荧光标记克氏螯虾壳聚糖溶液及游离荧光对照的pH调节到5.8.
1.2.2 核酸蛋白质测定: 将大肠埃希菌(E.coli)及金黄色葡萄球菌(S.aureus)实验菌分别在液体培养基中培养至对数期, 离心收集, 用生理盐水洗2次后制成菌体浓度为108-109 CFU/mL的菌悬液, 各取0.8 mL菌液与0.2 mL不同浓度的荧光标记克氏螯虾壳聚糖溶液或游离荧光对照混合, 荧光标记壳聚糖的终浓度分别为2000、500、125 mg/L, 整个体系的pH为5.6, 其后37℃条件下220 r/min作用3.5 h, 10 000 g离心5 min, 吸取上清液, 用核酸紫外监测仪(A260 nm)测核酸含量、全自动生化分析仪测蛋白质含量. 每组实验均重复3次, 取平均值.
1.2.3 激光共聚焦显微镜观察: 将浓度为107-108 CFU/mL的2种实验菌分别与荧光标记克氏螯虾壳聚糖实验组及游离荧光对照组1:1(V/V)混合, 220 r/min摇8 h, 其后5000 g离心10 min, 收集沉渣, 再清洗3次, 最后取沉渣在激光共聚焦显微镜下以488 nm为激发波长, 进行断层扫描.
细菌上清液中出现菌内容物, 说明细菌细胞膜的屏障功能遭到破坏. 与克氏螯虾壳聚糖作用3.5 h后, E.coli及S.aureus上清液中各种物质含量如表1所示. 结果表明, pH5.6条件下, 相比167 mmol/L醋酸对照, 克氏螯虾壳聚糖可以使AST、TP及核酸这样的菌内物质发生泄漏(P<0.05); 并且克氏螯虾壳聚糖浓度越高, 细菌上清液中AST活性及TP及核酸含量也逐渐增高(图1).
| E.coli | S.aureus | |||||
| AST(U/L) | TP(g/L) | A260nm | AST(U/L) | TP(g/L) | A260nm | |
| 壳聚糖(mg/L) | ||||||
| 2000 | 8.33±0.58b | 1.13±0.06b | 1.49±0.05b | 4.33±0.58b | 1.00±0.10b | 0.81±0.01b |
| 500 | 3.33±0.58b | 0.43±0.06a | 1.13±0.02a | 2.33±0.58b | 0.37±0.06a | 0.64±0.03b |
| 125 | 2.33±0.58a | 0.13±0.06a | 0.71±0.01a | 0.67±0.58 | 0.17±0.05 | 0.51±0.01a |
| 对照组 | 0.67±0.58 | 0.00 | 0.22±0.01 | 0.33±0.57 | 0.03±0.06 | 0.21±0.02 |
| F值 | 98.00 | 307.00 | 1017.60 | 30.25 | 107.94 | 526.68 |
| P值 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 | <0.01 |
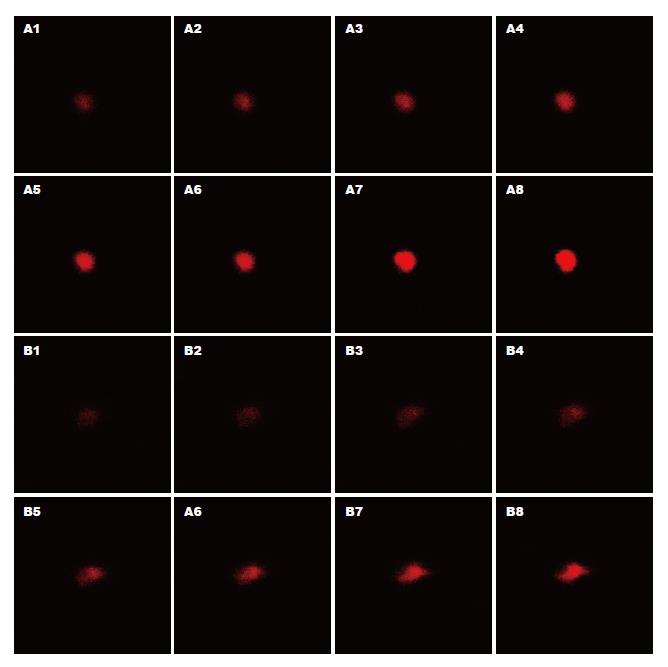
荧光标记克氏螯虾壳聚糖实验组和游离荧光对照组分别与2种实验菌作用8 h后, 对照组在激光共聚焦显微镜下无荧光; 实验组其2种实验菌由表及里的荧光强度逐渐增强, 可见荧光标记克氏螯虾壳聚糖已进入活细胞内(图2).
克氏螯虾为地产盱眙龙虾, 学名克氏原螯虾. 由于人为传播和他自身繁殖, 目前, 己遍布长江中下游南北的每个角落, 并成为我国自然水体的一个种群, 资源十分丰富. 我们从克氏螯虾的外壳提取纯化的一种天然碱性氨基多糖, pKa为6.3, 单体结构为1, 4-2-氨基-2-脱氧-β-D葡萄糖[1], 对H. pylori和皮肤浅表真菌均具较强的杀抑作用, 临床应用前景较好[4-5], 但其抗菌的作用机制尚未见报道. 本研究采用荧光标记克氏螯虾壳聚糖与大肠埃希菌及金黄色葡萄球菌作用后, 从检测生化物质的改变和跟踪荧光标记克氏螯虾壳聚糖的聚集部位来观察克氏螯虾壳聚糖对细菌表面结构和菌体内部的作用特性, 以探讨其抗菌机制.
荧光试剂5(6)-羧-四甲基罗丹明-5-马来酰亚胺是罗丹明类标准荧光素的衍生物, 具有很强的光稳定性及荧光产量, pH敏感性低, 其活性基团可以通过与对方大分子结构上的氨基结合形成荧光标志物[6]. 激光共聚焦显微镜利用激光作为光源, 在传统光学显微镜基础上采用共轭聚焦的原理和装置, 与传统光学显微镜相比, 具有更高的分辨率, 能实现多重荧光的同时观察, 并可形成清晰的三维图像. 激光共聚焦显微镜对生物样品进行观察时, 能实现无损伤的断层扫描和成像[7], 是图像分析的有效工具. 克氏螯虾壳聚糖分子上存在有游离氨基[1], 能够和5(6)-羧-四甲基罗丹明-5-马来酰亚胺结合形成克氏螯虾壳聚糖荧光标记物[8]. 可作为一种荧光探针, 用于克氏螯虾壳聚糖抗菌作用靶位的研究.
本研究用荧光标记克氏螯虾壳聚糖与大肠埃希菌及金黄色葡萄球菌作用3.5 h后, 测定作用前后上清液中的核酸及蛋白质含量, 发现荧光标记克氏螯虾壳聚糖对大肠埃希菌作用前后的上清液中, 核酸和蛋白质的含量由作用前的0.00和0.22±0.01升高为1.13±0.06和1.49±0.05, (P<0.01); 对金黄色葡萄球菌作用前后的上清液中, 核酸和蛋白质的含量由作用前的0.03±0.06和0.21±0.02升高为1.00±0.10和0.81±0.01, (P<0.01); 并且随着荧光标记克氏螯虾壳聚糖浓度增高, 核酸及蛋白质含量也逐渐增高; 另外, 其作用时间越长, 上清液中核酸含量越高. 说明克氏螯虾壳聚糖具有破坏细菌细胞膜屏障功能的效应. 原因可能与克氏螯虾壳聚糖所带的氨基有关. 由于克氏螯虾壳聚糖的等电点高达6.3, 在微酸性条件下其氨基带正电荷, 可以结合细菌表面(细胞壁、细胞膜)带负电荷的蛋白质及磷脂等重要大分子, 破坏细菌表面结构, 保护胞内物质的屏障功能丧失, 导致菌内物质大量漏出. 对其他来源壳聚糖的抗菌机制研究, 也有类似的报道[9-11]. 用荧光标记克氏螯虾壳聚糖与两种实验菌作用8 h后, 在激光共聚焦显微镜下观察发现, 菌体由表及里其荧光强度逐渐增强, 可见荧光标记克氏螯虾壳聚糖已进入活细胞内.
由此可见, 克氏螯虾壳聚糖的抗菌作用靶位, 除作用于细菌的细胞膜外, 还能进入细菌内, 作用于细胞核、线粒体这样的细胞器. 其作用机制可能是: (1)在酸性条件下, 克氏螯虾壳聚糖分子中的质子化铵-NH+3具有正电性, 吸附带有负电荷的细菌, 使细菌细胞壁和细胞膜上的负电荷分布不均, 干扰细胞壁的合成, 使细胞壁趋向于溶解, 细胞膜因不能承受渗透压而变形破裂, 细胞的内容物如水、蛋白质等渗出, 发生细菌溶解而死亡. (2)克氏螯虾壳聚糖吸附细菌后, 穿过细菌的多孔细胞壁进入到细胞内, 作用于DNA, 导致核酸、蛋白质外泄, 影响细菌的核酸代谢和蛋白质代谢, 从而抑制了细菌的生长繁殖.
克氏螯虾壳聚糖是本课题组从克氏螯虾外壳中提取制备的一种碱性氨基多糖, 经实验对E.coli、S.aureus及H. pylori等具有较强的天然抗菌活性, 但其抗菌作用的机制, 未见报道.
曹志成, 英国生物医学科学研究所院士, 伊利沙伯医院临床肿瘤科.
本研究发现用荧光标记克氏螯虾壳聚糖与菌作用后, 菌体由表及里其荧光强度逐渐增强; 并随荧光标记克氏螯虾壳聚糖浓度增高, 核酸及蛋白质的泄漏量也逐渐增高, 且其作用时间越长, 核酸泄漏量越多. 究其抗菌作用的靶位可能是细胞膜和细胞核、线粒体这样的细胞器.
克氏螯虾壳聚糖对E.coli、S. aureus及H. pylori等具有较强的天然抗菌活性, 弄清其作用机制, 可为临床研发应用提供依据.
本研究选题尚可, 设计合理, 结果可靠, 实用性较强.
编辑: 李军亮 电编:何基才
| 6. | Liu H, Du Y, Wang X, Sun L. Chitosan kills bacteria through cell membrane damage. Int J Food Microbiol. 2004;95:147-155. [PubMed] [DOI] |
| 7. | Neu TR, Woelfl S, Lawrence JR. Three-dimensional differentiation of photo-autotrophic biofilm constituents by multi-channel laser scanning microscopy (single-photon and two-photon excitation). J Microbiol Methods. 2004;56:161-172. [PubMed] [DOI] |
| 8. | Shapiro HM. Microbial analysis at the single-cell level: tasks and techniques. J Microbiol Methods. 2000;42:3-16. [PubMed] [DOI] |
| 9. | Chung YC, Chen CY. Antibacterial characteristics and activity of acid-soluble chitosan. Bioresour Technol. 2008;99:2806-2814. [PubMed] [DOI] |
| 10. | Helander IM, Nurmiaho-Lassila EL, Ahvenainen R, Rhoades J, Roller S. Chitosan disrupts the barrier properties of the outer membrane of gram-negative bacteria. Int J Food Microbiol. 2001;71:235-244. [PubMed] [DOI] |
| 11. | Je JY, Kim SK. Chitosan derivatives killed bacteria by disrupting the outer and inner membrane. J Agric Food Chem. 2006;54:6629-6633. [PubMed] [DOI] |