修回日期: 2009-08-22
接受日期: 2009-08-24
在线出版日期: 2009-09-08
目的: 探讨抑制Janus激酶/信号转导和转录激活子(JAK/STAT)通路在大鼠结肠炎发病机制中的作用.
方法: 建实验性大鼠结肠炎模型后, 给予JAK特异性抑制剂AG490和STAT抑制剂雷帕霉素(RPM), 腹腔注射治疗1 wk后处死大鼠, 观察结肠炎症改变并进行评分, 采用蛋白印迹法(Western blot)检测MMP-1、MMP-2、MMP-3、TIMP-1蛋白表达; 用明胶酶谱法检测结肠组织中MMP-2的活性.
结果: 与对照组相比, AG490治疗组肠道损伤积分降低(5.50±2.16分 vs 8.53±2.18分, P = 0.012); RPM治疗组肠道损伤积分(5.17±1.80分)较对照组低(P<0.05). AG490组和RPM组MMP-1、MMP-2的蛋白质表达量均明显低于对照组(均P<0.05), 而两实验组分别与对照组比较其MMP-3、TIMP-1蛋白质表达均无明显差异(均P>0.05). 与对照组相比, 两实验组MMP-2的活性均显著下降(P<0.05).
结论: AG490和RPM通过阻断JAK/STAT信号通路的活化能缓解大鼠结肠炎, 这一作用可能是通过抑制MMP-1、MMP-2的表达来实现的.
引文著录: 杨涓, 缪应雷. JAK/STAT抑制剂在TNBS诱发大鼠结肠炎中的作用. 世界华人消化杂志 2009; 17(25): 2571-2576
Revised: August 22, 2009
Accepted: August 24, 2009
Published online: September 8, 2009
AIM: To investigate the role of the Janus kinase/signal transducer and activator of transcription (STAT) signaling pathway in the pathogenesis of trinitrobenzenesulfonic acid (TNBS)-induced experimental colitis in rats.
METHODS: TNBS was used to induce experimental colitis in rats. The rats were then intraperitoneally injected with rapamycin (RPM) and AG490 (a specific inhibitor of Janus kinase). Colonic inflammation was evaluated by histology. Western blot was used to detect the expression of matrix metalloproteinase (MMP)-1, MMP-2, MMP-3 and ITMP-1 proteins in the colon. Gelatin zymography was used to examine the activity of MMP-2 in colitis.
RESULTS: The pathological inflammation scores in the AG490 treatment group and RPM treatment group were significantly lower than that in the control group (5.50 ± 2.16 and 5.17 ± 1.80 vs 8.53 ± 2.18, respectively; P = 0.012 and P < 0.05). The expression levels of MMP-1 and MMP-2 proteins in the AG490 treatment group and RPM treatment group were significantly lower than those in the control group (all P < 0.05). In contrast, there were no significant changes in the expression levels of MMP-3 and TIMP-1 proteins between the control group and the two treatment groups (both P > 0.05). Compared with the control group, the activity of MMP-2 was obviously reduced in the two treatment groups (both P < 0.05).
CONCLUSION: Inhibition of the JAK/STAT signaling pathway by AG490 or RPM reduces disease activity in TNBS-induced experimental colitis through downregulation of MMP-1 and MMP-2 mRNA expression in colonic tissue.
- Citation: Yang J, Miao YL. Role of the Janus kinase/signal transducer and activator of transcription pathway in the pathogenesis of trinitrobenzenesulfonic acid-induced experimental colitis in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2571-2576
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2571.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2571
炎症性肠病(inflammatory bowel disease, IBD)包括溃疡性结肠炎(ulcerative colitis, UC)和克罗恩病(Crohn's disease, CD), 属于原因不明的肠道非特异性炎症疾病. 由于其病因和发病机制不明, 给治疗带来很大的困难. 既往认为IBD的病因及发病机制与感染因素、遗传因素、免疫反应异常等有关, 近年来研究较热的细胞因子网络备受关注, 不少学者把研究的方向转向了信号转导与炎症介质之间的关系上, 炎症介质及细胞因子可导致机体多条信号通路活化, 从而通过他直接或间接地介导炎症介质的表达, 导致肠黏膜受损产生; 而JAK/STAT通路环节少而简洁, 他把细胞膜上感受的信号直接传递到核内-启动基因转录, 因而引起人们的普遍兴趣[1]. 我们利用TNBS诱发大鼠肠炎模型, 探索肠黏膜基质金属蛋白酶(matrix metalloproteinases, MMPs)的高表达是否经过JAK/STAT途径传递信息, 开辟治疗IBD的新途径.
♀、未育、健康的清洁级SD大鼠36只, 体质量193-205 g, 购自昆明医学院实验动物中心, TNBS购于美国Sigma公司; AG490购于美国Calbiochem公司; RPM购于美国Biomol公司; BCA蛋白浓度测定试剂盒购于北京博奥森生物技术有限公司; 兔抗大鼠MMP-1多抗、MMP-2多抗、MMP-3多抗、TIMP-1多抗、ACTIN多抗、HRP标记的羊抗兔IgG购于武汉博士德公司; PageRulerTM Prestained Protein Ladder(Fermentas).
1.2.1 分组及造模: 参考Morris et al[2]的二次致炎细胞免疫方法, 随机选24只SD大鼠, 轻度乙醚麻醉, TNBS 30 mg溶于500 mL/L的乙醇中(共0.85 mL), 用硅胶管从肛门插入8 cm灌肠. 3 wk后再次从肠道灌入10 mg TNBS+0.25 mL生理盐水, 造模慢性复发性大鼠结肠炎成功后, 将大鼠随机分为2组, AG490组(n = 12)将1 mg AG490粉剂溶于二甲基亚砜(dimethyl sulphoxide, DMSO)中, 配成50 g/L溶液, 注射时溶于0.4 mL生理盐水中配成混悬液, JAK2抑制剂AG490 8 mg/(kg·d)腹腔注射, 治疗7 d; RPM处理组(n = 12): 将RPM粉剂溶于DMSO中, 配成浓度为25 g/L溶液, 注射时溶于0.4 mL生理盐水中配成混悬液, RPM 0.4 mg/(kg·d)腹腔注射, 治疗7 d; 对照组(n = 12)生理盐水0.4 mL/d腹腔注射, 共7 d. 治疗结束后, 乙醚麻醉后开胸摘除心脏处死大鼠, 立刻(1 min内)开腹观察肠道病变, 距肛门6 cm左右截断肠道, 置冰上, 沿系膜对侧纵行剖开以冰盐水冲洗干净, 仔细观察肠道病变, 按照Medina et al[3]的标准做出大体和组织损伤评分; 另取结肠组织, 液氮速冻后于-70℃冰箱保存备用. 次日从-70℃冰箱取出大鼠结肠组织. 称取各组大鼠结肠组织100 mg将组织放于冰上, 将其剪碎, 置于匀浆器中, 加入组织提取液, 匀浆后离心, 并取其上清, 并置于-20℃保存. 蛋白质浓度用BCA法测定.
1.2.2 MMPs与TIMP-1的蛋白测定: 采用Western blot法分析肠黏膜中MMP-1(52 kDa)、MMP-2(72 kDa)、MMP-3(57 kDa)、ITMP-1(28.5 kDa)蛋白质表达. β-actin兔多克隆抗体(42 kDa)作为内参. 每个样品取60 μg总蛋白以2×上样缓冲液, 煮沸5 min. 将样品经10%聚丙烯酰胺凝胶分离蛋白, 4℃下电转至PVDF硝酸纤维素膜上. 用50 g/L脱脂牛奶封闭后, 分别加1:400稀释的抗actin、MMP-1、MMP-2、MMP-3及TIMP-1抗体4℃过夜. PBST洗膜后, 再加1:5000, HRP标记的IgG于室温孵育2 h, PBST洗膜后, 用化学增强荧光剂检验蛋白条带, 柯达X光胶片曝光、显影. 数码照相后, Image J软件进行图像处理, 测定灰度值. 将同一张蛋白印迹膜曝光后, 0.5% SDS洗脱抗体, 再用β-actin进行孵育杂交以作为内参照.
1.2.3 MMP-2的活性测定: 采用明胶酶谱分析法, SDS-PAGE的分离胶浓度为8%, 每毫升凝胶含2 mg明胶, 浓缩胶为5%, 取90 μg总蛋白加等体积的2×SDS非还原加样缓冲液, 室温下混匀后直接点样, 4℃条件下恒压电泳(120 V)至溴酚蓝达凝胶下沿. 电泳结束后, 凝胶置2.5% TritonX-100中漂洗15 min×2次, 然后浸入反应缓冲液, 37℃孵育9 h. 取出凝胶, 用0.5%考马斯亮蓝R250染色0.5 h, 脱色液脱色至蓝色背景现出清晰的白色条带.
统计学处理 采用SPSS11.5统计软件. 所有数据用mean±SD表示. 计量资料的多组数据比较采用随机区组设计的方差分析, 组间的两两比较采用q检验. P<0.05为差异有统计学意义.
在第1次TNBS灌肠后未给予治疗的3 wk内, 大鼠主要在第1周内出现腹泻, 大便为黄色稀便, 或肛周体毛被稀便沾染. 灌肠后第1周体质量明显降低(P值分别为0.000、0.000、0.000). 第2周体质量开始增加(P值分别为0.002、0.001、0.001), 腹泻症状开始好转. 第3周后, 大便正常, 体质量逐渐恢复正常(P值分别为0.000、0.000、0.000). 第4周再次给予TNBS灌肠后, 对照组直到处死前, 仍有腹泻; 而雷帕霉素组与AG490处理组出现腹泻, 持续3 d, 以后逐渐恢复正常. 第4周结束时, 雷帕霉素组与AG490组体质量较对照组高(P值均为0.000). 逐周的体质量变化见表1.
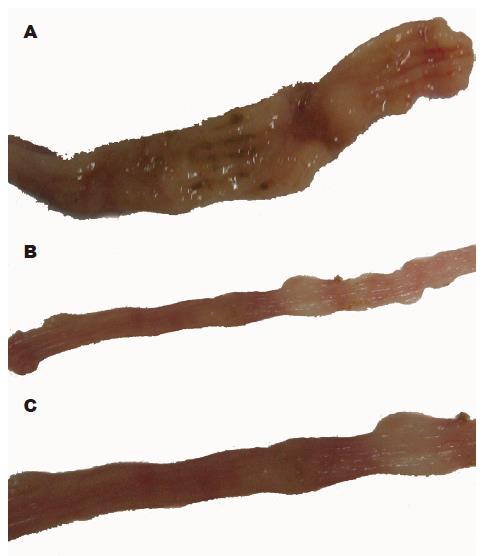
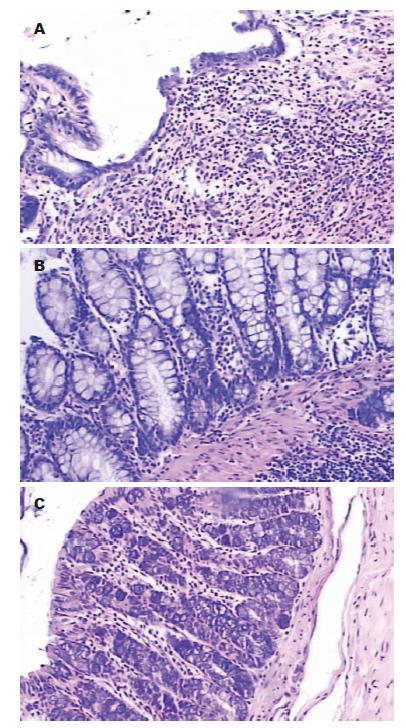
对照组(图1A)结肠可见肠壁充血、水肿明显, 少数腹腔粘连, 近端肠道扩张. 沿系膜缘剖开后见黏膜充血、水肿、糜烂及溃疡形成, 几乎所有大鼠均有肠壁增厚; 光镜下(图2A)病变主要位于黏膜和黏膜下层, 少数出现在肌层, 甚至是全层炎症, 以中性粒细胞、浆细胞、淋巴细胞浸润为主, 黏膜及黏膜下层有单核细胞和巨噬细胞的浸润, 甚至溃疡形成, 肠道损伤积分(包括大体和组织学积分)为8.53±2.18. AG490处理组大体观察结肠炎症较轻, 无明显糜烂和溃疡出现(图1B); 光镜下观察可见黏膜及黏膜下层炎症明显减轻(图2B), 肠道损伤积分为5.50±2.16, 低于对照组(t = 2.825, P<0.05). RPM处理组大体观察结肠炎症较轻, 无明显糜烂和溃疡出现(图1C); 光镜下观察可见黏膜及黏膜下层炎症明显减轻(图2C), 肠道损伤积分为5.17±1.80, 低于对照组(t = 3.963, P<0.01).
AG490组和RPM组MMP-1, MMP-2表达量显著低于对照组, 差异有统计学意义(均P<0.05). AG490组和RPM组MMP-3, TIMP-1表达量与对照组差异无统计学意义(均P>0.05, 表2, 图3).
AG490组和RPM组MMP-2(66 kDa)活性显著低于对照组(P<0.05. 图4).
本研究采用TNBS二次致炎细胞免疫方法构建实验性大鼠结肠炎模型, 第1次给予TNBS刺激后, 大鼠出现腹泻、便血、体质量减轻等症状, 急性期后症状渐缓解, 大鼠结肠炎进入慢性期; 3 wk后再次给予小剂量的TNBS灌肠后病情复发, 再次出现上述症状. 4 wk后处死大鼠, 观察发现结肠肠壁黏膜充血、水肿、糜烂及溃疡形成, 几乎所有大鼠均有肠壁增厚; 光镜下病变主要位于黏膜和黏膜下层, 少数出现在肌层, 甚至是全层炎症, 以中性粒细胞、浆细胞、淋巴细胞浸润为主, 黏膜及黏膜下层有单核细胞和巨噬细胞的浸润, 甚至溃疡形成, 肠道损伤积分明显增高. 结果表明本研究的大鼠结肠炎模型构建成功, 并且通过采用2次刺激法, 使大鼠在慢性结肠炎的基础上再次出现急性结肠炎的表现, 具有急、慢性结肠炎共存的特点, 类似于慢性复发性炎症, 更接近人类IBD反复发作-缓解-复发的慢性病程. 我们给予AG490与雷帕霉素治疗TNBS大鼠结肠炎后, 动物体质量增加, 腹泻、便血等症状好转, 大体观察结肠炎症较轻, 无明显糜烂和溃疡出现; 光镜下观察可见黏膜及黏膜下层炎症明显减轻, 本研究结果提示AG490与雷帕霉素治疗能够有效抑制TNBS大鼠结肠炎的炎症反应. 文献[4]报道AG490是JAK2的特异性抑制剂, RPM是STAT的阻断剂, 他们通过阻断各自激酶701位丝氨酸和727位酪氨酸磷酸化, 来阻断下游激酶的活化进而抑制细胞的生理和病理效应. 最近有多项研究[5-6]显示活化的STAT3通过调节炎症反应在结肠炎发病机制中起着重要作用. 在多种结肠炎动物模型中, Suzuki et al[7]均发现活化STAT3的高表达; 另外, 有多个研究[5,8]也发现在UC和DC患者炎症肠黏膜总STAT3和磷酸化的STAT3水平持续性升高, 且无论在动物模型还是IBD患者炎症肠黏膜中活化的STAT3水平都与这些组织炎症损伤程度呈正相关. 但Takeda et al[9]敲除了小鼠单核细胞的STAT3基因, 发现STAT3基因缺失使小鼠对内毒素的敏感性增加, TNF-α、IL-1等炎性细胞因子的数量也增加, 提示STAT3可能具有免疫抑制功能. STAT3在肠道炎症反应中的作用尚需进一步深入研究.
近年来有多位学者对MMPs在IBD中的表达情况及其可能作用进行了研究, 以探索MMPs在IBD发病及其病程进展中的作用, 结果令人鼓舞. Danese et al[10]测定了52例UC患者病变区MMPs及TIMPs的含量, 结果显示: MMP-1、MMP-2、MMP-9和TIMPs在病变组织基质细胞中表达; MMP-3在基质细胞和上皮细胞中均表达; MMP-7则主要表达在溃疡边缘的上皮细胞内, 而且其表达与炎症的严重度相关, 故认为MMP-7的表达可作为评价UC炎症活动度的重要指标. 有研究者对21例UC患者和21例CD患者内镜结肠活检标本的MMP及其抑制物TIMP mRNAs的含量进行了测定, 结果显示, MMP-2、MMP-14及TIMP-1的mRNAs含量在所有病变标本中均显著增加, 其中MMP-1及MMP-3的mRNA含量是正常组织的15倍, 因而推测MMPs在IBD的组织破坏和重构中发挥重要作用[11]. IBD不仅具有慢性消耗性特征, 可造成局部组织的炎症坏死, 而且有导致局部癌变的可能. 因而,研究如何有效阻断这一病变过程具有重要的现实意义. 正常时, 在结肠或身体其他组织, MMPs和TIMPs协同作用, 使ECM的合成和降解处于动态平衡, 保持人体结构和功能的完整性, 一旦代谢失衡, 势必出现一系列病理状态. 在肠道, 这种代谢失衡则可破坏肠黏膜屏障, 导致溃疡等的形成[10]. 最近大量研究报道均提示, IBD活检组织有MMPs的过表达, 包括mRNA和蛋白质水平. MMPs主要通过降解ECM、促进细胞凋亡、影响新生血管生成、促进细胞因子释放等多种途径参与IBD及其并发症的发生、发展.
另有多个研究证实MMPs抑制剂能有效地防止肠道的损伤和炎症, 并降低肠道炎症的积分[3,12]. 局部MMPs的浓度与黏膜破坏间存在因果关系, 对该酶的抑制可导致组织破坏的减轻, 且该酶与黏膜的重构间有很强的相关性, 然而, 总的胶原降解程度取决于局部有活性的酶和该酶天然抑制剂之间的平衡. TIMPs是MMPs的一种天然抑制剂, 研究发现, 在炎症肠病的病变肠黏膜中TIMPs的表达并没有相应的升高, 导致MMPs/TIMPs比值升高, MMPs和其天然抑制剂的平衡被破坏, 导致组织损伤的发生[13].
本实验进一步探讨了JAK/STAT通路是否参与IBD肠组织MMP表达的调控过程, 旨在为寻找有效干预MMP表达途径提供新的线索. 实验结果显示, 以TNBS诱导的IBD大鼠模型中AG490与RPM能明显降低肠组织中MMP-1、MMP-2的蛋白表达和MMP-2的活性, 而不影响MMP-3与TIMP-1的表达; 抑制JAK/STAT通路能显著减少TNBS诱导的IBD大鼠模型中肠组织糜烂和溃疡的出现. 结果表明JAK/STAT参与了IBD肠组织MMP表达的调节过程, 抑制JAK/STAT通路可下调MMP的表达, 并有助于防止IBD肠组织的损伤.
总之, 通过干预JAK/STAT通路调控MMP的表达与活性, 可能达到防御或治疗IBD的目的. 这对未来治疗IBD开辟了新的途径. 关于JAK/STAT与MMP的确切作用机制及临床意义有待更深入的研究.
既往认为IBD的病因及发病机制与感染因素、遗传因素、免疫反应异常等有关, 近年来研究较热的细胞因子网络备受关注, 不少学者把研究的方向转向了信号转导与炎症介质之间的关系上, 炎症介质及细胞因子可导致机体多条信号通路活化, 从而通过他直接或间接地介导炎症介质的表达, 导致肠黏膜受损产生; 而JAK/STAT通路环节少而简洁, 他把细胞膜上感受的信号直接传递到核内-启动基因转录, 因而引起人们的普遍兴趣.
秦成勇, 教授, 山东省立医院消化内科; 许玲, 副教授, 中国人民解放军第二军医大学长征医院中医科.
近年来有多位学者对MMPs在IBD中的表达情况及其可能作用进行了研究, 以探索MMPs在IBD发病及其病程进展中的作用, 结果令人鼓舞.
最近有多项研究显示活化的STAT3通过调节炎症反应在结肠炎发病机制中起着重要作用.
通过干预JAK/STAT通路调控MMP的表达与活性, 可能达到防御或治疗IBD的目的. 这对未来治疗IBD开辟了新的途径.
本研究选题合理, 实验方法正确, 参考文献引用恰当, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Mudter J, Weigmann B, Bartsch B, Kiesslich R, Strand D, Galle PR, Lehr HA, Schmidt J, Neurath MF. Activation pattern of signal transducers and activators of transcription (STAT) factors in inflammatory bowel diseases. Am J Gastroenterol. 2005;100:64-72. [PubMed] [DOI] |
| 2. | Morris GP, Beck PL, Herridge MS, Depew WT, Szewczuk MR, Wallace JL. Hapten-induced model of chronic inflammation and ulceration in the rat colon. Gastroenterology. 1989;96:795-803. [PubMed] |
| 3. | Medina C, Videla S, Radomski A, Radomski M, Antolín M, Guarner F, Vilaseca J, Salas A, Malagelada JR. Therapeutic effect of phenantroline in two rat models of inflammatory bowel disease. Scand J Gastroenterol. 2001;36:1314-1319. [PubMed] [DOI] |
| 5. | Lovato P, Brender C, Agnholt J, Kelsen J, Kaltoft K, Svejgaard A, Eriksen KW, Woetmann A, Ødum N. Constitutive STAT3 activation in intestinal T cells from patients with Crohn's disease. J Biol Chem. 2003;278:16777-16781. [PubMed] [DOI] |
| 6. | Musso A, Dentelli P, Carlino A, Chiusa L, Repici A, Sturm A, Fiocchi C, Rizzetto M, Pegoraro L, Sategna-Guidetti C. Signal transducers and activators of transcription 3 signaling pathway: an essential mediator of inflammatory bowel disease and other forms of intestinal inflammation. Inflamm Bowel Dis. 2005;11:91-98. [PubMed] [DOI] |
| 7. | Suzuki A, Hanada T, Mitsuyama K, Yoshida T, Kamizono S, Hoshino T, Kubo M, Yamashita A, Okabe M, Takeda K. CIS3/SOCS3/SSI3 plays a negative regulatory role in STAT3 activation and intestinal inflammation. J Exp Med. 2001;193:471-481. [PubMed] [DOI] |
| 8. | Musso A, Dentelli P, Carlino A, Chiusa L, Repici A, Sturm A, Fiocchi C, Rizzetto M, Pegoraro L, Sategna-Guidetti C. Signal transducers and activators of transcription 3 signaling pathway: an essential mediator of inflammatory bowel disease and other forms of intestinal inflammation. Inflamm Bowel Dis. 2005;11:91-98. [PubMed] [DOI] |
| 9. | Takeda K, Clausen BE, Kaisho T, Tsujimura T, Terada N, Förster I, Akira S. Enhanced Th1 activity and development of chronic enterocolitis in mice devoid of Stat3 in macrophages and neutrophils. Immunity. 1999;10:39-49. [PubMed] [DOI] |
| 10. | Danese S. Negative regulators of angiogenesis in inflammatory bowel disease: thrombospondin in the spotlight. Pathobiology. 2008;75:22-24. [PubMed] [DOI] |
| 11. | Chidlow JH Jr, Shukla D, Grisham MB, Kevil CG. Pathogenic angiogenesis in IBD and experimental colitis: new ideas and therapeutic avenues. Am J Physiol Gastrointest Liver Physiol. 2007;293:G5-G18. [PubMed] [DOI] |
| 12. | Di Sebastiano P, di Mola FF, Artese L, Rossi C, Mascetta G, Pernthaler H, Innocenti P. Beneficial effects of Batimastat (BB-94), a matrix metalloproteinase inhibitor, in rat experimental colitis. Digestion. 2001;63:234-239. [PubMed] [DOI] |
| 13. | 沈 哓伶. 基质金属蛋白酶与炎症性肠病. 国外医学·消化系疾病分册. 2005;25:340-342. |