修回日期: 2009-07-28
接受日期: 2009-08-03
在线出版日期: 2009-09-08
目的: 探讨γ-氨基丁酸(GABA)B受体在肝纤维化大鼠中的表达.
方法: SD大鼠, 腹腔注射50% CCl4制备大鼠肝纤维化模型. 从第6周开始, 每周1次取大鼠肝组织, 得到不同肝纤维化程度的肝脏标本. 一部分标本40 g/L甲醛固定, 常规石蜡包埋, 连续4 μm切片, 做组织病理学染色(HE、Masson)和免疫组织化学(α-SMA), 以确定不同肝纤维化水平. 另一部分标本-80℃保存用于提取肝脏RNA, 逆转录得到cDNA, 设计GABA(B)受体、α-SMA、TGF-β、胶原Ⅰ、胶原Ⅲ的引物, 做实时荧光定量PCR, 分析GABA(B)受体的表达与大鼠肝纤维化程度的相关性.
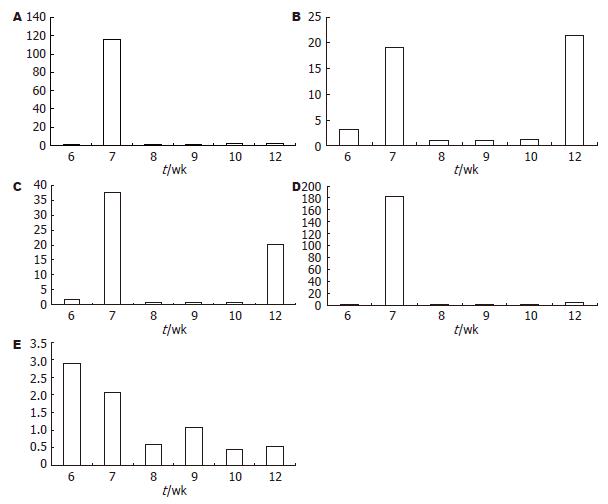
结果: 建模7 wk时, α-SMA、TGF-β、胶原Ⅰ和胶原Ⅲ较6 wk分别增加19.2倍、2.1倍、37.5倍和183.5倍. GABA(B)受体基因表达也明显升高, 升高量达到116.2倍. 6 wk对照组GABA(B)受体基因表达是模型组的2倍. 到12 wk初步形成假小叶时, 只有α-SMA和胶原Ⅰ增加显著, 分别为21.6倍和20.1倍. TGF-β和胶原Ⅲ变化不明显. 其他时间点基因表达与6 wk模型相比无明显变化.
结论: GABA(B)受体可能参与了肝纤维化的发生. 在肝纤维化晚期, 细胞外基质的合成主要以胶原Ⅰ为主, 胶原Ⅲ次之. α-SMA的表达与肝纤维化水平呈正相关.
引文著录: 樊文梅, 石炳毅, 马锡慧, 魏红山, 黎立, 韩永, 何秀云. γ-氨基丁酸B受体在CCl4诱导肝纤维化大鼠中的表达. 世界华人消化杂志 2009; 17(25): 2555-2560
Revised: July 28, 2009
Accepted: August 3, 2009
Published online: September 8, 2009
AIM: To investigate the expression of γ-aminobutyric acid (GABA) B receptor in carbon tetrachloride-induced liver fibrosis in rats.
METHODS: Male Sprague-Dawley rats were intraperitoneally injected with 50% carbon tetrachloride to induce liver fibrosis. Six weeks after induction, liver tissue samples were taken once a week. Each sample was divided into two parts: one was used for hematoxylin and eosin and Masson's trichrome staining to assess the degree of liver fibrosis and immunohistochemistry to determine the level of α-smooth muscle actin (α-SMA), the other was used for real-time reverse transcription-polymerase chain reaction to detect the expression of GABA B receptor, α-SMA, transforming growth factor-β (TGF-β), collagen I and collagen III mRNAs.
RESULTS: The expression levels of α-SMA, TGF-β, collagen I, collagen III and GABA(B) receptor mRNAs in liver fibrosis at week 7 increased 19.2, 2.1, 37.5, 183.5 and 116.2 times as much as those at week 6, respectively. At week 6, the expression level of GABA(B) receptor in the liver in rats with liver fibrosis was reduced by two times when compared with that in normal control rats. At week 12 when pseudolobule formed, the expression levels of α-SMA and collagen I mRNAs increased 21.6 and 20.6 times as much as those at week 6, respectively, while those of TGF-β and collagen III mRNAs showed no obvious changes. The expression levels of these genes at other time points were almost unchanged when compared with those at week 6.
CONCLUSION: GABA(B) receptor may be involved in the progression of liver fibrosis. In advanced liver fibrosis, the extracellular matrix synthesized is mainly collagen I. The expression of α-SMA is positively correlated with the degree of liver fibrosis.
- Citation: Fan WM, Shi BY, Ma XH, Wei HS, Li L, Han Y, He XY. Expression of γ-aminobutyric acid B receptor in carbon tetrachloride-induced liver fibrosis in rats. Shijie Huaren Xiaohua Zazhi 2009; 17(25): 2555-2560
- URL: https://www.wjgnet.com/1009-3079/full/v17/i25/2555.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i25.2555
肝纤维化是大多数慢性肝病所共有的病理特征, 是多种慢性肝病向肝硬化发展的主要中间环节[1]. 20世纪60-80年代, 肝纤维化多被认为是不可逆转的, 近20年来, 越来越多的证据表明, 肝纤维化甚至早期肝硬化都有逆转的可能[2-4]. 若能早期诊断和治疗可逆转这一过程, 若诊断和治疗不及时则可进一步发展为肝硬化, 部分病例最终导致肝癌, 严重威胁着人们的健康和生命. 因此, 揭示肝纤维化的发生机制, 是解决肝病问题的根本所在. 众所周知, 肝星状细胞(heptic stellate cells, HSCs)的活化是肝纤维化发生的核心环节[5-7]. 我们前期研究表明, γ-氨基丁酸(γ-aminobutyric, GABA)能够影响HSCs的基因表达谱、刺激HSCs活化的基因表达上调[8]. GABA是脑内最重要的抑制性神经递质, 主要分布在哺乳动物脑内. 临床研究表明, 在肝病患者中, 血清GABA水平升高, 肝性脑病患者血清中GABA水平亦升高. GABA与其受体结合发挥生理功能, 根据受体对激动剂和拮抗剂的敏感性, 可以将GABA受体分为A型、B型及C型3个亚型[9]. 脑内GABA受体主要是GABA(A)受体, GABA(B)受体较少, GABA(C)受体目前仅在视网膜发现, GABA(B)受体属G蛋白偶联受体家族, 他广泛存在于中枢神经系统和外周组织, 在多种生理过程中发挥重要作用[10]. 本组前期用血管紧张素Ⅱ刺激肝星状细胞系, 随后的基因芯片结果表明, GABA(B)受体表达上调[11]. 因此本研究试图通过在大鼠肝纤维化模型的基础上, 运用组织病理学染色、免疫组织化学、实时荧光定量PCR技术探讨GABA(B)受体基因在肝纤维化不同阶段表达量的差异, 以期了解GABA(B)受体基因表达与大鼠肝纤维化水平的相关性, 为开发新的抗肝纤维化药物提供一种新的靶点.
雄性SD大鼠20只, SPF级动物, 体质量230-250 g, 购自北京维通利华实验动物技术有限公司. 普通饲料喂养, 随机分成2组: 肝纤维化模型组15只(随机分到3个笼子里喂养, 每笼5只)、对照组5只. 甲醛溶液、橄榄油、CCl4购自北京化学试剂公司. 即用型(非生物素)两步法免疫组织化学试剂盒购自北京中杉生物技术有限公司. TRIzol试剂购自美国Invitrogen公司, 实时PCR试剂盒(货号DRR081A)购自大连宝生物公司. α-SMA一抗购自武汉博士德生物工程公司. 引物合成在上海生物工程公司合成.
1.2.1 造模: 每周2次腹腔注射, 模型组注射剂量按0.1 mL/100 g体质量注射橄榄油配制的CCl4溶液, 1:1配制, 对照组注射橄榄油. 从第6周开始, 每周四随机选取模型组2只, 对照组1只, 颈椎脱臼处死, 进行取材. 所取肝脏组织, 一部分用100 g/L的甲醛溶液固定, 一部分放入冻存管并于-80℃保存.
1.2.2 病理组织染色: 常规组织脱水、包埋, 切片, 染色. 免疫组织化学用两步法(非生物素)检测试剂盒, α-SMA免疫组织化学染色步骤按说明书进行.
1.2.3 TRIzol法提取RNA, 逆转录得到cDNA: 称取50-100 mg肝脏组织, 在液氮中磨成粉末后, 加入1 mL TRIzol, 静置5 min, 转移到1.5 mL的eppendof管中, 详细步骤按照TRIzol说明书进行, RNA沉淀重悬于DEPC水中, 用分光光度计测定样品浓度, 分别取1 μg做逆转录.
1.2.4 荧光定量PCR: 用SYBR实时PCR试剂盒配制反应体系, 20 μL反应体系中包含SYBR Premix Ex TaqⅡ(2×)10 μL、10 μmol/L的Primer Forward 0.8 μL、10 μmol/L Primer Reverse 0.8 μL、cDNA模板2 μL、超纯水6.4 μL. 用Bio-rad Chromo4荧光定量PCR仪进行扩增检测, 扩增程序为: 95℃, 30 s, 95℃, 5 s, 60℃, 20 s, 40个循环, 溶解曲线绘制秩序如下, 95℃ 3 min, 55.0℃ 3 min, 溶解曲线制作温度设定从55.0℃-95.0℃, 每0.5℃读1次板, 停2 s. 引物序列见表1.
| 基因 | 引物序列 |
| β-actin | 5'-GGAGATTACTGCCCTGGCTCCTA-3' |
| 5'-GACTCATCGTACTCCTGCTTGCTG-3' | |
| GABA(B)受体 | 5'-GTCCTGTACAAATGTGCTCGCTTC-3' |
| 5'-GTGCTCAACGCATCATACACACC-3' | |
| 胶原 I | 5'-TCCTGGCAATCGTGGTTCAA-3' |
| 5'-ACCAGCTGGGCCAACATTTC-3' | |
| 胶原 III | 5'-GGTCCTGCAGGTAACAGTGGTTC-3' |
| 5'-TGCTCCAGTTAGCCCTGCAA-3' | |
| TGF-β1 | 5'-TGCGCCTGCAGAGATTCAAG-3' |
| 5'-AGGTAACGCCAGGAATTGTTGCTA-3' | |
| α-SMA | 5'-AGCCAGTCGCCATCAGGAAC-3' |
| 5'-CCGGAGCCATTGTCACACAC-3' |
统计学处理 用∆∆CT法处理数据并进行相对定量比较, 增加2倍以上或下降0.5倍以下被认为有显著性差异.
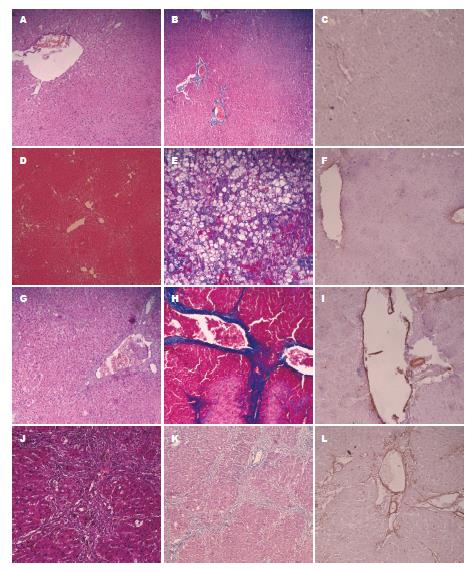
6 wk时, 对照组可见肝小叶结构完整, 中央静脉清晰, 肝细胞呈放射状排列, 马苏染色可见极少量的胶原纤维, α-SMA在汇管区和中央静脉处微量存在. 肝纤维化模型组, 6 wk时, HE及马苏染色可见肝细胞气球样变较为严重, 胶原纤维散在分布, α-SMA在汇管区表达较正常对照组高. 7 wk时, HE染色可见肝细胞排列紊乱, 中央静脉偏位. 马苏染色可见汇管区有大量的胶原纤维, α-SMA在汇管区表达呈强阳性, 较6 wk时阳性都增强. 12 wk时, HE及马苏染色可见大量纤维束包绕, 即形成初步假小叶. α-SMA表达呈强阳性. 6-7 wk时, 大鼠肝脏的结构及成分的变化最明显, 8-10 wk的纤维化程度无明显差异(数据未显示), 但都不如7 wk纤维化明显, 12 wk时, 初步假小叶形成, 即到了肝硬化初期(图1).
如图2所示, GABA(B)受体、α-SMA、TGF-β、胶原Ⅰ和胶原Ⅲ这5个基因在建模6-7 wk的进程中表达量明显升高, 尤其是GABA(B)受体基因7 wk模型表达量达到6 wk模型的116倍. 6 wk模型与6 wk对照相比, GABA(B)受体表达有所下降, 胶原 Ⅲ没有明显变化. 而α-SMA、TGF-β和胶原Ⅰ基因表达较6 wk对照分别增加3.1、2.9、1.7倍. 10 wk模型GABA(B)受体基因表达较6 wk模型稍有升高, TGF-β基因表达稍有降低, 而其他时间点GABA(B)受体基因表达与6 wk模型相比无明显差异. 12 wk模型α-SMA、胶原Ⅰ和胶原Ⅲ基因表达较6 wk模型高, 其中α-SMA、胶原Ⅰ的升高幅度比较明显, 分别为21.6倍和20.1倍.
在肝纤维化形成过程中, HSCs是主要的细胞外基质(extracellular matrix, ECM)形成细胞[6-7]. 任何病因的肝损伤都会导致HSCs的活化和大量增殖, 发生表型转化, 转变为肌成纤维细胞(myofibroblast, MFB). MFB主要表达α-SMA, 后者是MFB活跃的标志性抗原[3,12-14]. MFB合成分泌大量的ECM, 导致肝纤维化的形成. GABA和GABA受体是最重要的抑制性神经递质, 早期的研究发现, 肝病患者的血清中GABA水平升高[15], 肝性脑病患者的血清GABA浓度与脑病程度平行[16]. 早在2002年, Dubuissonet al用交感神经系统的抑制剂缓减了实验大鼠的肝纤维化[17]. 霍普京斯大学医学院的Oben et al也在这一领域作了探索, 他们发现HSCs表达肾上腺素受体, 能够释放去甲肾上腺素, 在HSCs中加入肾上腺素受体拮抗剂后, HSCs的生长即受到抑制, 去甲肾上腺素可以使HSCs重新活化[18]. HSCs表达多种神经内分泌蛋白以及他们相应的受体[19-21], 这些都暗示了肝脏和神经方面的联系.
本研究利用CCl4诱导大鼠肝纤维化模型, 结果显示GABA(B)受体在7 wk增加了116.2倍. 提示GABA(B)受体可能与肝纤维化的发展相关. 本研究首次报道了GABA(B)受体在肝纤维化过程中的表达. GABA(B)受体是G蛋白偶联受体, 在所有组织器官中均有表达, 因而他可能广泛的控制着外周组织器官[10]. 他与药物成瘾、癫痫病和神经痛等有关[22-24]. 有研究显示GABA(B)受体激动剂可以抑制肝癌细胞的生长[25], 提示GABA(B)受体与肝病之间的关系. 其后的几周, GABA(B)没有显著的变化, GABA(B)受体在早期的显著升高, 到后期相对于基点的没有变化, 其具体的生物学意义尚未可知.
本组研究表明, 建模7 wk时的基因合成最为活跃. 与肝纤维化发生明确相关的α-SMA、TGF-β、胶原Ⅰ和胶原Ⅲ分别增加19.2、2.1、37.5和183.5倍. 可见7 wk是模型组大鼠肝纤维化发生的关键期. 到12 wk初步形成假小叶时, 只有α-SMA和胶原Ⅰ增加显著, TGF-β和胶原Ⅲ变化均不明显, 其中胶原Ⅰ在12 wk时增加20.1倍, 而胶原Ⅲ增加了4.4倍, 由此可见, 在肝纤维化晚期即肝硬化初期, ECM的合成主要以胶原Ⅰ为主, 胶原Ⅲ次之. α-SMA的表达与肝纤维化水平呈正相关, 这与国外的研究结果是一致的[24].
TGF-β是一组具有多种功能的蛋白多肽,已有研究证明, 他在ECM的产生、修饰以及成分的变化、细胞黏附、细胞之间的相互作用中发挥着重要作用. 肝纤维化时, 活化的HSCs是细胞外基质的主要来源, 虽然多种因子参与了HSCs的活化, 但TGF-β是最有效的刺激因子之一. 他有激活HSCs并促使其转化为肌成纤维细胞、合成大量ECM、抑制肝细胞再生、激活转录因子NF-κB, 引起一系列靶基因激活等作用[27-29]. 在CCl4诱导的实验性大鼠肝纤维化模型中, TGF-β在7 wk时明显升高, 达2.1倍, 6 wk模型组TGF-β水平较对照组增加了2.9倍, 可见TGF-β在肝纤维化发生中的重要作用. 理论上CCl4诱导的肝纤维化程度呈进展性发展, HE和马苏染色也揭示了这样的一个过程. 但是7 wk后, TGF-β水平呈下降趋势, 本研究只检测了TGF-β1的表达, 有研究显示TGF-β1主要表达于Kupffer细胞, 其次是星状细胞[30]. 本研究中TGF-β水平和组织纤维化不一致的原因可能与实验中称取的组织部位有关.
本组前期的研究证明, GABA能够影响HSCs的基因表达谱、刺激HSCs增殖相关基因上调[8,11]. 本研究发现, GABA(B)受体基因表达与其他肝纤维化相关基因一样, 在建模6-7 wk的进程中第1次出现表达量升高, 即在肝纤维化的早期, GABA(B)受体一过性升高, 到12 wk时有所下降, 可能GABA(B)受体在肝纤维化的早期促进了相关DNA的合成, Biju et al也发现GABA(B)受体参与了肝细胞DNA的合成, 加入GABA(B)受体激动剂可促进肝细胞DNA的合成[31]. 6 wk时, GABA(B)受体表达水平和对照组相比下降了50%, 提示GABA(B)受体可能对于维持肝细胞的正常生理功能是必要的, 他在肝脏等周边组织中的表达, 也提示他可能具有的重要作用, 但是GABA(B)受体如何影响肝纤维化发生发展, 甚至肝细胞再生等过程, 其具体机制还有待于深入研究.
近年来, 相关证据表明, 肝纤维化甚至早期肝硬化都有逆转的可能. 因此, 揭示肝纤维化的发生机制, 是解决肝病问题的根本所在.
王凯, 教授, 山东大学齐鲁医院肝病科.
GABA是一种抑制性神经递质, 在肝衰及肝性脑病患者血清中GABA水平升高, 已有证据表明GABA与肝性脑病相关, 一些肝病患者往往出现一些神经综合征, 而神经递质如何调控肝脏功能尚属空白.
神经营养因子受体p75NTR对肝脏的保护是近来在神经和肝脏关系方面影响力较大的一篇研究, 研究发现敲除营养因子受体的小鼠肝脏炎症明显加重.
本研究的创新之处在于GABA(B)受体与肝纤维化的关系为国内外首次报道, 结果提示, 在肝纤维化早期GABA(B)受体显著上调, 建模7 wk时达到6 wk的116倍, 其上调的生物学意义尚待进一步研究.
本研究初步发现GABA(B)受体在肝纤维化早期表达增加, 其具体的生物学意义尚未明确, 本课题组将通过进一步的动物实验来深入探讨GABA(B)受体在肝纤维化中的调节机制, 从而为抗纤维化药物的研制提供新的靶点.
细胞外基质(ECM): 是由大分子构成的错综复杂的网络. 为细胞的生存及活动提供适宜的场所, 并通过信号转导系统影响细胞的形状、代谢、功能、迁移、增殖和分化.
本文选题明确, 设计思路清晰合理, 具有一定的创新性, 实验方法简单可靠, 文题较准确反映了研究工作的科学问题和特定内容, 可读性强.
编辑: 李军亮 电编:吴鹏朕
| 1. | 李 才. 器官纤维化基础与临床. 第1版. 北京: 人民卫生出版社 2003; 52. |
| 2. | Bonis PA, Friedman SL, Kaplan MM. Is liver fibrosis reversible? N Engl J Med. 2001;344:452-454. [PubMed] [DOI] |
| 3. | Bataller R, Brenner DA. Liver fibrosis. J Clin Invest. 2005;115:209-218. [PubMed] |
| 4. | Kisseleva T, Brenner DA. Hepatic stellate cells and the reversal of fibrosis. J Gastroenterol Hepatol. 2006;21 Suppl 3:S84-S87. [PubMed] [DOI] |
| 5. | Reeves HL, Friedman SL. Activation of hepatic stellate cells--a key issue in liver fibrosis. Front Biosci. 2002;7:d808-d826. [PubMed] [DOI] |
| 6. | Moreira RK. Hepatic stellate cells and liver fibrosis. Arch Pathol Lab Med. 2007;131:1728-1734. [PubMed] [DOI] |
| 7. | Kisseleva T, Brenner DA. Role of hepatic stellate cells in fibrogenesis and the reversal of fibrosis. J Gastroenterol Hepatol. 2007;22 Suppl 1:S73-S78. [PubMed] [DOI] |
| 9. | Bettler B, Kaupmann K, Mosbacher J, Gassmann M. Molecular structure and physiological functions of GABA(B) receptors. Physiol Rev. 2004;84:835-867. [PubMed] [DOI] |
| 10. | Castelli MP, Ingianni A, Stefanini E, Gessa GL. Distribution of GABA(B) receptor mRNAs in the rat brain and peripheral organs. Life Sci. 1999;64:1321-1328. [PubMed] [DOI] |
| 12. | Friedman SL. Hepatic stellate cells: protean, multifunctional, and enigmatic cells of the liver. Physiol Rev. 2008;88:125-172. [PubMed] [DOI] |
| 13. | Carpino G, Morini S, Ginanni Corradini S, Franchitto A, Merli M, Siciliano M, Gentili F, Onetti Muda A, Berloco P, Rossi M. Alpha-SMA expression in hepatic stellate cells and quantitative analysis of hepatic fibrosis in cirrhosis and in recurrent chronic hepatitis after liver transplantation. Dig Liver Dis. 2005;37:349-356. [PubMed] [DOI] |
| 14. | Nouchi T, Tanaka Y, Tsukada T, Sato C, Marumo F. Appearance of alpha-smooth-muscle-actin-positive cells in hepatic fibrosis. Liver. 1991;11:100-105. [PubMed] |
| 16. | Campollo O, MacGillivray BB, McIntyre N. [Association of plasma ammonia and GABA levels and the degree of hepatic encephalopathy]. Rev Invest Clin. 1992;44:483-490. [PubMed] |
| 17. | Dubuisson L, Desmouliere A, Decourt B, Evade L, Bedin C, Boussarie L, Barrier L, Vidaud M, Rosenbaum J. Inhibition of rat liver fibrogenesis through noradrenergic antagonism. Hepatology. 2002;35:325-331. [PubMed] [DOI] |
| 18. | Oben JA, Roskams T, Yang S, Lin H, Sinelli N, Torbenson M, Smedh U, Moran TH, Li Z, Huang J. Hepatic fibrogenesis requires sympathetic neurotransmitters. Gut. 2004;53:438-445. [PubMed] [DOI] |
| 19. | Sato M, Suzuki S, Senoo H. Hepatic stellate cells: unique characteristics in cell biology and phenotype. Cell Struct Funct. 2003;28:105-112. [PubMed] [DOI] |
| 20. | Oben JA, Yang S, Lin H, Ono M, Diehl AM. Norepinephrine and neuropeptide Y promote proliferation and collagen gene expression of hepatic myofibroblastic stellate cells. Biochem Biophys Res Commun. 2003;302:685-690. [PubMed] [DOI] |
| 21. | Passino MA, Adams RA, Sikorski SL, Akassoglou K. Regulation of hepatic stellate cell differentiation by the neurotrophin receptor p75NTR. Science. 2007;315:1853-1856. [PubMed] [DOI] |
| 22. | Cousins MS, Roberts DC, de Wit H. GABA(B) receptor agonists for the treatment of drug addiction: a review of recent findings. Drug Alcohol Depend. 2002;65:209-220. [PubMed] [DOI] |
| 23. | Gambardella A, Manna I, Labate A, Chifari R, La Russa A, Serra P, Cittadella R, Bonavita S, Andreoli V, LePiane E. GABA(B) receptor 1 polymorphism (G1465A) is associated with temporal lobe epilepsy. Neurology. 2003;60:560-563. [PubMed] |
| 24. | Sindrup SH, Jensen TS. Pharmacotherapy of trigeminal neuralgia. Clin J Pain. 2002;18:22-27. [PubMed] [DOI] |
| 25. | Wang T, Huang W, Chen F. Baclofen, a GABAB receptor agonist, inhibits human hepatocellular carcinoma cell growth in vitro and in vivo. Life Sci. 2008;82:536-541. [PubMed] [DOI] |
| 26. | Akpolat N, Yahsi S, Godekmerdan A, Yalniz M, Demirbag K. The value of alpha-SMA in the evaluation of hepatic fibrosis severity in hepatitis B infection and cirrhosis development: a histopathological and immunohistochemical study. Histopathology. 2005;47:276-280. [PubMed] [DOI] |
| 29. | Inagaki Y, Okazaki I. Emerging insights into Transforming growth factor beta Smad signal in hepatic fibrogenesis. Gut. 2007;56:284-292. [PubMed] [DOI] |
| 30. | De Bleser PJ, Niki T, Rogiers V, Geerts A. Transforming growth factor-beta gene expression in normal and fibrotic rat liver. J Hepatol. 1997;26:886-893. [PubMed] [DOI] |
| 31. | Biju MP, Pyroja S, Rajeshkumar NV, Paulose CS. Enhanced GABA(B) receptor in neoplastic rat liver: induction of DNA synthesis by baclofen in hepatocyte cultures. J Biochem Mol Biol Biophys. 2002;6:209-214. [PubMed] [DOI] |