修回日期: 2009-08-15
接受日期: 2009-08-17
在线出版日期: 2009-08-28
目的: 探讨TGF-β1、TGF-β1R siRNA联合应用对小鼠急性肝损伤TGF-β/Smad信号传导通路的干预作用.
方法: 清洁级健康大鼠36只分为2组: 正常对照组(n = 6, 注射生理盐水)与实验组(n = 30). 实验组动物在实验第1天和第5天腹腔注射CCl4花生油溶液6 mL/kg, 造成急性肝损伤并启动TGF-β/Smad信号传导通路. 实验分为TGF-β1 shRNA干预组(T); TGF-β1 siRNA+TβRⅠshRNA干预组(T+R1); TGF-β1 shRNA+TβRⅡ siRNA干预组(T+R2); TGF-β1 siRNA+TβRⅠshRNA+TβRⅡ shRNA干预组(T+R1+R2)和模型对照组(M). 观察各实验组血清ALT、AST、HA; 肝组织学RT-PCR和免疫组织化学检测肝组织中α-SMA、COL-1、COL-3、TGF-β1、Smad3、PCNA和TGF-α mRNA及蛋白的表达.
结果: 经shRNA质粒DNA干预的4个治疗组与模型组比较, 均能显著降低血清ALT, AST及HA的水平(ALT: 592.80±98.4 IU/L, 440.80±91.9 IU/L, 461.61±120.0 IU/L, 284.00±49.0 IU/L vs 949.5±196.1 IU/L; AST: 686.80±112.3 IU/L, 591.00±99.87 IU/L, 607.50±84.8 IU/L, 398.30±61.9 IU/L vs 985.67±274.8 IU/L; HA: 5682.80±824.14 µg/L, 2871.26±394.68 µg/L, 3004.29±354.25 µg/L, 1982.12±402.71 µg/L vs 8444.65±812.15 µg/L, P<0.05)的测定值; 4个治疗组两两比较, T+R1+R2组疗效明显高于其他3组(P<0.01). 与模型组比较. shRNA质粒DNA干预能明显抑制TGF-β1, Smad3, α-SMA, COL-1及COL-3的mRNA与蛋白的表达(均P<0.05). 其抑制效果以T+R1+R2组最明显. 对蛋白水平表达的作用也有相似趋势.
结论: 针对TGF-βRⅠ及其Ⅰ型受体(TβR Ⅰ)、Ⅱ型受体(TβRⅡ)的siRNA联合治疗对小鼠肝损伤中TGF-β/Smad信号传导通路相关的基因表达的抑制具有协同作用.
引文著录: 黄顺玲, 谭德明, 张涛, 彭忠田, 孙克伟, 刘菲, 傅荣泉, 郭光辉. 联合应用TGF-β、TGF-βR siRNA对小鼠急性肝损伤TGF-β/Smad信号传导通路相关基因表达的抑制. 世界华人消化杂志 2009; 17(24): 2444-2450
Revised: August 15, 2009
Accepted: August 17, 2009
Published online: August 28, 2009
AIM: To investigate the inhibitory effect of combined use of small interfering RNAs (siRNAs) specific for transforming growth factor beta 1 (TGF-β1) and transforming growth factor beta 1 receptors (TGF-β1 RI and TGF-β1 RII) on the TGF-β/Smad signaling pathway in rats with acute liver injury.
METHODS: Thirty rats were given two intraperitoneal injections of carbon tetrachloride (CCl4; 6 mL/kg) to induce acute liver injury and initiate the TGF-β/Smad signaling pathway. The rats were then divided into five groups: TGF-β1 siRNA intervention group (T), TGF-β1 siRNA plus TGF-β1 RI siRNA intervention group (T+R1), TGF-β1 siRNA plus TGF-β1 RII siRNA intervention group (T+R2), TGF-β1 siRNA plus TGF-β1 RI siRNA plus TGF-β1 RII siRNA intervention group (T+R1+R2) and model control group (M). Serum samples were taken to determine serum ALT, AST and HA. The pathological changes in the liver were evaluated by HE staining. Quantitative detection of α-SMA, collagen I and III, TGF-β1, Smad3, PCNA and TGF-α mRNAs was performed by RT-PCR. The expression of α-SMA, collagen I and III, TGF-β1, Smad3, PCNA and TGF-α in the liver was detected by immunohistochemistry.
RESULTS: After acute liver injury rats were transfected with plasmids harboring specific siRNA, serum ALT, AST and HA levels compared with that of model control group decreased significantly (ALT: 592.80 ± 98.4 IU/L, 440.80 ± 91.9 IU/L, 461.61 ± 120.0 IU/L, 284.00± 49.0 IU/L vs 949.5 ± 196.1 IU/L; AST: 686.80 ± 112.3 IU/L, 591.00 ± 99.87 IU/L, 607.50 ± 84.8 IU/L, 398.30 ± 61.9 IU/L vs 985.67 ± 274.8 IU/L and HA: 5682.80 ± 824.14 µg/L, 2871.26 ± 394.68 µg/L, 3004.29 ± 354.25 µg/L, 1982.12 ± 402.71 µg/L vs 8444.65 ± 812.15 µg/L, respectively; all P < 0.05). The best effect was achieved in the T+R1+R2 group. Compared with nonspecific siRNA transfection, siRNAs specific for TGF-β1, TGF-β1 RI and TGF-β1 RII could significantly inhibit the expression of TGF-β1, Smad3, α-SMA, collagen I and collagen III mRNAs in the liver (all P < 0.05). The best effect was achieved in the T+R1+R2 group. Similar results were observed for protein expression.
CONCLUSION: Combined use of siRNAs specific for TGF-β1, TGF-β1 RI and TGF-β1 RII can synergistically inhibit the TGF-β/Smad signaling pathway and reduce liver injury in rats with acute liver injury.
- Citation: Huang SL, Tan DM, Zhang T, Peng ZT, Sun KW, Liu F, Fu RQ, Guo GH. Combined use of siRNAs specific for TGF-β1, TGF-β1 RI and TGF-β1 RII synergistically inhibits the TGF-β/Smad signaling pathway in rats with acute liver injury. Shijie Huaren Xiaohua Zazhi 2009; 17(24): 2444-2450
- URL: https://www.wjgnet.com/1009-3079/full/v17/i24/2444.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i24.2444
我国是慢性病毒性肝炎(包括乙型和丙型肝炎)高发生率地区, 慢性肝炎常伴有肝纤维化, 他是各种慢性肝病发展为肝硬化、肝癌的必经病理过程[1]. 体外研究和肝硬化动物模型研究表明乙型肝炎病毒和血吸虫均能促进转化生长因子-β(transforming growth factor β, TGF-β)表达[2-4], TGF-β/Smad信号传导通路与肝纤维化的发生、发展密切相关, 是肝纤维化发生的主要信号传导途径[5-8]. 利用RNA干扰(RNA interference, RNAi)高效沉默靶基因的原理, 阻断纤维化的关键环节TGF-β/Smad信号传导通路及相应的调节基因的表达, 应能够高效阻断或逆转肝纤维化. 本文联合应用特异性沉默TGF-β1和TGF-β1受体(transforming growth factor-beta1 receptor, TGF-β1R)的shRNA治疗肝纤维化早期的大鼠模型, 探讨这些特异性shRNA单独和联合应用对TGF-β/Smad信号传导通路及相应的调节基因的表达的影响.
清洁级健康SD大鼠36只, 体质量300±50 g, 雌雄各半, 由湖南农业大学动物实验中心提供(合格证号sck(湘)2003-0003); 表达TGF-β1, TβRⅠ和TβRⅡ siRNA质粒DNA: 采用pGenesil-1 vector与目的基因(表1)重组, 由武汉晶赛生物工程技术有限公司构建重组质粒TGF-β1/pGenesil-1, TβRⅠ/pGenesil-1和TβRⅡ shRNA/pGenesil-1以及placeb/pGenesil-1; 分析纯CCl4, 无水乙醇(湖南师大化学试剂厂); Regaud苏木素染液, 酸性品红染液(BASO公司); 兔抗大鼠TGF-β1、Smad3、COL-1、COL-3、TGF-α、PCNA亲和抗体(武汉博士德生物工程有限公司); 抗鼠α-SMA(DATA SHEET公司); SABC试剂盒(武汉博士德生物工程有限公司); RT-PCR引物(表2, 日本TaKaRas生物技术有限公司合成); RT-PCR反应体系(Promega, USA).
| 基因 | siRNA基因序列 |
| TGF-β1 | |
| 正义链: 5'-GUCAACUGUGGAGCAACACDTDT-3' | |
| 反义链: 5'-GUGUUGCUCCACAGUUGACDTDT-3' | |
| TβRⅠ | |
| 正义链: 5'-AGUCGGUUAACAGCGAUCU-3' | |
| 反义链: 5'-UUUCAGCCAAUUGUCGCUAGA-3' | |
| TβRⅡ | |
| 正义链: 5'-GUCUUGCAUGAGCAACUGC-3' | |
| 反义链: 5'-UUCAGAACGUACUCGUUGACG-3' | |
| 无关siRNA | |
| 正义链: 5'-GACUUCAUAAGGCGCAUGC-3' | |
| 反义链: 5'-UUCUGAAGUAUUCCGCGUACG-3' |
| 名称 | 引物序列 | PCR产物(bp) |
| α-SMA | ACT GGG ACG ACA TGG AAA AG | 368 |
| GAT GGA TGG GAA AAC AGC C | ||
| Ⅰ型胶原 | CAT AAA GGG TCA TCG TGG CTT C | 789 |
| GTG ATA GGT GAT GTT CTG GGA G | ||
| Ⅲ型胶原 | AAC CCA GTA TTC TCC ACT CTT | 349 |
| CGA GGT AAC AGA GGT GAA AGA | ||
| TGF-β1 | CAA AGA CAT CAC ACA CAG TA | 441 |
| AGG TGT TGA GCC CTT TCC AG | ||
| Smad3 | AAG GGC GAG CAG AAC GGG | 425 |
| GGG ATG GAA TGG CTG TAG TC | ||
| PCNA | AAC TTG GAA TCC CAG AAC A | 293 |
| AGA CAG TGG AGT GGC TTT T | ||
| TGF-α | ACC TGC AGG TTT TTG GTG CAG | 239 |
| GCA GAC GAG GGC ACG GCA CCA | ||
| GAPDH | GGT GAA GGT CGG TGT GAA CGG A | 245 |
| TGT TAG TGG GGT CTC GCT CCT G | ||
| β-actin | GCT GTC CCT GTA TGC CTC T | 461 |
| GGT CTT TAC GGA TGT CAA CG |
1.2.1 分组及给药: 清洁级健康大鼠36只分正常对照组(n = 6, 注射生理盐水)和实验组(n = 30). 实验组动物在实验当天和第5天腹腔注射CCl4花生油溶液6 mL/kg, 造成急性肝损伤并启动TGF-β/Smad信号传导通路. 在完成第2次CCl4腹腔注射后, 尾静脉注射shRNA质粒DNA溶液50 µg/2 mL; 实验组分为: TGF-β1 shRNA干预组(T); TGF-β1 siRNA+TβRⅠshRNA干预组(T+R1); TGF-β1 shRNA+TβRⅡ siRNA干预组(T+R2); TGF-β1 siRNA+TβRⅠshRNA+TβRⅡ shRNA干预组(T+R1+R2)和模型对照组(M): 注射placeb/pGenesil-1质粒DNA. 尾静脉注射shRNA质粒DNA溶液48 h后处死动物, 取血清和肝组织待检测.
1.2.2 血清ALT、AST和血清透明质酸(hyaluronic acid, HA)检测和肝组织病理学观察: 血清ALT、AST检测采用全自动生化分析仪测定; HA检测采用放射免疫分析法(RIA)检测; 肝组织标本用100 g/L中性甲醛固定, 石蜡包埋, 按常规方法进行组织病理学检查.
1.2.3 RT-PCR检测肝组织中α-SMA、COL-1、COL-3、TGF-β1、Smad3、PCNA和TGF-α mRNA的表达: 将超低温冰箱冷冻的肝组织100 mg, 放入经DEPC处理过的玻璃匀浆器中, 组织磨碎后加1 mL TRIzol将组织充分匀浆, 并提取肝组织总RNA. 应用M-MLV RT反应系统和Oligo(dT)合成cDNA. 然后经特异性引物聚合酶链反应(PCR)扩增相应的cDNA. PCR条件: 预变性95℃, 5 min; 变性94℃, 30 s, 退火58℃, 30 s, 延伸72℃, 30 s, 共30个循环, 最后72℃, 10 min. PCR产物电泳并经凝胶电泳处理系统扫描半定量分析. 用凝胶图像分析系统检测灰度值.
1.2.4 免疫组织化学检测肝组织中α-SMA、COL-1、COL-3、TGF-β1、Smad3、PCNA和TGF-α蛋白的表达: 经100 g/L甲醛液固定, 石蜡包埋肝组织标本常规切片、脱蜡、30 mL/L双氧水溶液灭活内源性过氧化物酶和经正常山羊血清封闭液封闭. 处理过的肝组织切片先后与抗原特异性一抗(α-SMA、COL-1、COL-3、TGF-β1、Smad3、PCNA和TGF-α), 37℃, 孵育30 min后4℃过夜; 生物素二抗37℃, 恒温30 min; 亲和素一过氧化酶溶液37℃, 20 min; DAB显色和苏木素复染; 中性树胶封片镜检, 并用全自动图像分析仪计算α-SMA、COL-1、COL-3、TGF-β1、Smad3、PCNA和TGF-α的阳性信号和相对含量.
统计学处理 采用SPSS13.0统计软件. 先进行正态性分布及方差齐性检验, 若呈正态分布, 方差齐, 各组之间采用多重比较: 各治疗组分别与模型组比较时采用Dunnett法; 各治疗组间比较采用Sidak法. 方差不齐者进行H检验. P<0.05认为有统计学意义.
模型组与空白对照组比较, ALT(949.5±196.1 IU/L vs 52.7±11.0 IU/L)、AST(985.67±274.8 IU/L vs 108.8±20.4 IU/L及HA(8444.65±812.15 µg/L vs 111.45±24.24 µg/L)测定值的差异有显著性意义(P<0.01). 经shRNA质粒DNA干预的4个治疗组与模型组比较, 均能显著降低血清ALT(P<0.05)、AST(P<0.05)及HA(P<0.05)的测定值(表3); 4个治疗组两两比较, T+R1+R2组疗效明显高于其他3组, T组疗效最差(P<0.05, 表3), T+R1组与T+R2组疗效差异没有统计学意义(P>0.05, 表3).
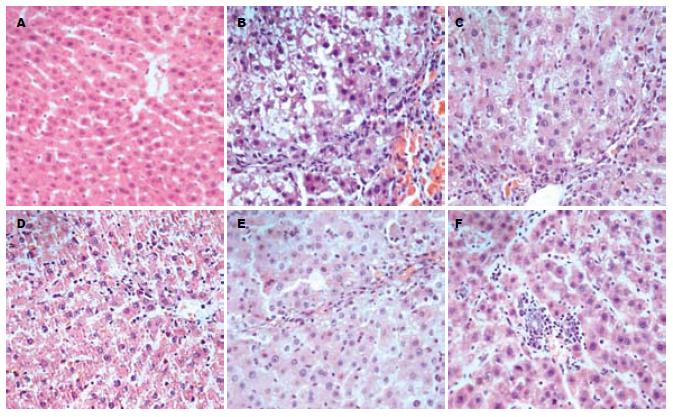
各治疗组相对模型组, 肝组织损伤及纤维增生情况明显减轻, 可见肝细胞再生及胆小管的增生, 肝细胞病变以胞质疏松、脂肪变性及炎性细胞浸润为主, 纤维增生少见; 各治疗组间T+R1+R2组肝组织学的改善明显好于其他3组, T组肝组织情况相对最差, T+R1组与T+R2组比较差别不明显(图1).
α-SMA、COL-1、COL-3、TGF-β1、Smad3 mRNA的表达的结果显示, 模型组与空白对照组比较mRNA的表达明显增强; 4个治疗组与模型组比较, mRNA的表达明显下降; 4个治疗组之间, mRNA的表达量以T组>T+R1组 = T+R2组>T+R1+R2组. PCNA和TGF-α mRNA的表达显示, 模型组与空白对照组比较mRNA的表达无明显差别; 4个治疗组之间, mRNA的表达强度以T+R1+R2组>T+R1组 = T+R2>T组(表4).
| 分组 | α-SMA | COL-1 | COL-3 | TGF-β1 | Smad3 | PCNA | TGF-α |
| N组 | 0.02±0.01 | 0.04±0.03 | 0.11±0.04 | 0.22±0.03 | 0.18±0.05 | 0.29±0.06 | 0.31±0.06 |
| M组 | 0.91±0.26b | 0.87±0.11b | 0.95±0.16b | 0.96±0.11b | 0.91±0.15b | 0.30±0.07 | 0.25±0.04 |
| T组 | 0.65±0.14c | 0.55±0.10c | 0.71±0.11c | 0.78±0.10c | 0.67±0.13c | 0.43±0.11c | 0.42±0.09c |
| T+R1组 | 0.43±0.08c | 0.40±0.08c | 0.55±0.06c | 0.65±0.09c | 0.41±0.08c | 0.59±0.12c | 0.64±0.11c |
| T+R2组 | 0.41±0.07c | 0.38±0.09c | 0.53±0.05c | 0.63±0.10c | 0.42±0.07c | 0.58±0.08c | 0.59±0.15c |
| T+R1+R2组 | 0.26±0.09ce | 0.20±0.06ce | 0.28±0.06ce | 0.48±0.06ce | 0.28±0.04ce | 0.72±0.14ce | 0.76±0.15ce |
免疫组织化学检测的结果表明: 肝细胞内所检测的蛋白表达, 以细胞质或细胞核及部分细胞膜, 呈界限清楚的棕黄色或深棕色反应为阳性细胞. 与空白组比较, 模型组α-SMA、COL-1、COL-3、TGF-β1、Smad3蛋白在炎性细胞浸润区、坏死灶、汇管区及纤维间隔等地方的阳性细胞表达明显增强, PCNA、TGF-α的阳性细胞表达差别不明显; 各治疗组与模型组比较, α-SMA、COL-1、COL-3、TGF-β1、Smad3蛋白阳性细胞染色强度明显下降; 而PCNA、TGF-α蛋白的阳性细胞表达明显增强; 各治疗组间比较, α-SMA、COL-1、 COL-3、TGF-β1、Smad3蛋白的阳性细胞表达强度以T组>T+R1组 = T+R2组>T+R1+R2组; PCNA、TGF-α蛋白的阳性细胞表达强度以T+R1+R2组>T+R1组 = T+R2组>T组(表5).
| 分组 | α-SMA | COL-1 | COL-3 | TGF-β1 | Smad3 | PCNA | TGF-α |
| N组 | 29.3±9.1 | 62.1±14.9 | 80.7±17.2 | 44.9±12.3 | 65.6±11.6 | 73.5±11.6 | 65.9±13.7 |
| M组 | 634.7±33.9b | 457.4±31.7b | 515.2±31.3b | 589.1±38.9b | 482.9±31.2b | 79.6±12.4 | 74.7±15.9 |
| T组 | 489.4±24.5c | 321.8±21.6c | 386.9±26.7c | 434.8±31.0c | 367.1±27.6c | 347.5±25.1c | 343.2±25.7c |
| T+R1组 | 401.6±17.8c | 225.2±16.9c | 302.4±22.7 | 343.8±25.0c | 282.7±23.1c | 436.8±26.2c | 429.6±26.1c |
| T+R2组 | 394.5±16.2c | 237.7±15.9c | 298.3±21.3c | 361.4±24.7c | 286.0±22.1c | 431.8±23.6c | 446.3±23.3c |
| T+R1+R2组 e | 297.1±13.5c | 151.4±12.6ce | 214.5±19.5ce | 285.6±22.1ce | 205.7±16.8ce | 501.3±22.9ce | 512.5±21.7ce |
肝纤维化是指由多种慢性疾病引起的肝脏持续的创伤修复反应而导致的细胞外基质(extracellular matrix, ECM)过度沉积和肝脏功能的受损. 对肝纤维化的细胞及分子机制研究表明, 多种细胞和细胞因子参与肝纤维化形成的病理生理过程, 其中TGF-β被认为是最关键的细胞因子[9-10].
TGF-β来源广泛, 肝星状细胞(hepatic stellate cells, HSCs)、Kupffer细胞、内皮细胞、肝细胞等都可以分泌. 目前认为TGF-β至少有6种亚型, 哺乳动物主要是TGF-β1-3 3种亚型, 其中TGF-β1与肝纤维化的发生和发展的关系最为密切. TGF-β1是促进肝纤维化形成过程中主要细胞, HSCs的增殖和产生ECM, 形成肝纤维化, 破坏肝组织结构, 乃至肝硬化, 也能增强HSCs的移行能力[11-12]. 有研究表明, HSCs受TGF-β1刺激活化后, 其移动能力增加4.1倍[12]. HSCs移动更促进了肝纤维化形成的范围和程度[12-13].
TGF-β1激活HSCs, 启动和形成肝纤维化的过程有赖于信号传导通路的通畅. TGF-β1信号转导主要通过受体丝氨酸/酪氨酸激酶途径及胞内的Smad蛋白途径, 后者被认为是介导TGF-β信号进入细胞核内的最主要途径[9,14-15]. TGF-β1必须通过其特异的膜受体结合后, 其生物信息才能通过Smad蛋白信号传递途径下传, 激活靶细胞, 发挥生物学效应. 目前已确定TGF-β1有TβRⅠ、TβRⅡ、TβRⅢ 3种受体, 其中TβRⅠ、TβRⅡ在传导TGF-β1作用的信号通道中起主要作用, 两者缺一不可. 在TGF-β信号传导通路中, TGF-β1必须首先与TβRⅡ结合, 结合后的受体配体复合物再导致TβRⅠ的活化, 产生病理生理效应[16]; Smads是TGF-β1受体唯一的作用底物, 是一族传递TGF-β信号的分子. 根据Smad蛋白在TGF-β信号转导中的作用, 可将其分为3类: (1)膜受体激活的Smads(receptor-activated Smads, R-Smads), 包括Smad 1, 2, 3, 5和8; (2)通用Smad(common mediator Smads, Co-Smad), 目前发现的只有Smad4; (3)抑制性Smad(inhibitory Smads, I-Smads), 包括Smad6、7, 为TGF-β/Smad信号通路的抑制分子. TGF-β与其受体结合后可激活Smad2和Smad3并磷酸化, 其与Smad4形成异源三聚体复合物易位入核, 与DNA结合, 通过和转录因子的相互作用调节靶基因表达, 活化HSCs[14,17].
针对肝纤维化的发病机制和病理生理基础, 对肝纤维化, 乃至肝硬化的治疗有了很大的进展. 临床上, 有大量的证据说明针对慢性乙型肝炎的抗病毒治疗能阻断肝纤维化的病程进展, 甚至能逆转肝纤维化程度[18-19]. Moucari et al[20]对接受干扰素治疗获得了持续病毒学应答(sustained virological response; SVR)的25例HBeAg阳性的慢性乙型肝炎患者进行了长达14年的随访, 随访结束后64%患者获得了HBsAg血清转换, 发生了HBsAg血清转换的患者中70%的患者肝纤维化得到了明显的改善. Lin et al[21]对台湾接受干扰素治疗的慢性乙型肝炎的患者进行了15年的随访也得到了相似的结果, 肝硬化的发生率在干扰素治疗组为17.8%, 明显低于未用干扰素治疗的对照组(33.7%). Liaw et al[22]报道长期应用拉米夫定治疗肝炎肝硬化患者能明显延缓病情进展和肝硬化并发症及肝癌的发生率. 治疗3年后治疗组的病情明显进展及肝癌的累计发生率分别为7.8%和3.4%, 明显的低于安慰剂治疗组的17.7%和7.4%. 除病原治疗能明显延缓肝纤维化的进展, 甚至逆转肝纤维化外, 抗肝纤维化的中成药也能改善肝纤维化[23]. 抗肝纤维化的药物, 包括针对TGF-β1的基因治疗, 均能通过减低TGF-β1的表达, 阻断星状细胞的活化和改善肝硬化大鼠模型的病理改变和提高肝硬化大鼠的存活率[24-30]. 本研究组曾报道应用TGF-β1 siRNA能在体外明显减少HSCs Smad3、Smad7 mRNA表达, 并抑制HSCs的活化[31]. 本文的研究也证明TGF-β1 siRNA能减少肝损伤小鼠肝组织中TGF-β1和Smad的表达, 并明显减少了与HSCs活化相关的α-SMA表达和肝纤维化相关的ECM, 如COL-1、COL-3的表达. 这种抑制作用能通过联合应用针对TGF-β1及其受体的siRNA所增强. 研究结果说明TGF-β/Smad信号传导通路在激活HSCs, 启动和促进肝纤维化形成过程中起非常重要的作用. 同时也证明多靶位的TGF-β1、TβRⅠ和TβRⅡ的shRNA的联合应用具有阻断TGF-β/Smad信号传导通路, 抑制HSCs活化和肝纤维化形成的协同或相加作用.
我们同时注意到在本研究的肝损伤动物模型中, 通过TGF-β1、TβRⅠ和TβRⅡ的shRNA对其相应的基因沉默后, 还可以观察到肝细胞内PCNA和TGF-α的表达明显增强. 这两种因子的表达增强均具有促使细胞内DNA的合成, 导致细胞增殖、分化, 从而促进了肝细胞的增殖和修复[32-33]. 因此, 我们的结果提示阻断TGF-β/Smad信号传导不仅具有抗肝纤维化的作用, 而且在急性肝损伤时可能也具促肝细胞增殖的作用. 但针对TGF-β1 shRNA和TβRⅠ、TβRⅡ的shRNA在抗急性肝损伤和促进肝细胞增殖的意义还有待进一步研究.
肝纤维化是各种慢性肝病发展为肝硬化、肝癌的必经病理过程. 体外研究和肝硬化动物模型研究表明, 乙型肝炎病毒和血吸虫均能促进TGF-β表达, TGF-β/Smad信号传导通路是各种致病因子引发肝纤维化的主要的信号传导途径, 与肝纤维化的发生、发展密切相关.
宣世英, 教授, 山东省青岛市市立医院肝病内科; 张绪清, 副教授, 中国人民解放军第三军医大学附属西南医院全军感染病研究所
siRNA技术是基因沉默新的基因抑制治疗技术, 被证明能阻止基因过度表达所致的病理生理反应, 应用TGF-β1 siRNA能减轻肺和肾纤维化.
有研究表明能对肝纤维化治疗有效的药物, 治疗后显示疗效均伴有TGF-β1表达的下降, 一些体外和肝纤维化动物模型的研究表明阻断TGF-β1信号传导, 包括药物, 基因治疗(反义寡核苷酸技术, 缺陷性TGF-β1受体基因表达产物等)均能抑制TGF-β1表达, 阻断TGF-β1信号传导, 伴随着肝脏的细胞外基质减少和肝纤维化的病理学改变.
本文通过应用TGF-β1和其受体的siRNA, 多位点使TGF-β1和其受体表达受到抑制, 阻断TGF-β1的信号传导, 观察多位点阻断.
本研究结果证明多位点的基因沉默具有协同作用. 对于今后在抗肝纤维化的治疗策略中, 如何发挥最大的治疗效应具有指导作用.
本研究立题新颖, 思路清晰, 方法得当, 数据可靠, 引用参考文献合理, 结论对肝脏疾病的治疗有一定的指导意义.
编辑: 李军亮 电编:吴鹏朕
| 2. | 哈 明昊, 饶 慧瑛, 刘 峰, 潘 孝本, 封 波, 陈 红松, 魏 来. 乙型肝炎病毒促进CTGF和TGF-β1在肝星状细胞中的表达. 世界华人消化杂志. 2008;16:924-928. [DOI] |
| 3. | 哈 明昊, 饶 慧瑛, 刘 峰, 潘 孝本, 封 波, 陈 红松, 魏 来. 乙型肝炎病毒促进Ⅰ型胶原和Ⅲ型胶原在肝星状细胞中的表达. 世界华人消化杂志. 2008;16:2031-2035. [DOI] |
| 6. | Tahashi Y, Matsuzaki K, Date M, Yoshida K, Furukawa F, Sugano Y, Matsushita M, Himeno Y, Inagaki Y, Inoue K. Differential regulation of TGF-beta signal in hepatic stellate cells between acute and chronic rat liver injury. Hepatology. 2002;35:49-61. [PubMed] [DOI] |
| 9. | Kong L, Zhang YG, Wang RQ, Yao SK. [The effects of transforming growth factor beta1/Smads signaling pathway changes on the pathogenesis of liver fibrosis]. Zhonghua Ganzangbing Zazhi. 2006;14:842-844. [PubMed] |
| 11. | Bissell DM, Roulot D, George J. Transforming growth factor beta and the liver. Hepatology. 2001;34:859-867. [PubMed] [DOI] |
| 13. | Yang C, Zeisberg M, Mosterman B, Sudhakar A, Yerramalla U, Holthaus K, Xu L, Eng F, Afdhal N, Kalluri R. Liver fibrosis: insights into migration of hepatic stellate cells in response to extracellular matrix and growth factors. Gastroenterology. 2003;124:147-159. [PubMed] [DOI] |
| 14. | Schnabl B, Kweon YO, Frederick JP, Wang XF, Rippe RA, Brenner DA. The role of Smad3 in mediating mouse hepatic stellate cell activation. Hepatology. 2001;34:89-100. [PubMed] [DOI] |
| 15. | Inagaki Y, Mamura M, Kanamaru Y, Greenwel P, Nemoto T, Takehara K, Ten Dijke P, Nakao A. Constitutive phosphorylation and nuclear localization of Smad3 are correlated with increased collagen gene transcription in activated hepatic stellate cells. J Cell Physiol. 2001;187:117-123. [PubMed] [DOI] |
| 16. | Wrana JL, Attisano L, Wieser R, Ventura F, Massagué J. Mechanism of activation of the TGF-β receptor. Nature. 1994;370:341-347. [PubMed] [DOI] |
| 17. | Dooley S, Delvoux B, Streckert M, Bonzel L, Stopa M, ten Dijke P, Gressner AM. Transforming growth factor beta signal transduction in hepatic stellate cells via Smad2/3 phosphorylation, a pathway that is abrogated during in vitro progression to myofibroblasts. TGFbeta signal transduction during transdifferentiation of hepatic stellate cells. FEBS Lett. 2001;502:4-10. [PubMed] [DOI] |
| 18. | European Association For The Study Of The Liver. EASL Clinical Practice Guidelines: management of chronic hepatitis B. J Hepatol. 2009;50:227-242. [PubMed] [DOI] |
| 19. | Lok AS, McMahon BJ. Chronic hepatitis B. Hepatology. 2007;45:507-539. [PubMed] [DOI] |
| 20. | Moucari R, Korevaar A, Lada O, Martinot-Peignoux M, Boyer N, Mackiewicz V, Dauvergne A, Cardoso AC, Asselah T, Nicolas-Chanoine MH. High rates of HBsAg seroconversion in HBeAg-positive chronic hepatitis B patients responding to interferon: a long-term follow-up study. J Hepatol. 2009;50:1084-1092. [PubMed] [DOI] |
| 21. | Lin SM, Yu ML, Lee CM, Chien RN, Sheen IS, Chu CM, Liaw YF. Interferon therapy in HBeAg positive chronic hepatitis reduces progression to cirrhosis and hepatocellular carcinoma. J Hepatol. 2007;46:45-52. [PubMed] [DOI] |
| 22. | Liaw YF, Sung JJ, Chow WC, Farrell G, Lee CZ, Yuen H, Tanwandee T, Tao QM, Shue K, Keene ON. Lamivudine for patients with chronic hepatitis B and advanced liver disease. N Engl J Med. 2004;351:1521-1531. [PubMed] [DOI] |
| 23. | 刘 平, 胡 义扬, 刘 成, 徐 列明, 刘 成海, 孙 克伟, 胡 德昌, 尹 有宽, 周 霞秋, 万 谟彬. 扶正化瘀胶囊干预慢性乙型肝炎肝纤维化作用的多中心临床研究. 中西医结合学报. 2003;1:89-98, 102. |
| 24. | 付 德才, 杨 世忠, 孙 钰玮, 于 春艳, 毛 丽珍, 姜 相莲, 关 瑞锋. 甲珠对肝纤维化大鼠α-SMA和TGF-β1表达的影响. 世界华人消化杂志. 2008;16:253-258. [DOI] |
| 26. | 齐 晓艳, 高 润平, 王 淑华, 张 瑞娟, 包 万国, 金 清龙, 辛 桂杰, 杨 永广. 靶向CTGF锤头核酶对TGF-β1作用下人肝星状细胞合成Ⅰ型胶原的作用. 世界华人消化杂志. 2008;16:2587-2591. [DOI] |
| 27. | 陈 益平, 卢 朝升, 汪 洪姣, 徐 志伟, 陈 均亚, 石 海矾, 狄 军波. 肝素对大鼠肝星状细胞中转化生长因子β1和Ⅰ型胶原的影响. 世界华人消化杂志. 2007;15:3629-3632. [DOI] |
| 28. | 甄 茂川, 王 效民, 尹 震宇, 汪 谦, 刘 平果, 吴 国洋, 俞 可克, 李 岗山. EGCG对肝纤维化大鼠TGF-β1和CTGF表达的影响. 世界华人消化杂志. 2008;16:3828-3834. [DOI] |
| 32. | Waseem NH, Lane DP. Monoclonal antibody analysis of the proliferating cell nuclear antigen (PCNA). Structural conservation and the detection of a nucleolar form. J Cell Sci. 1990;96:121-129. [PubMed] |