修回日期: 2008-11-30
接受日期: 2008-12-01
在线出版日期: 2009-01-18
目的: 构建靶向肝癌HepG2细胞VEGF基因的siRNA表达载体并在体外检测其对VEGF基因表达的抑制作用.
方法: 设计合成靶向HepG2细胞VEGF基因的siRNA cDNA序列并与pSUPER载体连接, 构建VEGF siRNA表达载体, 经酶切鉴定和测序确认后, 脂质体2000介导VEGF siRNA转染HepG2细胞. RT-PCR及Western blot检测VEGF siRNA表达载体转染的HepG2细胞中VEGF基因表达.
结果: 通过双酶切鉴定和测序分析, 成功构建了靶向HepG2细胞VEGF基因的siRNA表达载体. RT-PCR和Western blot法检测转染VEGF siRNA表达载体的HepG2细胞VEGF mRNA及VEGF165表达下调, 其抑制率分别为65%和74%. 实验组中的HepG2中VEGF mRNA表达较阴性对照组、空载体组表达量显著下降(0.304±0.062 vs 0.896±0.061, 0.884±0.074, P<0.05).
结论: 成功构建了靶向肝癌HepG2细胞VEGF基因的siRNA表达载体, 且该载体在体外能有效抑制HepG2细胞VEGF基因表达.
引文著录: 黄秋林, 于永政, 阳勇, 吕忠诚. 靶向肝癌HepG2细胞VEGF基因的siRNA表达载体构建及体外抑制作用. 世界华人消化杂志 2009; 17(2): 186-189
Revised: November 30, 2008
Accepted: December 1, 2008
Published online: January 18, 2009
AIM: To construct vascular endothelial growth factor (VEGF) siRNA expression vector and to evaluate its inhibitory effect on VEGF in HepG2 cells.
METHODS: Sequencer of a short hairpin RNA targeting VEGF of HepG2 cells was designed and synthesized. pSUPER-VEGF-siRNA was constructed and transfected to HepG2 cells by lipofectamine 2000. The expression of VEGF protein in HepG2 cells transfected with pSUPER-VEGF-siRNA was detected using RT-PCR and Western blot.
RESULTS: After evaluation and sequencing, pSUPER-VEGF-siRNA expression vector was successfully constructed. The expressions of VEGF mRNA and VEGF165 protein were decreased markedly after pSUPER-VEGF-siRNA transfection using lipofectamine 2000 and the inhibitive ratio was 65% and 74%, respectively; expressions of VEGF mRNA was lower in experimental group than negative control group and empty vector group (0.304 ± 0.062 vs 0.896 ± 0.061, 0.884 ± 0.074, P < 0.05).
CONCLUSION: VEGF siRNA expression vector (pSUPER-VEGF-siRNA) is successfully constructed which can significantly inhibit VEGF gene expression in HepG2 cells.
- Citation: Huang QL, Yu YZ, Yang Y, Lv ZC. Construction of VEGF siRNA expression vector and its inhibition to VEGF in HepG2 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 186-189
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/186.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.186
血管内皮细胞生长因子(vascular endothelialcell growth factor, VEGF)是目前已知在原发性肝癌(hepatocellular carcinoma, HCC)血管生成中作用最强的血管生成诱导因子, 可通过作用于血管内皮细胞、提高血管的通透性、促进肝癌细胞的增值来促进肝癌的发生、发展、转移. 因此, 抑制VEGF基因的表达可望抑制肝癌细胞的增殖、转移. 本研究以VEGF为靶点, 体外构建VEGF siRNA表达载体, 并转染HepG2细胞, 研究其对HepG2细胞VEGF基因表达的抑制作用.
细胞株HepG2由中南大学肿瘤研究所黄建惠赠, 大肠杆菌DH5α购自上海捷瑞公司, 逆转录病毒载体pSUPER.retro.neo由荷兰莱顿大学Yvonne教授惠赠. 寡核苷酸片段、PCR引物由上海生工公司合成; 逆转录试剂盒、即用型PCR试剂盒、TRIzol购自上海生工公司; T4 DNA连接酶、限制性内切酶, 购自美国MBI公司; 质粒抽提试剂盒、凝胶DNA回收试剂盒, 购自上海捷瑞公司; 兔抗人VEGF165 mAb、羊抗人b-actin多克隆抗体购自天津灏洋公司; 辣根过氧化物酶羊抗兔二抗、辣根过氧化物酶鼠抗羊二抗购自美国Santa Cruz公司; PVDF膜购自美国Roche公司.
1.2.1 VEGF基因特异的siRNA表达载体构建: 根据已知GenBank VEGF mRNA序列和siRNA的设计原则, 设计并合成VEGF基因RNAi靶序列(5'-GATCCCCTCATCACGAAGTGGTGAAGttcaagagaCTTCACCACTTCGT GATGATTTTTGGAAA-3')和一条阴性对照序列(即无关序列: 5'-GATCCCCGTGAGATCGTAGTGCGTGAttcaagagaTCACGCACTACGATCTCACTTTTTGGAAA-3')及其互补的反义链. 利用Blaster软件比对, 确定siRNA对靶基因的特异性. 靶序列和阴性对照序列各自的互补两条寡核苷酸片段经退火反应(95℃ 5 min, 70℃ 10 min, 缓慢降至30℃, 维持30 min, 缓慢降至4℃)形成双链DNA即模板链. 用HindⅢ和BglⅡ限制性内切酶将pSUPER.retro.neo载体双酶切形成线性化载体, 酶切反应产物用10 g/L的琼脂糖凝胶电泳, DNA凝胶回收试剂盒回收线性载体. 采用T4 DNA连接酶连接线性化pSUPER.retro.neo载体和模板链形成重组载体, 靶序列和阴性对照序列的重组载体分别命名为pSUPER-siRNA-VEGF载体和pSUPER-siRNA-N载体.
1.2.2 重组载体经酶切、测序鉴定: 重组pSUPER载体转化感受态DH5α细菌, 筛选阳性克隆, 摇菌过夜, 使用质粒提取试剂盒提取重组载体. 重组载体经酶切、测序鉴定.
1.2.3 转染: HepG2细胞置于含100 mL/L新生牛血清的RPMI 1640培养基中, 37℃、50 mL/L的CO2孵箱内培养至对数生长期. 用2.5 g/L胰酶消化并调节细胞浓度以每孔1×105对数期生长的细胞接种于24孔培养板, 1 mL/孔, 培养过夜. 按转染试剂说明书用Lipofectamine 2000将pSUPER-siRNA -VEGF、pSUPER-siRNA-N、pSUPER分别转染HepG2细胞. G418筛选1 wk, 得到上述稳定转染细胞克隆, 分别为实验组、阴性对照组、空载体组, 共3组.
1.2.4 RT-PCR检测HepG2细胞VEGF mRNA表达: 取3组稳定转染细胞, 使用TRIzol法分别提取总RNA. 紫外分光光度计定量. PCR反应以β-actin为内参照, VEGF上游引物: 5'-TTGTGCTCTACCTCCAC-3', VEGF下游引物: 5'-AATGCTTTCTCCGCTCTG-3'扩增片段长度418 bp; β-actin上游引物: 5'-CTATTGGCAACGAGCGGTTC-3', β-actin下游引物: 5'-CTTAGGAGTGGGGGTGGCTT-3'扩增片段长度776 bp. 根据PCR试剂盒与扩增仪说明, 采用50 μL反应体系: cDNA 5 μL, 2×PCR Master 25 μL, 25 mmol/L MgCl2 2 μL, VEGF上游引物(10 μmol/L)2 μL, VEGF下游引物(10 μmol/L)2 μL, β-actin上游引物(10 μmol/L)2 μL, β-actin下游引物(10 μmol/L)2 μL, ddH2O 10 μL. 反应条件: 预变性94℃ 5 min; 94℃ 1 min, 56℃ 50 s, 72℃ 1 min共30个循环; 72℃延伸10 min, 4℃保温30 min. 取 扩增产物于12 g/L的琼脂糖凝胶进行电泳. Alpha Imager3400型凝胶成像分析系统对目的DNA条带进扫描, 用自带分析软件测得电泳图谱上每条基因条带的灰度值. 每组设4个样本, 计算3组各个样本VEGF强度与β-actin内对照强度的比值, VEGF mRNA表达抑制率 = (对照组Rv-实验组Rv)/对照组Rv×100%.
1.2.5 Western blot检测HepG2细胞VEGF165蛋白表达: 收集3组稳定转染细胞, 用单去污法裂解细胞. 样品进行SDS PAGE后, 电转移至硝酸纤维素膜, 加入含50 g/L去脂奶粉封闭液, 室温摇床温育2 h. 使用单去污法提取细胞内总蛋白, Bradford法测定蛋白的含量, 取适量样品, 进行SDS聚丙烯酰胺凝胶电泳; 转膜封闭后分别加入1:200兔抗人VEGF165 mAb、羊抗人β-actin多克隆抗体, 4℃下孵育过夜; 再用1:1000辣根过氧化物酶羊抗兔二抗、辣根过氧化物酶鼠抗羊二抗, 孵育1 h. 化学发光法分别检测PVDF膜上和β-actin蛋白的表达量. Mias图像分析系统测定各条带灰度值, 以同一管中和β-actin条带积分吸光度值之比作数据分析, 以反映蛋白的表达程度, 抑制率 = (对照组Rv-实验组Rv)/对照组Rv×100%.
统计学处理 所有资料采用SPSS13.0统计分析软件进行处理, 所得到的数值均以mean±SD表示, 两组间均数比较用t检验进行处理, 多组间均数比较用单因素方差分析, P<0.05为差异有显著性.
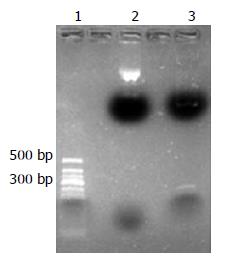
pSUPER-siRNA-VEGF及pSUPER-siRNA-N重组载体被EcoRⅠ及HindⅢ双酶切后电泳发现一条281 bp及6400 bp左右的条带(图1). 初步表明载体pSUPER-siRNA-VEGF构建成功. 酶切鉴定后的重组载体送上海生工公司检测序列, 经Blaster对比, VEGF基因的测序结果与GenBank登陆的VEGF序列完全一致. 证实pSUPER-siRNA-VEGF构建成功.
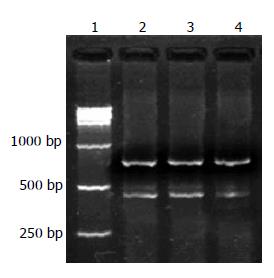
VEGF和β-actin引物的扩增基因片段经电泳和EB染色后电泳结果显示扩增片段大小与所设计的大小完全一致, 分别为418 bp和776 bp(图2). 实验组、阴性对照组、空载体组VEGF扩增产物的强度与内对照β-actin的比值分别为0.304±0.062、0.896±0.061、0.884±0.074, 实验组中的HepG2中VEGF mRNA的表达较阴性对照组、空载体组中VEGF mRNA表达量显著下降(P<0.05), 实验组与空载体组比较VEGF mRNA表达抑制率为65%.
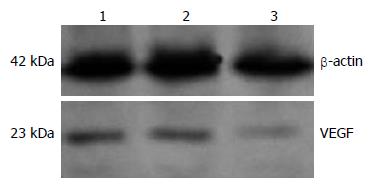
各组细胞经Western blot检测分析表明, 内参照β-actin为均一显影的条带, 但VEGF165显影条带密度不同(图3). 其中空载体组、阴性对照组细胞VEGF165表达量较高, 而实验组细胞VEGF表达量显著下降(P<0.05), 与空载体组比较VEGF165表达抑制率为74%.
HCC通常为一种富血管性肿瘤, 现已证实VEGF是目前已知在肝癌血管生成中作用最强的血管生成诱导因子, 正常肝组织中VEGF表达量极低, 而HCC中VEGF的表达显著升高, 且随着HCC的进展呈上升趋势. 研究表明VEGF与HCC的形成、生长、侵袭、转移、复发及预后关系密切[1-2]. 因此, 有效地抑制VEGF的表达是肝癌抗血管生成治疗的一个有效途径[3].
RNA干扰(RNA interfcrence), 是一种在真核生物体中广泛存在的通过双链RNA分子在mRNA水平上诱导特异性序列基因表达部分或完全抑制的过程, 他具有高靶向性、高稳定性、高效率性、小分子性、高特异性以及高穿透性等特点[4], 克服了mAb、反义寡核苷酸技术的不足, 现已经成为研究基因功能、新基因筛选、基因治疗和寻找药物靶点的重要工具[5-7].
部分学者将RNA干扰技术应用于一些实体肿瘤抗血管生成研究, 并取得了满意效果, 韩庆旺 et al在小发夹RNA(shRNA)载体介导抑制人卵巢癌细胞中血管内皮生长因子(VEGF)的表达和对卵巢癌细胞增殖的影响研究中发现VEGF小发夹RNA质粒载体可显著抑制卵巢癌细胞细胞中VEGF基因的表达, 并可抑制卵巢癌细胞的增殖[8]. 本研究将VEGF作为RNA干扰的靶基因, 力图利用VEGF siRNA靶向阻断VEGF表达途径, 从而阻断VEGF促肝癌血管形成, 以达到抑制肝癌细胞增殖和转移的目的.
本研究应用siRNA技术, 从GenBank查序获得人VEGF的mRNA序列, 利用设计软件在VEGF的序列中选取特异的寡核干扰靶序列, 利用逆转录病毒表达载体法, 将其连接入表达载体内, 该重组载体经酶切和测序证实成功构建了靶向VEGF基因的RNAi逆转录表达载体, 我们将靶向VEGF mRNA序列的VEGF siRNA体外转染人肝癌HepG2细胞, 结果显示转染的肿瘤细胞中VEGF mRNA表达显著低于对照组的肿瘤细胞, 表达抑制率为65%, 证明了我们所合成的VEGF siRNA对人肝癌细胞株HepG2中VEGF mRNA表达有较强的特异性抑制效果. 同时本研究也从蛋白水平上检测了VEGF表达. 由于VEGF mRNA的剪切方式的不同, 产生了5种多肽: VEGF121、VEGF145、VEGF189和VEGF206. 而以VEGF165与肿瘤发生最为密切, 研究证明[9], 在HCC中主要表达的是VEGF165和VEGF121, 尤其是前者. 所以本研究以作为蛋白水平的检测指标, 通过Western blot检测VEGF165蛋白表达量, 从蛋白水平上亦证实了我们所合成的VEGF siRNA对人肝癌细胞株HepG2中VEGF有较强的特异性抑制效果, 其表达抑制率达74%, 其抑制程度与mRNA水平不完全一致, 主要原因是由于5种多肽在肿瘤中的表达不同造成的.
总之, 我们应用RNA干扰技术合成的VEGF siRNA, 从mRNA和蛋白水平上均证实能特异、有效地抑制肝癌HepG2细胞体外VEGF的表达. 为RNA干扰技术在肝癌体内抗VEGF基因作用研究提供了实验基础和理论依据, 并可望通过靶向阻断VEGF表达途径以阻断VEGF促血管形成, 从而阻止肝癌的生长与转移, 为肝癌治疗开辟新途径.
RNA干扰是在mRNA水平上诱导特异性序列基因表达部分或完全抑制的过程, 现已经成为研究基因治疗和寻找药物靶点的重要工具. 研究表明VEGF与肝癌形成、生长、侵袭、转移、复发关系密切.
田晓峰, 教授, 大连医科大学附属第二医院普通外科
研究已经证明使用RNAi方法可降低宫颈癌、卵巢癌、胃癌、结肠癌及乳腺癌等恶性肿瘤中VEGF的表达, 并一定程度上抑制了肿瘤的生长.
本文利用RNA干扰技术靶向研究其对肝癌细胞中VEGF表达, 为RNA干扰技术在肝癌抗血管生成基因治疗开辟新途径.
本文应用RNA干扰技术合成的VEGF siRNA, 从mRNA和蛋白水平上证实其在体外对肝癌HepG2细胞VEGF表达有较强的靶向抑制作用, 为RNA干扰技术在肝癌体内抗VEGF基因作用研究提供了实验基础和理论依据.
本研究立题较好, 研究方法先进可靠, 全文书写规范, 逻辑层次清楚, 研究结果对进一步开展临床有一定的指导意义, 为RNA干扰技术在肝癌体内抗VEGF基因作用研究提供了实验基础和理论依据.
编辑: 史景红 电编:何基才
| 1. | Yao DF, Wu XH, Zhu Y, Shi GS, Dong ZZ, Yao DB, Wu W, Qiu LW, Meng XY. Quantitative analysis of vascular endothelial growth factor, microvascular density and their clinicopathologic features in human hepatocellular carcinoma. Hepatobiliary Pancreat Dis Int. 2005;4:220-226. [PubMed] |
| 2. | El-Assal ON, Yamanoi A, Soda Y, Yamaguchi M, Igarashi M, Yamamoto A, Nabika T, Nagasue N. Clinical significance of microvessel density and vascular endothelial growth factor expression in hepatocellular carcinoma and surrounding liver: possible involvement of vascular endothelial growth factor in the angiogenesis of cirrhotic liver. Hepatology. 1998;27:1554-1562. [PubMed] [DOI] |
| 3. | Pang R, Poon RT. Angiogenesis and antiangiogenic therapy in hepatocellular carcinoma. Cancer Lett. 2006;242:151-167. [PubMed] [DOI] |
| 4. | Shankar P, Manjunath N, Lieberman J. The prospect of silencing disease using RNA interference. JAMA. 2005;293:1367-1373. [PubMed] [DOI] |
| 5. | Yano J, Hirabayashi K, Nakagawa S, Yamaguchi T, Nogawa M, Kashimori I, Naito H, Kitagawa H, Ishiyama K, Ohgi T. Antitumor activity of small interfering RNA/cationic liposome complex in mouse models of cancer. Clin Cancer Res. 2004;10:7721-7726. [PubMed] [DOI] |
| 7. | McManus MT, Sharp PA. Gene silencing in mammals by small interfering RNAs. Nat Rev Genet. 2002;3:737-747. [PubMed] [DOI] |
| 9. | Jeng KS, Sheen IS, Wang YC, Gu SL, Chu CM, Shih SC, Wang PC, Chang WH, Wang HY. Is the vascular endothelial growth factor messenger RNA expression in resectable hepatocellular carcinoma of prognostic value after resection? World J Gastroenterol. 2004;10:676-681. [PubMed] |