修回日期: 2008-12-12
接受日期: 2008-12-15
在线出版日期: 2009-01-18
目的: 研究急性重症型胆管炎(ACST)时大鼠内毒素性肝损伤与肝组织中清道夫受体A(SR-A)表达水平的关系.
方法: Wistar大鼠随机分为2组, 第1组(急性胆道感染组, AOC组), 胆总管予以结扎并注入大肠杆菌O111B4建立ACST动物模型, 第2组(胆总管结扎组, BDL组), 结扎胆总管并注射等量生理盐水. 于术后0、4、8、16、24 h分别采用Western blot和RT-PCR检测肝组织中SR-A蛋白和基因表达水平; 以鲎试验和ELISA测定血浆内毒素和白介素-6(IL-6); 光镜观察肝组织病理变化并测定血浆ALT、TB含量.
结果: 在ACST时随着病程的延长、血浆内毒素浓度逐渐升高(0-24 h: 0.058±0.009, 0.207±0.024, 0.433±0.049, 0.645±0.077, 0.784±0.097, P<0.01), 血浆IL-6、ALT和TB含量明显增加(均P<0.01), 肝功能减损, 同时肝细胞变性、坏死等病理改变逐渐加重, 而AOC组SR-A在术后4 h, 表达已开始下降(P<0.01), 随着病程延长其表达逐渐下降, 至24 h与BDL比较有明显显著性差异(蛋白: 0.156±0.014 vs 0.809±0.107, P<0.01; mRNA: 0.138±0.019 vs 0.578±0.068, P<0.01).
结论: ACST时, 内毒素性肝损伤与肝组织SR-A表达水平的进行性下调有关. 随着枯否细胞清除内毒素的防御能力下降, 肝组织内毒素性损伤进行性加重.
引文著录: 杨慷, 刘作金, 龚建平, 赵蕾, 涂兵. 肝组织清道夫受体A在急性重症胆管炎时的表达与内毒素性肝损伤的关系. 世界华人消化杂志 2009; 17(2): 141-145
Revised: December 12, 2008
Accepted: December 15, 2008
Published online: January 18, 2009
AIM: To investigate the relationship of endotoxic hepatic injury with the expression of scavenger receptor A (SR-A) in liver tissue during acute cholangitis of severe type (ACST).
METHODS: A rat model of ACST was established by ligating choledochus and injecting escherichia coli O111B4 into Wistar rats. At 0, 4, 8, 16, 24 h after operation, the expressions of SR-A protein and mRNA in liver tissue were assayed by western blot and RT-PCR respectively; the levels of plasma endotoxin and interleukin-6 (IL-6) were measured using limulus test and ELISA. Pathological changes in liver tissue were detected by light microscopy, while ALT and TB were determined too.
RESULTS: The plasma endotoxin levels in ACST were progressively increased with time (0-24 h: 0.058 ± 0.009, 0.207 ± 0.024, 0.433 ± 0.049, 0.645 ± 0.077, 0.784 ± 0.097, P < 0.01). With elevated endotoxin, the levels of IL-6, ALT and TB were markedly increased; hepatic histopathological injury was gradually aggravated, while the SR-A expression was obviously decreased. There was significant difference between the expression of SR-A and expression of BLD at 24 h (protein: 0.156 ± 0.014 vs 0.809 ± 0.107, P < 0.01; mRNA: 0.138 ± 0.019 vs 0.578 ± 0.068, P < 0.01).
CONCLUSION: Endotoxic hepatic injury is related with the progressively decreased expression of SR-A in liver tissue during ACST. With the Kupffer cells abilities of clearing endotoxin down-regulated, endotoxic hepatic injury is gradually aggravated.
- Citation: Yang K, Liu ZJ, Gong JP, Zhao L, Tu B. Relation of endotoxic hepatic injury with expression of scavenger receptor A in liver tissue during severe acute cholangitis. Shijie Huaren Xiaohua Zazhi 2009; 17(2): 141-145
- URL: https://www.wjgnet.com/1009-3079/full/v17/i2/141.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i2.141
急性重症型胆管炎(acute cholangitis of severe type, ACST)易导致脓毒症、多器官功能障碍综合征(multiple organ dysfunction syndrome, MODS), 是良性胆道疾病死亡的重要原因. 尽管手术引流胆道是根治方法, 但由于常并发MODS特别是肝损伤导致肝功能衰竭, 该病仍有较高的病死率. Kupffer细胞(Kupffercells, KCs)作为寄居于肝血窦内, 体内固定型巨噬细胞中最大的群体[1], 除有极强的吞噬功能外, 还可通过分泌多种细胞因子介导MODS, 尤其是内毒素性肝损伤, 在炎症反应中发挥重要作用. 清道夫受体A(scavenger receptor A, SR-A)是巨噬细胞表面重要的防御性受体, 他在ACST中表达的变化必然会影响其转归和预后. 本研究初步探讨ACST时肝组织中SR-A的表达及其与内毒素性肝损伤的关系, 为临床进一步治疗ACST及其并发症提供理论依据.
健康Wistar大鼠80只, 体质量200±20 g, 由重庆医科大学实验动物研究中心提供. 鲎试剂盒购自上海伊华临床医学科技公司. ELISA试剂盒购自武汉博士德生物技术有限公司. SR-A羊抗鼠mAb购自Santa Cruz公司. SR-A基因引物由上海英骏生物技术有限公司合成. RT-PCR试剂盒购自TaKaRa大连宝生物工程有限公司.
1.2.1 分组及造模: 随机分为2组. 第1组(急性胆道感染组, AOC组), 参照龚建平 et al[2]的方法建立ACST动物模型: 结扎大鼠胆总管并于其内注入大肠杆菌O111B4 0.2 mL(菌落浓度5×1012 CFU/L); 第2组(胆总管结扎组, BDL组), 结扎胆总管并注射等量生理盐水. 2组动物分别于术后0、4、8、16、24 h活杀取材(每组每时相点动物各8只).
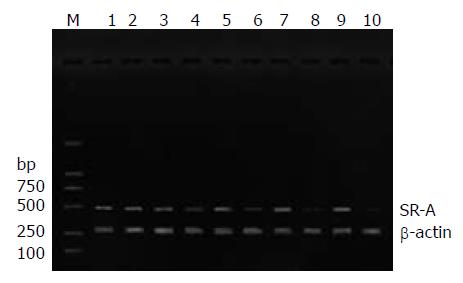
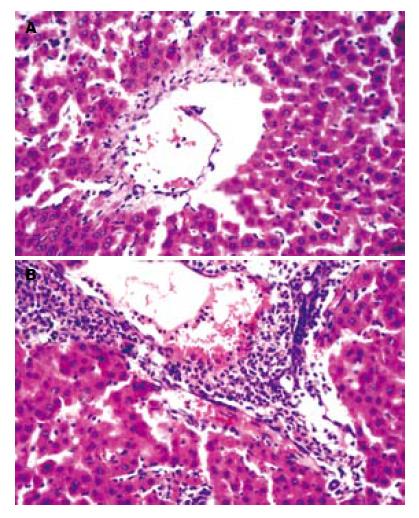
1.2.2 检测指标及方法: 血浆内毒素含量测定采用鲎试剂基质偶氮显色法; 血浆IL-6含量测定采用ELISA测定; 采用Olympus560生化分析仪检测血浆谷丙转氨酶(ALT)及总胆红素(TB). 肝组织SR-A蛋白检测, 采用Western blot法测定, 以β-actin作为内参对照. 肝组织匀浆后在裂解液中裂解; 抽提蛋白质并用分光光度计测定蛋白浓度; 聚丙烯酰胺凝胶电脉后取下凝胶进行电转印; 一抗及二抗孵育; 胶片曝光, 扫描计算目的条带灰度值而得到IA(条带吸光度RA×面积A), 蛋白相对表达量则以SR-A条带IA/β-actin条带IA表示. 肝组织SR-A mRNA表达量检测, 采用RT-PCR测定, SR-A基因引物参照文献[3]设计, 仍以β-actin作为内参对照. SR-A的序列: 上游: 5'-ATGACAAAGAGATGACAGAGAAT-3', 下游: 5'-TTATGAAGTACAAGTGACCCC-3', 序列长度为495 bp. β-actin的序列: 上游: 5'-ACCACAGCTGAGAGGGAAATCG-3', 下游: 5'-AGAGGTCTTTACGGATGTCAACG-3', 序列长度为281 bp. SR-A mRNA相对表达量也为SR-A条带IA/β-actin条带IA. 常规HE染色, 光镜观察肝组织的病理改变.
统计学处理 实验数据以mean±SD表示, 用SPSS13.0统计软件分析. P<0.05表示存在显著性差异; P<0.01表示存在明显显著性差异.
AOC组在术后4 h血浆内毒素含量升高明显, 并随刺激时间延长其含量逐渐增加, 与BDL组相应时相点比较差异非常显著(P<0.01). BDL组血浆内毒素含量在24 h时仅轻度升高(表1).
AOC组血浆IL-6在术后4 h开始升高, 8 h后才显著增高, 并随梗阻感染时间延长其含量继续增加且组间差异进一步加大. 与BDL组相应时相点比较差异非常显著(P<0.01). BDL组IL-6在24 h时轻度升高(表1).
AOC组在术后4 h血浆ALT、TB水平开始升高, 并随作用时间延长其含量进行性增加, 在各时相点分别与BDL组比较, 差异非常显著(P<0.01). BDL组血浆ALT和TB水平分别在8 h和4 h时也开始逐渐增加(表2).
AOC组SR-A蛋白表达在术后4 h已有轻度下降(P<0.01), 随着梗阻感染时间延长其表达逐渐下降, 至24 h时下降非常显著, 与BDL组比较有明显显著性差异(P<0.01); 在BDL组SR-A蛋白表达无明显改变(表3, 图1).
| 分组 | 蛋白表达水平(IASR-A/IAβ-actin) | mRNA表达水平(IASR-A/IAβ-actin) | ||||||||
| 0 h | 4 h | 8 h | 16 h | 24 h | 0 h | 4 h | 8 h | 16 h | 24 h | |
| AOC | 0.813±0.102 | 0.647±0.087bd | 0.463±0.055bd | 0.229±0.028bd | 0.156±0.014bd | 0.596±0.061 | 0.472±0.052bd | 0.395±0.043bd | 0.281±0.032bd | 0.138±0.019bd |
| BDL | 0.786±0.097 | 0.795±0.113 | 0.821±0.104 | 0.812±0.121 | 0.809±0.107 | 0.588±0.063 | 0.617±0.073 | 0.595±0.062 | 0.6022±0.072 | 0.578±0.068 |
AOC组SR-A在术后4 h, mRNA的表达已开始下降(P<0.01), 随着病程延长其表达逐渐下降, 至24 h时与BDL比较有明显显著性差异(P<0.01), 且组间差异进一步加大; BDL组无明显的SR-A mRNA表达的改变(表3, 图2).
ACST是外科常见急腹症之一, 病情凶险. 虽然积极的外科手术挽救了不少患者的生命, 但由于其复杂的临床过程加大了治疗的难度, 其病死率一直居高不下, 尤其是在合并脏器衰竭和脓毒症时. 而内毒素性肝损伤往往是导致肝功能衰竭的一个重要原因. 本研究利用Wistar大鼠复制ACST动物模型, 研究内毒素性肝损伤与肝组织中SR-A表达的关系, 为临床防治内毒素性肝损伤提供新思路.
肝脏是机体主要的天然免疫器官[4], 具有重要的物质代谢和免疫防御功能, 易受细菌、毒素攻击而造成损害. 其富含的KCs占巨噬细胞总数的80%-90%[1,5-6]. 脂多糖(lipopolysaccharide, LPS)是内毒素的主要成分, 而KCs表面就存在多种LPS受体, 如SR-A、CD14、Toll样受体、β2白细胞整合素等[7]. 他在宿主防御及肝脏疾病的发生发展中都起重要作用[8-11], 也是肝脏缺血再灌注损伤的主要参与者[12-13]. SR-A是KCs表面的一类有三种亚型的跨膜糖蛋白, 是在介导巨噬细胞对内毒素清除和灭活等防御反应中起重要作用的LPS受体. 正常情况下, 单核巨噬细胞通过SR-A与LPS结合的非炎性途径以清除LPS[14], 他在ACST时并发的内毒素性肝损伤中表达的改变会极大影响ACST治疗效果和预后, 这就是我们研究的核心问题.
实验发现, 血浆内毒素浓度随着处理时间的延长逐渐升高, SR-A的表达在基因和蛋白水平均呈进行性下调, 与血浆内毒素水平呈明显的负向变化关系. 同时肝脏从形态和功能两个方面显示肝组织损伤逐渐加重: 肝功能进行性减损; 大量以中性粒细胞为主的混合性炎症细胞浸润, 后期出现肝细胞大面积的变性坏死. 与肝内SR-A表达下调呈显著负相关. 另外血浆中细胞因子IL-6的含量进行性增加并高表达, 与SR-A的表达也呈显著负相关.
有研究显示, 阻断SR功能或敲除SR基因后机体对LPS的反应性明显增强[15], 因此, 在ACST的发展过程中, 随着SR-A表达进行性下调, 其灭活、清除内毒素的能力也逐渐降低. 大量内毒素对KCs表面其他LPS受体如CD14的作用也相应增强, 通过一系列信号转导机制使KCs激活, 产生和释放细胞因子也相应增多. 而TNF-α、IL-6, 作为能广泛参与炎症过程中组织、器官损害及细胞免疫功能降低等多种病理过程的细胞因子, 他们的升高与内毒素血症休克患者病死率有关, 其中又以IL-6的升高与病死率的关系最大[16], 并且已有研究表明他们与急性肺、肝、脑损伤有密切相关[17]. 因此, 我们有理由认为在ACST的发展过程中由于SR-A表达的下降, KCs得以大量激活, 诱发或加重了内毒素性肝损伤, 这也是KCs的功能由防御型转变为炎症效应型的原因之一.
在目前针对内毒素的治疗手段仍十分有限的情况下, 若能调控SR-A的表达, 有可能为临床开辟治疗ACST及并发的内毒素性肝损伤的新途径.
急性重症型胆管炎病情凶险, 国内报道其病死率高达4.5%-43.5%. 由于该病易并发内毒素性肝损伤, 而内毒素性肝损伤导致的肝功能衰竭又是患者死亡的重要原因之一. 因此, 明确内毒素性肝损伤的机制对降低患者的病死率有一定意义.
李靖, 副教授, 中国人民解放军第三军医大学附属新桥医院肝胆外科
巨噬细胞表面清道夫受体A(SR- A)除了通过吞噬修饰的血浆脂蛋白、在动脉粥样硬化的发生发展中发挥重要作用外, 还在介导巨噬细胞对抗原的识别、凋亡细胞的吞噬、内毒素的清除以及炎性递质分泌的调控等机体防御反应中起重要作用, 是目前研究的热门课题.
本实验应用Western blot和RT-PCR法进行研究, 从蛋白和基因两个层次探讨肝组织中SR-A的表达特性, 发现在急性重症型胆管炎时SR-A表达的进行性降低, 这可能是内毒素性肝损伤逐渐加重的重要原因之一.
本研究密切结合临床选题, 立论依据充分, 实验设计合理, 数据可信, 相关研究国内外报道较少, 有一定价值.
编辑: 李军亮 电编:何基才
| 1. | Bilzer M, Roggel F, Gerbes AL. Role of Kupffer cells in host defense and liver disease. Liver Int. 2006;26:1175-1186. [PubMed] [DOI] |
| 3. | Duryee MJ, Freeman TL, Willis MS, Hunter CD, Hamilton BC 3rd, Suzuki H, Tuma DJ, Klassen LW, Thiele GM. Scavenger receptors on sinusoidal liver endothelial cells are involved in the uptake of aldehyde-modified proteins. Mol Pharmacol. 2005;68:1423-1430. [PubMed] [DOI] |
| 4. | Gao B, Jeong WI, Tian Z. Liver: An organ with predominant innate immunity. Hepatology. 2008;47:729-736. [PubMed] [DOI] |
| 5. | Liu ZJ, Yan LN, Li XH, Xu FL, Chen XF, You HB, Gong JP. Up-regulation of IRAK-M is essential for endotoxin tolerance induced by a low dose of lipopolysaccharide in Kupffer cells. J Surg Res. 2008;150:34-39. [PubMed] [DOI] |
| 7. | Triantafilou M, Triantafilou K. Lipopolysaccharide recognition: CD14, TLRs and the LPS-activation cluster. Trends Immunol. 2002;23:301-304. [PubMed] [DOI] |
| 8. | Fainboim L, Cherñavsky A, Paladino N, Flores AC, Arruvito L. Cytokines and chronic liver disease. Cytokine Growth Factor Rev. 2007;18:143-157. [PubMed] [DOI] |
| 9. | Jeong WI, Gao B. Innate immunity and alcoholic liver fibrosis. J Gastroenterol Hepatol. 2008;23 Suppl 1:S112-S118. [PubMed] [DOI] |
| 10. | Hirose M, Nishikawa M, Qian W, Haque A, Mashimo M, Inoue M. Mannose-conjugated alendronate selectively depletes Kupffer cells and inhibits endotoxemic shock in the mice. Hepatol Res. 2006;36:3-10. [PubMed] [DOI] |
| 11. | Teufelhofer O, Parzefall W, Kainzbauer E, Ferk F, Freiler C, Knasmüller S, Elbling L, Thurman R, Schulte-Hermann R. Superoxide generation from Kupffer cells contributes to hepatocarcinogenesis: studies on NADPH oxidase knockout mice. Carcinogenesis. 2005;26:319-329. [PubMed] [DOI] |
| 12. | Tanaka Y, Chen C, Maher JM, Klaassen CD. Kupffer cell-mediated downregulation of hepatic transporter expression in rat hepatic ischemia-reperfusion. Transplantation. 2006;82:258-266. [PubMed] [DOI] |
| 13. | Montalvo-Jave EE, Escalante-Tattersfield T, Ortega-Salgado JA, Piña E, Geller DA. Factors in the pathophysiology of the liver ischemia-reperfusion injury. J Surg Res. 2008;147:153-159. [PubMed] [DOI] |
| 14. | Platt N, Haworth R, Darley L, Gordon S. The many roles of the class A macrophage scavenger receptor. Int Rev Cytol. 2002;212:1-40. [PubMed] [DOI] |
| 17. | Agay D, Andriollo-Sanchez M, Claeyssen R, Touvard L, Denis J, Roussel AM, Chancerelle Y. Interleukin-6, TNF-alpha and interleukin-1 beta levels in blood and tissue in severely burned rats. Eur Cytokine Netw. 2008;19:1-7. [PubMed] |