修回日期: 2009-05-28
接受日期: 2009-06-08
在线出版日期: 2009-06-28
目的: 探讨双途径化疗联合三维立体定向伽玛刀治疗局部晚期胰腺癌的临床价值.
方法: 2005-06/2007-12我科选择性收治局部晚期胰腺癌患者23例, 均经穿刺病理学检查证实或经CT、MRI、肿瘤标志物(CA199、CEA等)临床诊断. 患者随机分为2组: 联合治疗组(方法: n = 12)采用双途径化疗(区域动脉灌注和全身静脉化疗)联合三维立体定向伽玛刀治疗; 对照组(n = 11)仅采用双途径化疗. 对比2组患者治疗后疗效、疼痛缓解程度、生存期、不良反应.
结果: 联合治疗组完全缓解和部分缓解率明显高于对照组(75.0% vs 27.3%, P<0.01); 联合治疗组患者的6、9 mo生存率分别为83.3%和75.0%, 与对照组72.7%和45.5%比较, 无统计学差异; 联合治疗组12 mo生存率50.0%(中位生存期13.1 mo)明显高于对照组9.1%(中位生存期8.7 mo)(P<0.05); 联合治疗组肿瘤标志物CA199的表达明显降低(P<0.05); 联合治疗组比对照组能够较大程度改善患者的疼痛症状(P<0.05); 2组治疗模式的不良反应无统计学差异.
结论: 双途径化疗联合三维立体定向伽玛刀是治疗局部晚期胰腺癌的较好方法.
引文著录: 夏念信, 邱宝安, 温居一, 祝建勇, 刘澎. 双途径化疗联合伽玛刀治疗局部晚期胰腺癌12例. 世界华人消化杂志 2009; 17(18): 1888-1893
Revised: May 28, 2009
Accepted: June 8, 2009
Published online: June 28, 2009
AIM: To evaluate the therapeutic effect of two-pathway chemotherapy combined with gamma-ray stereotactic radiotherapy on local advanced pancreatic cancer.
METHODS: From June 2005 to December 2007, 23 patients with local advanced pancreatic cancer were divided into two groups randomly, namely, combined treatment group (n = 12) and control group (n = 11). The combined treatment group received the two-pathway chemotherapy (regional arterial infusion and systemic venous chemotherapy) combined with gamma-ray stereotactic radiotherapy. The control group were only treated with the two-pathway chemotherapy. The curative effect, relief extent of pain, life span and the adverse reaction were compared in the course of treatment between the two groups.
RESULTS: The proportion of CR and PR in the combined treatment group was 75.0%, much higher than 27.3% of the control group. The survival rates at 6 mo and 9 mo were 83.3% and 75.0% in the combined treatment group, similar to 72.7% and 45.5% of the control group. But the 12 months' survival rate of combined treatment group was 50% which was higher than the control group. The average life span of the combined treatment group was 13.1 mo, higher than that of the control group, which was 8.7 mo (P < 0.05). The data of tumor marker CA199 of combined treatment group dropped significantly compared with that of control group (P < 0.05). Abdominal pain in combined treatment group was relieved more than that in control group (P < 0.05). And the adverse effect between two groups had no significant difference (P > 0.05).
CONCLUSION: The therapeutic model of two-pathway chemotherapy combined with gamma-ray stereotactic radiotherapy could be considered one of choice for the patients with local advanced pancreatic cancer.
- Citation: Xia NX, Qiu BA, Wen JY, Zhu JY, Liu P. Therapeutic effect of two-pathway chemotherapy in combination with gamma-ray stereotactic radiotherapy on local advanced pancreatic cancer: an analysis of 12 cases. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1888-1893
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1888.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1888
近年来胰腺癌的发病率和病死率呈上升趋势, 据统计我国部分城市发病率达5.5/10万-8.5/10万[1]. 胰腺癌恶性程度高、预后差, 其病死率占消化系肿瘤的第2位, 仅次于结肠癌, 居全部恶性肿瘤的第4位[2]. 由于胰腺的解剖位置深, 早期症状隐袭和非特异性, 80%以上患者确诊时已属中晚期, 手术切除率不足20%. 如果不行干预治疗, 晚期胰腺癌从诊断到死亡的平均时间约为3 mo[3]. 因此放疗及化疗等非手术治疗模式对局部晚期胰腺癌有相当重要的意义[4-5]. 2005-06/2007-12我科选择性收治局部晚期胰腺癌患者23例, 采用双途径化疗联合三维立体定向伽玛刀治疗, 现报道如下.
2005-06/2007-12我科选择性收治局部晚期胰腺癌(依据2002年AJCC胰腺癌分期)患者23例, 其中男16例, 女7例, 平均年龄61±13(48-73)岁, 均经穿刺病理学检查证实或经CT、MRI、肿瘤标志物(CA-199、CEA等)临床诊断. 患者随机分为实验组(n = 12, 采用双途径化疗联合三维立体定向伽玛刀治疗)和对照组(n = 11, 仅采用双途径化疗, 即区域动脉灌注联合全身静脉化疗). 其中胰头癌5例, 胰颈体癌13例, 胰尾癌5例; 伴肝转移12例, 腹膜后局部淋巴结转移16例. 伴梗阻性黄疸3例, 采用微创方法减轻黄疸(PTCD/ERCP下胆管支架植入)至总胆红素≤3 g/L和谷丙转氨酶≤80 U/L时入选本研究. 主要症状为腹部及腰背部疼痛、体质量减轻和腹胀. 患者Karnofski评分≥60, 估计生存期≥3 mo. 血小板>100000/mm3, 白细胞>4000/mm3, 血色素>10 g/dL; 肝功能Child-Pugh A-B级, 凝血机制和肾功能正常; 心电图基本正常. 血清CA-199水平为291±1.2 kU/L, 对胰腺癌的敏感度为81.3%. 两组在年龄、性别、病灶部位、临床症状和实验室检测指标等方面无显著差别, 具有可比性. 此前接受过其他模式抗癌治疗以及继发肺、骨、脑转移患者均剔除在本研究之外.
1.2.1 双途径化疗: 采用改良Seldinger股动脉穿刺法, 分别行腹腔干动脉和肠系膜上动脉造影, 观察胰腺肿瘤和肝脏转移瘤的多血供染色并确定靶动脉血管; 微导管超选靶血管灌注化疗. 区域动脉灌注化疗方案: GEM 1000 mg/m2(Gemcitabine, 商品名健择)、卡铂500 mg/m2、拓喜(羟喜树碱)20 mg/m2、Avastin 5 mg/kg(Avastin = Bevacizumab, 人源化肿瘤血管表皮生长因子的单克隆抗体); 合并肝内转移者, 除灌注化疗药物外, 部分Avastin与5mL碘化油乳化后栓塞肝微动脉. 全身静脉化疗方案: GEM 1000 mg/m2、四氢叶酸钙200 mg/m2, 分别在第8天和第15天. 化疗期间5-HT3受体拮抗剂预防性止吐, 洛赛克预防应激性溃疡. 化疗期间及化疗后2 wk内每周复查血常规2次, 白细胞<3.0×109/L或者中性粒细胞<1.5×109/L时皮下注射粒细胞集略刺激因子(G-CSF), 血小板<50×109/L时予INF-11治疗. 每4-5 wk重复1次为一疗程, 2-3个治疗周期后评价疗效.
1.2.2 三维立体定向伽玛刀治疗方法(gamma-ray stereotactic radiotherapy): 采用设备OUR-QGD型立体定向体部γ射线放射治疗系统. 患者平卧于三维坐标的立体定向体架中, 体架内置负压袋, 抽真空成型固定躯体. 全组均经螺旋CT薄层(3-5 mm)扫描并增强, 获得定位图像; 在γ-TPS治疗规划系统上进行三维图像重建、显示. 计划靶体积(planning target volume, PTV)根据肿瘤所在位置、临床靶体积、患者身体状况与治疗目的制定. 放射治疗计划及剂量分布调整: PTV覆盖95%以上CTV, 等剂量曲线为50%-60%. 肿瘤≤5 cm的单次周边剂量3.5-4.5 Gy, 肿瘤>5 cm的单次周边剂量3.0-4.0 Gy. 重复摆位时X轴及Z轴方向不允许与定位值有误差, Y轴方向定位值误差小于2 mm. 治疗总剂量为40-50 Gy, 治疗8-12次, 多数患者为先隔日后连续治疗. 与靶区相邻的器官十二指肠受量: 胰头癌患者在30%左右, 胰体尾癌均小于15%.
1.2.3 疗效评价标准: 按照WHO1981年制定的实体瘤疗效标准评价客观疗效: (1)完全缓解(complete remission, CR): 所有可见病灶均消失, 并在至少4 wk后复测确认; (2)部分缓解(partial remission, PR): 各病灶最大双径乘积总和或单径总和缩小≥50%, 并在至少4 wk后复测确认; (3)病情稳定(stable disease, SD): 各病灶最大双径乘积总和或单径总和增大或缩小≤50%, 并在至少4 wk后复测确认; (4)病情进展(progressive disease, PD): 至少其中一个病灶的双径乘积或单径增大>25%, 或出现新病灶. 评定指标包括临床症状、体征以及B超、X线、CT/MRI等检查结果.
1.2.4 VAS法疼痛评分标准: 0分表示无痛; 3分以下表示有轻微的疼痛, 患者能忍受; 4-6分表示疼痛并影响睡眠, 尚能忍受; 7-10分表示有逐渐增强的疼痛并难忍.
1.2.5 肿瘤标志物检测: 治疗前后分别采集静脉血测CA199数值.
1.2.6 不良反应观察项目: 遵循RTOG(the radiation therapy oncology group)标准[6], 观察防、化疗导致的血液毒性、胃肠道反应、肝功能损害、肾功能损害、呃逆以及同时观察血管介入操作的并发症情况等.
统计学处理 采用SPSS10.0统计软件处理, 疗效比较采用秩和检验, VAS法疼痛评分变化、生存率、不良反应的比较均采用χ2检验.
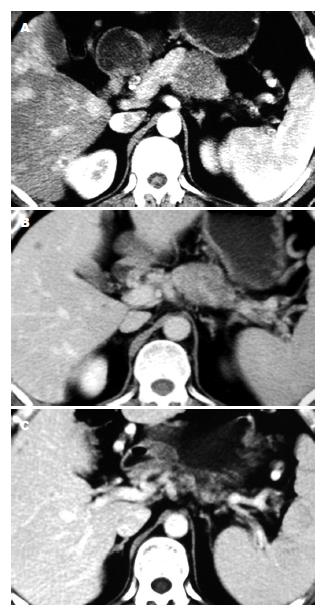
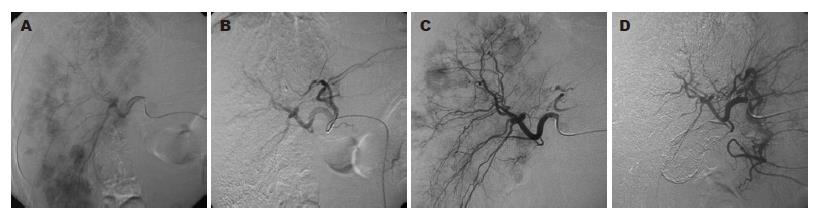
应用WHO实体瘤疗效评价标准评价客观疗效, 实验组CR+PR(%)明显高于对照组(75.0% vs 27.3%, χ2= 98.5000, P = 0.0174). 本组胰腺癌合并肝转移CT影像治疗前后的比较显示治疗效果明显(图1). DSA肝动脉造影治疗前后比较显示, 肝脏多血供转移结节化疗后肿瘤明显缩小, 部分消失(图2).
23例患者治疗前进行了CA199的测定, 其中19例异常增高(实验组10例, 对照组9例), 4例正常. CA199异常增高的患者经治疗后15例降低(实验组10例, 对照组5例), 4例升高. 两组共11例CA199降低幅度>50%, 其中实验组9例, 对照组2例. 比较两组CA199降低幅度>50%患者的比例, 实验组与对照组比较, 两组间差异有统计学意义(90.0% vs22.2%, P<0.05).
两组治疗前VAS法疼痛评分统计学无明显差异(P>0.05). 实验组VAS法疼痛评分7.69±0.99分, >3分10例; 对照组VAS法评分为7.06±1.32分, >3分9例. 以两组中>3分患者为研究对象, 以VAS法疼痛评分降低50%以上为参考值, 治疗后实验组10例中有8例(80%), 治疗组9例中有3例(33.3%)符合评价标准, 两组比较有显著性差异(P<0.05).
两组6、9 mo累积生存率比较无统计学意义(P>0.05), 实验组12 mo累积生存率及中位生存期(13.1 mo vs 8.7 mo, χ2 = 4.5213, P = 0.0312)均高于对照组, 有统计学意义(P<0.05, 表1).
| 生存期(mo) | 试验组(%) | 对照组(%) | χ2值 | P值 |
| 6 | 83.5 | 72.7 | 0.3795 | 0.5379 |
| 9 | 75.0 | 45.5 | 2.1034 | 0.1470 |
| 12 | 50.0 | 9.1 | 4.5365 | 0.0332 |
按WHO分级标准, 两组患者均未出现治疗相关的Ⅳ度不良反应及死亡. 主要不良反应(实验组/对照组, 例次)为血液毒性(6/5)、胃肠道反应(10/9)、肝肾功能损坏(3/4)、脱发(7/8)、消化系出血(1/1)等. 实验组2例患者出现持续5 d的低热, 1例患者出现放射性肠炎, 经对症处理后症状缓解, 完成治疗计划. 实验组不良反应与对照组比较无统计学差异(P>0.05). 未发生消化系穿孔、导管断折等动脉介入和Avastin应用相关的并发症.
局部晚期胰腺癌的治疗原则是高姑息, 目的是改善症状、提高生存质量及延长生存期. 局部晚期胰腺癌的治疗目前仍以全身静脉化疗为主, 但疗效欠佳[3]. 双途径化疗(区域性动脉灌注联合全身静脉化疗)以及三维立体定向伽玛刀治疗为近年来新兴的治疗方法. 文献报道[7,8]区域性动脉灌注化疗治疗局部晚期胰腺癌的疗效优于全身静脉化疗, 经腹腔干动脉和/或肠系膜上动脉进行区域性灌注化疗, 高浓度的抗癌药物能够覆盖整个胰腺和/或肝脏. 药物在靶器官产生首过效应, 动脉灌注化疗时导致局部血流缓慢, 可产生肿瘤内的乏氧环境, 从而发挥化疗的增敏作用; 合并肝内转移者同时栓塞肝微动脉, 毁坏了肿瘤生存的微环境, 促进肿瘤的坏死和凋亡. 临床和实验证实肿瘤化疗的疗效与药物的有效浓度和持续时间成正比; 全身静脉化疗作为区域动脉灌注化疗的延续, 维持血中的有效药物浓度, 消灭血液循环及器官中的微小卫星病灶和游离癌细胞[7]. 张明 et al[9]报道双途径化疗治疗中晚期胰腺癌能提高患者中位生存期(8.0 mo)和临床获益率(71.4%); 优于单纯区域性动脉灌注化疗.
双途径化疗药物被仔细遴选. 1996年吉西他滨(GEM)被FDA批准为抗胰腺癌一线药物, 并被视为临床研究的"金标准". GEM作为抗腺癌药物, 具有防止远处转移、消灭微小病灶的作用, 且与放疗有协同作用[10]. 羟喜树碱是细胞毒类抗肿瘤药, 对DNA拓扑异构酶有选择性抑制作用, 阻滞DNA的复制和转录, 同时还有诱导肿瘤细胞分化和凋亡的作用, 是局部灌注治疗的理想药物. 无论在体外或体内, GEM/顺铂协同作用; 2006年Heinemann et al[11]和2005年Reni et al[17]报道GEM联合顺铂等药物治疗胰腺癌的临床效果优于单一GEM, 而卡铂不良反应小于顺铂. 2005年Kindler et al[12]报道GEM联合Avastin治疗中晚期胰腺癌, 提高了临床获益率、疾病无进展时间和中位生存期; 目前国外多中心正进行GEM联合Avastin治疗中晚期胰腺癌的临床研究. 当恶性肿瘤直径超过1-2 mm后, 需要滋生血管来维持肿瘤的供氧和营养[13-14]; 肿瘤核心部分的低氧环境刺激肿瘤自分泌血管生长因子, 血管表皮生长因子(vascular endothelial growth factor, VEGF)被认为是所有血管生长因子中最具有活力的. Avastin抑制了VEGF的生物活性, 不允许任何VEGF的同质异构体与肿瘤上的相关受体衔接. 所有患者动脉灌注化疗同时应用Avastin, 合并肝内转移者则将部分Avastin与碘化油乳化后栓塞供养肿瘤的微动脉血管, 在肿瘤周围形成25 µm间距的"鸿沟", 破坏肿瘤微环境, 阻止肿瘤滋生营养血管, 促进肿瘤坏死和凋亡. 利用介入技术, 动脉灌注乳化后的Avastin治疗局部晚期胰腺癌文献报道尚属首次.
三维适形放疗技术使胰腺癌的局部控制率得以明显提高[15-16]. 体部伽玛刀是利用能产生γ射线的60Co作为放射源, 根据几何聚焦原理, 将30束γ射线从不同方向和位置通过3种型号(10、30、50 mm)准直器做非共面锥状旋转聚焦照射, 其剂量分布的最大特征使高剂量集中在靶区, 靶外剂量递减十分陡峭, 半影区范围小(20%-80%等剂量线范围在5-10 mm), 具有"刀"的特征, 尤其适用于病灶周围有不能耐受高剂量照射的重要且不敏感的组织和器官. 三维适形放射治疗胰腺癌可使局部肿瘤短期内受到大剂量照射, 致大量肿瘤细胞能在较短时间内坏死, 瘤体迅速缩小, 从而减轻对胆总管、腹膜后神经的压迫, 降低肿瘤张力, 改善黄疸、疼痛等临床症状, 延长生存期. 伽玛刀治疗胰腺癌可使肿瘤区域达到高剂量的照射, 而周围正常组织如胃、十二指肠等受照射剂量低(5%-30%), 损伤轻, 且在整体上缩短了治疗时间. Bai et al[18]的临床研究表明, 放疗联合GEM能使66.7%的局部晚期胰腺癌患者疼痛明显缓解, 47.6%的患者KPS评分值提高, 1年生存率为35%, 未见大于Ⅲ度放射毒性, 治疗前后CA199值分别是716 kU/L和255 kU/L, 差异有统计学意义. 张丽萍 et al[19]报道伽玛刀联合热化疗治疗局部晚期胰腺癌, 能提高患者的生活质量和生存期.
本研究揭示, 双途径化疗联合三维立体定向伽玛刀治疗局部晚期胰腺癌能提高患者的临床客观疗效(P<0.05), 明显缓解疼痛(P<0.05), 降低了肿瘤标志物CA199的表达(P<0.05), 提高了12 mo累积生存率(P<0.05)及延长了中位生存期(P<0.05). 但两组6、9 mo的累积生存率无明显差异(P>0.05). 两组患者的不良反应经对症治疗均可耐受, 均能完成全部治疗计划. 两组放化疗不良反应无统计学意义(P>0.05). 此治疗模式的临床研究文献报道尚属首次; 由于本研究样本量有限, 此治疗模式的临床推广还有待于进一步探讨.
双途径化疗联合三维立体定向伽玛刀治疗局部晚期胰腺癌患者近期客观效果满意, 不良反应可耐受, 能提高患者的生存质量及生存期, 是治疗局部晚期胰腺癌的较好方法.
特别感谢中国人民解放军海军总医院影像中心张燕群教授、郭新红副教授以及放射肿瘤科工作人员对本研究给予的帮助和支持.
胰腺癌的发病率逐年上升, 大多数患者确诊时已经失去手术机会; 化疗和放疗等非手术模式是局部晚期胰腺癌主要的治疗方法, 效果均不理想. 双途径化疗(区域性动脉灌注联合全身静脉化疗)以及三维立体定向伽玛刀治疗为近年来新兴的治疗方法.
崔云甫, 教授, 哈尔滨医科大学第二附属医院普外一科
张明 et al报道双途径化疗治疗中晚期胰腺癌能提高患者中位生存期和临床获益率, 优于单纯区域性动脉灌注化疗. 张丽萍 et al报道伽玛刀联合热化疗治疗局部晚期胰腺癌近期疗效满意, 能提高患者的生活质量和生存期.
单纯化疗或放疗、放化疗结合、化疗与靶向生物治疗等非手术模式是局部晚期胰腺癌主要的治疗手段. 双途径化疗联合三维立体定向伽玛刀治疗局部晚期胰腺癌, 临床研究报道尚属首次.
双途径化疗联合三维立体定向伽玛刀是治疗局部晚期胰腺癌的较好方法.
本文选题前沿, 临床资料可信, 研究设计科学, 可读性较强.
编辑: 李军亮 电编: 吴鹏朕
| 2. | Mulder I, Hoogenveen RT, van Genugten ML, Lankisch PG, Lowenfels AB, de Hollander AE, Bueno-de-Mesquita HB. Smoking cessation would substantially reduce the future incidence of pancreatic cancer in the European Union. Eur J Gastroenterol Hepatol. 2002;14:1343-1353. [PubMed] [DOI] |
| 4. | Fryer RA, Galustian C, Dalgelish AG. Recent advances and developments in treatment strategies against pancreatic cancer. Curr Clin Pharmacol. 2009;4:102-112. [PubMed] [DOI] |
| 6. | Cox JD, Stetz J, Pajak TF. Toxicity criteria of the Radiation Therapy Oncology Group (RTOG) and the European Organization for Research and Treatment of Cancer (EORTC). Int J Radiat Oncol Biol Phys. 1995;31:1341-1346. [PubMed] [DOI] |
| 7. | Aigner KR, Gailhofer S, Kopp S. Regional versus systemic chemotherapy for advanced pancreatic cancer: a randomized study. Hepatogastroenterology. 1998;45:1125-1129. [PubMed] |
| 11. | Heinemann V, Quietzsch D, Gieseler F, Gonnermann M, Schönekäs H, Rost A, Neuhaus H, Haag C, Clemens M, Heinrich B. Randomized phase III trial of gemcitabine plus cisplatin compared with gemcitabine alone in advanced pancreatic cancer. J Clin Oncol. 2006;24:3946-3952. [PubMed] [DOI] |
| 12. | Kindler HL, Friberg G, Singh DA, Locker G, Nattam S, Kozloff M, Taber DA, Karrison T, Dachman A, Stadler WM. Phase II trial of bevacizumab plus gemcitabine in patients with advanced pancreatic cancer. J Clin Oncol. 2005;23:8033-8040. [PubMed] [DOI] |
| 13. | Van Cutsem E, Vervenne WL, Bennouna J, Humblet Y, Gill S, Van Laethem JL, Verslype C, Scheithauer W, Shang A, Cosaert J. Phase III trial of bevacizumab in combination with gemcitabine and erlotinib in patients with metastatic pancreatic cancer. J Clin Oncol. 2009;27:2231-2237. [PubMed] [DOI] |
| 14. | Salmon JS, Lockhart AC, Berlin J. Anti-angiogenic treatment of gastrointestinal malignancies. Cancer Invest. 2005;23:712-726. [PubMed] [DOI] |
| 16. | Burris HA 3rd, Moore MJ, Andersen J, Green MR, Rothenberg ML, Modiano MR, Cripps MC, Portenoy RK, Storniolo AM, Tarassoff P, Nelson R, Dorr FA, Stephens CD, Von Hoff DD. Improvements in survival and clinical benefit with gemcitabine as first-line therapy for patients with advanced pancreas cancer: a randomized trial. J Clin Oncol. 1997;15:2403-2413. [PubMed] |
| 17. | Reni M, Cordio S, Milandri C, Passoni P, Bonetto E, Oliani C, Luppi G, Nicoletti R, Galli L, Bordonaro R. Gemcitabine versus cisplatin, epirubicin, fluorouracil, and gemcitabine in advanced pancreatic cancer: a randomised controlled multicentre phase III trial. Lancet Oncol. 2005;6:369-376. [PubMed] [DOI] |
| 18. | Bai YR, Wu GH, Guo WJ, Wu XD, Yao Y, Chen Y, Zhou RH, Lu DQ. Intensity modulated radiation therapy and chemotherapy for locally advanced pancreatic cancer: results of feasibility study. World J Gastroenterol. 2003;9:2561-2564. [PubMed] |