修回日期: 2009-05-22
接受日期: 2009-05-25
在线出版日期: 2009-06-28
目的: 建立耐VP16的胃癌耐药细胞株, 并初步探讨细胞发生VP16耐药的可能机制.
方法: 采用药物浓度梯度递增法诱导建立OCUM-2M/VP16耐药株. 细胞计数法绘制细胞生长曲线, 计算细胞倍增时间. MTT法检测细胞对6种化疗药物的IC50. 流式细胞仪分析细胞周期分布. 逆转录多聚酶链反应检测caspase-3, P53, DAPK-1, DAPK-2, DAPK-3, Bcl-2, ERCC-1, MDR-1及MRP基因mRNA的表达.
结果: OCUM-2M/VP16成功实现了对VP16的耐药, 耐药指数为40.53; 其增殖速率及细胞倍增时间明显低于OCUM-2M(细胞倍增时间: 22.96±0.96 h vs 30.29±2.55 h, P<0.01). OCUM-2M/VP16对Sn38、奥沙利铂及吉西他滨发生了交叉耐药, 但对5-FU及紫杉醇敏感性与亲代类似. OCUM-2M/VP16凋亡相关基因DAPK-2, DAPK-3和Bcl-2表达下调(OCUM-2M表达值为: 0.61、0.79及0.81, OCUM-2M/VP16为, 0.24、0.45、0.44, P<0.01), 耐药相关基因 ERCC-1和MDR-1表达上调(OCUM-2M为0.53及0.20, OCUM-2M/VP16则为0.84及0.41, P<0.01). caspase-3, P53, DAPK-1及MRP表达无变化.
结论: 成功构建胃癌耐药细胞株OCUM-2M/VP16, 该细胞株具有交叉耐药特性, 耐药机制涉及凋亡、耐药等多个基因表达变化.
引文著录: 邱红, 丁方勇, 熊慧华, 张明生, 李瑞超, 陈元. 胃癌耐药细胞株OCUM-2M/VP16的建立及其耐药机制. 世界华人消化杂志 2009; 17(18): 1809-1814
Revised: May 22, 2009
Accepted: May 25, 2009
Published online: June 28, 2009
AIM: To establish the VP16 resistant gastric cell line and to explore its potential multi-drug resistant mechanism.
METHODS: We used the drug concentration step-elevation method to establish VP16 resistant sub-line of gastric cell line OCUM-2M. Growth curves of cells were delineated and cell doubling times of cells were calculated using cell-counting methods. IC50 of chemotherapy drugs in two cell lines were determined by MTT methods. Cell cycle distributions were tested by FCM analysis. mRNA expression levels of caspase-3, P53, DAPK-1, DAPK-2, DAPK-3, Bcl-2, ERCC-1, MDR-1, and MRP were determined by RT-PCR.
RESULTS: OCUM-2M was a successful drug-resistant cell line, and the resistance index to VP16 was 40.53. The cell doubling time of OCUM-2M/VP16 was 30.29 ± 2.55 h, while that of parental cell line OCUM-2M was 22.96 ± 0.96 h (P < 0.01). The cross-drug-resistance of Sn38, oxaliplatin, and gemcitabine in OCUM-2M/VP16 was observed, while chemo-sensitivity of 5-FU and paclitaxol in OCUM-2M/VP16 remained the same with OCUM-2M. In OCUM-2M/VP16, the mean expression levels of apoptosis related genes, DAPK-2, DAPK-3 and Bcl-2 were respectively 0.24, 0.45, and 0.44, which were lower than OCUM-2M (0.61, 0.79 and 0.81). The expression levels of drug-resistance related genes ERCC-1 and MDR-1 in OCUM-2M/VP16 were respectively 0.84 and 0.41, which were higher than OCUM-2M (0.53 and 0.20, P < 0.01). The expression levels of caspase-3, P53, DAPK-1 and MRP had no significant change in the two cell lines.
CONCLUSION: OCUM-2M/VP16 is a successful VP16-resistant gastric cell line with cross-resistance ability, and the expression level changes of apoptosis and drug resistance related genes might contribute to drug-resistance in OCUM-2M/VP16.
- Citation: Qiu H, Ding FY, Xiong HH, Zhang MS, Li RC, Chen Y. Establishment of VP16-resistant gastric cell line and its multi-drug resistance mechanism. Shijie Huaren Xiaohua Zazhi 2009; 17(18): 1809-1814
- URL: https://www.wjgnet.com/1009-3079/full/v17/i18/1809.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i18.1809
鬼臼乙叉甙(etoposid, VP16)是DNA拓扑异构酶-Ⅱ抑制剂, 具有广谱抗肿瘤效应. 由VP16及5-FU联合组成的ELF方案是Preusser和Wilke针对年龄>65岁或不适合使用阿霉素类药物治疗的转移性胃癌患者设计的, 一般认为ELF方案比较温和、不良反应轻[1]、费用相对低廉, 在其基础上添加其他化疗药物组成新联合方案也经常被用于晚期胃癌的治疗[2]. 但是对于接受ELF方案一线化疗的胃癌患者, 治疗失败后如何选择二线化疗方案, 现有胃癌治疗指南中并没有给出针对性指导意见. 查阅相关文献, 目前国内外关于胃癌耐VP16的基础研究鲜有报道. 我们通过梯度浓度递增方法建立耐VP16的胃癌细胞亚株, 并分析其交叉耐药特性及基因表达, 为胃癌二线治疗方案选择及胃癌VP16耐药逆转提供前期基础研究资料.
本实验所用OCUM-2M细胞为日本大阪市立大学八代正和惠赠. 该细胞系及所建立的耐药子代细胞系OCUM-2M/VP16均在37 ℃、50 mL/L CO2、饱和湿度状态下培养. 所用培养基为DMEM(Nikken Biomedical Laboratory, Kyoto, Japan), 培养基中含有100 mL/L胎牛血清(ICN Biomedical, Costa Mesa, CA, USA)、100 IU/mL青霉素(ICN Biomedical, Costa Mesa, CA, USA)及0.5 mmol/L丙酮酸钠(Cambrex, Walkersville, MD, USA). 本研究共使用6种化疗药物, 5-氟尿嘧啶(5-FU, Kyowa Hakko, Tokyo, Japan), 紫杉醇(PTX, Bristol-Myers, Wallingford, Connecticut), 奥沙利铂(OXA, Yakult, Tokyo, Japan), Sn38(伊力替康体内活性代谢产物, Yakult), 吉西他滨(GEM, Eli Lilly, Kobe, Japan)及鬼臼乙叉甙(VP16, Biovision, Mountain View, CA, USA). 5-FU、Sn38用PBS稀释, OXA、PTX及GEM用蒸馏水稀释, VP16用DMSO溶解. 所有药物原液保存于-20 ℃冰箱中, 使用前溶解, 用培养基配成所需药物浓度.
1.2.1 OCUM-2M/VP16的建立: 采用浓度递增方法诱导耐药建立子细胞株. 预实验检测亲代细胞VP16的IC50为1.6 μmol/L, 选择0.032 μmol/L(即亲代细胞IC50的1/50, 在此浓度下大部分OCUM-2M细胞能继续存活, 属相对安全浓度)作为起始浓度, 每48 h更换药物, 去除死亡细胞后传代培养. 观察没有明显死亡细胞后, 选择对数生长期细胞传代, 并增加25%-50%药物浓度共培养. 最终细胞稳定存活于5 μmol/L浓度VP16后, 进行连续传代培养, 没有观察到明显死亡细胞后定义所得细胞亚株为VP16耐药细胞株OCUM-2M/VP16. 为保证耐药性持续存在, 该亚株培养时均给予5 μmol/L VP16. 进行下述实验检测前, 给予4 wk药物洗脱期培养.
1.2.2 细胞计数法绘制细胞生长曲线: 取对数生长期OCUM-2M及OCUM-2M/VP16, 分别计数, 2.0×104个细胞接种于24孔板培养. 每12 h取3孔, 台盼蓝区分活性细胞, 采用Coulter细胞计数仪(Industrial D; Coulter Electronics, Luton, UK)计算活细胞数目. 连续计数8次(共96 h), 绘制细胞生长曲线. 细胞倍增时间计算方法: 细胞繁殖代数 = log2(计数时间点细胞总数/接种细胞总数), 细胞倍增时间(h) = 计数时间点的细胞培养时间(h)/细胞繁殖代数.
1.2.3 MTT法检测化疗药物IC50: 对数生长期细胞 1×104接种于96孔板, 6种化疗药物按照不同浓度稀释加入培养孔(对于DMSO稀释的VP16, 控制DMSO浓度在1/1000以下, 确保对细胞无害). 每种药物浓度设6复孔. 培养72 h后, 加入5 g/L的3-(4, 5-二甲基-2-噻唑)-2, 5-二苯基溴化四唑(MTT, Sigma), 继续37 ℃培养3 h. 2000 r/min离心10 min, 吸去上清, 加入100 μL DMSO, 振荡床轻微振荡3 min, 采用自动酶标仪(PM2004; Wako, Osaka, Japan)检测各孔570 nm波长吸光度. 细胞增殖率 = 用药组平均吸光度/对照组平均吸光度×100%, 计算IC50. 耐药指数 = 子代细胞IC50/亲代细胞IC50.
1.2.4 FCM仪检测亲代及耐药子代细胞周期: 对数生长期细胞1×105接种于100 mm培养皿, 常规条件培养72 h后胰酶消化收获细胞. 按照Cycle Test Plus DNA reagent试剂盒(Becton Dickinson, Mountain View, CA, USA)要求处置细胞, 加入核糖核酸酶A室温下放置10 min, 加入PI染色剂避光冰浴30 min, 1 h内上流式细胞仪(Becton Dickinson)分析细胞周期, 采用Modofit软件(Becton Dickinson)分析周期分布.
1.2.5 RT-PCR检测部分凋亡及耐药相关基因: 对数生长期细胞1×105接种于100 mm培养皿, 常规条件培养72 h胰酶消化收获细胞. 用TRIzol(Invitrogen, Carlsbad, CA)提取细胞总RNA, 用DNAse(Invitrogen)去除DNA影响, 20 µg总RNA用鼠白血病病毒逆转录酶(Invitrogen)制备cDNA, 用表1所示引物进行PCR扩增. PCR循环条件为: 94 ℃预变性10 min, 94 ℃变性30 s, 59 ℃退火30 s, 72 ℃延伸1 min, 72 ℃终末延伸7 min, 35个周期. 20 g/L琼脂糖凝胶电泳检测扩增产物. 以内参基因(GAPDH)及目的基因灰度代表基因mRNA表达丰度.
| 基因 | 序列 | 扩增产物大小(bp) | |
| GAPDH | 上游引物 | ACCTGACCTGCCGTCTAGAA | 247 |
| 下游引物 | TCCACCACCCTGTTGCTGTA | ||
| caspase-3 | 上游引物 | GGCATTGAGACAGACAGTGGTG | 152 |
| 下游引物 | GCACAAAGCGACTGGATGAACC | ||
| P53 | 上游引物 | AGCGATGGTCTGGCCCCTCCT | 120 |
| 下游引物 | CTCAGGCGGCTCATAGGGCAC | ||
| DAPK-1 | 上游引物 | TCTACCAGCCACGGGACTTC | 134 |
| 下游引物 | GCTGGCCTGTGAGTAGACGT | ||
| DAPK-2 | 上游引物 | GCATCGTGTCCCTGTGCAAC | 121 |
| 下游引物 | GCTTTCCTCCTGGCGATGTC | ||
| DAPK-3 | 上游引物 | CCCAACCCACGAATCAAGCTC | 236 |
| 下游引物 | GCTGAGATGTTGGTGAGCGTC | ||
| Bcl-2 | 上游引物 | GAGTACCTGAACCGGCACCT | 162 |
| 下游引物 | CAGGGTGATGCAAGCTCCCA | ||
| ERCC-1 | 上游引物 | GTGGCCAAGCCCTTATTCCGATCT | 480 |
| 下游引物 | TGCAGTCGGCCAGGATACACATCT | ||
| MDR-1 | 上游引物 | GCCATAGCTCGTGCCCTTGT | 212 |
| 下游引物 | CCATGCTCCTTGACTCTGCC | ||
| MRP | 上游引物 | GGGCTTCTCTGTCTCTGCTG | 285 |
| 下游引物 | ATGCCCACCTTCTCTCCTGC |
统计学处理 使用SPSS12.0进行相关统计学分析, 均值比较采用t-test检验. P值小于0.05认为有统计学意义.
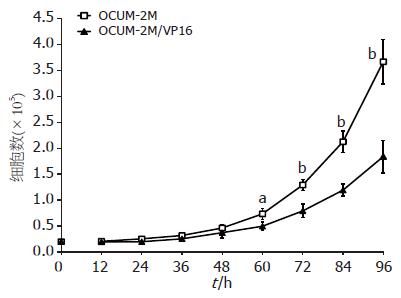
细胞计数显示60、72、84及96 h时间点, OCUM-2M细胞数明显多于耐药株OCUM-2M/VP16, 即子株增殖速度明显低于亲代. OCUM-2M细胞倍增时间为22.96 h, OCUM-2M/VP16细胞倍增时间为30.29 h, 具有显著性差异(图1).
OCUM-2M及OCUM-2M/VP16对各种化疗药物的IC50见表2. 耐药系数RI大于3, 认为存在交叉耐药. 与亲代细胞相比, OCUM-2M/VP16不仅对VP16耐药, 对伊立替康体内活性代谢产物Sn38、吉西他滨、奥沙利铂也耐药, 统计学显示两种细胞株的IC50有显著性差异. OCUM-2M/VP16的5-FU及紫杉醇IC50与亲代细胞OCUM-2M类似, 没有显著性差异.
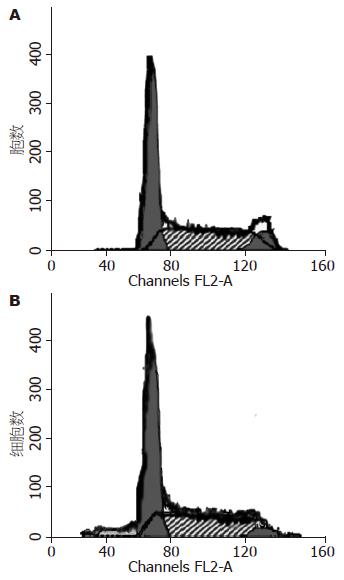
如图2及表3所示, 2种细胞株G2/M期细胞比例具有显著性差异, OCUM-2M/VP16的G2/M期细胞数少于OCUM-2M.
| G0/G1 | S | G2/M | |
| OCUM-2M | 46.72±3.17 | 42.80±3.22 | 10.48±1.20 |
| OCUM-2M/VP16 | 51.35±2.90 | 45.12±3.33 | 3.53±1.54b |
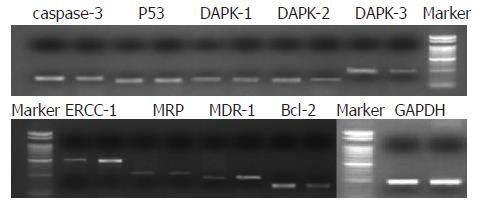
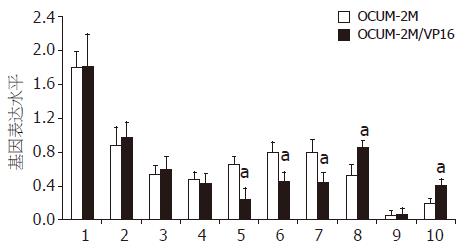
2种细胞株MRP、caspase-3、P53及DAPK-1没有明显差异. 子代耐药株DAPK-2、DAPK-3及Bcl-2表达明显低于亲代细胞(0.24 vs 0.61, 0.45 vs 0.79, 0.44 vs 0.81, 均P<0.01). OCUM-2M/VP16的ERCC-1及MDR-1表达增加(0.84 vs 0.53, 0.41 vs 0.20, 均P<0.01, 图3-4).
多药耐药是限制肿瘤化疗疗效提高的主要因素, 目前建立耐药细胞株常用方法有耐药基因转染导入法及梯度浓度诱导方法, 后者与癌细胞获得性耐药的产生情况类似, 被广泛用于建立多种耐药肿瘤细胞株. VP-16是一种半合成鬼臼脂毒衍生物, 具有广谱抗肿瘤效应. 本研究通过梯度浓度诱导方法成功建立胃癌细胞OCUM-2M的VP16耐药子株, 子代耐VP16指数达40.53.
对亲代及子代耐药株各种化疗药物IC50检测显示, 子株产生VP16耐药后, 对奥沙利铂、Sn38(伊立替康体内活性代谢产物)、吉西他滨产生交叉耐药(RI>3, 统计学分析显示有显著性差异). 奥沙利铂、伊立替康作为临床上使用较多的晚期胃癌化疗方案, 有研究[3]认为与其他方案相比, 有效率提高并不显著. 目前也有研究尝试吉西他滨与奥沙利铂联用治疗胃癌, 显示有一定疗效[4], 但本研究对IC50的检测结果并不支持选择这3种药物作为胃癌发生VP16耐药后的解救治疗, 这种交叉耐药的产生可能也部分解释晚期胃癌二线化疗方案未能提高疗效的原因. 虽然吉西他滨与5-FU抗肿瘤机制类似, 但OCUM-2M/VP16仍然保留与亲代细胞相似的5-FU敏感性, 提示胃癌细胞VP16耐药后, 5-FU及其类似物卡培他滨和S-1仍有可能作为治疗选择. Nagata et al研究认为晚期胃癌紫杉醇联合给药每周方案有效率高, 耐受性好[5]. 虽然紫杉醇与VP16都通过抑制拓扑异构酶Ⅱ活性来发挥抗肿瘤效果, 但我们数据显示子代细胞对紫杉醇敏感性几乎没有发生任何变化, 因此我们认为VP16耐药的胃癌解救治疗紫杉醇是较佳选择. OCUM-2M/VP16没有产生5-FU及紫杉醇交叉耐药的分子机制值得进一步分析.
OCUM-2M为细胞株惠赠者八代正和成功建立和传代的胃癌细胞系, 增殖速度较快[6](本研究检测其细胞倍增时间: 22.96±0.96 h), 而子代耐药细胞系OCUM-2M/VP16倍增时间明显延长(30.29±2.55 h), 提示胃癌细胞发生VP16耐药后增殖明显延缓. 细胞周期分析显示, 子代耐药细胞株G2/M期细胞比例显著低于亲代细胞. VP16为拓扑异构酶Ⅱ抑制剂, 对癌细胞S期末期及G2期细胞有较强杀伤作用, 属于周期特异性药物[4]. OCUM-2M/VP16细胞周期分布改变可能是细胞产生VP16耐药的部分机制, 这也提示诱导细胞S期及G2/M期阻滞的药物有可能逆转VP16耐药.
我们检测了亲代及子代细胞部分凋亡相关基因的表达情况. 虽然OCUM-2M为P53野生型[6], 但耐药子代细胞P53表达没有明显变化, 且caspase-3也没有明显表达上调或下降, 说明这2种凋亡相关基因可能没有参与胃癌细胞VP16耐药的产生. 死亡相关蛋白激酶(death-associated protein kinase, DAPK)含有3个家族成员, 其低表达常常与肿瘤发生密切相关, 其中DAPK-1和DAPK-2与药物诱导的细胞凋亡密切相关, 而DAPK-3主要诱导细胞发生凋亡相关形态学变化[7]. 子代耐药株OCUM-2M/VP16细胞DAPK-1的mRNA表达与亲代相比无明显变化, 但DAPK-2及DAPK-3表达下调. DAPK家族表达的差异可以部分解释OCUM-2M/VP16的耐药机制, 即通过避免凋亡的发生而提高VP16耐受性. Bcl-2是抗凋亡基因, 具有高度保守性, 其高表达可以使肿瘤细胞避免凋亡产生[8], 然而OCUM-2M/VP16与亲代细胞相比, 其Bcl-2表达下降. 此种现象虽然不能解释VP16耐药, 但从反面说明VP16耐药发生过程是多因素参与的, Bcl-2表达下调原因值得深入研究.
切除交叉互补修复基因(ERCC-1)近年来研究较多, 目前认为ERCC-1高表达与肺癌铂类制剂耐药密切相关, 是化疗敏感性独立预测指标[9]. Matsubara et al[10]对晚期胃癌的研究也证实高表达ERCC-1是不良预后预测因子, 有研究认为ERCC-1 mRNA高表达的患者应当考虑FOLFOX以外的化疗方案[11]. OCUM-2M/VP16细胞ERCC-1的mRNA表达高于亲代细胞, 可能与奥沙利铂的交叉耐药性密切相关, 提示胃癌在ELF方案治疗后的二线解救治疗方案选择铂类制剂可能无明显效果. 亲代细胞OCUM-2M中多药耐药蛋白(MRP)及多药耐药基因(MDR-1)的mRNA均属于低丰度表达, 子代耐药株MDR-1表达增加可能也是OCUM-2M/VP16发生Sn38等交叉耐药的部分机制之一.
总之, 我们在本研究中利用药物浓度梯度递增成功诱导建立耐VP16的胃癌子细胞株OCUM-2M/VP16, 该细胞株增殖速率较亲代明显降低, G2/M期细胞比例减少. 与亲代细胞相比, OCUM-2M/VP16对奥沙利铂、Sn38、吉西他滨有交叉耐药, 但保留与亲代细胞类似的5-FU及紫杉醇敏感性. DAPK家族基因低表达、ERCC-1及MDR-1基因高表达可能与该子株多药耐药密切相关. 在下一步研究中, 我们将利用OCUM-2M/VP16子株进行VP16逆转耐药相关研究, 为胃癌二线治疗方案选择提供进一步实验基础.
目前已经建立的肿瘤耐药细胞株主要对5-FU、PTX、OXA、ADM等耐药, 而对VP16耐药的细胞株相对研究较少. VP16抗瘤谱广, 目前在临床上仍有较广泛应用, 此研究的实施不仅对胃癌, 对于其他肿瘤也有一定临床指导意义.
王健生, 教授, 西安交通大学医学院第一附属医院肿瘤外科
多药耐药一直是化疗疗效提高的瓶颈, 肿瘤细胞耐药机制涉及了多方面因素. 周期分布改变、耐药相关基因高表达、抑制凋亡等多种机制都参与了多药耐药的产生, 针对这些机制的措施有可能逆转肿瘤耐药, 提高化疗疗效.
Matsubara et al对晚期胃癌的研究也证实高表达ERCC-1是不良预后预测因子, 有研究认为ERCC-1 mRNA高表达的患者应当考虑FOLFOX以外的化疗方案.
本文分析了不同化疗药物对耐药株的敏感性, 并从细胞倍增时间、周期分布、凋亡及耐药基因表达等多个基因对细胞耐药机制进行了较为广泛的探索, 再次证实耐药的产生可能是多个因素综合作用的结果.
目前常用建立耐药细胞株的方法有耐药基因导入法及药物诱导方法, 后者与临床耐药产生机制类似, 本研究采用此方法建立的细胞株被证实诱导了多药耐药的产生, 可用于多药耐药的后续研究.
本研究工作量较大, 数据丰富, 内容详实, 实验设计合理, 结果明确, 讨论重点突出, 具有较好的学术价值.
编辑: 李军亮 电编: 何基才
| 1. | Wilke H, Preusser P, Stahl M, Harstrick A, Meyer HJ, Achterrath W, Schmoll HJ, Seeber S. Etoposide, folinic acid, and 5-fluorouracil in carboplatin-pretreated patients with advanced gastric cancer. Cancer Chemother Pharmacol. 1991;29:83-84. [PubMed] [DOI] |
| 2. | Mathe G, Schwarzenberg L. Bone marrow transplantation (1958-1978) : conditioning and graft-versus-host disease, indications in aplasias and leukemias. Pathol Biol (Paris). 1979;27:337-343. [PubMed] |
| 3. | Brell JM, Krishnamurthi SS, Javle M, Saltzman J, Wollner I, Pelley R, Dowlati A, Kantharaj BN, Schluchter MD, Rath L. A multi-center phase II study of oxaliplatin, irinotecan, and capecitabine in advanced gastric/gastroesophageal junction carcinoma. Cancer Chemother Pharmacol. 2009;63:851-857. [PubMed] [DOI] |
| 4. | Correale P, Fulfaro F, Marsili S, Cicero G, Bajardi E, Intrivici C, Vuolo G, Carli AF, Caraglia M, Del Prete S. Gemcitabine (GEM) plus oxaliplatin, folinic acid, and 5-fluorouracil (FOLFOX-4) in patients with advanced gastric cancer. Cancer Chemother Pharmacol. 2005;56:563-568. [PubMed] [DOI] |
| 5. | Nagata N, Kimura M, Hirabayashi N, Tuburaya A, Murata T, Kondo K, Fukuda Y, Kobayashi M, Miyashita Y, Nakao A. Phase II study of weekly paclitaxel and cisplatin combination therapy for advanced or recurrent gastric cancer. Hepatogastroenterology. 2008;55:1846-1850. [PubMed] |
| 6. | Yashiro M, Chung YS, Nishimura S, Inoue T, Sowa M. Establishment of two new scirrhous gastric cancer cell lines: analysis of factors associated with disseminated metastasis. Br J Cancer. 1995;72:1200-1210. [PubMed] |
| 7. | Kögel D, Prehn JH, Scheidtmann KH. The DAP kinase family of pro-apoptotic proteins: novel players in the apoptotic game. Bioessays. 2001;23:352-358. [PubMed] [DOI] |
| 9. | Felip E, Rosell R. Testing for excision repair cross-complementing 1 in patients with non-small-cell lung cancer for chemotherapy response. Expert Rev Mol Diagn. 2007;7:261-268. [PubMed] [DOI] |
| 10. | Matsubara J, Nishina T, Yamada Y, Moriwaki T, Shimoda T, Kajiwara T, Nakajima TE, Kato K, Hamaguchi T, Shimada Y. Impacts of excision repair cross-complementing gene 1 (ERCC1), dihydropyrimidine dehydrogenase, and epidermal growth factor receptor on the outcomes of patients with advanced gastric cancer. Br J Cancer. 2008;98:832-839. [PubMed] [DOI] |
| 11. | Wei J, Zou Z, Qian X, Ding Y, Xie L, Sanchez JJ, Zhao Y, Feng J, Ling Y, Liu Y. ERCC1 mRNA levels and survival of advanced gastric cancer patients treated with a modified FOLFOX regimen. Br J Cancer. 2008;98:1398-1402. [PubMed] [DOI] |