修回日期: 2009-05-05
接受日期: 2009-05-11
在线出版日期: 2009-06-08
目的: 探讨DNA氧化损伤修复酶hMTH1在HBx致肝细胞癌发生机制中的作用.
方法: 应用HPLC/ECD法检测稳定表达HBx的转基因细胞HepG2/HBx及其对照组HepG2与HepG2/pcDNA3.1细胞中的8-OHdG的含量; 并以β-actin为内对照, 应用RT-实时PCR定量检测各组细胞中可水解8-OHdG的DNA修复酶hMTH1的表达.
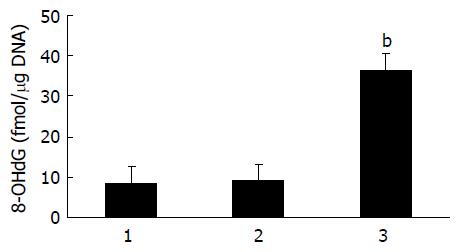
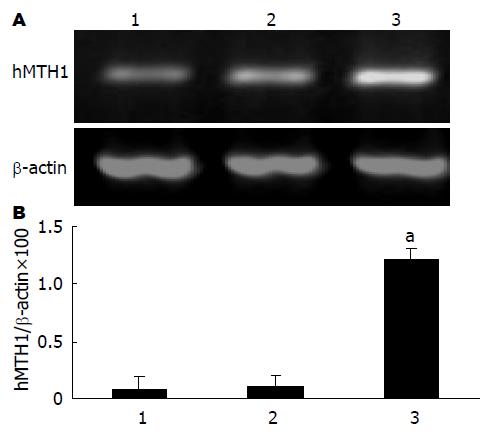
结果: 8-OHdG在HepG2/HBx细胞中的含量(fmol 8-OHdG/μg DNA)显著高于对照组HepG2和HepG2/pDNA3.1细胞(36.5±6.25vs 8.52±1.65, 9.12±2.69, 均P<0.05). DNA修复酶hMTH1在HepG2/HBx细胞中的表达较两对照组细胞明显增高(1.213±0.100 vs 0.087±0.026, 0.112±0.052 hMTH1/β-actin mRNA×100, 均P<0.05).
结论: HBx可能通过诱导氧化应激增加HepG2细胞内DNA氧化损伤产物8-OHdG的含量, 从而反应性上调DNA修复酶hMTH1的表达.
引文著录: 郭晓榕, 程斌, 郑要初, 王颖, 王凡, 夏秀梅, 黎培员. HBx上调HepG2细胞DNA修复酶hMTH1表达的意义. 世界华人消化杂志 2009; 17(16): 1660-1664
Revised: May 5, 2009
Accepted: May 11, 2009
Published online: June 8, 2009
AIM: To explore the role of oxidative DNA damage repair enzyme hMTH1 in the HBx-induced hepatocellular carcinoma.
METHODS: 8-OHdG levels were determined using HPLC/ECD in the HepG2/HBx and in HepG2 and HepG2/pcDNA3.1 of the control cells. Using the β-actin as the interior control, real-time quantitative polymerase chain reaction (qPCR) was employed to examine the expression of DNA repair enzyme hMTH1 of hydrolyze 8-OHdG.
RESULTS: The 8-OHdG level was significantly higher in the HepG2/HBx than in HepG2 and HepG2/pcDNA3.1 (36.5 ± 6.25 vs 8.52 ± 1.65, 9.12 ± 2.69 fmol 8-OHdG/mg DNA, both P < 0.05), and the expression of DNA repair enzyme hMTH1 mRNA was significantly higher than the control cells (1.213 ± 0.100 vs 0.087 ± 0.026, 0.112 ± 0.052 hMTH1/β-actin mRNA×100, both P < 0.05).
CONCLUSION: HBx gene may increase the level of oxidative DNA-adduct 8-OHdG by promoting the oxidative stress in HepG2 cells, thus reactivity increases the expression of DNA repair enzyme hMTH1.
- Citation: Guo XR, Cheng B, Zheng YC, Wang Y, Wang F, Xia XM, Li PY. Significance of HBx gene up-regulated expression of DNA repair enzyme hMTH1 in the HepG2 cells. Shijie Huaren Xiaohua Zazhi 2009; 17(16): 1660-1664
- URL: https://www.wjgnet.com/1009-3079/full/v17/i16/1660.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i16.1660
乙型肝炎病毒x基因(hepatitis B virus X gene, HBx)可通过复杂的反式激活作用、干扰宿主细胞受损DNA的修复等多种途径参与肝细胞癌(hepatocellular carcinoma, HCC)的发生[1-3], 一些体内、外实验研究为HBx参与HCC的发生发展提供了依据[4-5], 但其确切机制尚未阐明. 新近一些研究表明HBx可诱发宿主细胞DNA的氧化损伤[6]. 8-羟基鸟嘌呤(7, 8-dihydro-8-oxoguanine, 8-OHdG)是一种主要的具有致突变作用的DNA氧化损伤产物, 他可在细胞DNA复制中引起G:C→T:A的碱基颠换, 与肿瘤的发生发展密切相关[7]. DNA修复酶hMTH1可水解游离核苷酸池中8-OHdG, 在清除人类基因组内8-OHdG、维护基因组的稳定性与完整性中起着至关重要的作用. 本研究拟通过检测HBx转基因细胞模型HepG2/HBx中8-OHdG的含量及DNA修复酶hMTH1表达水平, 探讨DNA修复酶hMTH1在乙肝相关性肝癌发生机制中的作用.
稳定表达HBx的转基因细胞模型HepG2/HBx由本课题组构建[8], DMEM培养基、胎牛血清、G418(Gibco); 逆转录酶和实时PCR试剂(SYBR green PCR master mix)(Toyobo); LightCycler荧光定量PCR仪及毛细管(Roche). 核酸酶P1、8-羟基脱氧鸟苷标准品(8-OHdG)为Sigma公司产品; 扩增hMTH1基因片段上游引物为: 5'-AGCCTCAGCGAGTTCTCCTG-3', 下游引物为: 5'-GATCTGGCCCACCTTGTGC-3'; 扩增内对照β-actin基因片段上游引物为: 5'-CGGGAAATCGTGCGTGACAT-3', 下游引物为: 5'-GAACTTTGGGGGATGCTCGC-3'. 引物均由上海生工生物工程技术服务有限公司合成.
1.2.1 HPLC/ECD法检测各组细胞中8-OHdG的含量: 采用AXYGEN试剂盒从HepG2、HepG2/pcDNA3.1和HepG2/HBx培养细胞中抽提基因组DNA并用核酸蛋白定量仪定量, 取等量DNA加入DNA酶解缓冲液, 混匀后置磁力加热器中95 ℃热变性10 min, 并加入一种铁离子螯合物-甲磺酸去铁胺(deferoxamine mesylate, DFAM, Sigma公司)用于防止标本处理过程中人为产生 的8-OHdG. 离心后加入核酸酶P1和碱性磷酸酶, 混匀置37 ℃水浴酶解90 min. 酶解产物移至EP管中10000 r/min×15 min高速离心, 取上清液20 μL注入Atlantis d18色谱柱(waters公司)进行检测. 标本8-OHdG含量经转换计算后以fmol 8-OHdG/μg DNA表示, 每组细胞重复3次, 取平均值.
1.2.2 RT-实时PCR半定量检测DNA修复酶hMTH1的表达: 应用加100 g/L灭活的胎牛血清(Gibco)的DMEM高糖培养基, 于37 ℃, 50 mL/L CO2浓度的培养箱中传代培养HepG2、HepG2/pcDNA3.1和HepG2/HBx细胞, 以β-actin作为内对照. TRIzol一步法提取各组细胞总RNA(严格按试剂盒说明书操作), 经逆转录生成cDNA, PCR 反应体积为20 μL, 其中含引物各0.2 μmol/L, SYBR Green PCR Master Mix 10 μL, 2 μL来自3 μg总RNA 的cDNA以及 2 μL序列稀释的外标准物分别作为模板. 采用LightCycler实时PCR仪(Roche)扩增测量. 反应条件分别为94 ℃预变性30 s, 95 ℃变性3 s, β-actin和hMTH1分别在58 ℃和62 ℃退火5 s, 72 ℃延伸30 s, 均40个循环周期, 定量分析采用LightCycler软件, β-actin和hMTH1测量温度分别为92 ℃和91 ℃. 所有测量重复3次, 取其平均值, 结果以目的基因与β-actin基因表达的比值×100表示. PCR扩增片段大小均经Goldview染色的琼脂糖凝胶电泳紫外成像证实.
统计学处理 数据采用mean±SD表示. 运用SPSS13.0软件来进行统计学处理, 组间采用方差分析, 以P<0.05为差异有统计学意义.
HPLC/ECD法检测各组细胞中8-OHdG的含量发现, HepG2、HepG2/pcDNA3.1细胞中的浓度分别为8.52±1.65 fmol 8-OHdG/μg DNA和9.12±2.69 fmol 8-OHdG/μg DNA, 两者无显著性差异(P>0.05). 而在HepG2/HBx细胞中的表达增至36.5±6.25 fmol 8-OHdG/μg DNA, 与前二者相比差异有极显著性(P<0.01, 图1), 提示HBx基因可引起HepG2细胞内8-OHdG的含量增加.
DNA修复酶hMTH1 mRNA在HepG2、HepG2/pcDNA3.1细胞中的表达分别为0.087±0.026 hMTH1/β-actin mRNA×100和0.112±0.052 hMTH1/β-actin mRNA×100, 在HepG2/HBx细胞中的表达增至1.213±0.100 hMTH1/β-actin mRNA×100, 与前二者相比差异有显著性(P<0.05, 图2).
HBV慢性感染与HCC的发生密切相关[9-12], 研究表明乙肝病毒感染后HBV DNA的整合是造成宿主染色体不稳定的重要因素. HBx基因是HBV中最小的阅读框, 位于第1374-1838位核苷酸, 在HBV中高度保守, 其编码的X蛋白具有复杂的生物学功能, 可通过反式激活调节宿主细胞基因转录和信号转导通路以及诱导DNA损伤、干扰宿主细胞受损DNA的修复等参与HCC的发生机制[13-23]. 新近一些研究表明HBx可诱发宿主细胞DNA损伤. 当机体抗氧化保护机制不能消除高水平ROS的作用时, 便可产生氧化应激, 引起细胞内蛋白质、脂肪及DNA的氧化损伤[6], 其中8-OHdG是一种发生频率高、致突变能力强的DNA氧化损伤产物[24-26]. 被氧化的核苷酸池是8-OHdG的主要来源, 如不能及时清除便可在DNA复制过程中误配入基因组而发生G:C→T:A的碱基颠换, 从而导致机体功能基因的突变, 参与癌变发生过程. hMTH1是一种三磷酸酶, 具有糖苷酶活性, 可将游离核苷酸池中的8-OHdGTP水解为8-OHdGMP, 从而阻止8-OHdG错配入DNA双链中, 减少或避免DNA点突变的发生[27-29]. 因此我们通过测定HBx的转基因细胞模型HepG2/HBx中8-OHdG含量和DNA修复酶hMTH1的表达, 从DNA修复酶hMTH1这一角度探讨HBx对肝细胞生物学特性的影响及其在肝细胞癌发生的作用.
8-OHdG是一种具有有致突变作用的DNA氧化损伤产物, 可导致G/C到T/A的碱基颠换, 这种G/T碱基颠换的累积可导致基因基因组的不稳定和肿瘤发生. Kennedy et al在肺癌细胞系的研究显示, SV-40转化的非肿瘤性支气管上皮细胞(SV-40 transformed non-tumorigenic human bronchial epithelial cell, BEAS-2B)及肺癌细胞系中8-OHdG的含量明显低于正常支气管上皮细胞[30]. 相反, 在肾癌和结肠癌中的研究均显示肿瘤组织中8-OHdG的含量明显高于癌旁组织[31], 这可能与组织特异性有关. 晚近在肝癌组织的研究也发现癌组织中8-OHdG含量较癌旁组织明显增高[6], 认为可能与肿瘤细胞代谢相对活跃, 可持续产生氧化应激有关. Waris et al的研究发现HBx可加重细胞氧化应激水平, 导致产生大量的活性氧自由基(ROS)[6]. 本研究采用HPLC/ECD法检测发现HBx转基因细胞HepG2/HBx中8-OHdG含量明显高于对照组HepG2和HepG2/pcDNA3.1细胞(P<0.05), 而后两者之间差异无显著性, 提示HBx基因可引起HepG2细胞内8-OHdG的含量增加. 推测HBx可能通过诱导氧化应激, 造成细胞内DNA氧化损伤, 形成大量具有致突变作用DNA氧化损伤产物如8-OHdG而参与肝细胞的恶性转化和HCC的发生发展.
hMTH1的主要功能是水解清除细胞内游离核苷酸池中的8-OHdG, 从而减少或避免8-OHdG被错配入基因组DNA引起碱基颠换, 导致基因组的不稳定. Kennedy et al发现hMTH1表达在SV-40转化的非肿瘤性支气管上皮细胞和11/12株肺癌细胞系明显高于正常的支气管上皮细胞, 这表明癌前细胞和癌细胞8-OHdG的清除效应与hMTH1的上调表达密切相关[30]. Okamoto et al在肾癌组织中的研究也显示hMTH1在癌组织中的表达明显高于癌旁组织, 可作为癌组织持续氧化应激存在的证据[31]. 晚近在肝癌患者的研究中也发现肝癌组织中hMTH1有过度表达[32]. 本研究采用实时定量PCR检测HepG2/HBx及其对照组细胞中DNA修复酶hMTH1的表达水平, 结果发现hMTH1 mRNA在HepG2/HBx细胞中的表达较HepG2细胞及HepG2/pcDNA3.1细胞显著增高(P<0.05), 而后两者之间差异无显著性, 提示HBx可能参与上调HepG2细胞DNA修复酶hMTH1的表达. 我们推测hMTH1的高表达可能是由于细胞内8-OHdG大量积累反馈刺激所致, 也就是说hMTH1的表达上调可能是一种反应性的.
一般情况下机体具有一套完善的DNA损伤修复机制, 只有当DNA损伤与修复失衡时才可能出现不可逆的DNA损伤, 造成基因突变的积累以至细胞生物学行为的改变. 本研究初步提示HBx可能通过诱导氧化应激, 造成细胞内DNA氧化损伤, 形成大量具有致突变作用DNA氧化损伤产物如8-OHdG, 后者进而反应性地上调hMTH1的表达, 因而hMTH1也可作为反映氧化应激水平的检测指标之一. 当然, 8-OHdG的清除和修复也并不仅由hMTH1完成, 新近发现DNA修复酶8-羟基鸟嘌吟糖苷酶(hOGG1)和hMYH也在DNA复制的不同环节协同参与修复基因组中的8-OHdG[27], 因此DNA氧化损伤及其相关的DNA修复酶在HBx致肝细胞恶性转化及癌变发生机制的作用值得深入研究.
HBx基因如何参与乙肝相关性肝癌发生机制是目前研究的热点, 但其作用机制尚未完全阐明, 从DNA氧化损伤及其修复这一新的角度进行探讨可能具有重要意义.
郑鹏远, 教授, 郑州大学第二附属医院消化科
HBx对肝细胞氧化应激的影响是HBV致HCC发生的重要机制之一, hMTH1是一种重要的DNA氧化损伤修复酶, 可将游离核苷酸池中的8-OHdGTP水解为8-OHdGMP, 但两者之间的关系及其在肝癌发生中的作用尚未见报道.
本研究应用HPLC/ECD法检测发现HBx可通过诱导氧化应激增加HepG2细胞内DNA氧化损伤产物8-OHdG的含量, 同时通过RT/实时PCR定量检测发现各组细胞中可水解8-OHdG的DNA修复酶hMTH1的表达升高, 进一步丰富了HBx致乙型肝炎相关性肝癌发生机制的研究.
本文为乙型肝炎相关性肝癌的早期发现和防治提供了新的线索和依据, 深入研究有助于乙型肝炎相关性肝癌的早期发现和预防.
本文设计合理, 方法先进, 结论明确, 具有较大的理论价值.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Tanaka Y, Kanai F, Kawakami T, Tateishi K, Ijichi H, Kawabe T, Arakawa Y, Kawakami T, Nishimura T, Shirakata Y. Interaction of the hepatitis B virus X protein (HBx) with heat shock protein 60 enhances HBx-mediated apoptosis. Biochem Biophys Res Commun. 2004;318:461-469. [PubMed] [DOI] |
| 2. | Hoare J, Henkler F, Dowling JJ, Errington W, Goldin RD, Fish D, McGarvey MJ. Subcellular localisation of the X protein in HBV infected hepatocytes. J Med Virol. 2001;64:419-426. [PubMed] [DOI] |
| 3. | Tang H, Oishi N, Kaneko S, Murakami S. Molecular functions and biological roles of hepatitis B virus x protein. Cancer Sci. 2006;97:977-983. [PubMed] [DOI] |
| 4. | Wang XZ, Jiang XR, Chen XC, Chen ZX, Li D, Lin JY, Tao QM. Seek protein which can interact with hepatitis B virus X protein from human liver cDNA library by yeast two-hybrid system. World J Gastroenterol. 2002;8:95-98. [PubMed] |
| 5. | Arbuthnot P, Kew M. Hepatitis B virus and hepatocellular carcinoma. Int J Exp Pathol. 2001;82:77-100. [PubMed] [DOI] |
| 6. | Waris G, Huh KW, Siddiqui A. Mitochondrially associated hepatitis B virus X protein constitutively activates transcription factors STAT-3 and NF-kappa B via oxidative stress. Mol Cell Biol. 2001;21:7721-7730. [PubMed] [DOI] |
| 7. | Bruner SD, Norman DP, Verdine GL. Structural basis for recognition and repair of the endogenous mutagen 8-oxoguanine in DNA. Nature. 2000;403:859-866. [PubMed] [DOI] |
| 9. | Wei Y, Liu D, Zhou F, Ge Y, Xu J, Yun X, Gu J, Jiang J. Identification of beta-1,4-galactosyltransferase I as a target gene of HBx-induced cell cycle progression of hepatoma cell. J Hepatol. 2008;49:1029-1037. [PubMed] [DOI] |
| 10. | Lupberger J, Hildt E. Hepatitis B virus-induced oncogenesis. World J Gastroenterol. 2007;13:74-81. [PubMed] |
| 11. | Ganem D, Prince AM. Hepatitis B virus infection--natural history and clinical consequences. N Engl J Med. 2004;350:1118-1129. [PubMed] [DOI] |
| 12. | Marusawa H, Matsuzawa S, Welsh K, Zou H, Armstrong R, Tamm I, Reed JC. HBXIP functions as a cofactor of survivin in apoptosis suppression. EMBO J. 2003;22:2729-2740. [PubMed] [DOI] |
| 13. | Jüngst C, Cheng B, Gehrke R, Schmitz V, Nischalke HD, Ramakers J, Schramel P, Schirmacher P, Sauerbruch T, Caselmann WH. Oxidative damage is increased in human liver tissue adjacent to hepatocellular carcinoma. Hepatology. 2004;39:1663-1672. [PubMed] [DOI] |
| 14. | Xu ZH, Zhao MJ, Li TP. p73beta inhibits transcriptional activities of enhancer I and X promoter in hepatitis B virus more efficiently than p73alpha. World J Gastroenterol. 2002;8:1094-1097. [PubMed] |
| 15. | Su F, Theodosis CN, Schneider RJ. Role of NF-kappaB and myc proteins in apoptosis induced by hepatitis B virus HBx protein. J Virol. 2001;75:215-225. [PubMed] [DOI] |
| 16. | Ahn JY, Jung EY, Kwun HJ, Lee CW, Sung YC, Jang KL. Dual effects of hepatitis B virus X protein on the regulation of cell-cycle control depending on the status of cellular p53. J Gen Virol. 2002;83:2765-2772. [PubMed] |
| 17. | Arbuthnot P, Capovilla A, Kew M. Putative role of hepatitis B virus X protein in hepatocarcinogenesis: effects on apoptosis, DNA repair, mitogen-activated protein kinase and JAK/STAT pathways. J Gastroenterol Hepatol. 2000;15:357-368. [PubMed] [DOI] |
| 18. | Jung JK, Arora P, Pagano JS, Jang KL. Expression of DNA methyltransferase 1 is activated by hepatitis B virus X protein via a regulatory circuit involving the p16INK4a-cyclin D1-CDK 4/6-pRb-E2F1 pathway. Cancer Res. 2007;67:5771-5778. [PubMed] [DOI] |
| 19. | Lau WM, Ho TH, Hui KM. p16INK4A-silencing augments DNA damage-induced apoptosis in cervical cancer cells. Oncogene. 2007;26:6050-6060. [PubMed] [DOI] |
| 20. | Chen J, Siddiqui A. Hepatitis B virus X protein stimulates the mitochondrial translocation of Raf-1 via oxidative stress. J Virol. 2007;81:6757-6760. [PubMed] [DOI] |
| 21. | Gao J, Chen C, Hong L, Wang J, Du Y, Song J, Shao X, Zhang J, Han H, Liu J. Expression of Jagged1 and its association with hepatitis B virus X protein in hepatocellular carcinoma. Biochem Biophys Res Commun. 2007;356:341-347. [PubMed] [DOI] |
| 22. | Gao J, Song Z, Chen Y, Xia L, Wang J, Fan R, Du R, Zhang F, Hong L, Song J. Deregulated expression of Notch receptors in human hepatocellular carcinoma. Dig Liver Dis. 2008;40:114-121. [PubMed] [DOI] |
| 23. | Purow BW, Haque RM, Noel MW, Su Q, Burdick MJ, Lee J, Sundaresan T, Pastorino S, Park JK, Mikolaenko I. Expression of Notch-1 and its ligands, Delta-like-1 and Jagged-1, is critical for glioma cell survival and proliferation. Cancer Res. 2005;65:2353-2363. [PubMed] [DOI] |
| 24. | Barbone F, Bovenzi M, Cavallieri F, Stanta G. Cigarette smoking and histologic type of lung cancer in men. Chest. 1997;112:1474-1479. [PubMed] [DOI] |
| 25. | Liu L, Zhang Q, Feng J, Deng L, Zeng N, Yang A, Zhang W. The study of DNA oxidative damage in benzene-exposed workers. Mutat Res. 1996;370:145-150. [PubMed] |
| 26. | Luna L, Rolseth V, Hildrestrand GA, Otterlei M, Dantzer F, Bjørås M, Seeberg E. Dynamic relocalization of hOGG1 during the cell cycle is disrupted in cells harbouring the hOGG1-Cys326 polymorphic variant. Nucleic Acids Res. 2005;33:1813-1824. [PubMed] [DOI] |
| 27. | Nakabeppu Y. Regulation of intracellular localization of human MTH1, OGG1, and MYH proteins for repair of oxidative DNA damage. Prog Nucleic Acid Res Mol Biol. 2001;68:75-94. [PubMed] [DOI] |
| 28. | Tsutsui H, Ide T, Shiomi T, Kang D, Hayashidani S, Suematsu N, Wen J, Utsumi H, Hamasaki N, Takeshita A. 8-oxo-dGTPase, which prevents oxidative stress-induced DNA damage, increases in the mitochondria from failing hearts. Circulation. 2001;104:2883-2885. [PubMed] [DOI] |
| 29. | Nash HM, Bruner SD, Schärer OD, Kawate T, Addona TA, Spooner E, Lane WS, Verdine GL. Cloning of a yeast 8-oxoguanine DNA glycosylase reveals the existence of a base-excision DNA-repair protein superfamily. Curr Biol. 1996;6:968-980. [PubMed] [DOI] |
| 30. | Kennedy CH, Cueto R, Belinsky SA, Lechner JF, Pryor WA. Overexpression of hMTH1 mRNA: a molecular marker of oxidative stress in lung cancer cells. FEBS Lett. 1998;429:17-20. [PubMed] [DOI] |
| 31. | Okamoto K, Toyokuni S, Kim WJ, Ogawa O, Kakehi Y, Arao S, Hiai H, Yoshida O. Overexpression of human mutT homologue gene messenger RNA in renal-cell carcinoma: evidence of persistent oxidative stress in cancer. Int J Cancer. 1996;65:437-441. [PubMed] [DOI] |