修回日期: 2009-04-15
接受日期: 2009-04-20
在线出版日期: 2009-06-08
目的: 探讨大鼠肝移植术后应用ω-3多不饱和脂肪酸对移植肝脏功能、受体免疫功能、急性排斥反应的影响.
方法: 二袖套法大鼠肝移植18例, 术后颈内静脉插管, 微量泵匀速输注液体. 盐水NS组(n = 6)输注生理盐水, 肠外营养PN组(n = 6)输注营养液, 脂肪酸OM组(n = 6)输注营养液+ω-3脂肪乳. 术后第7天, 留取肝组织标本病理检查, 取血清检测生化指标及IL-2、IL-4、IL-10、γ-IFN等细胞因子含量, 余血清检测生化指标, 流式细胞检测CD4+、CD8+、CD4+CD25+ T细胞和CD8+CD28- T细胞.
结果: 各组生化结果比较无统计学意义. 与NS组和PN组比较, OM组CD4+、CD8+、CD4+CD25+和CD8+CD28- T细胞含量下降(26.86%±1.60% vs 31.32%±5.92%, 32.87%±2.744%; 28.65%±1.40% vs 30.08%±1.37%, 30.64%±1.47%; 3.89%±0.20% vs 4.75%±0.46%, 5.27%±0.20%; 13.31%±2.06% vs 22.08%±3.81%, 21.00%±3.46%, 均P<0.05). OM组CD4+/CD8+与NS组和PN组比较下降有差异(0.94±0.001 vs 1.04±0.01, 1.07±0.001, 均P<0.05). OM组IL-2、γ-IFN含量与NS组和PN组比较下降(20.17±2.87 ng/L vs 35.47±8.94 ng/L, 35.92±3.31 ng/L, 2.12±0.84 ng/L vs28.30±6.25 ng/L, 28.38±11.07 ng/L, 均P<0.05). 病理学检查移植肝排斥反应强度(RAI)评分OM组与PN组、NS组比较下降有差异(均P<0.05).
结论: 静脉输注ω-3多不饱和脂肪酸可以通过抑制IL-2和γ-IFN, 抑制T淋巴细胞, 更显著的降低CD4+辅助性T细胞比例, 减轻排斥反应.
引文著录: 刘燕南, 韦军民, 乔江春, 朱明炜. ω-3多不饱和脂肪酸对大鼠肝移植急性排斥反应的影响. 世界华人消化杂志 2009; 17(16): 1609-1613
Revised: April 15, 2009
Accepted: April 20, 2009
Published online: June 8, 2009
AIM: To discuss the effect of omega-3 fatty acid on liver function, receiver's immunologic function and acute rejection following orthotopic liver transplantation in rats.
METHODS: Orthotopic liver transplantation using two-cuff technique from BN (RT1n) to Lewis (RT1l) was performed in 18 rats. After transplantation, the internal jugular vein tube was catheterized and the solution was given through a micro-pump. Normal saline was given to the NS group (n = 6), parenteral nutrition to PN group (n = 6), and parenteral nutrition + Omega-3 fatty acid to OM group (n = 6). At 7th day, the liver function, levels of cytokines (IL-2, IL-4, IL-10, γ-IFN) and pathological changes of the liver were observed. The percentage of CD4+, CD8+, CD4+CD25+ and CD8+CD28- T lymphocytes were analyzed using flow-cytometry.
RESULTS: There were no significant differences among NS, PN and OM groups in liver function. In OM group, the CD4+, CD8+, CD4+CD25+ and CD8+CD28- T lymphocytes were significantly decreased, compared with NS group and PN group (26.86% ± 1.60% vs 31.32% ± 5.92%, 32.87% ± 2.744%; 28.65% ± 1.40% vs 30.08% ± 1.37%, 30.64% ± 1.47%; 3.89% ± 0.20% vs4.75% ± 0.46%, 5.27% ± 0.20%; 13.31% ± 2.06% vs 22.08% ± 3.81%, 21.00% ± 3.46%, all P < 0.05). The ratio of CD4+/CD8+ of OM group was significantly decreased, compared with the other two groups (0.94 ± 0.001 vs 1.04 ± 0.01, 1.07 ± 0.001, P < 0.05). The levels of IL-2 and γ-IFN of OM group were significantly elevated, compared with NS group and PN group (20.17 ± 2.87 ng/L vs 35.47 ± 8.94 ng/L, 35.92 ± 3.31 g/L, 2.12 ± 0.84 ng/L vs 28.30 ± 6.25 ng/L, 28.38 ± 11.07 ng/L, all P < 0.05). The pathology examination showed that the rejection activity index (RAI) of OM group were significantly decreased, compared with PN group or NS group (P < 0.05).
CONCLUSION: Omega-3 fatty acid decreases the secretion of IL-2 and γ-IFN, inhibits the T lymphocytes, especially the help T lymphocytes, and alleviates the acute rejection.
- Citation: Liu YN, Wei JM, Qiao JC, Zhu MW. Effects of omega-3 fatty acid transfusion on acute rejection in rat liver transplantation. Shijie Huaren Xiaohua Zazhi 2009; 17(16): 1609-1613
- URL: https://www.wjgnet.com/1009-3079/full/v17/i16/1609.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i16.1609
脂肪酸是人体必须营养素, 具有广泛而重要的生物功能, 其中多不饱和脂肪酸, 尤其是ω-3多不饱和脂肪酸(ω-3 polyunsaturaed fatty acids, ω-3 PUFAs)可通过多种机制影响免疫细胞的功能, 对机体免疫功能有较强的调节作用, 对免疫性疾病和炎性疾病具有治疗作用. 已经发现鱼油对心血管、肝脏、肾脏等组织器官具有保护作用[1-2]. 在大鼠心脏移植中, ω-3脂肪酸可使移植受体排斥反应减轻、延长受体存活时间及免疫抑制剂不良反应方面得以改善[3]. 本研究通过给肝移植大鼠静脉输注ω-3脂肪酸, 观察ω-3脂肪酸对肝脏功能、受体免疫功能、急性排斥反应的影响.
选用近交系健康雄性BN(RT1n)大鼠作为供体, Lewis(RT1l)大鼠为受体, 体质量200-300 g, 供、受体体质量相仿, 购自北京维通利华公司. 美国BD公司FACS Calibur流式细胞仪, 瑞士Tecan SUNRISE酶标仪, 德国Perfusor secura FT, B. Braun Melsunge AG微量输液泵. 20%力能中长链脂肪乳(250 mL含大豆油25 g、中链甘油三酸酯25 g、卵磷脂3 g)、8.5%乐凡命(18AA-Ⅱ, 氨基酸含量为85 g/L)、水乐维他、安达美、维他利匹特和尤文ω-3鱼油脂肪乳注射液为华瑞制药公司产品. 抗大鼠CD4、CD25、CD8、CD28荧光抗体购自BD公司. 大鼠IL-2、IL-4、IL-10、γ-IFN定量酶联检测试剂盒购自上海森雄科技实业有限公司.
1.2.1 分组及给药: 大鼠术前测质量, 原位肝移植手术方法参照Kamada et al[4]的二袖套法肝移植方法. 大鼠采用随机数字表法分3组, 肝移植后6 h颈内静脉插管, 微量泵匀速输注液体. 生理盐水NS组(n = 6)输注生理盐水, 速度8.9 mL/(kg·h), 不禁食. 肠外营养PN组(n = 6)术后禁食水, 输注PN液, 速度8.9 mL/(kg·h), PN液配置参照马正伟 et al[5]的方法, PN液提供非蛋白热量为741.8 kJ/(kg·d), 氮量1.5 g/(kg·d), 非蛋白热量:氮 = 494.5 kJ:1 g, 糖脂供能比6:4. 脂肪酸OM组(n = 6)术后禁食水, 输注PN和ω-3脂肪乳液2 mL/(kg·d). 因血管吻合口出血、气栓、血栓及静脉插管并发症等技术原因而死亡的, 不进入实验.
1.2.2 肝脏病理观察: 每组术后7 d输液停止6 h后测体质量, 大鼠麻醉后剖腹, 留取肝组织标本. 用100 g/L甲醛溶液固定, 石蜡包埋, 切片厚度为3-4 μm, HE染色, 光镜下观察. 按Banff分级法计算移植肝排斥反应强度计分(rejection activity index, RAI)[6].
1.2.3 流式细胞检测T细胞亚群: 腹主动脉取血0.5 mL, EDTA抗凝. CD4+、CD8+、CD4+CD25+和CD8+CD28- T细胞测定: 取专用试管3支, 分别加入IgG-FITC、IgG-PE、CD25-PE、CD4-FITC、CD28-PE、CD8-FITC各2 μL, 立即加入EDTA抗凝血100 μL并充分混匀后, 室温(20 ℃-25 ℃)避光放置15 min, 每管加溶血剂2 mL, 充分混匀后, 室温(20 ℃-25 ℃)避光放置10 min, 1200 r/min离心5 min弃上清液, 用PBS洗涤2次后, 加入含10 g/L多聚甲醛的PBS 250 μL(4 ℃)待测, 1 wk内用流式细胞仪检测. 采用CellQuest软件获取数据和分析, 全淋巴细胞门, 分析门内CD4+CD25+、CD8+CD28-细胞亚群, 结果以CD4+、CD8+、CD4+CD25+、CD8+CD28-细胞分别占淋巴细胞的百分率来表示.
1.2.4 血清学指标检测: 腹主动脉取血6-8 mL, 4 ℃ 3000 r/min离心10 min, 取上清置于-80 ℃冰箱保存待测. 用双抗体夹心ABC-ELISA法测定血清IL-2、IL-4、IL-10、γ-IFN含量. 余血清检测生化指标.
统计学处理 本组数据以mean±SD表示, 组间比较采用t检验, 所有统计采用SPSS11.0计算机统计软件进行数据分析.
术后7 d输液停止6 h后测体质量, 体质量NS组平均降低59±39.9 g, PN组平均增长10.5±4.7 g, OM组平均增长6.5±5.9 g. NS组与PN组、OM组相比下降有差异(P<0.05). PN与OM组比较, 没有差异(P>0.05).
ALT在NS组为65.00±24.26 U/L, PN组47.50±33.23 U/L, OM组37.33±1.53 U/L; AST在NS组为201.33±89.91 U/L, PN组303.50±229.80 U/L, OM组174.33±61.33 U/L; TBIL在NS组为1.03±0.15 μmol/L, PN组0.85±0.07 μmol/L, OM组0.87±0.15 μmol/L. 各组生化结果比较没有差异(P>0.05).
OM组CD4+、CD8+、CD4+CD25+和CD8+CD28- T细胞与NS组比较下降有差异(26.86%±1.60% vs 31.32%±5.92%, 28.65%±1.40% vs 30.08%±1.37%, 3.89%±0.20% vs 4.75%±0.46%, 13.31%±2.06% vs 22.08%±3.81%, 均P<0.05), 与PN组比较下降有差异(26.86%±1.60% vs 32.87%±2.744%, 28.65%±1.40% vs 30.64%±1.47%, 3.89%±0.20% vs 5.27%±0.20%, 13.31%±2.06% vs 21.00%±3.46%, 均P<0.05). OM组CD4+/CD8+比NS组和PN组降低有差异(0.94±0.001 vs 1.04±0.01, 1.07±0.001, 均P<0.05, 表1).
OM组IL-2、γ-IFN与NS组比较下降有差异(20.17±2.87 ng/L vs 35.47±8.94 ng/L, 2.12±0.84 ng/L vs28.30±6.25 ng/L, 均P<0.05), 与PN组比较下降有差异(20.17±2.87 ng/L vs 35.92±3.31 ng/L, 2.12±0.84 ng/L vs28.38±11.07 ng/L, 均P<0.05). OM组IL-4、IL-10与NS组、PN组比较降低没有差异(P>0.05, 表2).
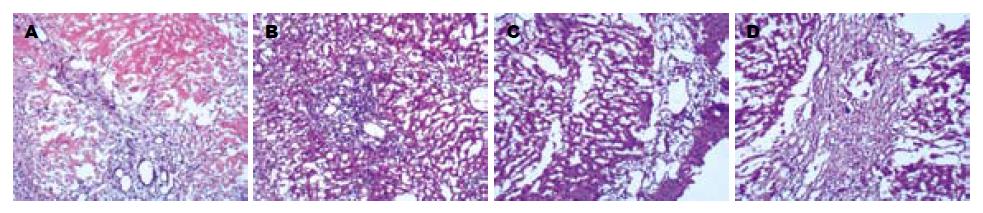
NS组RAI评分为7.17±0.98分, PN组RAI评分为6.17±0.75分, OM组RAI评分为4.33±0.52分, OM组与PN组、NS组比较排斥反应减轻有差异(P<0.05, 图1).
肝移植术后排斥反应是一个以细胞免疫为主的复杂病理生理过程, T淋巴细胞在诱发肝移植术后排斥反应及诱导肝移植免疫耐受方面有着十分重要的作用. T淋巴细胞按其功能可分为多个亚群, 主要有CD4+辅助性T细胞(help T cell, Th)、CD8+杀伤性T细胞(cytotoxic T lymphocyte, CTL)、抑制性T细胞(suppressor T cell, Ts)和调节性T细胞(regulatory T cell, Treg). Th细胞分为Th1和Th2细胞. Th1细胞分泌IL-2、γ-IFN等细胞因子, 移植后IL-2、γ-IFN水平的升高是与急性排斥反应密切相关[7-8]. Th2细胞主要分泌IL-4、IL-10等细胞因子, 可以诱导特异性细胞免疫耐受[9-10]. Treg为CD4+CD25+ T细胞, 他可以抑制效应性T细胞的增殖及其细胞因子和抗体的产生, 发挥免疫调节作用[11]. CTL可以通过释放颗粒酶、穿孔素和Fas/FasL途径诱导细胞凋亡, 特异性直接杀伤靶细胞, 参与急性排斥反应[12]. CD8+CD28- Ts细胞可以抑制抗原呈递细胞的活化, 对活化的CD4+ T细胞进行了抑制, 从而诱导免疫耐受的形成. Liu et al[13]在研究大鼠肝移植急性排斥反应过程中, 给急性排斥大鼠输注CD8+CD28- TS细胞可以显著抑制肝脏急性排斥反应.
近期的研究发现, ω-3 PUFAs对多种免疫细胞具有抑制作用, 使其在移植免疫治疗中具有较好的应用前景. ω-3脂肪酸影响免疫细胞功能的机制包括: ω-3脂肪酸能置换细胞膜磷脂中的花生四烯酸, 竞争环氧合酶和脂氧合酶从而减少来源于花生四烯酸的炎性介质, 减轻炎症反应. ω-3脂肪酸也可通过改变细胞膜磷脂脂肪酸构成来影响细胞膜流动性及膜上相关信号分子、酶、受体的功能, 从而改变信号传导过程. 此外通过影响酶或细胞因子的基因表达、抑制促炎症因子产生、调节黏附分子表达来调节免疫功能[14].
实验证实ω-3脂肪酸可以在体内、体外抑制多种细胞因子的表达. Ogita et al[15]术前给予受体大鼠ω-3脂肪酸饮食, 第19天行小肠移植, 术后发现受体IL-1β、TNF和IL-2表达水平较对照组降低. Schmöcker et al[16]发现在小鼠化学性肝损伤时, 给予ω-3脂肪酸可以抑制TNF-α、IL-1β、γ-IFN和IL-6的表达, 从而抑制炎症反应. Alexander et al[17]总结在体内、体外, 鱼油可以抑制IL-2、IL-4、IL-10、γ-IFN的分泌. 但也有人发现, 鱼油喂养的小鼠脾细胞在有丝分裂原刺激时较对照组γ-IFN分泌显著减少, IL-4分泌减少但没有统计学差异[18]. 我们的研究也发现肝移植术后给予输注ω-3脂肪酸, 细胞因子IL-2和γ-IFN分泌较NS组和PN组显著降低, 而细胞因子IL-4和IL-10分泌较NS组和PN组降低, 但没有统计学意义. 说明ω-3脂肪酸可以抑制移植术后Th1细胞因子IL-2和γ-IFN的分泌.
Grimm et al[19-20]在大鼠心脏移植中, 实验组给予鱼油(富含ω-3脂肪酸)强化的脂肪乳剂, 而不进行免疫抑制剂干预. 结果显示, 实验组移植物存活时间显著延长, 与急性排斥反应密切相关的IL-6明显减少, 外周血T细胞数显著下降, 免疫组织化学发现, 移植物内多形核中性粒细胞、巨噬细胞、NK细胞、T细胞及B细胞的浸润下降了50%以上. 他们认为给予鱼油后, 特异性免疫细胞的活化以及向移植物内的浸润和增殖明显受抑制, 这可以用体内细胞因子的产生减少来解释, 而这些细胞数的下降反过来又使细胞因子的产生进一步减少. 同样的结果也见于大鼠肾脏移植, Kort et al[21]发现肾脏移植后早期口服鱼油, 可以改善移植肾功能、降低排斥死亡率. 在临床肾移植中, van der Heide et al[22]给肾移植术后患者口服鱼油1年, 环孢霉素A剂量与对照组相同, 发现鱼油组急性排斥发生率降低, 1年存活率延长. 我们的组织病理学显示, 给予ω-3脂肪酸后OM组排斥反应较对照NS组和PN组减轻, 但不能完全逆转排斥反应. 同时我们发现, OM组CD4+、CD8+、CD4+CD25+和CD8+CD28- T细胞与对照NS组、PN组比较均显著降低, 说明ω-3脂肪酸可以明显抑制移植术后外周血T淋巴细胞各亚群, 这可能与IL-2分泌受抑制有关. 而实验OM组CD4+/CD8+下降显著, 表明ω-3脂肪酸对CD4+ Th细胞亚群抑制更明显, 进一步减少IL-2、γ-IFN分泌, 抑制T淋巴细胞的增殖、活化, 从而减轻了对靶器官的杀伤, 起到减轻排斥反应的作用. 而TS和Treg细胞与ω-3脂肪酸减轻大鼠肝移植排斥反应的效应无关.
我们的研究中也发现, 与PN组、OM组相比, NS组大鼠术后体质量减轻较明显, 与肝移植术后, 大鼠进食较差, 而肠外营养可以很好补充营养, PN组、OM组大鼠术后体质量增加明显. ω-3脂肪酸对术后生化指标没有显著影响.
ω-3 PUFAs不仅可以作为营养支持物质提供能量, 而且他可以通过抑制Th1类细胞因子IL-2和γ-IFN, 抑制T淋巴细胞亚群, 更显著地降低Th细胞比例, 减轻排斥反应. ω-3 PUFAs目前已经开始在临床移植中研究和使用. 可以预见, ω-3 PUFAs在器官移植中将有广泛的应用前景.
在大鼠心脏移植中, ω-3脂肪酸可使移植受体排斥反应减轻、延长受体存活时间及免疫抑制剂不良反应方面得以改善. 本研究通过给肝移植大鼠静脉输注ω-3脂肪酸, 观察ω-3脂肪酸对肝脏功能、受体免疫功能、急性排斥反应的影响.
黄志勇, 副教授, 华中科技大学同济医院普外科
Ogita et al术前给予受体大鼠ω-3脂肪酸饮食, 第19天行小肠移植, 术后发现受体IL-1β、TNF和IL-2表达水平较对照组降低. Schmöcker et al发现在小鼠化学性肝损伤时, 给予ω-3脂肪酸可以抑制TNF-α、IL-1β、γ-IFN和IL-6的表达, 从而抑制炎症反应.
ω-3 PUFAs对多种免疫细胞具有抑制作用, 使其在移植免疫治疗中具有较好的应用前景.
本研究实验手段和技术路线设计合理, 结果可靠, 为ω-3多不饱和脂肪酸的临床应用范围提供理论基础和实验依据, 具有指导和参考价值.
编辑: 李军亮 电编: 何基才
| 1. | Bonis PA, Chung M, Tatsioni A, Sun Y, Kupelnick B, Lichtenstein A, Perrone R, Chew P, DeVine D, Lau J. Effects of omega-3 fatty acids on organ transplantation. Evid Rep Technol Assess (Summ). 2005;1-11. |
| 2. | 张 鸣, 李 波. ω-3多不饱和脂肪酸的免疫调节作用及其在器官移植中的应用. 中国普外基础与临床杂志. 2007;14:497-501. [PubMed] |
| 3. | Alexander JW. Role of immunonutrition in reducing complications following organ transplantation. Transplant Proc. 2000;32:574-575. [PubMed] [DOI] |
| 4. | Kamada N, Calne RY. A surgical experience with five hundred thirty liver transplants in the rat. Surgery. 1983;93:64-69. [PubMed] |
| 6. | Banff schema for grading liver allograft rejection: an international consensus document. Hepatology. 1997;25:658-663. [PubMed] [DOI] |
| 7. | Boleslawski E, Conti F, Sanquer S, Podevin P, Chouzenoux S, Batteux F, Houssin D, Weill B, Calmus Y. Defective inhibition of peripheral CD8+ T cell IL-2 production by anti-calcineurin drugs during acute liver allograft rejection. Transplantation. 2004;77:1815-1820. [PubMed] [DOI] |
| 8. | Wang YL, Tang ZQ, Gao W, Jiang Y, Zhang XH, Peng L. Influence of Th1, Th2, and Th3 cytokines during the early phase after liver transplantation. Transplant Proc. 2003;35:3024-3025. [PubMed] [DOI] |
| 9. | He XY, Chen J, Verma N, Plain K, Tran G, Hall BM. Treatment with interleukin-4 prolongs allogeneic neonatal heart graft survival by inducing T helper 2 responses. Transplantation. 1998;65:1145-1152. [PubMed] [DOI] |
| 10. | Tashiro H, Shinozaki K, Yahata H, Hayamizu K, Okimoto T, Tanji H, Fudaba Y, Yamamoto H, Fan X, Ito H. Prolongation of liver allograft survival after interleukin-10 gene transduction 24-48 hours before donation. Transplantation. 2000;70:336-339. [PubMed] [DOI] |
| 11. | Sakaguchi S. Naturally arising CD4+ regulatory t cells for immunologic self-tolerance and negative control of immune responses. Annu Rev Immunol. 2004;22:531-562. [PubMed] [DOI] |
| 12. | 王 琳, 窦 科峰. T淋巴细胞与肝移植免疫. 国外医学·外科学分册. 2005;32:339-342. |
| 13. | Liu Y, Chen N, Chen G, You P. The protective effect of CD8+CD28- T suppressor cells on the acute rejection responses in rat liver transplantation. Transplant Proc. 2007;39:3396-3403. [PubMed] [DOI] |
| 15. | Ogita K, Suita S, Taguchi T, Yamanouchi T, Nakamura M, Taguchi S, Nishimoto Y, Uesugi T. Effects of omega-3 fatty acids in rat allogenic small intestinal transplantation. Pediatr Surg Int. 2003;19:157-161. [PubMed] |
| 16. | Schmöcker C, Weylandt KH, Kahlke L, Wang J, Lobeck H, Tiegs G, Berg T, Kang JX. Omega-3 fatty acids alleviate chemically induced acute hepatitis by suppression of cytokines. Hepatology. 2007;45:864-869. [PubMed] [DOI] |
| 17. | Alexander JW. Immunonutrition: the role of omega-3 fatty acids. Nutrition. 1998;14:627-633. [PubMed] [DOI] |
| 18. | Wallace FA, Miles EA, Evans C, Stock TE, Yaqoob P, Calder PC. Dietary fatty acids influence the production of Th1- but not Th2-type cytokines. J Leukoc Biol. 2001;69:449-457. [PubMed] |
| 19. | Grimm H, Tibell A, Norrlind B, Schott J, Bohle RM. Nutrition and allorejection impact of lipids. Transpl Immunol. 1995;3:62-67. [PubMed] [DOI] |
| 20. | Grimminger F, Grimm H, Führer D, Papavassilis C, Lindemann G, Blecher C, Mayer K, Tabesch F, Krämer HJ, Stevens J. Omega-3 lipid infusion in a heart allotransplant model. Shift in fatty acid and lipid mediator profiles and prolongation of transplant survival. Circulation. 1996;93:365-371. [PubMed] |
| 21. | Kort WJ, de Keijzer MH, Hekking-Weijma I, Vermeij M. Dietary fatty acids and kidney transplantation in the rat. Ann Nutr Metab. 1991;35:148-157. [PubMed] [DOI] |
| 22. | van der Heide JJ, Bilo HJ, Donker JM, Wilmink JM, Tegzess AM. Effect of dietary fish oil on renal function and rejection in cyclosporine-treated recipients of renal transplants. N Engl J Med. 1993;329:769-773. [PubMed] [DOI] |