修回日期: 2009-04-09
接受日期: 2009-04-13
在线出版日期: 2009-05-28
目的: 比较H pylori动物模型适应菌株SS1与其初发菌株10700间蛋白质组差异, 试图获得H pylori在小鼠体内适应过程中可能与定植能力增强相关的蛋白特征.
方法: 在相同件下培养SS1菌株及其初始菌株, 并制备全菌蛋白样品, 相同实验条件下重复3次, 样品经二维电泳分离, 扫描获得数字化的电泳胶图像并用ImageMaster2D图像分析软件比较分析, 识别SS1与初始菌株间的差异蛋白点. 取3次制备的样品间的共同差异点进行胶内酶解, 经基质辅助激光电离解析飞行时间质谱(MALDI-TOF-TOF/MS)获得肽质量指纹图谱, 用Mascot软件在Swiss-Prot和NCBI数据库中搜索匹配蛋白.
结果: 表达量有明显下降的11个点, 经鉴定对应10个蛋白: 4个属于H pylori的氧化还原系统, 即过氧化氢酶、超氧化物双歧酶、硫氧环蛋白和环氧蛋白还原酶; 5个蛋白与代谢有关, 即脯氨酸肽酶(proline peptidase)、果糖磷酸氢盐醛缩酶(fructose-bisphosphate aldolase)、无机焦磷酸酶(inorganic pyrophosphatase)、3-含氧酸辅酶A转移酶亚单位B(3-oxoacid CoA-transferase subunit B)和延伸因子(elongation factor P); 另1个蛋白为假想蛋白HPAG0942.
结论: H pylori在小鼠体内的定植适应过程中, 伴有代谢酶表达的降低和抗氧化水平的减弱, 提示代谢和抗氧化能力适度下调可能与菌株的定植力增强相关.
引文著录: 李晶, 赵飞, 肖迪, 何利华, 张建中. 幽门螺杆菌动物模型驯化菌株SS1与其初始菌株的差异蛋白质组分析. 世界华人消化杂志 2009; 17(15): 1508-1512
Revised: April 9, 2009
Accepted: April 13, 2009
Published online: May 28, 2009
AIM: To analyze the protein profiles of mouse-adapted H pylori SS1 and its initial strain 10700 and to find out the proteins associated with enhanced adhesive ability of SS1.
METHODS: Three sets of cellular proteins of SS1 and 10 700 were prepared independently. The samples were separated by two-dimensional gel electrophoresis (2DE) technique, and the gels were scanned and recorded as digitalized images with high-resolution scanner. The images were analyzed by Image Master 2D software. Spots on gels were paired between 10 700 and SS1. Differently expressed proteins in all three sets were cut for in-gel digestion and identified by MALDI-TOF-TOF/MS. Peptide mass fingerprints were searched in the NCBI and Swiss-Prot database.
RESULTS: Eleven down-regulated spots presented with ten proteins. Four were related to anti-oxidation, namely, catalase, thioredoxin reductase, superoxide dismutase and thioredoxin. Five were enzymes associated with metabolism, including proline peptidase, fructose-bisphosphate aldolase, inorganic pyrophosphatase, 3-oxoacid CoA-transferase subunit B and Elongation factor P. Another one was a putative protein HPAG0942.
CONCLUSION: In the course of mouse-adapted, H pylori strain SS1 may increase its adhesive ability by decreasing metabolism and anti-oxidative level measurably.
- Citation: Li J, Zhao F, Xiao D, He LH, Zhang JZ. Comparative proteomic analysis of Helicobacter pylori animal model adapted SS1 and its original strain. Shijie Huaren Xiaohua Zazhi 2009; 17(15): 1508-1512
- URL: https://www.wjgnet.com/1009-3079/full/v17/i15/1508.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i15.1508
幽门螺杆菌(Helicobacter pylori, H pylori)是定植于人体胃部的革兰阴性微需氧细菌, 他能引起胃炎、胃溃疡、甚至胃癌等多种胃部疾病[1]. H pylori的宿主特异性和组织特异性很强, 在小鼠体内的黏附定植能力弱, 为了建立小动物模型便于
H pylori的致病机制研究及防治, 人们筛选了许多种动物做实验模型[2-4], 也在小动物体内驯化H pylori以获得定植能力好的菌株[5-6], 比如中国人民解放军第三军医大学驯化的蒙古沙土鼠适应株M13[7], 本实验室驯化26695所得的88-3887(未发表), 澳大利亚Lee团队驯化的SS1及SS2000, 其中应用最为广泛的适应株当属SS1, 该菌株的黏附能力清楚, 符合洛桑会议提出的建立动物模型的标准: 动物感染后窦部和体部的定植和致病程度明确; 每克胃组织内所含的H pylori数目明确; 黏附出现和消失的时间明确; 感染达到的最长时间明确; 菌株在体外 传代多少次还能够保证有黏附能力明确. SS1具有稳定的能达到107-108 cfu/g小鼠胃的良好定植能力, 其初始菌株10700在小鼠体内能达到106 cfu/g小鼠胃, 经过驯化, SS1定植能力明显增强. 研究其定植前后的适应性变化可能会为整体上阐释H pylori的适应性机制找到线索, 也有助于说明H pylori在适应过程中与小鼠间的相互作用关系, 并为对比该菌在人体内的情况有何不同提供参考.
由O'Farrell et al[8]在1975年建立的双向电泳(two-dimensional electrophoresis, 2DE)技术可以同时分离数千种蛋白, 结合基质辅助激光解析电离飞行时间质谱(matrix assisted laser desorption ionization time of flight mass spectrometry, MALDI-TOF-MS)的快速鉴定蛋白能力, 可以对H pylori的蛋白表达有全面的认识. 本实验拟通过SS1及其初始菌株10700驯化前后的蛋白质组差异分析, 了解小鼠体内连续传代导致的细菌适应性变化规律.
H pylori动物模型适应菌株SS1、SS1初始菌株10700均由澳大利亚新南威尔士大学生物技术和分子生物学学院Jani O'Rourke博士惠赠. 哥伦比亚琼脂为Oxcid产品, 两性霉素B、多黏菌素B、万古霉素、磺胺增效剂TMP均为Ameresco产品, DTT、尿素、溴芬兰、CHAPS、Tris为Amersham Biosciences产品, 蛋白定量试剂盒、pH3-10非线性干胶条、IPG Buffer、考马斯亮兰G-250为GE Healthcare产品, 碘乙酰胺、丙烯酰胺、N, N'-甲叉双丙烯酰胺、硫脲、胰酶、乙腈为Sigma产品, 三氯醋酸为Fluka产品. 其他试剂购于北京化学试剂厂.
1.2.1 细菌培养: 将SS1和10700菌株接种于含50 mL/L绵羊全血的哥伦比亚琼脂平板上, 平板中含有两性霉素B 200 mg/L、多黏菌素B 200 mg/L、万古霉素250 mg/L、TMP 300 mg/L. 平板置于50 mL/L O2, 100 mL/L CO2, 850 mL/L N2的微需氧气体环境中37℃培养48 h后刮取菌苔, 用8.5 g/L的NaCl溶液洗涤3次以去除培养基成分和死菌, 每次离心条件为4500 g、4℃、10 min, 弃上清, 保留沉淀.
1.2.2 制备蛋白: 用丙酮三氯醋酸法制备H pylori全菌蛋白[9]. 向洗涤后的沉淀(约3皿细菌所得)中加入4-8 mL、-20℃预冷的含2 g/L二巯基苏糖醇(DTT)、200 g/L三氯醋酸(TCA)的丙酮溶液, 边加边搅拌, 然后置于-20℃约2 h; 4500 g离心后去除上清; 沉淀于-80℃冰箱中预冻1 h后冻干. 蛋白干粉溶于裂解液中, 终浓度约为5-10 g/L, 蛋白裂解液在4℃放置约4 h, 超声助溶, 至溶液澄清透明时离心, 17 000 g、4℃、10 min, 弃沉淀取上清分装保存于-80℃冰箱中备用. 蛋白定量按GE Healthcare产品说明书进行.
1.2.3 二维电泳: 第一向等电聚焦(IEF)使用24 cm pH3-10非线性干胶条, 上样量为800 μg/胶, 设置聚焦仪(Amersham Biosciences)程序为: 30 V, 6 h; 60 V, 6 h; 100 V, 1 h; 600 V, 1 h; 1000 V, 1 h; 8000 V, 10 h, gradient; 聚焦至VhT80000将胶条取出. 先后置于含10 g/L DTT和48 g/L碘乙酰胺的平衡液中振荡平衡各15 min后, 转至浓度为12.5%的聚丙烯酰胺凝胶, 进行第二向电泳: 2.5 W/胶, 30 min; 18 W/胶, 4.5 h至溴酚蓝线跑到胶最底部. 考马斯亮兰G-250染色, 并用ImageMaster 2D Platinum 5.0分析软件采集图像. 同一批制备的10700和SS1蛋白样品做差异比较, 2-DE胶上匹配点占蛋白总量的百分含量增加或降低1.5倍的为差异点, 切取3批样品中变化一致的差异点, 按说明书用胰酶进行胶内酶解.
1.2.4 质谱鉴定: ABI4700基质辅助激光电离解析飞行时间质谱分析, Nd: YAG激光器, 335 nm, 200 Hz激光激发, 应用GSP Explorer Workstation软件搜索NCBInr数据库.
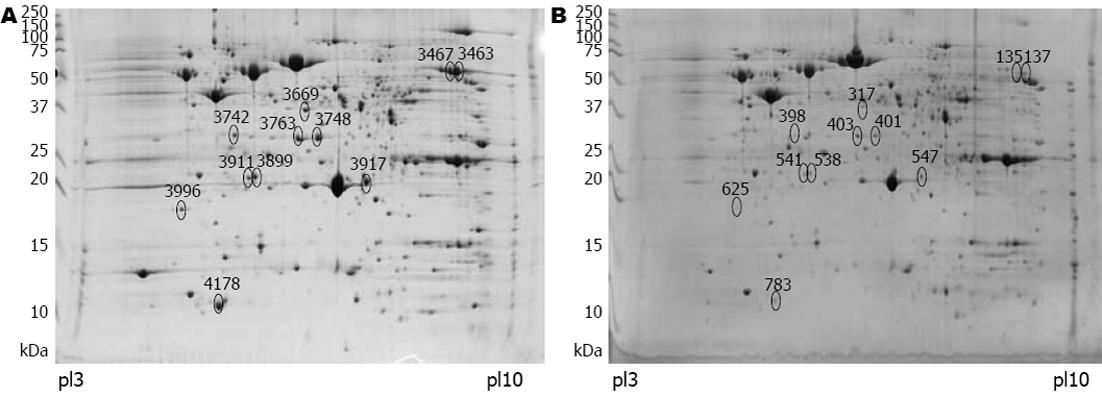
10700和SS1蛋白样品的部分2-DE图谱见图1. SS1与其初始菌株10700相比, 两个图的蛋白点分布非常相似, 差异蛋白共11个, 均为表达量减少, 差异点在2-DE图谱中的位置为图2所示.
分析每批次内制备的样品10700与SS1间的差异点, 切取三批样品的共同差异点, 胶内酶解后经MALDI-TOF/TOF-MS鉴定, 取蛋白得分值大于95%的作为鉴定结果. 每块2-DE胶切下11个点, 均表现为表达量下降倍数≥1.5倍, 鉴定结果表明为10种蛋白. 其中4个属于氧化还原系统蛋白: 过氧化氢酶, 超氧化物双歧酶, 硫氧环蛋白, 硫氧环蛋白还原酶; 5个蛋白与代谢有关: 脯氨酸肽酶(proline peptidase)、果糖磷酸氢盐醛缩酶(fructose-bisphosphate aldolase)、延伸因子Elongation factor P、无机胶磷酸酶(inorganic pyrophosphatase)、3-含氧酸辅酶A转移酶亚单位B(3-oxoacid CoA-transferase subunit B); HPAG0942为假想蛋白, 该蛋白点的表达量下降幅度比较明显. 各蛋白点鉴定时, 蛋白与离子的置信区间均高于95%, 且至少有两个肽段得分大于50或一个肽段得分大于60, 确认蛋白. 鉴定信息见表1.
| 10700 | SS1 | Protein spot | 表达量降低倍数 | Accession No. | pI/MW[Da] |
| 3463 | 137 | Catalase | 5.7 | gi|84626117 | 8.7/58489.1 |
| 3467 | 135 | Catalase | 5.4 | gi|84626117 | 8.7/58489.1 |
| 3669 | 317 | Proline peptidase | 1.8 | gi|108562835 | 5.88/40818.9 |
| 3742 | 398 | HPAG0942/jhp0892/HP0958 | 3.8 | gi|108563367 | 5.6/29515.4 |
| 3748 | 401 | Fructose-bisphosphate aldolase | 1.6 | gi|15611232 | 5.9/33776.4 |
| 3763* | 403 | Thioredoxin reductase | 1.6 | gi|15611831 | 5.93/33411.8 |
| 3899 | 538 | Elongation factor P | 1.8 | gi|18075740 | 5.43/20388.5 |
| 3911 | 541 | 3-oxoacid CoA-transferase subunit B | 1.8 | gi|2370065 | 5.42/22243,5 |
| 3917 | 547 | Superoxide dismutase | 1.8 | gi|54111600 | 6.19/24458.2 |
| 3996 | 625 | Inorganic pyrophosphatase | 1.6 | gi|15384250 | 4.99/19228.8 |
| 4178 | 783 | Thioredoxin | 1.5 | gi|15611830 | 5.16/11847.1 |
SS1菌株在小鼠体外传代20次以后仍然能够以107-108 cfu/g的定植能力定植于小鼠[5], 本实验中所用的H pylori在体外传代的次数均小于20次. 在菌株尽可能保持其定植能力的情况下, 减小细菌培养和样品制备造成的误差, 用相同的培养条件、操作方法获得其全菌蛋白是差异蛋白质组的前提, 本次实验培养细菌3次并分别制备蛋白样品. 同批次内的样品做差异点分析, 取3批样品的共同差异点用MALDI-TOF-MS/MS鉴定. H pylori蛋白的等电点大部分集中在pI 4-7和pI 7.5-10[10], 实验采用了pH3-10的胶条进行第一向等电聚焦.
2DE电泳目前仍然是分离水溶性较好的蛋白质的主流技术. 用本实验室长期使用的适合于H pylori的蛋白提取方法和2DE条件提取、分离蛋白, SS1及其原始菌株的蛋白质组轮廓很相似, 没有发现在某菌株中独特表达的菌株, 也验证了Thompson et al[6]关于SS1和初始菌株基因水平变化极小的说法.
表达下降的蛋白中, 有4个蛋白属于抗氧化系统. 许多实验都证明了抗氧化系统对H pylori的重要性, 抗氧化系统能帮助H pylori消除中性粒细胞和巨噬细胞产生的氧自由基的杀伤作用[11], 缺失了过氧化氢酶[12]和超氧化物歧化酶[13]的SS1定植于小鼠的能力大为下降. 体外克隆表达的H pylori环氧蛋白[14]能特异地还原IgG、IgA和黏液素(mucin)的链间二硫键, 环氧蛋白还原酶主要能够还原环氧蛋白, 回复环氧蛋白的活性[15]. 脯氨酸肽酶是自然界分布最广泛的渗透保护性物质, 可以防止渗透胁迫对生物造成的伤害, 且能清除自由基. 这些结果说明抗氧化系统对于H pylori的生存和定植非常重要. 在本实验中过氧化氢酶表达量明显降低, 超氧化物歧化酶、环氧蛋白和环氧蛋白还原酶也有不同程度的降低, 提示2种可能: 一方面是H pylori的防御系统有所减弱但并不明显影响其生存; 另一方面H pylori的抗氧化能力的减弱可能有助于增加定植局部的炎性反应强度, 产生有利于H pylori生存的小环境.
部分差异蛋白与代谢相关. 果糖磷酸氢盐醛缩酶催化果糖-1, 6-二磷酸形成甘油磷酸和甘油醛-3-磷酸[16], 是能量代谢中重要的一环. 无机焦磷酸酶催化无机焦磷酸水解为正磷酸, 保证细胞内焦磷酸的平衡, 同时释放出能量[17]. 延伸因子促进翻译和肽键合成的有效进行[18]. 3-含氧酸辅酶A转移酶亚单位B也参与能量代谢[19]. 能量代谢降低, 可能伴随着细菌生长速度的减慢、对生存条件中营养要求的降低, 反而利于H pylori在动物体内的生存.
据Lee et al报道[5], SS1与10700之间大约48个基因有细小变化[6], 但与本实验中鉴定出的蛋白没有直接对应关系, 说明本实验中的蛋白表达量变化可能并不是直接由于基因的变化导致. 就全菌蛋白水平来说, 可能通过调节部分抗氧化蛋白和代谢相关蛋白, SS1获得了明显增强的定植能力.
假想蛋白HPAG0942功能尚不清楚, 为何在定植能力提高的H pylori菌株SS1中表达量降低还需要进一步分析.
总之, 小鼠适应株SS1与初始菌株10700相比, 伴随着定植能力的增加, 代谢相关的蛋白、抗氧化蛋白表达量明显下降, 表明SS1菌株与机体的相互作用对长期、稳定、高效定植十分重要, 此研究结果为进一步认识H pylori与人体的相互提供了重要线索.
幽门螺杆菌(H pylori)动物模型菌株SS1筛选自大批量的临床菌株, 由其原始株在小鼠体内经过多次传代获得, 每克小鼠胃的SS1的定植数量比原始株高出两个数量级, 在体外传代20次以内定植能力不会降低, 其良好的定植能力在许多实验室被验证. 以26695菌株基因组作标准, SS1及其原始株基因水平上的变化涉及48个基因, 没有丢失或获得26695菌株中已知的基因. .
吴建国, 教授, 武汉大学生命科学学院.
SS1菌株是使用范围最广的H pylori动物模型适应菌株, 与其他临床菌株相比, 经驯化后的SS1黏附定植能力更稳定, 驯化前后变化的原因不详.
筛选出SS1菌株的实验室又筛选得一株定植能力良好的小鼠适应株SS2000, 并在基因组水平上比较了适应前后的变化; 郭刚 et al研究了HP0318基因在H pylori适应蒙古沙土鼠过程中的作用.
本实验中所用菌株为传代次数在7代以内的原始株和SS1, 原始株临床分离后未经过驯化, 尽量保持SS1和原始株各自的蛋白表达水平的原貌.
本研究采用经基质辅助激光电离解析飞行时间质谱(MALDI-TOF-TOF/MS)的方法, 对H pylori动物模型驯化菌株SS1与其出发菌株的蛋白质差异进行了分析, 实验设计合理, 实验方法新颖, 学术价值较好.
编辑: 李军亮 电编:吴鹏朕
| 1. | Maeda S, Mentis AF. Pathogenesis of Helicobacter pylori infection. Helicobacter. 2007;12 Suppl 1:10-14. [PubMed] [DOI] |
| 2. | Lachman LB, Ozpolat B, Rao XM, Graham DY, Osato M. Development of a murine model of Helicobacter pylori infection. Helicobacter. 1997;2:78-81. [PubMed] [DOI] |
| 3. | Hirayama F, Takagi S, Yokoyama Y, Iwao E, Ikeda Y. Establishment of gastric Helicobacter pylori infection in Mongolian gerbils. J Gastroenterol. 1996;31 Suppl 9:24-28. [PubMed] [DOI] |
| 4. | Lee JU, Kim O. Natural maternal transmission of H. pylori in Mongolian gerbils. World J Gastroenterol. 2006;12:5663-5667. [PubMed] |
| 5. | Lee A, O'Rourke J, De Ungria MC, Robertson B, Daskalopoulos G, Dixon MF. A standardized mouse model of Helicobacter pylori infection: introducing the Sydney strain. Gastroenterology. 1997;112:1386-1397. [PubMed] [DOI] |
| 6. | Thompson LJ, Danon SJ, Wilson JE, O'Rourke JL, Salama NR, Falkow S, Mitchell H, Lee A. Chronic Helicobacter pylori infection with Sydney strain 1 and a newly identified mouse-adapted strain (Sydney strain 2000) in C57BL/6 and BALB/c mice. Infect Immun. 2004;72:4668-4679. [PubMed] [DOI] |
| 7. | Guo G, Tong WD, Zeng H, Liu KY, Zou QM. [Comparative proteomics analysis of Helicobacter pylori after adaptive colonization in Mongolian gerbils]. Weishengwu Xuebao. 2007;47:461-464. [PubMed] |
| 8. | O'Farrell PH. High resolution two-dimensional electrophoresis of proteins. J Biol Chem. 1975;250:4007-4021. [PubMed] |
| 9. | Jiang L, He L, Fountoulakis M. Comparison of protein precipitation methods for sample preparation prior to proteomic analysis. J Chromatogr A. 2004;1023:317-320. [PubMed] [DOI] |
| 10. | Bae SH, Harris AG, Hains PG, Chen H, Garfin DE, Hazell SL, Paik YK, Walsh BJ, Cordwell SJ. Strategies for the enrichment and identification of basic proteins in proteome projects. Proteomics. 2003;3:569-579. [PubMed] [DOI] |
| 11. | Wang G, Alamuri P, Maier RJ. The diverse antioxidant systems of Helicobacter pylori. Mol Microbiol. 2006;61:847-860. [PubMed] [DOI] |
| 12. | Harris AG, Wilson JE, Danon SJ, Dixon MF, Donegan K, Hazell SL. Catalase (KatA) and KatA-associated protein (KapA) are essential to persistent colonization in the Helicobacter pylori SS1 mouse model. Microbiology. 2003;149:665-672. [PubMed] [DOI] |
| 13. | Seyler RW Jr, Olson JW, Maier RJ. Superoxide dismutase-deficient mutants of Helicobacter pylori are hypersensitive to oxidative stress and defective in host colonization. Infect Immun. 2001;69:4034-4040. [PubMed] [DOI] |
| 14. | Comtois SL, Gidley MD, Kelly DJ. Role of the thioredoxin system and the thiol-peroxidases Tpx and Bcp in mediating resistance to oxidative and nitrosative stress in Helicobacter pylori. Microbiology. 2003;149:121-129. [PubMed] [DOI] |
| 15. | Windle HJ, Fox A, Ni Eidhin D, Kelleher D. The thioredoxin system of Helicobacter pylori. J Biol Chem. 2000;275:5081-5089. [PubMed] [DOI] |
| 16. | Fonvielle M, Coincon M, Daher R, Desbenoit N, Kosieradzka K, Barilone N, Gicquel B, Sygusch J, Jackson M, Therisod M. Synthesis and biochemical evaluation of selective inhibitors of class II fructose bisphosphate aldolases: towards new synthetic antibiotics. Chemistry. 2008;14:8521-8529. [PubMed] |
| 17. | Chao TC, Huang H, Tsai JY, Huang CY, Sun YJ. Kinetic and structural properties of inorganic pyrophosphatase from the pathogenic bacterium Helicobacter pylori. Proteins. 2006;65:670-680. [PubMed] [DOI] |