修回日期: 2009-04-08
接受日期: 2009-04-13
在线出版日期: 2009-05-18
目的: 探索干扰Bmi-1基因后对其可能的下游基因Akt/PKB活性和P16INK4a基因表达的影响及对肿瘤细胞增殖和细胞衰老的作用.
方法: 用siRNA技术干扰Bmi-1表达后, 运用Western blot检测Bmi-1蛋白及相关蛋白pAkt、Akt和P16INK4a的表达, 同时进行SA-β-Gal染色检测细胞衰老, 软琼脂克隆形成实验检测细胞的增殖能力.
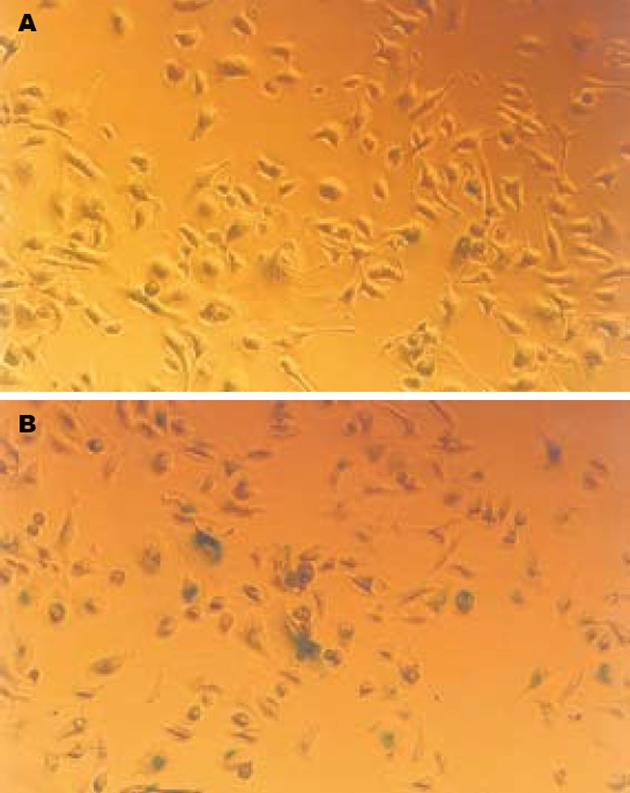
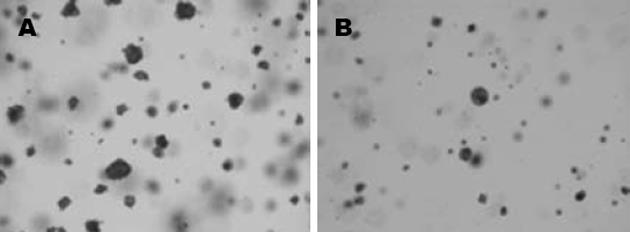
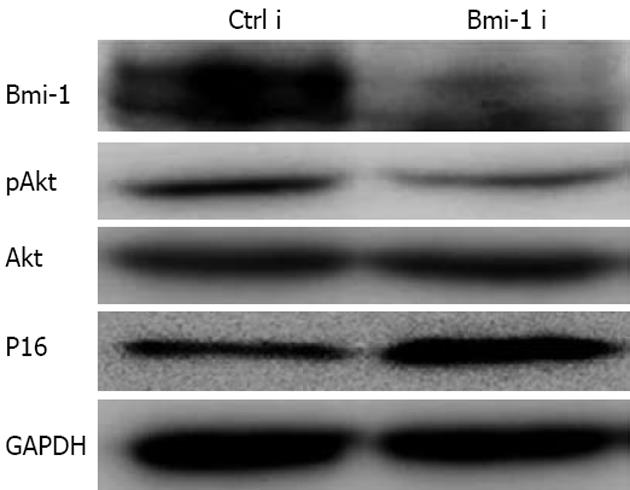
结果: 转染Bmi-1 i质粒组平均细胞衰老率28%±3.5%, 而对照Ctrl i组为16%±2.7%, 有明显统计学差异(P<0.01). 转染Bmi-1 i质粒组细胞平均克隆形成数为3.4±1.4个, 而对照Ctrl i组为11±2.3个, 两组比较有明显的统计学差异(P<0.01). Bmi-1 i 组较Ctrl i 组Bmi-1和pAkt蛋白表达明显下降, 而P16INK4a蛋白表达升高.
结论: 干扰Bmi-1可以通过降低Akt/PKB活性和上调P16INK4a蛋白表达, 促进肿瘤细胞衰老并减弱肿瘤细胞的增殖能力.
引文著录: 张晓伟, 秦薇, 郭伟剑, 李建芳, 刘炳亚, 张凤春. Bmi-1基因对胃癌细胞增殖的影响及机制. 世界华人消化杂志 2009; 17(14): 1390-1393
Revised: April 8, 2009
Accepted: April 13, 2009
Published online: May 18, 2009
AIM: To explore the effect of Bmi-1 knock-down on Akt/PKB activity, P16INK4a expression, cell proliferation and cell senescence.
METHODS: Bmi-1 expression in AGS was down-regulated using SiRNA approach; Bmi-1 protein and related proteins (pAkt, Akt, P16INK4a) were detected by Western blot. SA-β-Gal activity assay was applied for detection of the senescent cells, and soft-agar growth assay was used to detect the clone formation.
RESULTS: In the SA-β-Gal activity assay, the average senescent cell rate in Bmi-1 i group was 28% ± 3.5%, compared with 16% ± 2.7% in Ctrl i group (P < 0.01). In the soft-agar growth assay, the average clone formation number was 3.4 ± 1.4, compared with 11 ± 2.3 in Ctrl i group (P < 0.01). The Bmi-1 protein level was down-regulated significantly in the Bmi-1 i group, Akt activity was down-regulated and P16INK4a protein was up-regulated.
CONCLUSION: Bmi-1 knock-down may promote cell senescence and inhibit cell proliferation via down-regulating Akt/PKB activity and up-regulating P16INK4a.
- Citation: Zhang XW, Qin W, Guo WJ, Li JF, Liu BY, Zhang FC. Effect of Bmi-1 gene on the proliferation of gastric cancer cells and its mechanism. Shijie Huaren Xiaohua Zazhi 2009; 17(14): 1390-1393
- URL: https://www.wjgnet.com/1009-3079/full/v17/i14/1390.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i14.1390
Bmi-1基因对于肿瘤的发生、发展起着重要促进作用, 在许多肿瘤中存在Bmi-1基因的高表达[1-5], Bmi-1高表达提示预后不良[6-10]. 干扰Bmi-1的表达可以促进肿瘤细胞衰老, 而细胞衰老目前被认为是体内抵抗肿瘤的重要机制之一[11-12]. 目前研究发现, Bmi-1基因主要通过调节P16INK4a[4-5,7]和(或)Akt/PKB活性[13]在肿瘤中发挥作用, 但Bmi-1基因在胃癌细胞中的具体作用机制和功能如何, 目前相关的研究甚少. 本研究重在阐述Bmi-1基因对胃癌细胞基因表达的影响与机制.
本试验所用AGS胃癌细胞株由上海消化外科研究所保种. 采用细胞RPMI 1640培养液(杭州吉诺生物医药技术有限公司); 小牛血清(杭州四季青生物公司); 质粒抽提试剂盒(Qiagen公司); Bmi-1 i、Ctrl i质粒(Bmi-1 i指Bmi-1干扰质粒, Ctrl i指非特异片段质粒)由美国西北大学ENH研究院Dimri GP博士惠赠; 脂质体LipofectinineTM2000(Invitrogen公司); 细胞蛋白裂解液(Promega公司); BCA蛋白浓度测定试剂盒(Promega公司); 一抗: Bmi-1 mAb(Up State公司)、Akt抗体(Cell Signaling公司)、pAkt抗体(Ser 473)(Santa Cruz公司)、P16(Thermo Scientific公司)、GAPDH抗体(Kang Chen公司); 二抗: Rabbit IgG-HRP(KPL公司)、Mouse IgG-HRP(Santa Cruz公司); ECL发光液(碧云天生物技术研究所); 细胞衰老特异性β-半乳糖苷酶检测试剂盒(Genmed Scientific公司).
1.2.1 细胞培养: 本试验中胃癌细胞AGS采用含有100 g/L小牛血清的RPMI 1640细胞培养液, 于37℃, 50 mL/L CO2条件下培养.
1.2.2 Western blot: 培养AGS胃癌细胞株, 选取对数增长期细胞, 用1×PBS洗涤2次, 按细胞蛋白裂解液说明书进行操作, BCA法测定蛋白浓度. 每孔上样蛋白50 mg, 用100 g/L聚丙烯酰胺凝胶100 V恒压电泳分离约2 h; 经200 mA, 2 h湿转至PVDF膜; 加入一抗Bmi-1(1∶500)、pAkt(1∶1000)、tAkt(1∶1000)、P16(1∶1000)抗体分别4℃孵育过夜, TBST洗1次, TBS洗2次, 每次5 min; 后用辣根过氧化物酶耦联的二抗室温孵育1 h, TBST洗1次, TBS洗2次, 每次5 min; 加ECL发光液显像.
1.2.3 Bmi-1 i质粒转染AGS细胞株与筛选: 将处于对数增长期的AGS细胞铺六孔板, 用脂质体LipofectamineTM2000(Invitrogen公司)转染. 第2天转染前4 h更换含100 g/L小牛血清的RPMI 1640细胞培养液2 mL, 具体转染过程如下: 将5 mL脂质体和100 mL Opti-MEM培养液混匀静置5 min, 2 mg Bmi-1 i质粒、Ctrl i质粒分别和100 mL Opti-MEM培养液混匀静置5 min, 后将两者混匀后静置20 min加入六孔板中. 转染6 h后换液, 用0.5 mg/L嘌呤霉素筛选后进行软琼脂克隆形成实验和细胞衰老试验. 同时收取蛋白检测Bmi-1蛋白及pAkt、Akt和P16INK4a蛋白表达情况.
1.2.4 细胞衰老染色: 本实验通过检测β-半乳糖苷酶活性来判断细胞是否发生衰老, 将转染后AGS细胞接种六孔板, 24 h细胞贴壁后, 按照试剂盒说明书步骤进行染色, 后随机选取5个视野进行拍照(×200), 计数每个视野下衰老细胞百分率.
1.2.5 软琼脂克隆形成能力实验: 六孔板底层采用6 g/L软琼脂铺底, 上层采用3 g/L软琼脂培养基. 用2.5 g/L胰蛋白酶消化转染后的AGS细胞成单细胞悬液, 并作梯度倍比稀释, 按3000个/孔均匀接种到上层软琼脂中, 每组设3复孔, 培养2 wk, 随机选取5个视野进行克隆计数.
统计学处理 采用SAS 8.0软件进行统计学处理. 以mean±SD表示, 采用总体均数的假设检验(t检验)比较Bmi-1 i组与对照组Ctrl i的克隆形成能力和细胞衰老率的差异, 假定P<0.05有统计学差异. 其中克隆形成能力比较, 随机选取5个视野(×40)的平均克隆(直径>1 mm为一个克隆)数目来衡量; 细胞衰老检测随机选取5个视野(×200), 每个视野衰老细胞百分率来衡量.
每个×200视野下, 转染Bmi-1 i质粒组平均细胞衰老率28±3.5%, 而对照Ctrl i组为16%±2.7%(图1). 统计学结果显示Bmi-1下调可以促进细胞衰老, 有明显的统计学意义(P<0.01).
每个×40视野下, 转染Bmi-1 i质粒组细胞平均克隆形成数为3.4±1.4个, 而对照Ctrl i组为11±2.3个(图2). 统计学结果显示干扰Bmi-1表达可以抑制细胞增殖能力, 有明显的统计学意义(P<0.01).
Western blot结果显示: Bmi-1 i组较Ctrl i组Bmi-1蛋白表达明显下降, pAkt蛋白表达水平明显下降, 同时P16蛋白的表达升高(图3).
在人淋巴瘤[1-3]及许多癌中存在Bmi-1的高表达. 近年来的研究证实了实体瘤, 包括肺癌[4], 结、直肠癌[5]、乳腺癌[6]、鼻咽癌[7]、口腔癌[8]、皮肤癌[9]及胃癌[10]等肿瘤中均有Bmi-1高表达. Bmi-1在肿瘤中的高表达提示其在肿瘤中发挥作用.
在许多肿瘤(如肺癌[4]、结、直肠癌[5]及鼻咽癌[7])中发现, Bmi-1癌基因可以通过下调抑癌基因P16发挥作用. 同时Bmi-1基因可以通过使P16下调而延长成纤维细胞[14]和乳腺上皮细胞[15]的寿命. Itahana et al研究小鼠发现, INK4a-ARF位点是Bmi-1在体内的一个下游目标位点. INK4a-ARF编码2种抑癌基因P16Ink4a和P19ARF即(在人类为P14ARF), 前者抑制CDK4和CDK6而诱导Rb磷酸化, 后者通过与Mdm2连接而阻止P53被灭活[16]. 但对霍奇金淋巴瘤(HL)的研究却发现, Bmi-1高表达并不与P16Ink4a下调相关, 提示Bmi-1可能存在其他通路. 最近Guo et al[13]在MCF-7乳腺癌细胞中发现, 使Bmi-1基因沉默可以使Akt/PKB活性下调, 并促进肿瘤细胞衰老, 同时细胞增殖能力下降. 然而, 在胃癌中是否存在该调控机制, 目前仍无相关研究报道.
本研究通过RNA i技术干扰AGS胃癌细胞中Bmi-1基因表达后, Bmi-1蛋白表达下调, Akt/PKB活性随之下调, P16蛋白表达亦升高. 提示在该细胞中Bmi-1可能通过调节Akt/PKB活性和上调P16蛋白途径发挥作用. 被Bmi-1活化后的pAkt可能进一步通过激活或抑制其下游靶蛋白GSK-3、FKHR、P21Cip1和P27Kip1等, 进而调节细胞增殖、分化、凋亡以及迁移等[17].
细胞增殖能力和以生长停滞为特征的细胞衰老均与细胞周期的关系密切. 细胞周期被细胞周期蛋白依赖性激酶(cyclin-dependent kinase, CDK)复合物和CDK抑制剂(cyclin-dependent kinases inhibitors, CDIs)的协调作用所调节, Akt可以通过调节细胞周期影响细胞增殖. Akt通过直接磷酸化抑制GSK3β的激酶活性从而阻止Cyclin D1的降解, Akt还对CKIs如P27Kip1和P21Cip1的表达具有负调节作用, 通过影响P21Cip1的磷酸化和与PCNA结合而调节P21Cip1的活性, 导致细胞增殖的增加[17]. Akt还能直接磷酸化P27Kip1的Thr157, 导致P27Kip1在细胞质中的滞留, 防止由P27Kip1所导致的细胞周期的阻滞[18]. 本研究Bmi-1 i组的细胞克隆形成能力较对照组下降, 这与Guo et al[13]和Chang et al[19]的研究结果一致. AGS细胞中, 干扰Bmi-1导致其对Akt的磷酸化下降, 进而可能通过GSK3β/Cyclin D1途径和(或)使CKI(P27Kip1和P21Cip1)进而导致细胞生长停滞, 引起细胞衰老增加和增殖能力的下降. 而越来越多的研究证实: 细胞衰老是体内细胞抵抗肿瘤发生的重要机制. 在人和鼠的体内实验均证实: 肿瘤细胞衰老是体内抵抗肿瘤发生的重要机制[11,14], 许多抗肿瘤药物可以诱导肿瘤细胞发生衰老, 可见如何使肿瘤细胞发生衰老可能成为肿瘤治疗的新途径. 本研究表明: 干扰Bmi-1可以使Akt/PKB活性下降而促进肿瘤细胞衰老, 同时在Bmi-1基因沉默或缺失的MCF-7乳腺癌细胞[13], MEF细胞[12]和Bmi-1-/- 3T3细胞[16]中均发现细胞过早衰老, 与本实验研究结果一致.
总之, Bmi-1作为癌基因在肿瘤的发生、发展中发挥作用; 干扰Bmi-1基因表达可通过下调Akt/PKB活性和上调P16的表达而导致胃癌细胞衰老, 同时细胞增殖能力亦下降而起到抑制肿瘤作用. 可见, 对Bmi-1基因的深入研究, 将更好揭示Bmi-1在肿瘤发生、发展中的机制, 有可能成为生物治疗的新靶点.
胃癌是消化系肿瘤中常见肿瘤. 较多的研究发现癌基因Bmi-1广泛参与肿瘤发生、发展、浸润及转移, 其高表达提示预后不良. Bmi-1癌基因具体机制目前主要集中对P16INK4a和Akt/PKB活性调节两方面. 在胃癌细胞中对Bmi-1进行研究, 将进一步明确Bmi-1的功能和机制.
陈卫昌, 教授, 苏州大学附属第一医院消化内科
RNA干扰技术现已广泛应用于基因机制的探索, 通过其干扰基因的表达后, 可进一步探索该基因对细胞的具体功能和可能下游基因的表达改变, 从而有助于明确该基因可能的下游基因.
本研究应用RNA干扰技术干扰胃癌细胞Bmi-1癌基因的表达后, 检测其对细胞衰老和增殖能力的影响. 同时运用Western blot技术验证其可能的下游调控蛋白的表达改变, 从而明确Bmi-1基因具体发挥作用机制.
本研究选题尚可, 设计合理, 具有一定的研究价值和可读性.
编辑: 李军亮 电编:何基才
| 1. | van Kemenade FJ, Raaphorst FM, Blokzijl T, Fieret E, Hamer KM, Satijn DP, Otte AP, Meijer CJ. Coexpression of BMI-1 and EZH2 polycomb-group proteins is associated with cycling cells and degree of malignancy in B-cell non-Hodgkin lymphoma. Blood. 2001;97:3896-3901. [PubMed] [DOI] |
| 2. | Lindström MS, Klangby U, Wiman KG. p14ARF homozygous deletion or MDM2 overexpression in Burkitt lymphoma lines carrying wild type p53. Oncogene. 2001;20:2171-2177. [PubMed] [DOI] |
| 3. | Beà S, Tort F, Pinyol M, Puig X, Hernández L, Hernández S, Fernandez PL, van Lohuizen M, Colomer D, Campo E. BMI-1 gene amplification and overexpression in hematological malignancies occur mainly in mantle cell lymphomas. Cancer Res. 2001;61:2409-2412. [PubMed] |
| 4. | Vonlanthen S, Heighway J, Altermatt HJ, Gugger M, Kappeler A, Borner MM, van Lohuizen M, Betticher DC. The bmi-1 oncoprotein is differentially expressed in non-small cell lung cancer and correlates with INK4A-ARF locus expression. Br J Cancer. 2001;84:1372-1376. [PubMed] [DOI] |
| 5. | Kim JH, Yoon SY, Kim CN, Joo JH, Moon SK, Choe IS, Choe YK, Kim JW. The Bmi-1 oncoprotein is overexpressed in human colorectal cancer and correlates with the reduced p16INK4a/p14ARF proteins. Cancer Lett. 2004;203:217-224. [PubMed] [DOI] |
| 6. | Feng Y, Song LB, Guo BH, Liao WT, Li MZ, Liu WL, Zeng MS, Zhang L. [Expression and significance of Bmi-1 in breast cancer]. Ai Zheng. 2007;26:154-157. [PubMed] |
| 7. | Song LB, Zeng MS, Liao WT, Zhang L, Mo HY, Liu WL, Shao JY, Wu QL, Li MZ, Xia YF. Bmi-1 is a novel molecular marker of nasopharyngeal carcinoma progression and immortalizes primary human nasopharyngeal epithelial cells. Cancer Res. 2006;66:6225-6232. [PubMed] [DOI] |
| 8. | Kang MK, Kim RH, Kim SJ, Yip FK, Shin KH, Dimri GP, Christensen R, Han T, Park NH. Elevated Bmi-1 expression is associated with dysplastic cell transformation during oral carcinogenesis and is required for cancer cell replication and survival. Br J Cancer. 2007;96:126-133. [PubMed] [DOI] |
| 9. | Reinisch CM, Uthman A, Erovic BM, Pammer J. Expression of BMI-1 in normal skin and inflammatory and neoplastic skin lesions. J Cutan Pathol. 2007;34:174-180. [PubMed] [DOI] |
| 10. | Reinisch C, Kandutsch S, Uthman A, Pammer J. BMI-1: a protein expressed in stem cells, specialized cells and tumors of the gastrointestinal tract. Histol Histopathol. 2006;21:1143-1149. [PubMed] |
| 11. | Feldser DM, Greider CW. Short telomeres limit tumor progression in vivo by inducing senescence. Cancer Cell. 2007;11:461-469. [PubMed] [DOI] |
| 12. | Jacobs JJ, Kieboom K, Marino S, DePinho RA, van Lohuizen M. The oncogene and Polycomb-group gene bmi-1 regulates cell proliferation and senescence through the ink4a locus. Nature. 1999;397:164-168. [PubMed] [DOI] |
| 13. | Guo WJ, Zeng MS, Yadav A, Song LB, Guo BH, Band V, Dimri GP. Mel-18 acts as a tumor suppressor by repressing Bmi-1 expression and down-regulating Akt activity in breast cancer cells. Cancer Res. 2007;67:5083-5089. [PubMed] [DOI] |
| 14. | Braig M, Lee S, Loddenkemper C, Rudolph C, Peters AH, Schlegelberger B, Stein H, Dörken B, Jenuwein T, Schmitt CA. Oncogene-induced senescence as an initial barrier in lymphoma development. Nature. 2005;436:660-665. [PubMed] [DOI] |
| 15. | Dimri GP, Martinez JL, Jacobs JJ, Keblusek P, Itahana K, Van Lohuizen M, Campisi J, Wazer DE, Band V. The Bmi-1 oncogene induces telomerase activity and immortalizes human mammary epithelial cells. Cancer Res. 2002;62:4736-4745. [PubMed] |
| 16. | Itahana K, Zou Y, Itahana Y, Martinez JL, Beausejour C, Jacobs JJ, Van Lohuizen M, Band V, Campisi J, Dimri GP. Control of the replicative life span of human fibroblasts by p16 and the polycomb protein Bmi-1. Mol Cell Biol. 2003;23:389-401. [PubMed] [DOI] |
| 17. | Lee SH, Kim HS, Park WS, Kim SY, Lee KY, Kim SH, Lee JY, Yoo NJ. Non-small cell lung cancers frequently express phosphorylated Akt; an immunohistochemical study. APMIS. 2002;110:587-592. [PubMed] [DOI] |
| 18. | Viglietto G, Motti ML, Bruni P, Melillo RM, D'Alessio A, Califano D, Vinci F, Chiappetta G, Tsichlis P, Bellacosa A. Cytoplasmic relocalization and inhibition of the cyclin-dependent kinase inhibitor p27(Kip1) by PKB/Akt-mediated phosphorylation in breast cancer. Nat Med. 2002;8:1136-1144. [PubMed] [DOI] |