修回日期: 2009-03-02
接受日期: 2009-03-09
在线出版日期: 2009-04-28
目的: 系统评价全胃联合脾切除治疗进展期胃癌的有效性及安全性.
方法: 计算机检索PubMed、EMBase、Cochrane Library、中国生物医学文献数据库、中国期刊全文数据库及中文科技期刊全文数据库, 手工检索相关杂志搜集有关全胃联合脾切除(TGS)与全胃切除(TG)两种不同术式治疗进展期胃癌的随机对照试验. 按照Cochrane系统评价方法对纳入研究的方法学质量进行评价, 用RevMan 4.2.10软件进行统计分析.
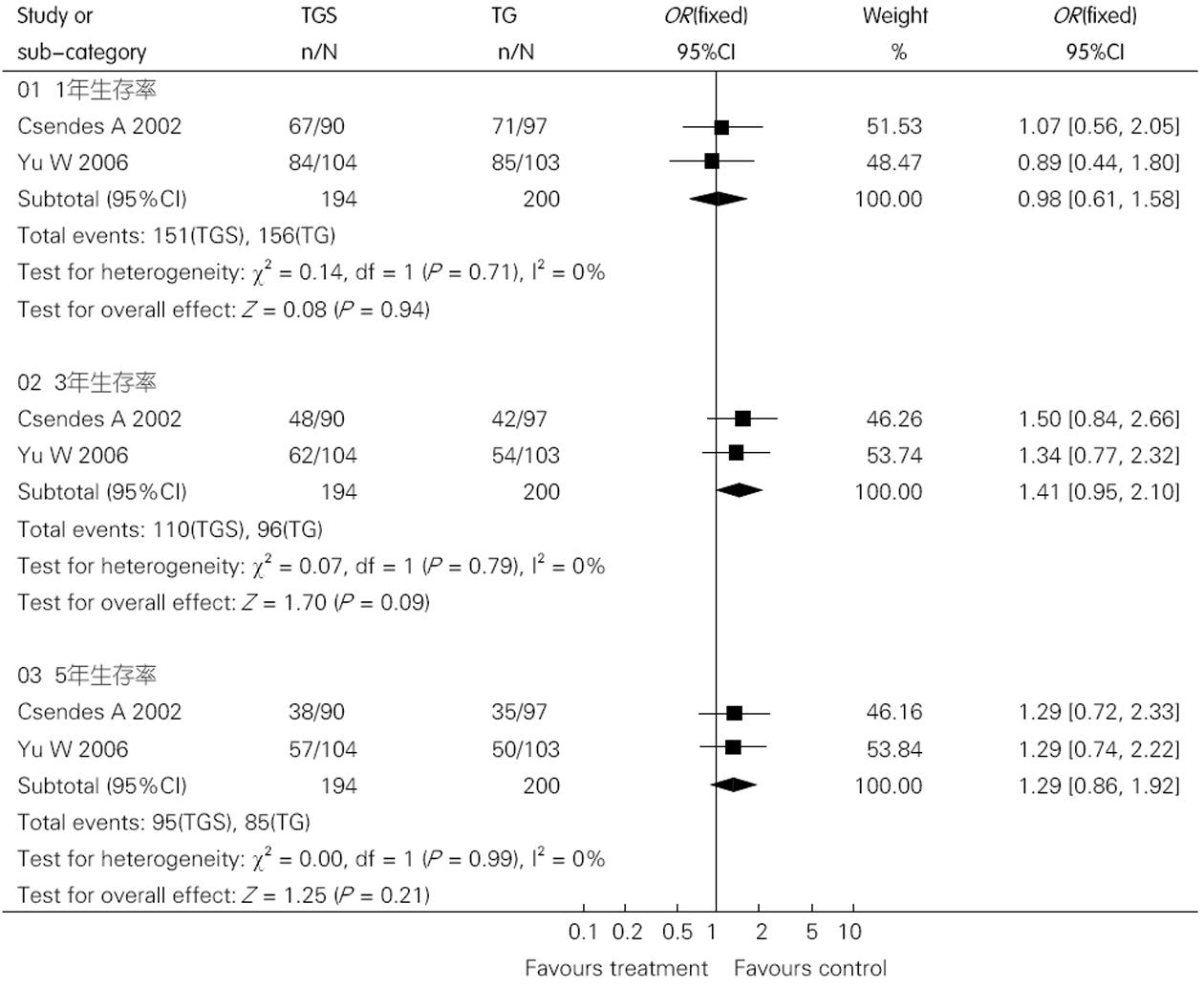
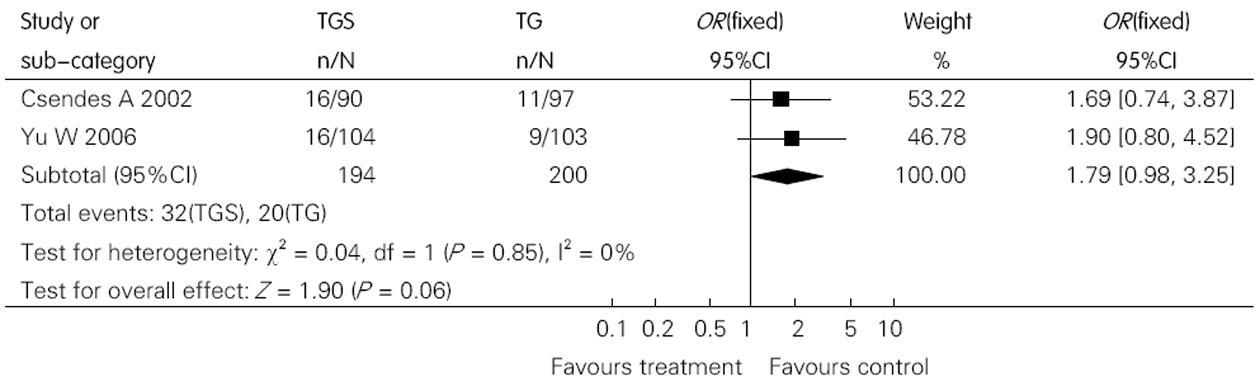
结果: 纳入2个随机对照试验共394例患者, 各研究基线资料具有可比性, 均报道随机方法但未提及盲法和分配隐藏. Meta分析显示, 两组1、3、5年生存率和并发症发生率的差异均无统计学意义[OR = 0.98、1.41、1.29、1.79, 95%CI: (0.61, 1.58)、(0.95, 2.10)、(0.86, 1.29)、(0.98, 3.25), P>0.05], 但感染性并发症的差异有统计学意义(P<0.05).
结论: 除非脾脏癌转移或为彻底清扫脾门和脾动脉干阳性淋巴结, 应避免在进展期胃癌全胃切除术中联合脾切除.
引文著录: 李鹏, 何晓东, 田金徽, 杨克虎, 姜雷. 全胃联合脾切除治疗进展期胃癌的系统评价. 世界华人消化杂志 2009; 17(12): 1241-1246
Revised: March 2, 2009
Accepted: March 9, 2009
Published online: April 28, 2009
AIM: To assess the efficacy and safety of total gastrectomy and splenectomy versus total gastrectomy in patients with advanced gastric cancer.
METHODS: We searched PubMed, Embase, Cochrane Library, Chinese Bio-medicine Database, China journal full-text database, Chinese scientific journals full-text database and manually searched some related randomized controlled trials about total gastrectomy splenectomy (TGS) and total gastrectomy (TG) for advanced gastric cancer in journals. The quality of included studies was assessed according to the Cochrane systematic review method and statistical analysis was performed using RevMan 4.2.10 software.
RESULTS: Two randomized controlled trials involving 394 patients met the inclusion criteria. All the studies mentioned method of randomization but didn't describe the use of blinding and allocated concealment. The baseline of the included study was comparable. The meta-analysis showed that there were no statistically differences between the two groups in 1, 3, 5 year survival rate and complications [OR = 0.98, 1.41, 1.29, 1.79; 95%CI: (0.61, 1.58), (0.95, 2.10), (0.86, 1.29), (0.98, 3.25), all P > 0.05] respectively, but there were statistically differences in infected complications (P < 0.05).
CONCLUSION: Splenectomy in advanced gastric cancer patients who receive total gastrectomy should generally be avoided, unless cancer metastatis has reached spleen or in order to thoroughly clear away positive lymphoid node.
- Citation: Li P, He XD, Tian JH, Yang KH, Jiang L. Meta-analysis of total gastrectomy and splenectomy in advanced gastric cancer. Shijie Huaren Xiaohua Zazhi 2009; 17(12): 1241-1246
- URL: https://www.wjgnet.com/1009-3079/full/v17/i12/1241.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i12.1241
胃癌是临床最常见的肿瘤之一, 其发病率和死亡率在恶性肿瘤中均排列前三位. 我国是胃癌的高发地区, 发病率在全国有明显的地区差异. 以手术为主的综合治疗一直是胃癌根治性治疗的主要手段, 目前胃癌切除术后患者的5年生存率为30%-60%. 胃癌的确切发病机制仍不清楚, 愈后受肿瘤病理类型、临床分期、手术范围、围手术期辅助治疗和机体免疫状态等因素的综合影响. 1948年提出脾切除作为胃癌根治的组成部分, 希望更利于清扫脾门和脾动脉干淋巴结[1-2]. 随着对脾脏免疫功能的不断认识和手术病例的积累与回顾分析总结, 对脾切除治疗进展期胃癌的价值受到了学者们的疑问[3-8], 其焦点主要集中在: (1)脾切除对手术根治性、生存率、并发症及手术死亡率的影响; (2)脾脏在肿瘤生物学和免疫学方面的影响; (3)脾切除的指征等. 目前, 胃癌根治是否联合脾切除及其预后在不同地域仍有较大的差异, 为此我们搜集全胃联合脾切除(total gastrectomy splenectomy, TGS)与全胃切除(total gastrectomy, TG)治疗进展期胃癌的随机对照试验进行疗效和安全性的系统评价, 以期为临床实践提供决策依据.
以"(胃癌 OR 胃肿瘤)AND(胃切除 OR 胃癌根治术)AND脾切除术"检索中国生物医学文献数据库(1978/2008-09), 中国期刊全文数据库(1994/2008-09), 中文科技期刊全文数据库(1989/2008-09); 以"(stomach neoplasm* OR gastric neoplasm* OR stomach cancer* OR gastric cancer*) AND gastrectomy AND splenectomy"检索Cochrane Library(2008年第1期), PubMed (1966/2008-09), EMBase(1974/2008-09). 检索词分目标疾病和干预措施两大部分, 并根据具体数据库调整, 所有检索采用主题词与自由词相结合的方式, 检索策略经多次预检索后确定. 再通过手工检索《中华外科杂志》、《中国实用外科杂志》、《普外临床》、《腹部外科》、《中华胃肠外科杂志》、《癌症》、《肿瘤》, 期限为1994/2008-09. 并用Google Scholar、Medical Martix等搜索引擎在互联网上查找相关文献, 追查已纳入研究的参考文献, 与本领域专家、通讯作者等联系以获取以上检索未发现的相关信息. 如研究报告不详或资料缺乏, 通过与作者联系获取.
最初检出相关文献309篇, 阅读题目和摘要, 排除非随机对照试验、重复无实质性相关内容、非临床研究和非治疗性文献306篇, 剩下3篇查找原文进一步确定, 1篇为D1与D2术式的RCT被排除, 最终2篇RCT符合纳入标准, 共394例患者, 其中TGS组194例, TG组200例.
1.2.1 文献纳入/排除标准: (1)研究类型: 纳入随机对照试验, 无论是否采用盲法. (2)研究对象: 所有具有手术指征的进展期胃癌患者. 无严重心肺功能病变, 无肝硬化、门静脉高压、腹水和自发血小板减少性紫癜. 排除肺、肝脏、腹膜及肾上腺等脏器转移, 无食管、胰腺、胃大弯、肠道及脾脏等浸润. 排除术中放疗、化疗等辅助性治疗患者. (3)干预措施: 试验组: D2全胃切除联合脾切除; 对照组: D2 TG不联合脾切除. (4)观察指标: 1、3、5年生存率、并发症发生率、手术死亡率、肿瘤学方面、再手术率、手术时间和住院时间.
1.2.2 文献筛选与资料提取: 2位研究者独立阅读所获文献题目和摘要, 排除明显不符合纳入标准的试验, 对可能符合纳入标准的试验阅读全文, 以确定其是否纳入. 2位研究者交叉核对纳入试验的结果, 对有分歧而难以确定其是否纳入的试验通过讨论或由第3位研究者决定其是否纳入.
提取资料主要包括: 一般资料: 题目、发表年份和出处; 研究特征: 研究对象的一般情况、各组患者的基线、干预措施; 测量指标: 生存率、并发症发生率、手术死亡率、肿瘤学方面、再手术率、手术时间和住院时间.
1.2.3 质量评价: 纳入文献的方法学质量依据Cochrane评价手册4.2.6随机对照试验的质量评价标准进行评价. 采用何种随机分配方法, 方法是否正确; 是否进行分配隐藏, 方法是否正确; 是否采用盲法, 对那些人实施盲法; 有无失访和退出, 是否采用意向性分析(ITT).
统计学处理 采用Cochrane协作网提供的RevMan 4.2.10软件进行Meta分析. 计数资料采用比数比(OR)为疗效分析统计量; 计量资料采用加权均数差(WMD)或标准化均数差(SMD). 各效应量均以95%CI表示. 纳入研究结果间的异质性采用c2检验, 若纳入研究具有足够一致性(P>0.10和I2<50%)时, 采用固定效应模型进行分析, 若纳入研究存在异质性时, 分析其异质性来源, 对可能导致异质性的因素进行亚组分析. 若各研究间存在统计学异质性而无临床异质性或差异无临床意义时, 采用随机效应模型. 如各组间异质性过大, 则采用描述性分析. 必要时, 采用敏感性分析检验结果的稳定性.
2个研究均提到随机, 1个研究[9]采用计算机软件对患者和手术方案编号, 然后进行随机分组, 1个研究[10]未提到具体随机方法; 2个研究的分配隐藏和盲法均不清楚; 2个研究提及失访但均未进行ITT(表1).
2.2.1 生存率: 本研究报告的随访时间均为5年, 分别失访7例(3.4%)[9]和8例(4.4%)[10]. Meta分析显示(图1), 两组之间1, 3, 5年生存率的差异均无统计学意义, 其OR(95%CI)分别为0.98(0.61, 1.58), 1.41(0.95, 2.10), 1.29(0.86, 1.92).
2.2.2 并发症发生率: 并发症包括肺部感染、十二指肠残端瘘、吻合口瘘、腹腔脓肿、上消化道出血、深静脉血栓形成及切口感染等. 本研究显示两组之间并发症的差异无统计学意义(OR = 1.79, 95%CI 0.98, 3.25)(图2). Csendes et al[10]报告TGS组感染性并发症高于TG组, 分别为106和79例, 差异有统计学意义(P<0.04), 非感染性并发症的差异无统计学意义(P>0.05); Yu et al[9]报告TGS组与TG组并发症分别为16例(15.4%)和9例(8.7%), 感染性并发症分别为8例和7例, 差异无统计学意义(P>0.05).
2.2.3 手术死亡率: 包括术中和住院期间死亡病例, Csendes et al[10]报告TGS组4例(4.4%)、TG组3例(3.1%); Yu et al[9]报告TGS组2例(1.9%)、TG组1例(1%). 差异无统计学意义(P>0.05).
2.3.1 肿瘤学方面: Yu et al[9]报告TGS组与TG组的淋巴结清扫数分别为40(5-93)枚和40(4-94)枚, TGS组45例死于癌复发, TG组是51例; Csendes et al[10]报告两组的淋巴结清扫数平均为30(22-38)枚, 差异无统计学意义(P>0.05).
2.3.2 再手术: Csendes et al[10]报告因并发腹腔脓肿、瘘、肠梗阻等行再次手术, TGS组与TG组分别为10例(11.1%)和9例(9.3%), 差异无统计学意义(P>0.8).
2.3.3 手术时间评估: Csendes et al[10]报告TGS组与TG组的平均手术时间分别为218(120-440) min和208(90-450) min, 差异无统计学意义(P>0.07).
2.3.4 住院时间: Csendes et al[10]报告TGS组与TG组的平均住院时间分别为21.6(9-71) d和18.4(9-81) d; Yu et al[9]报告TGS组与TG组的平均住院时间分别为11(1-71) d和11(8-60) d; 差异无统计学意义(P>0.05).
进展期胃癌TG是否联合脾切除一直存在争议. 脾切除者认为从胚胎、解剖方面考虑胃癌是一区域性疾病, 唯区域性整块切除(包括脾脏和脾门、脾动脉干淋巴结的清扫)才能使手术具有更大的彻底性; 脾切除可使脾门、脾动脉干淋巴结和周围组织暴露更清楚, 清扫更彻底, 必将减少肿瘤复发和增加生存率[2]. 脾保留者认为保留脾脏可以改善患者的全身免疫与自身调节功能, 进而提高生存率和生活质量; 另外, 胃的淋巴回流是从胃左上方进人脾门沿脾动脉流向腹腔动脉, 但脾门、脾动脉旁淋巴液并不回流入脾脏, 脾脏很少发生癌肿转移. 本研究[9-10]显示两组生存率的差异无统计学意义, 表明脾切除对生存率无影响, 这与回顾性研究认为脾切除降低生存率的结论相左[8,11-15]; 分析显示, (1)RCT的两组患者在年龄、性别、肿瘤大小、肿瘤位置、Borrmann分型、组织学类型、分化程度、浸润深度、TNM分期、切除的淋巴结数目和淋巴结转移率等方面差异较小, 而回顾性研究[1-3,13-15]的两组患者在此方面的差异较大, 虽显示TGS组明显降低生存率, 但同时也发现TGS组脾门、脾动脉干阳性淋巴结, Ⅲ、Ⅳ期病例比例高, 而脾门或脾动脉干淋巴结转移的几率与肿瘤分期和部位有关. 由此可知, 回顾性研究的病例, 病程越晚越偏向于脾切除, 因此其生存率也随之降低. (2)RCT是多个专业治疗中心合作研究, 回顾性研究多来自单个医疗单位的资料, 手术者的实践经验、手术技能和围手术期处理可能有差异; 部分研究[16]含有D1术式, 其两组的5年生存率相似, 而D2术式TGS组的5年生存率比TG组高; 部分是胃大部切除患者, 接受化疗、放疗和免疫等辅助治疗, 且治疗方案各异; 这些因素影响了脾切除与生存率关系的判断. 由于RCT设计严谨, 偏倚较小, 因此, RCT的结论更可靠真实.
Fujita et al[17]研究证明脾脏在调节人体免疫功能和抑制肿瘤细胞生长方面发挥积极作用, 脾切除不仅使机体易感染, 而且使肿瘤易复发. Csendes et al[10]研究显示TGS组感染性并发症高于TG组, 而非感染性并发症两组间无差异, 回顾性研究[2-3,8,13,18]的报告与此类似, 通过逻辑回顾分析证明脾切除是独立的与感染性并发症增加有关的因素[7,18]. 本研究报告胃癌各分期的5年生存率均相似; Yu et al[9]报道随访死于癌复发者两组相似; 证明了仅肿瘤浸润深度和淋巴结转移率是影响胃癌愈后的独立因素, 虽脾脏对肿瘤具有免疫功能, 但脾切除不是独立的影响因素这一观点.
Meta分析结果显示两组手术死亡率相似且较低, 回顾性研究[2,14,17]也有类似报道, 从研究发表时间看, 早期的病例5年生存率较低, 并发症发生率和手术死亡率较高, 而近年发表的研究[15-16]与此相反, 且手术死亡率近于零; 表明手术技术、学习曲线和围手术期治疗影响胃癌愈后.
Meta分析结果显示两组的淋巴结清扫数无差异, 而回顾性研究[4,12]报告两组的淋巴结清扫数差异很小, 表明不切除脾脏仍能彻底清扫胃周区域淋巴结. 回顾性研究[1-3,14]报告存在脾门、脾动脉干淋巴结微转移灶, 本研究报告与此类似, 因脾门、脾动脉干淋巴结转移影响胃癌愈后, 对其清扫很有必要. 本研究报告两组患者的平均住院时间无差异. Csendes et al[10]报告两组患者的手术时间, 再手术率无差异; 表明脾切除不增加手术时间、再手术率和住院时间.
总之, 影响胃癌愈后的因素很多, 脾切除降低抗肿瘤免疫功能和脾切除使胃周淋巴结清扫更彻底对肿瘤复发和生存率的影响孰大孰小尚难定论, 因手术技术的不断进步, 围手术期综合治疗与护理水平的提高, 目前手术死亡率, 并发症发生率明显降低, 术后生存率无差异.
本研究两篇文献没有对分配隐藏和盲法作具体的描述, 外科手术疗效比较的RCT可行性差, 即可对照病例难选择, 尤其肿瘤手术治疗的个体化原则使RCT很难实施分配隐藏和盲法, 只能实施随机和减少失访率与资料缺失, 干预措施即手术方式的具体操作过程和围手术期综合治疗难比较, 术后随访和生存质量亦难评估, 即存在选择性偏倚、实施偏倚和测量性偏倚. 本研究纳入的两篇RCT由不同的研究中心完成, 手术者的操作技能和围手术期治疗可能有一定的差别, 如根治标准、手术创伤大小、术中失血量、淋巴结清扫范围、是否联合其他脏器切除、术后护理和支持治疗等. 另外, 纳入的研究存在失访, 资料提取过程中, 部分数据来源于图表, 可能存在信息偏倚.
当前研究可能表明, 脾切除增加进展期胃癌全胃切除术的感染性并发症发生率, 不改善生存率, 不影响手术死亡率, 因此, 除非脾脏癌转移或为彻底清扫脾门和脾动脉干阳性淋巴结, 应避免在进展期胃癌TG术中联合脾切除. 由于纳入文献样本量较少, 本结论尚需更高质量的多中心大样本的随机对照试验进一步证实.
1948年提出脾切除作为胃癌根治的组成部分, 希望更利于清扫脾门和脾动脉干淋巴结. 随着对脾脏免疫功能的不断认识和手术病例的积累与回顾分析总结, 对脾切除治疗进展期胃癌的价值受到了学者们的疑问.
高泽立, 主任医师, 上海交通大学医学院附属第九人民医院周浦分院消化科; 吴泰璜, 教授, 山东省立医院肝胆外科
目前, 胃癌根治是否联合脾切除及其预后在不同地域仍有较大的差异.
Yu et al报道随访死于癌复发者两组相似; 证明了仅肿瘤浸润深度和淋巴结转移率是影响胃癌愈后的独立因素, 虽脾脏对肿瘤具有免疫功能, 但脾切除不是独立的影响因素这一观点.
除非脾脏癌转移或为彻底清扫脾门和脾动脉干阳性淋巴结, 应避免在进展期胃癌全胃切除术中联合脾切除.
本文不但为外科医师为胃癌手术术式的选择提供了理论依据, 对基础研究者与肿瘤工作者在化疗、生物治疗及综合治疗胃肠道恶性肿瘤中的实践提供了理论和实践依据.
编辑: 李军亮 电编:何基才
| 1. | Okajima K, Isozaki H. Splenectomy for treatment of gastric cancer: Japanese experience. World J Surg. 1995;19:537-540. [PubMed] [DOI] |
| 2. | Wanebo HJ, Kennedy BJ, Winchester DP, Stewart AK, Fremgen AM. Role of splenectomy in gastric cancer surgery: adverse effect of elective splenectomy on longterm survival. J Am Coll Surg. 1997;185:177-184. [PubMed] |
| 3. | Maehara Y, Moriguchi S, Yoshida M, Takahashi I, Korenaga D, Sugimachi K. Splenectomy does not correlate with length of survival in patients undergoing curative total gastrectomy for gastric carcinoma. Univariate and multivariate analyses. Cancer. 1991;67:3006-3009. [PubMed] [DOI] |
| 4. | Kim WS, Noh SH, Yoo CH, Kim YI, Kim CB, Lee KS, Min J. Effectiveness of combined resection of spleen in total gastrectomy for gastric cancer. J Korean Surg Soc. 1998;54:363-368. |
| 5. | Lee JB, Mok YJ. Significance of a splenectomy with a curative total gastrectomy for gastric cancer. J Kor Surg Soc. 1998;55:70-75. |
| 6. | Meyer HJ, Jähne J, Wilke H, Pichlmayr R. Surgical treatment of gastric cancer: retrospective survey of 1,704 operated cases with special reference to total gastrectomy as the operation of choice. Semin Surg Oncol. 1991;7:356-364. [PubMed] [DOI] |
| 7. | Otsuji E, Yamaguchi T, Sawai K, Ohara M, Takahashi T. End results of simultaneous splenectomy in patients undergoing total gastrectomy for gastric carcinoma. Surgery. 1996;120:40-44. [PubMed] [DOI] |
| 8. | Brady MS, Rogatko A, Dent LL, Shiu MH. Effect of splenectomy on morbidity and survival following curative gastrectomy for carcinoma. Arch Surg. 1991;126:359-364. [PubMed] |
| 9. | Yu W, Choi GS, Chung HY. Randomized clinical trial of splenectomy versus splenic preservation in patients with proximal gastric cancer. Br J Surg. 2006;93:559-563. [PubMed] [DOI] |
| 10. | Csendes A, Burdiles P, Rojas J, Braghetto I, Diaz JC, Maluenda F. A prospective randomized study comparing D2 total gastrectomy versus D2 total gastrectomy plus splenectomy in 187 patients with gastric carcinoma. Surgery. 2002;131:401-407. [PubMed] [DOI] |
| 11. | Stipa S, Di Giorgio A, Ferri M, Botti C. Results of curative gastrectomy for carcinoma. J Am Coll Surg. 1994;179:567-572. [PubMed] |
| 12. | Adachi Y, Kamakura T, Mori M, Maehara Y, Sugimachi K. Role of lymph node dissection and splenectomy in node-positive gastric carcinoma. Surgery. 1994;116:837-841. [PubMed] |
| 13. | Griffith JP, Sue-Ling HM, Martin I, Dixon MF, McMahon MJ, Axon AT, Johnston D. Preservation of the spleen improves survival after radical surgery for gastric cancer. Gut. 1995;36:684-690. [PubMed] [DOI] |
| 14. | Zhang CH, Zhan WH, He YL, Chen CQ, Huang MJ, Cai SR. Spleen preservation in radical surgery for gastric cardia cancer. Ann Surg Oncol. 2007;14:1312-1319. [PubMed] [DOI] |
| 15. | Saji S, Sakamoto J, Teramukai S, Kunieda K, Sugiyama Y, Ohashi Y, Nakazato H. Impact of splenectomy and immunochemotherapy on survival following gastrectomy for carcinoma: covariate interaction with immunosuppressive acidic protein, a serum marker for the host immune system. Tumor Marker Committee for the Study Group of Immunochemotherapy with PSK for Gastric Cancer. Surg Today. 1999;29:504-510. [PubMed] [DOI] |
| 16. | Cuschieri A, Weeden S, Fielding J, Bancewicz J, Craven J, Joypaul V, Sydes M, Fayers P. Patient survival after D1 and D2 resections for gastric cancer: long-term results of the MRC randomized surgical trial. Surgical Co-operative Group. Br J Cancer. 1999;79:1522-1530. [PubMed] [DOI] |