修回日期: 2008-11-28
接受日期: 2008-12-01
在线出版日期: 2009-01-08
目的: 研究酶解法制备的不同分子量壳寡糖对胰岛β细胞系NIT-1的促增殖及胰岛素分泌作用, 并进一步探讨在体内壳寡糖降低链脲佐菌素诱导的糖尿病大鼠的餐后2 h血糖的作用.
方法: 通过壳聚糖酶降解壳聚糖制备得到水溶性的不同分子量的壳寡糖, 在细胞水平上, 通过形态学观察、MTT比色法、放射免疫等方法研究不同分子量的壳寡糖对于胰岛β细胞系NIT-1细胞的增殖及促胰岛素分泌作用; 体内实验, 通过一般状态观察、餐后2 h血糖、尿糖、糖耐量测定研究了不同分子量壳寡糖对链脲佐菌素诱导的糖尿病大鼠降低餐后2 h血糖和改善葡萄糖耐量的作用.
结果: 不同分子量壳寡糖对于胰岛β细胞体外增殖具有明显的促进作用并可以显著促进胰岛β细胞的胰岛素分泌, 低分子量壳寡糖在体内能有效改善糖尿病大鼠的体重减轻、多饮、多食等症状, 降低餐后2 h血糖值(22.13±3.23, 21.78±3.09, 21.32±3.02, 19.73±4.12, 17.88±3.14, 16.14±3.55 vs 39.38±3.08, 均P<0.01), 改善葡萄糖耐量(101.19±12.44, 99.61±13.11, 96.79±9.22, 94.79±13.20, 89.41±11.10, 84.08±5.93 vs 122.40±12.05, P<0.05或0.01). 各组培养2-14 d的胰岛细胞的生物学活性活跃, 对葡萄糖刺激具有良好反应, 其中MⅥ组的胰岛素刺激指数与对照组比较有显著差异(2.94 vs2.01, P<0.05).
结论: 壳寡糖具有多种生物活性, 可以应用于糖尿病的治疗, 低分子量壳寡糖有较好的降血糖效果.
引文著录: 刘冰, 秦贞奎, 林祥梅, 梅琳, 刘万顺, 韩宝芹. 不同分子量壳寡糖对促胰岛细胞增殖、胰岛素分泌及调节餐后血糖的作用. 世界华人消化杂志 2009; 17(1): 36-42
Revised: November 28, 2008
Accepted: December 1, 2008
Published online: January 8, 2009
AIM: To estimate effects of varying molecular chitooligosaccharides prepared by enzymatic hydrolysis on the proliferation of pancreatic islet cells, and to investigate the release of insulin and 2 h plasma glucose in streptozotocin-induced diabetic rats.
METHODS: Chitooligosaccharides were prepared by enzymatic hydrolysis. The effects of varying molecular chitooligosaccharides on proliferation of pancreatic islet cells and the release of insulin in vitro were detected using optical microscopy, MTT colorimetric assay and radioimmunoassay methods respectively; the general clinical symptoms, 2 h plasma glucose and oral glucose tolerance were examined to determine the effects of chitooligosaccharides on diabetic rats induced by streptozotocin.
RESULTS: The results indicated that chitooligosaccharides markedly accelerated the proliferation of the pancreastic β cells. Chitooligosaccharides had prominent effects on insulin release. Lower molecular chitooligosaccharides improved general clinical symptoms of DM rats, decreased the 2 h plasma glucose levels (22.13 ± 3.23, 21.78 ± 3.09, 21.32 ± 3.02, 19.73 ± 4.12, 17.88 ± 3.14, 16.14 ± 3.55 vs 39.38 ± 3.08, all P < 0.01) and improved glucose tolerance (101.19 ± 12.44, 99.61 ± 13.11, 96.79 ± 9.22, 94.79 ± 13.20, 89.41 ± 11.10, 84.08 ± 5.93 vs 122.40 ± 12.05, P < 0.05 or 0.01). 2-14 d culture of each group of islet cell biology activity was active with good response to glucose stimulation. In MⅥ group, significant difference was observed in insulin stimulation index compared with the control group (2.94 vs 2.01, P < 0.05).
CONCLUSION: Chitooligosaccharides possess various biological activities and can be used in the treatment of diabetes mellitus. The lower molecular chitooligosaccharide has better effect.
- Citation: Liu B, Qin ZK, Lin XM, Mei L, Liu WS, Han BQ. Antidiabetic effects of chitooligosaccharides with different molecular weights on pancreatic islet cells in streptozotocin-induced diabetic rats. Shijie Huaren Xiaohua Zazhi 2009; 17(1): 36-42
- URL: https://www.wjgnet.com/1009-3079/full/v17/i1/36.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v17.i1.36
糖尿病(diabetes mellitus, DM)是一种常见的内分泌代谢病[1], 具有遗传倾向, 是由于胰岛素绝对或相对不足所致的血糖及尿糖增高为主要特征的并导致糖、蛋白和脂肪代谢障碍全身慢性代谢异常, 常伴发心脑血管、肾、眼及神经等多种并发症, 危害性大. 据WHO报告, 糖尿病已成为世界上继恶性肿瘤、心脑血管病后第3位严重威胁人类健康的慢性非传染性疾病[2]. 壳寡糖(chitooligosaccharides, COS)是壳聚糖的降解产物, 分子质量小, 溶于水, 可被人体、动物及植物机体吸收利用. 研究发现, 壳寡糖不仅具有和壳聚糖一些相似的性质, 而且一些生理活性或功能性质更加显著, 如提高机体免疫、抗肿瘤、降血脂、抗感染、防治病原生物感染、作为植物调节物质, 作为促进双歧杆菌生长因子的研究等[3-7]. 其降血糖作用国内外已有报道, 但具体到什么分子质量范畴的壳寡糖其降血糖作用最显著, 尚未见报道. 本实验以转基因小鼠的胰岛β细胞系NIT-1细胞株为研究对象, 从细胞水平研究了不同分子质量壳寡糖促胰岛β细胞增殖和胰岛素分泌的作用. 并以全♂Wistar大鼠为实验动物, 对链脲佐菌素诱导的DM大鼠定量ig壳寡糖水溶液, 对其60 d内餐后2 h血糖, 60 d后葡萄糖耐量的改变状况作了一些初步探讨.
壳寡糖(COS, Mw分别为1200、3210、4321、5101、7681、9987 Da, 分别以MⅠ、MⅡ、MⅢ、MⅣ、MⅤ、MⅥ表示)由本实验室制备, 其用于细胞培养时使用相应培养基溶解, 0.22 μm过滤除菌, 并稀释到相应浓度; NIT-1细胞株(转基因小鼠胰岛β细胞系)由中国海洋大学药物所提供; 封闭群纯系♂Wistar大鼠60只(200±20 g, 二级标准) 购自青岛市立医院动物试验中心, 批号: SCXK(鲁)20030010.主要试剂: 胰岛素放射免疫分析测试盒(北京原子能研究所); MTT(美国Sigma公司); 盐酸二甲双胍(北京中会药业); 链脲佐菌素(STZ, 美国Sigma公司); 血糖测定试剂盒(南京建成科技有限公司).
1.2.1 不同分子质量COS的制备和纯化及其理化性质测定: 壳聚糖溶液加入壳聚糖酶, 于40℃在pH5.6条件下水解反应, 每隔一定时间取出部分酶解液, 加入三氯乙酸后离心除蛋白, 上清液加入10倍体积的无水乙醇中, 离心取沉淀, 无水乙醇洗3次, 40℃真空干燥得不同分子质量COS粗品. 称取适量COS样品, 溶解于三蒸水中, Sephacryl S-100分离纯化, 收集主峰后冷冻干燥, 得到寡糖纯品测定其分子质量, 脱乙酰度等理化性质, TSK-GEL G3 000PWXL柱分析纯度.
1.2.2 不同分子质量COS在体外促胰岛β细胞增殖及胰岛素分泌的作用: (1)不同分子质量COS对胰岛β细胞株的促增殖作用. 胰岛β细胞株NIT-1用含100 mL/L胎牛血清的DMEM培养液培养, 在培养瓶中长满至单层后, 2.5 g/L胰蛋白酶消化, 制成单细胞悬液, 以5.0×107/L的浓度接种于96孔板中, 每孔加100 μL, 并设不含细胞的空白调零孔, 在50 mL/L CO2, 37℃, 饱和湿度的恒温培养箱中培养24 h后, 吸弃原培养液, 换成每孔100 μL无血清培养液, 同步化24 h. 之后换成含不同浓度COS的培养液(10、100、1000 mg/L), 每个浓度设置3个平行孔, 培养48 h后倒置显微镜100倍下拍片观察. 然后每孔加入浓度为5 mg/L的MTT 20 μL, 常规孵育4 h. 吸弃培养液, 每孔加入100 μL二甲基亚砜(DMSO), 震荡10 min, 使结晶物溶解充分均匀, 用酶标仪492 nm处比色, 测其各自的A值, 计算细胞增殖率(proliferation rate, PR), 实验结果重复3次.
胰岛β细胞接种于96孔板方法同上, 同时实验组加入最适浓度不同分子质量COS的培养液后, 在50 mL/L CO2, 37 ℃, 饱和湿度的恒温培养箱中培养, 并设加入不含样品的培养液作为对照组, 分别在加样后24、48、72、120、168和216 h取出, MTT法于酶标仪上492 nm测吸光度值(A值), 记录结果, 绘制细胞生长曲线. (2)不同分子质量COS对胰岛细胞的促胰岛素分泌作用. 胰岛β细胞接种于24孔培养板中方法同上, 每孔加1.0 mL, 置50 mL/L CO2, 37℃, 饱和湿度培养箱中培养, 24 h细胞贴壁后, 吸去培养板中的培养液, 实验组加入最适浓度不同分子质量COS的培养液, 并设不含样品的1640培养液作为对照组, 对照组和试验组均设5个平行孔, 分别在加样后2、4、6、8、10、12和14 d取出, 用放射免疫法测定培养液中的胰岛素含量, 记录结果, 绘制COS促胰岛素分泌作用曲线. 同时在培养6 d后进行胰岛素刺激释放试验, 吸出培养基, 将培养细胞用Hank's液洗净, 先后置于含5.6 mmol/L, 16.7 mmol/L葡萄糖的培养液中, 37℃各孵育2 h, 取培养液的上清液测定胰岛素释放量, 并计算刺激指数(stimulative index, SI).
1.2.3 不同分子质量COS在体内调节糖尿病大鼠餐后血糖及糖耐量的作用: 大鼠称质量并按65 mg/kg ip链脲菌素溶液, 正常对照组注射等量的柠檬酸缓冲液. 注射7 d后, 血糖>11.11 mmol/L者为成模标准. 成模大鼠随机分组, 每组9只: 正常对照组(normal control)和阴性对照组(DM): 每日灌胃蒸馏水(10 mL/kg); 二甲双胍组(Met): 200 mg/(kg·d) ig大鼠; COS组(Mw分别为1200、3210、4321、5101、7681、9987 Da, 分别以MⅠ、MⅡ、MⅢ、MⅣ、MⅤ、MⅥ表示): 500 mg/(kg·d) ig大鼠. 每10天采血1次, 葡萄糖氧化酶法测餐后2 h血糖值, 半定量试纸法测尿糖. 60 d后, 大鼠灌胃葡萄糖水溶液(2.5 g/kg), 分别于给糖后0.5、1、2 h眼眶后静脉丛采血, 描制血糖值随时间变化曲线. 糖耐量曲线下面积(AUC) = 0.5×空腹血糖+0.5 h血糖+1.5×1 h血糖+2 h血糖. 本研究动物实验经中国实验动物学会审核通过.
统计学处理 全部资料用mean±SD表示, 采用SPSS11.0软件采用One-way ANOVA进行多组样本均数的比较, 组间比较采用Duncan's法, 显著性界值分别设定为0.05, 0.01.
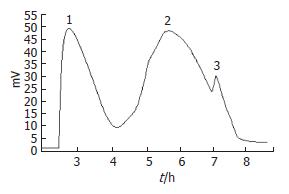
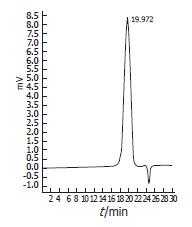
COS粗品经Sephacryl S-100柱分离(图1), 收集峰1和峰2后冷冻干燥, 测定纯品为白色粉末, 易溶于水, 稀酸及稀碱溶液微溶于甲醇, 乙醇, 难溶于丙酮, 乙醚, 石油醚及氯仿等溶剂. 水分含量10%, 灰分0.7%, 数均分子质量分别为1200、3210、4321、5101、7681、9987 Da, 脱乙酰度90%, 重金属含量(以Pb计)6 mg/kg. TSK-GEL G3000PWXL色谱柱分析COS图谱(图2), Waters Breeze图形分析软件分析主峰面积占整个峰面积的99%.
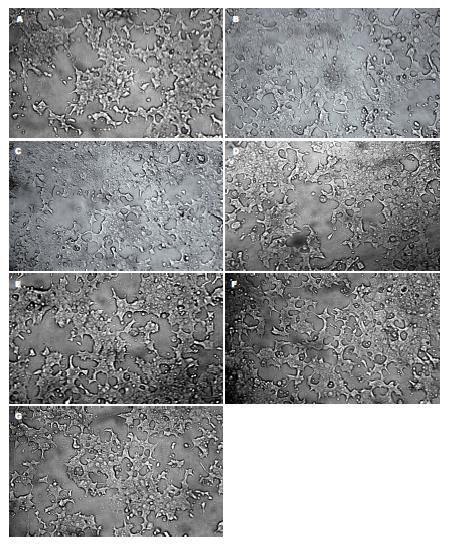
2.2.1 不同分子质量COS对胰岛β细胞生长状态的影响: 经不同分子质量COS刺激生长48 h后, 继续观察胰岛β细胞的生长状态,发现细胞集落情况明显比对照组的密集(图3A)、胞质丰富、胞体透明、细胞及核膜界限清晰、状态良好, 其中大分子质量的COSMⅠ处理组作用最好(图3B).
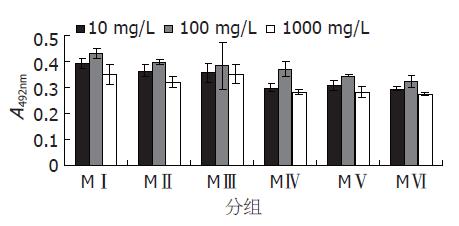
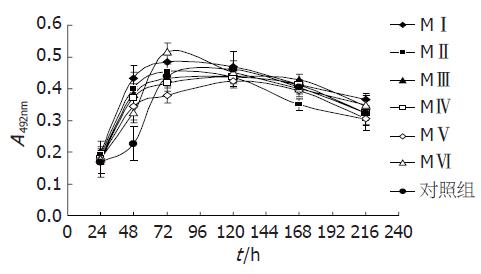
2.2.2 MTT法检测不同分子质量COS对胰岛β细胞的促增殖作用: 不同分子质量COS对胰岛β细胞增殖作用的影响(图4, 表1). 由图4可以看出, 不同分子质量的COS对胰岛β细胞增殖作用的最适浓度均为100 mg/L, 随着分子质量的增大, 胰岛β细胞的相对增殖率也随之增大, 当COS分子质量为1200 Da, 细胞相对增殖率为143.49%; 而当细胞COS分子质量增大至9987 Da, 细胞相对增殖率也增大为191.65%.
| 分子质量(Da) | 9987 | 7681 | 5101 | 4321 | 3210 | 1200 |
| 增殖率(%) | 191.65 | 176.71 | 169.51 | 164.64 | 152.57 | 143.49 |
2.2.3 不同分子质量COS对胰岛β细胞一代生长期的影响: MTT结果显示, 100 mg/L的不同分子质量COS均可以显著促进胰岛β细胞的生长, 缩短潜伏期及对数生长期的时间, 72 h细胞密度即可达到最大, 到达平台期, 对照组要延迟48 h才能长满孔到达平台期且细胞活力低; 低分子质量的COS MⅥ组(Mw = 1200 Da), 在一代生长期内可以显著促进胰岛细胞的生长, 72 h细胞密度达到最大, 活力高于其他组(图5).
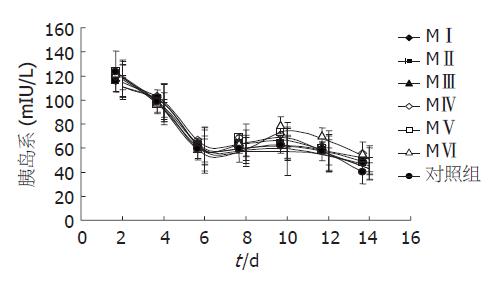
2.2.4 不同分子质量COS对胰岛细胞的促胰岛素分泌作用: 6 d以后实验组与对照组相比较, 胰岛素释放量逐渐增高. 在第10天时, 实验组与对照组差异最为明显, 试验结果显示, 随着分子质量的减小, 胰岛素释放量随之增大, COS分子质量为1200 Da的MⅥ组的促胰岛素分泌作用显著(图6). 培养第6天的胰岛细胞葡萄糖刺激实验显示, 16.7 mmol/L葡萄糖孵育的各组胰岛细胞, 其胰岛素释放量均大于2.8 mmol/L葡萄糖孵育的各组胰岛细胞2.0倍以上. 说明各组培养2-14 d的胰岛细胞生物学活性是活跃的, 对葡萄糖刺激具有良好反应. 其中COS分子质量为1200 Da的MⅥ组, 胰岛素刺激指数为2.94倍, 与对照组2.01倍比较有显著差异(P<0.05, 表2).
从60 d前后餐后2 h血糖变化上(表3), 可见不同分子质量的COS对2hPG均有不同程度的降低, 与阴性对照组比较有极显著差异(P<0.01). 随着分子质量的减小COS降糖率增加, COS MⅥ组的降血糖效果最好, 可使血糖降至16.14 mmol/L, 降糖率为47.48%. 各试验组的葡萄糖糖耐量均有不同程度受损, 以阴性对照组(DM)组的糖耐量曲线下面积为100%, 则正常组糖耐量曲线下面积只占其17.69%, COS MⅥ组为68.69%, COS各组与阴性对照组比较均有显著差异.
| 分组 | 剂量mg/kg | 餐后2 h血糖 (mmol/L) | 葡萄糖耐量试验 | |||
| 0 d | 60 d | 降糖率(%) | AUC | 比值 | ||
| 对照组 | - | 5.59±0.66a | 5.60±0.68b | -0.27 | 21.66±6.18b | 17.69 |
| Met | 200 | 30.32±3.77 | 26.65±2.09a | 12.08 | 105.33±3.74 | 86.05 |
| DM | - | 29.58±3.83 | 39.38±3.08 | -33.13 | 122.40±12.05 | 100.00 |
| MⅠ | 500 | 32.23±4.03 | 22.13±3.23b | 31.34 | 101.19±12.44a | 82.67 |
| MⅡ | 500 | 30.07±4. 31 | 21.78±3.09b | 27.57 | 99.61±13.11a | 81.38 |
| MⅢ | 500 | 28.16±4.14 | 21.32±3.02b | 24.29 | 96.79±9.22b | 79.08 |
| MⅣ | 500 | 32.93±3.67 | 19.73±4.12b | 40.09 | 94.79±13.20b | 77.44 |
| MⅤ | 500 | 29.87±4.10 | 17.88±3.14b | 40.14 | 89.41±11.10b | 73.05 |
| MⅥ | 500 | 30.73±2.81 | 16.14±3.55b | 47.48 | 84.08±5.93b | 68.69 |
COS是一种水溶性低聚糖类, 是壳聚糖经化学或酶降解后的产物, 具有良好的水溶性和独特的生理生化活性, 因而在医药、食品、化工及农业等领域具有广阔的应用前景[8-10]. 目前制备式生产COS的方法主要有化学降解法、物理降解法和生物酶降解法. 化学降解法可以通过酸水解(盐酸、乙酸、磷酸、氢氟酸等)、氧化(过氧化氢、过硼酸钠、次氯酸钠等)和NaNO2降解; 物理降解包括超声波降解、射线降解; 但最理想的方法是生物酶降解法. 本研究利用本实验室自制的壳聚糖酶对壳聚糖进行了酶解, 通过控制不同的酶解时间, 制备出不同分子质量级水溶性的COS系列, 并进一步研究了不同分子质量COS在体外促胰岛β细胞增殖和胰岛素分泌的作用及在体内调节链脲佐菌素诱导的糖尿病大鼠的餐后血糖的作用.
研究结果表明, 不同分子质量的COS对胰岛β细胞增殖作用的最适浓度均为100 mg/L, 在高浓度的情况下对细胞促生长均有抑制作用. 可能因为, 高浓度的情况下培养液的渗透压有变化, 使得细胞的生长环境受到影响. COS的分子质量对促胰岛β细胞增殖作用影响较大, 当细胞COS分子质量增大至9987 Da, 细胞相对增殖率为191.65%. 促增殖作用显著. 而分子质量为1200 Da的较低分子质量COS在一代生长期内可以显著促进胰岛细胞的生长, 缩短潜伏期及对数生长期的时间, 72 h细胞密度即可达到最大, 到达平台期, 活力高于其他组, 且其促胰岛素分泌作用显著, 胰岛素刺激指数可达2.94倍. 不同分子质量的COS对DM大鼠60 d前后餐后2 h PG均有不同程度的降低, COS MⅥ组的降血糖效果最好, 可使血糖降至16.14 mmol/L, 降糖率为47.48%. COS各组糖耐量AUC较低, 与阴性对照组比较均有极显著差异(P<0.01), MⅥ组仅为68.69%, 效果最好.
COS的降血糖机制可能有以下几点: (1)COS可以调节糖尿病大鼠机体的酸碱平衡进而增加胰岛素的敏感性, COS呈碱性, 服用后能使体液pH值上升, 改变酸性体质, 增强细胞活性和对胰岛素的敏感性. 实验证明, 血液的pH值每下降0.1, 胰岛素的活性便降低30%. (2)COS能有效地促进胰岛细胞的增殖,促进受损胰岛细胞的恢复等, 我们的实验证实了这一点, COS对于原代培养的大鼠胰岛细胞和胰岛β细胞株NIT-1体外增殖具有明显的促进作用可以显著缩短一代生长期内潜伏期及对数生长期的时间并可以显著促进原代培养胰岛细胞的胰岛素分泌. (3)COS具有调节内分泌系统的功能, 能促进β-细胞功能恢复, 通过其双向调节作用, 使胰岛素分泌量趋向正常, 以维持血糖的正常代谢.
壳寡糖是壳聚糖的降解产物, 分子质量小, 溶于水, 可被人体、动物及植物机体吸收利用. 壳寡糖作为功能性食品具有提高机体免疫、抗肿瘤、调节血脂、抗感染、防治病原生物感染、促进双歧杆菌生长等功能, 尤其是在糖尿病的防治研究方面有潜在的应用价值.
吴健雄, 教授, 中国医学科学院, 中国协和医科大肿瘤研究所肿瘤医院腹部外科; 曹志成, 英国生物医学科学研究所院士, 伊利沙伯医院临床肿瘤科
研究发现, 分子质量小于10 000 Da的壳寡糖具有许多良好的生理活性, 但具体到什么分子质量范畴的壳寡糖其降血糖作用最显著, 国内外尚未见报道.
乔新惠 et al报道, 壳寡糖可使58%的非肥胖性糖尿病小鼠血糖明显降低, 42%的非肥胖性小鼠血糖降低虽不显著, 但可维持生命, 而对照组小鼠陆续死亡, 证明壳寡糖对非肥胖性糖尿病小鼠确有治疗作用, 可预防高血糖过早出现. 任林 et al报道, 壳寡糖对链脲佐菌素糖尿病小鼠有治疗作用, 服用壳寡糖21 d后小鼠血糖得以控制, 且肠道双歧杆菌数量明显增多. 李邦良et al首次发现壳寡糖能抑制α-葡萄糖苷酶的催化活性, 延长酶作用于底物的时间, 延缓葡萄糖的释放, 有类似阿卡波糖样的作用, 即在小肠中起抑制α-葡萄糖苷酶类的作用.
本研究用生物酶降解壳聚糖, 通过控制不同的酶解时间, 制备出了水溶性的不同分子质量壳寡糖, 并通过细胞实验和动物实验, 从体内体外两个方面说明了分子质量的改变对壳寡糖降血糖功能改变的影响.
本研究评价了不同分子质量壳寡糖对动物高血糖的调节功能作用, 为今后壳寡糖应用于糖尿病的研究提供了理论依据. 深入研究和探讨壳寡糖的降血糖机制, 将对糖尿病及其并发症的预防与治疗将会产生积极的意义.
1 壳寡糖(COS): 壳聚糖的降解产物, 分子质量小, 溶于水, 可被人体、动物及植物机体吸收利用.
2 链脲佐菌素(STZ): 别名链脲菌素、链脲佐霉素. 是一种广谱抗菌素, 具有抗菌、抗肿瘤作用和致DM的不良反应. STZ对实验动物的胰岛β细胞具有高度选择性毒性作用, 是目前使用最广泛的DM动物模型化学诱导剂, 他可使多种动物如大鼠、小鼠、狗、猴、小羊、中国地鼠、豚鼠和兔等产生DM.
本研究科研思维较前沿, 实验设计较严谨, 实验操作步骤清晰, 但实验的最后一步设计欠妥. 总体来讲该研究具有临床、基础研究的科研价值.
编辑: 史景红 电编:吴鹏朕
| 1. | Rubio MA, Arrieta JL, Ruiz M, Garrido J, Rubio JA, del Llano J, Casimiro C, Raigada F. Design and validation of a scale to assess preferences of type 2 diabetic patients towards different nutritional supplements. Nutr Hosp. 2008;23:253-262. [PubMed] |
| 2. | Janghorbani M, Stenhouse EA, Jones RB, Millward BA. Is neighbourhood deprivation a risk factor for gestational diabetes mellitus? Diabet Med. 2006;23:313-317. [PubMed] [DOI] |
| 3. | Lin W, Hu X, Zhang W, Rogers WJ, Cai W. Hydrogen peroxide mediates defence responses induced by chitosans of different molecular weights in rice. J Plant Physiol. 2005;162:937-944. [PubMed] [DOI] |
| 4. | Je JY, Park PJ, Kim SK. Free radical scavenging properties of hetero-chitooligosaccharides using an ESR spectroscopy. Food Chem Toxicol. 2004;42:381-387. [PubMed] [DOI] |
| 5. | Lee SH, Suh JS, Kim HS, Lee JD, Song J, Lee SK. MR evaluation of radiation synovectomy of the knee by means of intra- articular injection of holmium-166-chitosan complex in patients with rheumatoid arthritis: results at 4-month follow-up. Korean J Radiol. 2003;4:170-178. [PubMed] |
| 6. | Park PJ, Je JY, Kim SK. Free radical scavenging activity of chitooligosaccharides by electron spin resonance spectrometry. J Agric Food Chem. 2003;51:4624-4627. [PubMed] [DOI] |
| 7. | Park PJ, Je JY, Kim SK. Angiotensin I converting enzyme (ACE) inhibitory activity of hetero-chitooligosaccharides prepared from partially different deacetylated chitosans. J Agric Food Chem. 2003;51:4930-4934. [PubMed] [DOI] |
| 8. | Fernandes JC, Tavaria FK, Soares JC, Ramos OS, João Monteiro M, Pintado ME, Xavier Malcata F. Antimicrobial effects of chitosans and chitooligosaccharides, upon Staphylococcus aureus and Escherichia coli, in food model systems. Food Microbiol. 2008;25:922-928. [PubMed] [DOI] |
| 9. | Oliveira EN Jr, El Gueddari NE, Moerschbacher BM, Peter MG, Franco TT. Growth of phytopathogenic fungi in the presence of partially acetylated chitooligosaccharides. Mycopathologia. 2008;166:163-174. [PubMed] [DOI] |
| 10. | Jung WK, Moon SH, Kim SK. Effect of chitooligosaccharides on calcium bioavailability and bone strength in ovariectomized rats. Life Sci. 2006;78:970-976. [PubMed] [DOI] |
| 11. | Liu B, Liu WS, Han BQ, Sun YY. Antidiabetic effects of chitooligosaccharides on pancreatic islet cells in streptozotocin- induced diabetic rats. World J Gastroenterol. 2007;13:725-731. [PubMed] |