修回日期: 2008-02-26
接受日期: 2008-03-05
在线出版日期: 2008-03-18
目的: 分析胃癌远处隐匿性腹膜转移(distant occult peritoneal metastasis, DOPM)的发生率、相关因素及其对预后的影响.
方法: 选择我院2002-01/2003-12收治胃癌根治性手术患者58例, 术前影像学检查或术中常规理学检查皆未发现远处转移. 所有患者于手术结束关腹前, 分别于陶氏腔两侧切取两片腹膜, 行HE染色和细胞角蛋白(cytokeratin)免疫组化染色检查. 比较有DOPM与无DOPM患者的性别、年龄, 肿瘤部位、大小、侵犯深度、分化程度和Laurén分型, 以及淋巴结转移状况; 并对上述变量进行Logistic多因素回归分析, 判断是否为DOPM的独立相关因素.
结果: 在58例患者中, 有12例发现DOPM, 占20.7%. 单因素分析结果表明, DOPM与患者的性别、肿瘤大小、侵犯深度、Laurén分型(弥漫型)以及淋巴结转移状况等相关, 与患者的年龄、肿瘤部位和分化程度不相关. Logistic多因素回归分析结果显示, 胃癌患者发生DOPM的独立相关因素依次是Laurén分型(弥散型)和肿瘤大小, 患者的性别、年龄、肿瘤部位、侵犯深度、分化程度和淋巴结转移状况并非DOPM的独立相关因素. 本组病例中Ⅰ期和Ⅱ期患者的5年生存率为100%, Ⅲ期患者的5年生存率为94.1%, Ⅳ期患者的5年生存率为24.7%(P<0.001). Ⅳ期患者中, 有DOPM患者的5年生存率为30.3%, 与N3期患者的5年生存率(22.1%)接近, 与Ⅲ期患者5年生存率的差异有显著性(P<0.001).
结论: 胃癌远处隐匿性腹膜转移发生率较高. 对进展期胃癌和具备Laurén分型弥散型等危险因素的胃癌患者, 术中应常规检测是否存在隐匿性腹膜转移.
引文著录: 邵永胜, 彭开勤, 张应天, 吴文良, 赵建国. 胃癌远处隐匿性腹膜转移组织学检测的意义. 世界华人消化杂志 2008; 16(8): 862-868
Revised: February 26, 2008
Accepted: March 5, 2008
Published online: March 18, 2008
AIM: To analyze the incidence rate and relative factors of distant occult peritoneal metastasis (DOMP) of gastric carcinoma as well as their influences on prognosis.
METHODS: Fifty-eight patients with gastric carcinoma undergoing radical surgery in our hospital from January 2002 to December 2003 were selected, and distant metastasis was not found by preoperative imaging examination and routine intraoperative physical exploration. Before closing abdomen in operation, two slices of peritoneum from each side of Tau's cavity were cut for HE and cytokeratin immunohistochemical staining. The gender, age of patients, tumor location, size, invasion depth, differentiation degree, Laurén classification and lymph lode metastasis were compared between the DOPM and non-DOMP cases. Logistic multivariable regression analysis was used to distinguish whether the above variables are independent relative factors for DOMP.
RESULTS: Among the 58 cases, there were 12 cases with DOMP, accounting for 20.7%. Single factor analysis showed that DOMP is associated with the gender of patients, tumor size, invasion depth, Laurén classification (diffusing class) and lymph node metastasis, but had nothing to do with the age patients, tumor location and differentiation degree. Logistic multivariable regression analysis showed that the independent relative factors of DOMP were Laurén classification (diffusing class) and tumor size, but not the gender, age of patients, tumor location, invasion depth, differentiation degree and lymph node metastasis. Among 58 cases, the 5-year survival rate of patients was 100% in stageⅠ and Ⅱ, 94.1% in stage Ⅲ and 24.7% in stage Ⅳ (P < 0.001). The 5-year survival rate of DOMP patients was 30.3%, which was similar to that of the stage-N3 patients (22.1%), but significantly different from that of the stage-Ⅲ patients (P < 0.001).
CONCLUSION: DOMP occurs frequently in gastric carcinoma, so routine detection for DOMP should be applied to in patients with advanced gastric carcinoma and diffusing classification (Laurén classification).
- Citation: Shao YS, Peng KQ, Zhang YT, Wu WL, Zhao JG. Histologic detection and significance of distant occult peritoneal metastasis of gastric carcinoma. Shijie Huaren Xiaohua Zazhi 2008; 16(8): 862-868
- URL: https://www.wjgnet.com/1009-3079/full/v16/i8/862.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i8.862
腹膜转移是胃癌最常见的转移形式, 也是胃癌根治性手术后最常见的复发形式, 是影响胃癌疗效的关键问题之一[1-4]. 腹膜转移通常出现在胃癌手术后, 但也有许多患者在手术时即已存在腹膜转移[5]. 胃癌手术中, 对于肉眼可见的或可触诊的腹膜转移容易诊断, 问题是肉眼看不见的和触摸不到的腹膜转移往往容易漏诊. 因此, 实际工作中胃癌远处腹膜转移的诊断存在一定困难[1,6-7].
当腹膜远处转移为微小病灶时, 术前影像学检查不能发现, 术中详细理学检查也无法察觉, 这种病变称之为远处隐匿性腹膜转移(distant occult peritoneal metastasis, DOPM). 关于胃癌的DOPM出现于何种分期的患者, 其发生率高低以及对预后的判断价值如何, 目前尚无确定的文献资料. 因此, 我们于胃癌手术中常规取陶氏腔腹膜活检, 以检测肉眼看不见的和触摸不到的DOPM, 为胃癌分期和术后治疗提供组织学证据.
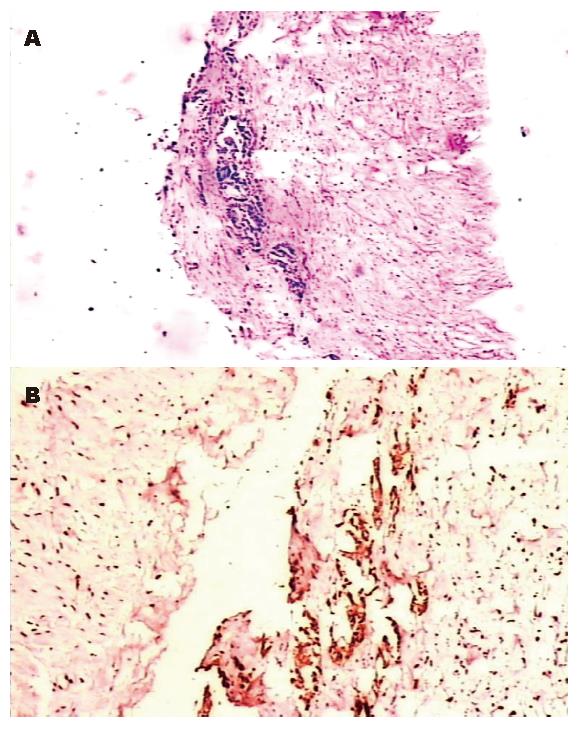
我院2002-01/2003-12胃癌根治性手术58例, 姑息性手术、以及术前影像学检查或术中常规理学检查发现远处转移患者除外. 其中, 男37例, 女21例; 年龄36-82(中位56)岁. 包括胃窦癌35例, 行远端胃D2切除术; 贲门癌和近端胃癌11例, 行近端胃D2切除术; 胃体癌11例, 行全胃D3切除术; 残胃癌1例, 行残胃D3切除术. 手术结束关腹前, 分别于陶氏腔两侧切取2片0.2 cm×0.5 cm腹膜, 创面缝扎止血. 腹膜标本单独送病检, 常规石蜡包埋切片, 行HE染色和细胞角蛋白(cytokeratin)免疫组化染色检查. 对于有DOPM患者, 术后除了全身化疗外, 还加用腹腔内化疗.
1.2.1 单因素分析: 比较有DOPM患者与无DOPM患者的性别、年龄, 肿瘤部位、大小、侵犯深度、分化程度和Laurén分型, 以及淋巴结转移状况. 其中, 两组患者性别、肿瘤部位、侵犯深度、分化程度、Laurén分型和淋巴结转移状况的比较用χ2检验, 年龄和肿瘤大小的比较用t检验. 肿瘤大小指甲醛固定标本上的原发灶大小, 以肿瘤长径×短径(cm2)计算. 淋巴结检查采用淋巴结显示技术[8], 将整块切除的标本经甲醛固定、乙醇-丙酮脱水和美兰染色后, 全数取出标本中的淋巴结; 每枚淋巴结作连续6张切片HE染色和单张切片cytokeratin染色镜检, 判断有无癌转移. 然后, 根据UICC/AJCC1997年公布的第5版胃癌TNM分期方案进行N分期: 无淋巴结转移为N0期, 淋巴结转移1-6枚为N1期, 淋巴结转移7-15枚为N2期, 淋巴结转移≥16枚为N3期, 有DOPM患者视为M1, 即为Ⅳ期.
1.2.2 Logistic多因素回归分析: 通过Logistic多因素回归分析, 判断上述变量是否为DOPM的独立相关因素.
1.2.3 累积生存率分析: 对本组患者全数随访, 用Kaplan-Meier方法计算累积生存率, 绘制生存率曲线. 对不同T分期患者、不同N分期患者, 以及不同TNM分期(Ⅰ-Ⅳ期)患者的累积生存率进行Log-rank检验.
统计学处理 本研究所有统计学处理均采用SPSS11.5统计软件完成, P<0.05为差异有显著性.
在本组58例中, 有12例发现DOPM(图1A-B), 占20.7%.
本组男性患者37例, 其中11例发现DOPM, 占29.7%; 女性21例, 1例发现DOPM, 占4.76%(χ2 = 5.089, P = 0.024, 表1). 12例有DOPM患者平均年龄59.8±15.4岁, 46例无DOPM患者平均年龄56.4±12.3岁(t = 0.796, P = 0.430). 贲门癌和近端胃癌11例, 其中2例发现DOPM, 占18.2%; 胃体癌12例, 其中4例发现DOPM, 占33.3%; 胃窦癌35例, 其中6例发现DOPM, 占17.1%(χ2 = 1.480, P = 0.477). 12例有DOPM患者平均肿瘤大小为33.0±31.2 cm2, 46例无DOPM患者平均肿瘤大小为11.5±9.4 cm2(t = 4.094, P<0.001). 肿瘤原发灶在黏膜或黏膜下层(T1期)6例, 均未发现DOPM; 肿瘤侵犯肌层(T2期)15例, 也未发现DOPM; 肿瘤侵犯浆膜(T3期)22例, 其中5例发现DOPM, 占22.7%; 肿瘤穿透浆膜或侵犯邻近器官(T4期)15例, 其中7例发现DOPM, 占46.7%(χ2 = 11.703, P = 0.008). 低分化和未分化癌34例, 其中8例发现DOPM, 占23.5%; 中分化癌19例, 其中3例发现DOPM, 占15.8%; 高分化癌5例, 其中1例发现DOPM, 占20.0%(χ2 = 0.447, P = 0.800). Laurén弥漫型23例, 其中12例发现DOPM, 占52.2%; 肠型29例, 其他型6例, 均未发现DOPM(χ2 = 23.025, P<0.001). 本组病例共取得淋巴结3289枚, 平均56.7±22.4(30-132)枚; 32例无淋巴结转移, 26例有淋巴结转移, 转移率44.8%. 转移淋巴结394枚, 平均15.2±15.2(1-69)枚.
按照UICC/AJCC的第5版胃癌TNM分期方案, 本组病例中N0期32例, 其中1例(3.2%)发现DOPM; N1期8例, 均未发现DOPM; N2期9例, 其中5例(55.6%)发现DOPM; N3期9例, 其中6例(66.7%)发现DOPM(χ2 = 26.365, P<0.001).
对DOPM相关因素的Logistic多因素回归分析结果中OR指优势比(odds ratio), 95%CI指优势比OR的95%可信区间见表2.
| 因素 | Wald χ2 | P值 | OR | 95%CI |
| 性别(男) | 2.474 | 0.061 | 0.010 | 0.000-1.241 |
| 年龄 | 0.596 | 0.440 | 0.962 | 0.873-1.061 |
| 肿瘤部位 | 1.087 | 0.297 | 0.414 | 0.079-2.173 |
| 肿瘤大小 | 4.297 | 0.038 | 1.067 | 1.004-1.134 |
| 肿瘤侵犯深度 | 1.927 | 0.165 | 3.432 | 0.602-19.577 |
| 肿瘤分化程度 | 0.637 | 0.425 | 2.231 | 0.311-16.025 |
| Laurén弥漫型 | 8.613 | 0.003 | 0.029 | 0.003-0.309 |
| 淋巴结转移 | 0.040 | 0.842 | 0.776 | 0.064-9.388 |
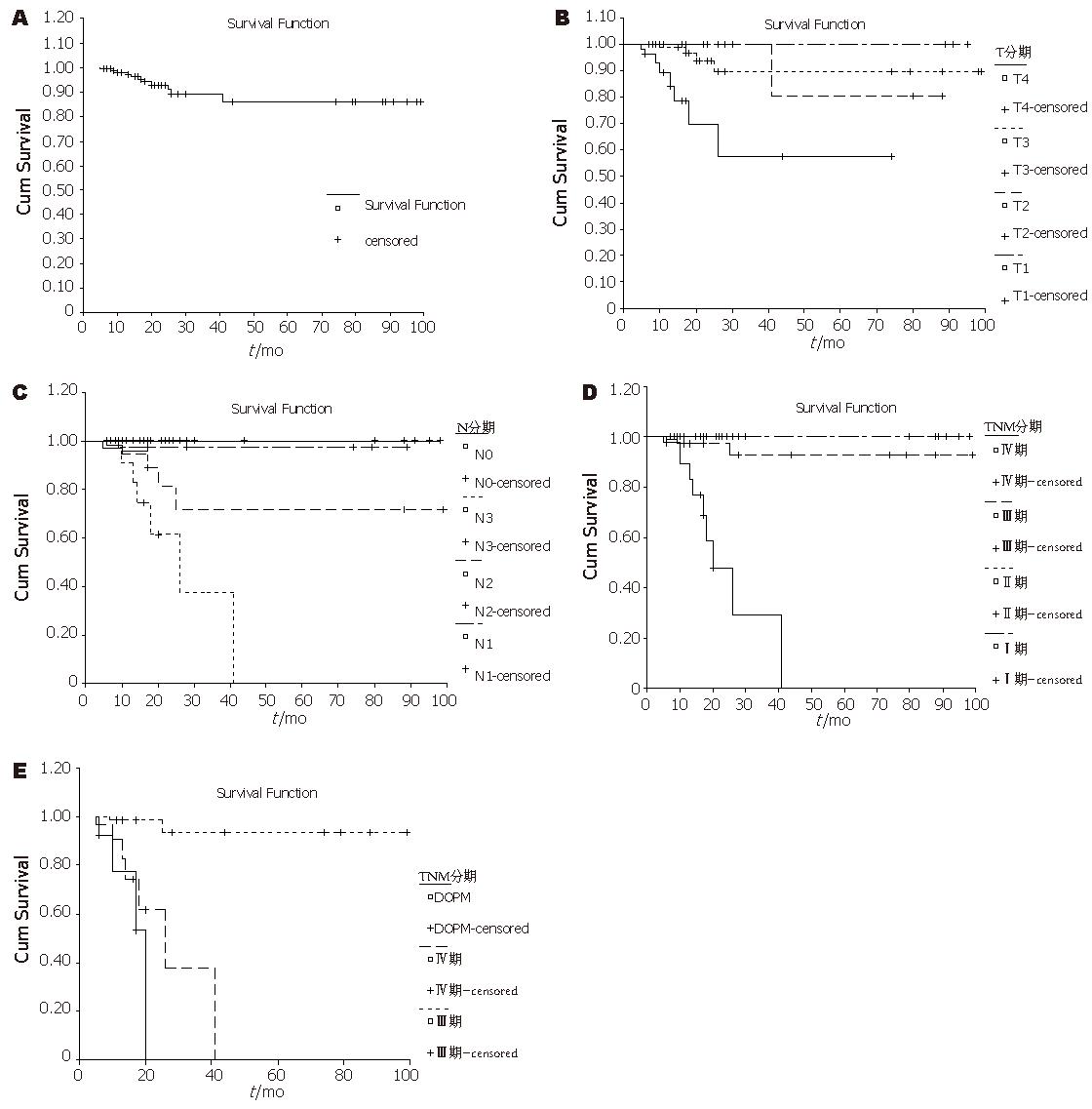
本组患者术后全数随访, 随访时间36-48(中位42) mo. 在58例患者中, 有13例在随访期间因肿瘤复发死亡, 其中12例因腹膜转移死亡, 1例因肝转移死亡. 存活的45例中, 有1例术中腹膜活检发现DOPM, 术后6 mo发现肝转移和腹膜转移, 目前正在接受全身和腹腔内化疗. 本组总体5年生存率为88.3%(图2A). 按照UICC/AJCC的第5版胃癌TNM分期方案, 本组病例中T1期6例的5年生存率为100%, T2期15例的5年生存率为90.5%, T3期22例的5年生存率为90.8%, T4期15例的5年生存率为64.3%(P<0.001, 图2B). N0期32例的5年生存率为100%, N1期8例的5年生存率为97.6%, N2期9例的5年生存率为73.9%, N3期9例的5年生存率为22.1%(P<0.001, 图2C).Ⅰ期18例和Ⅱ期12例的5年生存率为100%, Ⅲ期13例的5年生存率为93.2%, Ⅳ期15例的5年生存率为25.3%(P<0.001, 图2D). 有6例因DOPM(M1)而定为Ⅳ期, 另9例因N3而定为Ⅳ期. 为了分析DOPM对预后的影响, 将6例DOPM患者的累积生存率与Ⅲ期和Ⅳ期(N3)患者的累积生存率进行比较. 结果Ⅲ期患者的5年生存率为94.1%, DOPM患者的5年生存率30.3%, Ⅳ期(N3)患者的5年 生存率为22.1%(P<0.001, 图2E).
近年Fujimura et al[9]提出一种胃癌腹膜转移的体积评分系统, VS0表示腹盆腔无癌转移, VS1为转移灶直径<10 mm, VS2为转移灶直径1-5 cm, VS3为转移灶直径>5 cm或者邻近器官被肿瘤包裹. VS0, VS1, VS2和VS3的评分分别为为0, 1, 2, 3分. 总分1-3分为1级, 4-6分为2级, 7-9分为3级, >9分为4级. 通过对85例有腹膜转移的胃癌手术或腹腔镜探查患者随访发现, 日本传统的胃癌腹膜转移分级(P0, P1, P2和P3)与预后无相关性; 按照新的腹膜转移体积评分系统, 1-4级患者的50%存活时间分别为1.23, 0.66, 0.67和0.32年. 可以看出, 腹膜转移的程度与预后有密切的关联, 无腹膜转移和有腹膜微小转移的胃癌患者可望通过手术和辅助治疗获得治愈. 因此, 及时发现胃癌的隐匿性腹膜转移、及时给予相应的辅助治疗可望改善预后. 我们通过腹膜活检发现肉眼看不见的和触摸不到的腹膜转移, 结合临床和切片组织学检查可以认为是腹膜微小转移或腹膜转移的早期形式. 其主要意义在于指导术后辅助治疗, 同时为准确分期提供组织学依据.
Brigand et al[5]提出, 胃癌患者腹膜转移的相关危险因素包括Laurén分型弥漫-混合型、肿瘤侵犯深度(尤其是侵犯浆膜)、淋巴结转移和肿瘤大小. Yoo et al[6]的单因素和多因素分析结果表明, 肿瘤侵犯浆膜和淋巴结转移是胃癌术后复发的危险因素, 年轻、浸润或弥漫型、未分化癌和全胃切除术是胃癌术后腹膜复发的危险因素. 国内张成武et al[10]的Logistic多因素回归分析结果显示, 胃癌术后腹膜复发的独立相关因素依次为肿瘤侵犯深度、肿瘤大体分型和术后早期腹腔化疗. 吴泽宇et al[11]对76例有腹膜转移胃癌患者的临床病理资料进行回顾性分析发现, 胃癌腹膜转移与肿瘤部位、大小、分化程度、浸润深度和浆膜侵犯密切相关.
我们对DOPM的相关危险因素也进行了分析. 单因素分析结果表明, DOPM与患者的性别、肿瘤大小、侵犯深度、Laurén分型(弥漫型)以及淋巴结转移状况等相关, 与患者的年龄、肿瘤部位和分化程度不相关. Logistic多因素回归分析结果显示, 胃癌患者发生DOPM的独立相关因素依次是Laurén分型(弥漫型)和肿瘤大小, 患者的性别、年龄、肿瘤部位、侵犯深度、分化程度和淋巴结转移状况并非DOPM的独立相关因素. 因此, 对于进展期胃癌和具备上述危险因素的胃癌患者, 除术中详细病理学检查有无远处腹膜转移以外, 有必要检测是否存在隐匿性腹膜转移.
术前血清肿瘤标记物如CEA, CA19-9和CA72-4等对胃癌术后复发有一定的预测价值. 但关于术前血清肿瘤标记物预测胃癌术后复发、尤其是预测腹膜转移的确切价值尚无统一意见[12-14]. Aoyagi et al[15]对40例胃癌手术标本进行免疫组化染色, 检测原发病灶血管内皮生长因子(VEGF)的表达, 并进行免疫组化染色评分. 结果发现, 发生腹膜复发病例的VEGF评分为9.4±2.46, 未发生腹膜复发病例的VEGF评分3.47±2.36. 作者因此提出, 胃癌原发病灶VEGF高表达提示术后腹膜复发的可能, VEGF评分可以作为胃癌术后腹膜转移的预测指标. 国内吴晴et al[16]应用免疫组织化学ABC法检测253例胃癌组织中VEGF的表达, 发现肿瘤组织中VEGF的表达与肿瘤分化程度、TNM分期、腹膜转移等密切相关(P<0.01). 上述研究仅说明VEGF的表达与胃癌腹膜转移密切相关, 而并未提及其对腹膜转移的预测价值. 目前也未见通过检测VEGF的表达来预测胃癌腹膜转移的文献报告, 更无预测敏感性和特异性的数据资料.
腹腔灌洗液的检查包括腹腔灌洗液细胞学检查、常规方法检测腹腔灌洗液中的肿瘤标记物水平, 以及逆转录聚合酶链反应(RT-PCR)技术检测腹腔灌洗液中的肿瘤标记物. 腹腔灌洗液细胞学检查是检测腹腔游离癌细胞的常用方法, 但根据腹腔灌洗液细胞学检查阳性结果, 判断或预测腹膜转移缺乏敏感性; 而且细胞学检查阴性也可能存在腹膜转移[2]. Yamamoto et al[5]用化学发光酶联免疫法检测229例胃癌患者术中腹腔灌洗液中CEA、CA125和CA19-9的水平. 结果发现, 腹腔灌洗液中CEA的水平是判断胃癌腹膜转移的一个重要指标, 敏感性为75.8%, 特异性为90.8%. 因为腹腔灌洗液细胞学检查缺乏敏感性, 所以许多学者用逆转录聚合酶链反应(RT-PCR)技术检测腹腔灌洗液, 以提高诊断腹膜转移的敏感性. 其中报告最多的是检测腹腔灌洗液中的CEA-mRNA[2-3,17,19]. RT-PCR技术查CEA-mRNA预测腹膜转移的价值优于细胞学检查, 可替代细胞学检查作为预测胃癌腹膜复发的敏感方法[13,17]. 但正是RT-PCR技术的敏感, 也因此产生很多假阳性的结果[20].
不少学者将腹膜转移归咎于手术引起的癌细胞脱落和种植, 因而在手术中用生物胶封盖癌肿表面, 术毕再进行腹腔灌洗. 实际上, 80%以上的进展期胃癌患者手术时腹腔内即已存在游离的癌细胞[17]. 肿瘤腹膜转移的步骤, 除了肿瘤细胞的脱落和种植, 还包括肿瘤细胞在腹膜上的黏附、侵入和生长[15]. 因此, 发现腹腔内游离的癌细胞并不等于已经发生腹膜转移. 无论是细胞学检查、化学发光酶联免疫法或RT-PCR技术, 仅仅只是确定游离癌细胞的存在[17]. 这些技术通过确定游离癌细胞的存在, 对腹膜转移、复发有一定的预测价值, 但不能确诊腹膜转移. 我们对术前常规检查和术中病理学检查无远处转移的58例胃癌手术患者, 手术中切取陶氏腔腹膜, 作HE染色和细胞角蛋白免疫组化染色病理学检查, 结果发现, 12例(20.7%)存在隐匿性腹膜转移灶, 为准确分期和术后化疗提供了组织学依据. 无论如何, 腹腔灌洗液中发现癌细胞与腹膜活检证实有转移灶, 显然存在本质上的区别, 前者仅提示可能存在或发生腹膜转移, 后者则是组织学上已确认有腹膜转移. Yoshikawa et al[21]报告128例有腹膜转移胃癌患者的手术治疗结果, 总体平均生存时间为188 d. 其中, 行姑息性切除术患者的平均生存时间为259 d, 行旁路手术患者的平均生存时间为173 d, 剖腹探查无法手术患者的平均生存时间为108 d. 可见, 有腹膜转移的胃癌患者预后极差[5].
本组病例中有12例术中腹膜活检发现DOPM, 其中8例分别于术后5-26 mo死于腹膜转移, 1例于术后6 mo发现肝转移和腹膜转移, 目前正在接受全身和腹腔内化疗; 另外3例在随访期间无瘤生存. 从生存率分析结果看, 本组病例的累积生存率分别与肿瘤侵犯深度(T分期)、淋巴结转移程度(N分期)和TNM分期明显相关. 从图2E结果看, Ⅲ期患者的5年生存率为94.12%, DOPM患者的5年生存率30.26%, Ⅳ期患者的5年生存率为22.09%; DOPM患者的5年生存率与Ⅳ期患者相近, 而与Ⅲ期患者相比有明显差异(P<0.001). 因此, DOPM虽然是腹膜微小转移或腹膜转移的早期形式, 仍然应该看作是胃癌的远处转移, 分期应该是M1期(Ⅳ期).
总之, 胃癌患者(尤其是具备上述危险因素患者)手术中应常规切取陶氏腔腹膜送检, 以发现肉眼看不见的和触摸不到的隐匿性腹膜转移灶, 为准确分期和术后腹腔内化疗提供组织学依据.
腹膜转移是胃癌根治性手术后最常见的复发形式, 是影响胃癌疗效的关键问题之一. 手术后出现腹膜转移的胃癌患者, 可能在手术时即已存在腹膜转移, 只是肉眼看不见或触摸不到而已. 这种情况出现于何种分期的患者, 其发生率高低以及对预后的判断价值如何, 目前尚无确定的文献资料.
关晓辉, 主任医师, 吉林北华大学附属医院消化内科
关于胃癌腹膜转移的检测方法很多. 术前血清肿瘤标记物如CEA、CA19-9和CA72-4预测胃癌腹膜转移的价值尚无统一意见. 而无论是细胞学检查、化学发光酶联免疫法或RT-PCR技术, 仅仅只是确定腹腔内游离癌细胞的存在, 这些技术对腹膜转移、复发有一定的预测价值, 但不能确诊腹膜转移. RT-PCR是其中最为敏感的技术, 但也因此产生很多假阳性的结果.
本研究于胃癌手术中切取陶氏腔腹膜作病理学检查, 可以发现肉眼看不见的和触摸不到的隐匿性腹膜转移灶, 具有准确分期和判断预后的实用价值, 并能为术中、术后腹腔内化疗提供组织学依据.
本研究有助于对胃癌根治性手术患者进行准确分期, 并能为术中、术后腹腔内化疗提供组织学依据, 有望减少胃癌手术后腹膜复发的发生率, 可延长隐匿性腹膜转移胃癌患者的生存时间和改善生活质量.
本文采用免疫组化染色方法分析胃癌远处隐匿性腹膜转移的发生率及其对预后的影响, 具有一定的科学性和可读性, 进一步充实了该领域的研究.
编辑: 师忠芳 电编: 郭海丽
| 2. | Tokuda K, Natsugoe S, Nakajo A, Miyazono F, Ishigami S, Hokita S, Takao S, Eizuru Y, Aikou T. Clinical significance of CEA-mRNA expression in peritoneal lavage fluid from patients with gastric cancer. Int J Mol Med. 2003;11:79-84. [PubMed] [DOI] |
| 3. | Fujii S, Kitayama J, Kaisaki S, Sasaki S, Seto Y, Tominaga O, Tsuno N, Umetani N, Yokota H, Kitamura K. Carcinoembryonic antigen mRNA in abdominal cavity as a useful predictor of peritoneal recurrence of gastric cancer with serosal exposure. J Exp Clin Cancer Res. 2002;21:547-553. [PubMed] |
| 4. | Wang Z, Zhang X, Xu H, Zhou X, Jiang L, Lu C. Detection of peritoneal micrometastasis by reverse transcriptase-polymerase chain reaction for heparanase mRNA and cytology in peritoneal wash samples. J Surg Oncol. 2005;90:59-65. [PubMed] [DOI] |
| 5. | Brigand C, Arvieux C, Gilly FN, Glehen O. Treatment of peritoneal carcinomatosis in gastric cancers. Dig Dis. 2004;22:366-373. [PubMed] [DOI] |
| 6. | Yoo CH, Noh SH, Shin DW, Choi SH, Min JS. Recurrence following curative resection for gastric carcinoma. Br J Surg. 2000;87:236-242. [PubMed] [DOI] |
| 7. | Yamamoto M, Baba H, Kakeji Y, Endo K, Ikeda Y, Toh Y, Kohnoe S, Okamura T, Maehara Y. Prognostic significance of tumor markers in peritoneal lavage in advanced gastric cancer. Oncology. 2004;67:19-26. [PubMed] [DOI] |
| 9. | Fujimura T, Ishii K, Oyama K, Miyashita T, Kinami S, Ninomiya I, Kitagawa H, Fushida S, Nishimura G, Kayahara M. A new scoring system for peritoneal metastasis in gastric cancer. Gastric Cancer. 2003;6:146-152. [PubMed] [DOI] |
| 12. | Marrelli D, Pinto E, De Stefano A, de Manzoni G, Farnetani M, Garosi L, Roviello F. Preoperative positivity of serum tumor markers is a strong predictor of hematogenous recurrence of gastric cancer. J Surg Oncol. 2001;78:253-258. [PubMed] [DOI] |
| 13. | Gaspar MJ, Arribas I, Coca MC, Díez-Alonso M. Prognostic value of carcinoembryonic antigen, CA 19-9 and CA 72-4 in gastric carcinoma. Tumour Biol. 2001;22:318-322. [PubMed] [DOI] |
| 14. | Duraker N, Celik AN. The prognostic significance of preoperative serum CA 19-9 in patients with resectable gastric carcinoma: comparison with CEA. J Surg Oncol. 2001;76:266-271. [PubMed] [DOI] |
| 15. | Aoyagi K, Kouhuji K, Yano S, Miyagi M, Imaizumi T, Takeda J, Shirouzu K. VEGF significance in peritoneal recurrence from gastric cancer. Gastric Cancer. 2005;8:155-163. [PubMed] [DOI] |
| 16. | 吴 晴, 于 颖彦, 王 一, 朱 莉菲, 丁 红华, 陈 栋晖, 胡 宏慧, 周 小寒. 微血管计数和血管内皮生长因子在胃癌浸润转移中的作用. 实用癌症杂志. 2002;17:154-156. |
| 17. | Kodera Y, Nakanishi H, Ito S, Mochizuki Y, Yamamura Y, Fujiwara M, Hibi K, Ito K, Akiyama S, Tatematsu M. Detection of disseminated cancer cells in linitis plastica-type gastric carcinoma. Jpn J Clin Oncol. 2004;34:525-531. [PubMed] [DOI] |
| 18. | Kodera Y, Nakanishi H, Ito S, Yamamura Y, Kanemitsu Y, Shimizu Y, Hirai T, Yasui K, Kato T, Tatematsu M. Quantitative detection of disseminated free cancer cells in peritoneal washes with real-time reverse transcriptase-polymerase chain reaction: a sensitive predictor of outcome for patients with gastric carcinoma. Ann Surg. 2002;235:499-506. [PubMed] [DOI] |
| 19. | Zhang YS, Xu J, Luo GH, Wang RC, Zhu J, Zhang XY, Nilsson-Ehle P, Xu N. Detection of carcinoembryonic antigen mRNA in peritoneal washes from gastric cancer patients and its clinical significance. World J Gastroenterol. 2006;12:1408-1411. [PubMed] [DOI] |
| 20. | Kodera Y, Nakanishi H, Ito S, Yamamura Y, Fujiwara M, Koike M, Hibi K, Ito K, Tatematsu M, Nakao A. Prognostic significance of intraperitoneal cancer cells in gastric carcinoma: detection of cytokeratin 20 mRNA in peritoneal washes, in addition to detection of carcinoembryonic antigen. Gastric Cancer. 2005;8:142-148. [PubMed] [DOI] |
| 21. | Yoshikawa T, Kanari M, Tsuburaya A, Kobayashi O, Sairenji M, Motohashi H, Noguchi Y. Should gastric cancer with peritoneal metastasis be treated surgically? Hepatogastroenterology. 2003;50:1712-1715. [PubMed] |