修回日期: 2008-01-03
接受日期: 2008-01-15
在线出版日期: 2008-03-08
目的: 探讨RNA干扰(RNA interference, RNAi)沉默促肝细胞再生磷酸酶3(proteins in regenerating liver cell-3, PRL-3)基因对大肠癌细胞侵袭的影响.
方法: 应用PRL-3基因小干扰RNA(small interfering RNA, siRNA)转染处理大肠癌细胞系HCT116后, 采用荧光实时定量PCR方法检测PRL-3基因mRNA水平, 分别采用软琼脂集落培养实验和Boyden小室模型实验检测癌细胞的锚着不依赖性增殖和侵袭能力. 其次将转染48 h的细胞接种裸鼠, 观察对癌细胞体内侵袭的影响.
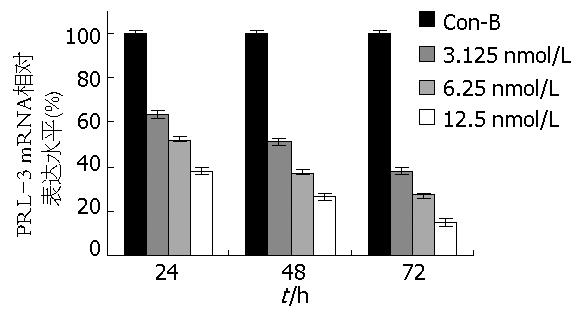
结果: 与两对照组比较, siRNA组PRL-3 mRNA水平明显降低, 且呈浓度和时间依赖性(P<0.05). 体外实验发现: 与对照组比较, PRL-3 siRNA转染组软琼脂集落形成数和穿过滤膜的癌细胞均呈剂量依赖性减少(P<0.05, P<0.05). 体内实验发现: 空白对照组和空载对照组有较多癌细胞侵袭癌肿组织周围的横纹肌, 并侵犯血管, 而siRNA转染组未见这些现象.
结论: PRL-3在大肠癌细胞侵袭中起着重要的作用, 采用PRL-3 siRNA转染可抑制大肠癌细胞侵袭.
引文著录: 钱立平, 范钰, 陈坚, 林庚金. RNAi沉默PRL-3基因对大肠癌细胞侵袭的抑制. 世界华人消化杂志 2008; 16(7): 767-770
Revised: January 3, 2008
Accepted: January 15, 2008
Published online: March 8, 2008
AIM: To investigate the effects of RNA interference-induced gene silence of proteins in regenerating liver cell-3 (PRL-3) on the invasion of human colon cancer cells.
METHODS: Colon cancer cell line HCT116 was transfected by PRL-3 small interfering RNA (siRNA), and the mRNA of PRL-3 was determined by fluorescence quantitative real-time polymerase chain reation (FRQ-PCR) assay. The anchorage-independent growth was examined using colony formation in soft agar, and invasion ability was evaluated by Boyden chamber model.
RESULTS: Compared with that in control groups, the level mRNA of PRL-3 in cancer cells transfected with PRL-3 siRNA was inhibited in a concentration- and time-dependent manner (P < 0.05). In vitro experiment showed that tranfection of colon cancer cells with PRL-3 siRNA resulted in a significant reduction of both colony formation and cell invasion in a concentration- and time-dependent manner, respectively (P < 0.05, P < 0.05). In vivo experiment showed that there were lots of cancer cells invading blood vessel and striped muscle around carcinoma tissue in two control groups, but such phenomenon did not occur in siRNA-transfected groups.
CONCLUSION: PRL-3 may play an important role in the invasion of human colon cancer cells, and RNAi-induced PRL-3 down-regulation can inhibit cell invasion ability.
- Citation: Qian LP, Fan Y, Chen J, Lin GJ. Silence of PRL-3 gene by RNA interference in inhibiting the invasion of human colon cancer cells. Shijie Huaren Xiaohua Zazhi 2008; 16(7): 767-770
- URL: https://www.wjgnet.com/1009-3079/full/v16/i7/767.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i7.767
促肝细胞再生磷酸酶(proteins in regenerating liver cell, PRLs)是新发现的一种蛋白酪氨酸磷酸酶(protein tyrosine phosphatase, PTP), 可通过酪氨酸的去磷酸化和磷酸化调节细胞的生长、分化、细胞周期、细胞间信息传递和其他活动[1]. PRLs基因家族主要有3个成员, PRL-1, PRL-2和PRL-3, 彼此之间的同源性高达76%-85%[2]. 许多实验研究发现, PRLs分子具有细胞转化的功能, 能导致细胞的恶性转化并且增强肿瘤细胞的增殖、移动、浸润和转移[3-6]. 尤其是PRL-3基因表达在转移性结直肠癌组织中显示出高度的特异性[7-8], 但目前对该基因在大肠癌细胞侵袭中的研究很少. 本研究借助于RNA干扰(RNA interference, RNAi)技术, 以合成的PRL-3基因小干扰RNA(small interfering RNA, siRNA)转染处理大肠癌细胞HCT116, 从体内外观察其对癌细胞侵袭的影响.
♀Balb/c裸鼠15只, 4周龄, 体质量约14-18 g, 购自中国科学院上海生物化学研究所, 于无特殊病原体条件(SPF)下饲养. 人大肠癌细胞HCT116本科实验室冻存, PRL-3 siRNA序列(5'-GUGACCUAUGACAAAACGCTT-3'和5'-GCGUUUUGUCAUAGGUCACTT-3')由Dharmacon公司合成, PRL-3抗体购自Santa Cruz公司, TRIzol, RNase inhibitor, 逆转录酶SSRTⅡ, Taq酶和转染试剂Oligofectamine购自Invitrogen公司.
1.2.1 细胞培养及转染处理: 大肠癌HCT116细胞在含100 mL/L胎牛血清的RBMI 1640培养液, 37 ℃、50 mL/L CO2、饱和湿度环境的条件下连续培养. 转染前1 d, 将1.0×105对数期生长的细胞接种于24孔培养板, 1 mL/well, 培养过夜. 次日进行转染. 基本操作说明书进行. 细胞分为(1)空白对照组(Con-A): 未经任何处理的大肠癌细胞, (2)空载对照组(Con-B): 即脂质体对照组, (3)siRNA组: 100 mL/L胎牛血清的RBMI 1640中含不同浓度(3.125、6.25、12.5 nmol/L)的已用脂质体包埋的siRNA. 转染后于不同时间采用胰酶消化收取细胞, 进行以下实验.
1.2.2 大肠癌细胞PRL-3基因mRNA水平检测: 采用荧光实时定量PCR检测. 应用TRIzol抽提细胞总RNA, 取总RNA 1 μg, 以Oligo dT为引物逆转录合成cDNA第一链, 以此cDNA链2 μL为模板进行PCR扩增, 荧光实时定量PCR检测步骤参照文献[9]进行. PRL-3引物序列为: 上游: 5'-GGGACTTCTCAGGTCGTGTC-3'; 下游: 5'-AGCCCCGTACTTCTTCAGGT-3'. FAM探针: 5'-CCGCTTCTCGTCGATGTAGGTCACG-3'-TAMRA. 以GAPDH为内参. PCR反应条件为: 95 ℃, 预变性3 min, 95 ℃ 30 s; 52 ℃ 45 s; 72 ℃ 45 s; 35个循环后72 ℃再延伸7 min.
1.2.3 软琼脂集落形成: 参照文献方法[10], 进行软琼脂集落培养实验, 观测PRL-3 siRNA对大肠癌细胞锚着不依赖性增殖的影响.
1.2.4 体外侵袭: 收集转染48 h的细胞, 采用Boyden小室模型[11]检测癌细胞侵袭情况. Boyden小室上室细胞穿过膜上matrigel到膜的下室面, 其数量反映了细胞侵袭能力的大小. 400倍光镜下计数穿过聚碳酸酯膜的细胞数, 以侵袭细胞的相对数目表示肿瘤细胞侵袭能力. 随机计数5个视野内的细胞数, 取平均值进行统计处理, 每组计数3份样本.
1.2.5 大肠癌细胞裸鼠体内侵袭: 收集各组细胞, 无血清的DMEM洗涤2次后, 准确计数并调整细胞浓度为3×109/L, 将各组细胞接种到裸鼠的皮下, 0.2 mL/只. 28 d后, 断颈处死裸鼠, 解剖裸鼠, 用40 g/L甲醛固定收集的组织, 制片, HE染色, 观察肿瘤细胞在体内有无转移和局部浸润的情况.
统计学处理 数据资料以mean±SD表示. 以SPSS10.0统计学软件进行处理. 以P<0.05为有统计学意义, 以P<0.01为差异性显著.
与对照组细胞比较, siRNA组PRL-3 mRNA水平明显降低, 且呈浓度和时间依赖性(P<0.05, 图1).
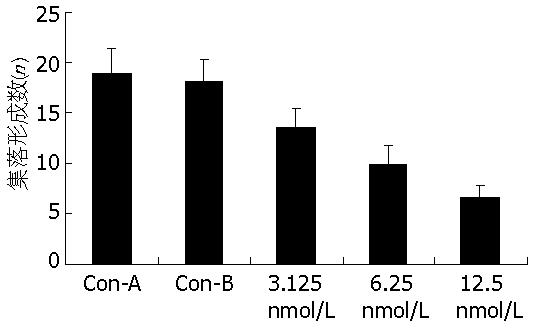
大肠癌HCT116细胞在体外半固体培养体系中可以自发地形成集落. 而经PRL-3 siRNA转染的细胞集落生长呈剂量依赖性减少(P<0.05, 图2).
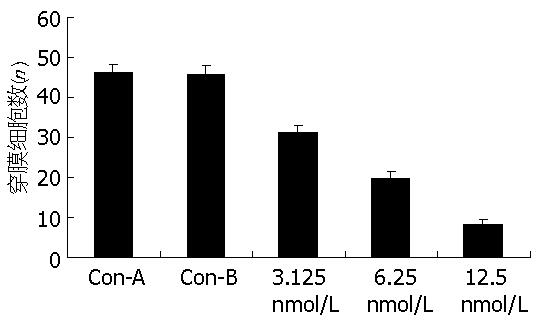
本研究采用Boyden小室模型方法采用PRL-3 siRNA转染对大肠癌细胞侵袭能力的影响, 结果发现: 与对照组比较, siRNA组穿过滤膜的癌细胞数明显下降, 且与浓度相关(P<0.05, 图3).
Con-A组和Con-B组癌细胞有较多部位侵犯癌组织周围的横纹肌, 并存在癌细胞侵入血管的现象, 而siRNA转染组未见这些现象. 说明转染组癌细胞体内侵袭能力明显受到抑制.
PRL-3是一种具有促进细胞生长、浸润和迁移的PTP酶. 有报道证实PRL-3在肝癌[11]、卵巢癌[12]、肠癌[13-14]和胃癌[15]中高表达, 且转染了PRL-3基因的细胞运动、侵袭和转移能力明显增强. 最近有学者[7]采用SAGE技术分析正常结直肠黏膜上皮、良性肿瘤、原发性和转移性结直肠癌组织间的基因表达差异, 发现只有PRL-3基因的表达具有特异性: 在18例转移灶中出现高表达, 在非转移性原发灶和正常黏膜上皮中呈低表达. Bardelli et al[8]在研究中发现了PRL-3基因表达的转移特异性和组织来源特异性: 在正常黏膜无高表达(0/8), 在转移性结直肠癌中高表达(27/29, 93.1%), 在非结直肠癌转移病灶中无高表达(0/10). 由此提示, PRL-3基因可能是反映大肠癌侵袭转移的重要标志之一. 但既往研究多在大肠癌病理组织学方面, 对该基因在细胞水平方面研究得较少. 为此, 本研究采用了先进的RNAi技术沉默该基因在大肠癌细胞中表达水平, 探讨其在大肠癌细胞侵袭中的可能作用.
在基因研究领域中, RNAi和siRNA已引起了广泛的注意. RNAi是近年来发现的一种调节mRNA的生物学现象, 能够使基因的mRNA被相应的双链RNA分子敲除, 其效果要远强于正义和反义RNA[16]. RNAi最主要的功能在于可以调节和关闭基因的表达, 进而调控细胞的各种高级生命活动. 而siRNA是指RNAi过程中在细胞内产生的长约21-25核苷酸(nt)的小双链RNA分子, 是RNAi作用机制的重要中间效应分子. 而且已有人工合成的siRNA, 具有明显的敲除相应基因mRNA的效果[17]. 由于siRNA具有高效敲除基因表达的工具, 已被广大科学工作者用来研究基因功能和基因治疗的工具.
本研究根据PRL-3基因mRNA特点, 设计siRNA序列, 并用化学方法合成, 转染大肠癌HCT116细胞, 然后采用荧光实时定量PCR方法检测PRL-3 mRNA水平. 结果发现, 转染组细胞mRNA水平明显下降, 提示PRL-3转染成功. 说明该siRNA可作为研究PRL-3基因功能的有力工具. 我们从体内外观察了PRL-3 siRNA转染对大肠癌细胞体内外侵袭的影响.
正常真核细胞, 除成熟血细胞外, 大多须黏附于特定的细胞外基质上才能抑制凋亡而存活, 称为锚着依赖性(anchorage dependence). 肿瘤细胞可以锚着不依赖性生长. 肿瘤细胞在软琼脂形成集落的多少与恶性程度呈正相关. 癌细胞侵袭能力强, 则在软琼脂上形成的集落数目多. 软琼脂集落培养实验和Boyden小室模型实验发现, 经PRL-3 siRNA转染处理的结肠癌细胞软琼脂集落数和穿膜细胞数明显减少, 且呈浓度依赖性. 裸鼠模型实验发现, 对照组癌细胞有多处侵犯肿瘤周围组织, 并存在癌细胞侵入血管的现象, 而PRL-3转染组未出现这些现象. 提示PRL-3下调可抑制大肠癌细胞的体内外侵袭能力.
本研究提示, PRL-3基因在大肠癌细胞侵袭中起着重要的作用, 以siRNA转染下调可明显抑制大肠癌细胞的体内外侵袭能力, 其内在机制尚需要进一步深入研究.
促肝细胞再生磷酸酶(PRLs)是新发现的一种蛋白酪氨酸磷酸酶(PTP), 可通过酪氨酸的去磷酸化和磷酸化调节细胞的生长、分化、细胞周期、细胞间信息传递和其他活动. PRLs基因家族主要有3个成员, PRL-1, PRL-2和PRL-3, 彼此之间的同源性高达76%-85%.
曹志成, 院士, 香港伊利沙伯医院临床肿瘤部, 肿瘤科研部
恶性肿瘤的综合治疗十分重要. 在大肠癌的综合治疗中, 基因治疗引起了重视, 但以PRL-3基因为靶点, 以RNAi技术为工具, 诊疗大肠癌的研究甚少.
文献报道, PRL-3基因与结直肠癌转移性组织呈高表达, 提示与大肠癌转移有关, 不过该基因在大肠癌细胞体外研究资料很少.
本研究以PRL-3基因为靶点, 以RNAi技术为工具, 探讨对大肠癌细胞体外侵袭的影响.
PRL-3在大肠癌细胞中高表达, 以该基因为靶点, 可针对PRL-3高表达相应肿瘤进行基因治疗.
本文就RNAi沉默PRL-3基因抑制大肠癌细胞侵袭进行研究, 推测PRL-3在大肠癌细胞侵袭中起着重要的作用, 对PRL-3基因及大肠癌细胞侵袭机制有一定的了解意义, 但讨论不够深入, 参考文献略嫌不足.
编辑: 李军亮 电编: 何基才
| 1. | Carter DA. Expression of a novel rat protein tyrosine phosphatase gene. Biochim Biophys Acta. 1998;1442:405-408. [PubMed] [DOI] |
| 2. | Peng Y, Genin A, Spinner NB, Diamond RH, Taub R. The gene encoding human nuclear protein tyrosine phosphatase, PRL-1. Cloning, chromosomal localization, and identification of an intron enhancer. J Biol Chem. 1998;273:17286-17295. [PubMed] [DOI] |
| 3. | Diamond RH, Cressman DE, Laz TM, Abrams CS, Taub R. PRL-1, a unique nuclear protein tyrosine phosphatase, affects cell growth. Mol Cell Biol. 1994;14:3752-3762. [PubMed] [DOI] |
| 4. | Zeng Q, Dong JM, Guo K, Li J, Tan HX, Koh V, Pallen CJ, Manser E, Hong W. PRL-3 and PRL-1 promote cell migration, invasion, and metastasis. Cancer Res. 2003;63:2716-2722. [PubMed] |
| 5. | Matter WF, Estridge T, Zhang C, Belagaje R, Stancato L, Dixon J, Johnson B, Bloem L, Pickard T, Donaghue M. Role of PRL-3, a human muscle-specific tyrosine phosphatase, in angiotensin-II signaling. Biochem Biophys Res Commun. 2001;283:1061-1068. [PubMed] [DOI] |
| 6. | Werner SR, Lee PA, DeCamp MW, Crowell DN, Randall SK, Crowell PL. Enhanced cell cycle progression and down regulation of p21(Cip1/Waf1) by PRL tyrosine phosphatases. Cancer Lett. 2003;202:201-211. [PubMed] [DOI] |
| 7. | Saha S, Bardelli A, Buckhaults P, Velculescu VE, Rago C, St Croix B, Romans KE, Choti MA, Lengauer C, Kinzler KW. A phosphatase associated with metastasis of colorectal cancer. Science. 2001;294:1343-1346. [PubMed] [DOI] |
| 8. | Bardelli A, Saha S, Sager JA, Romans KE, Xin B, Markowitz SD, Lengauer C, Velculescu VE, Kinzler KW, Vogelstein B. PRL-3 expression in metastatic cancers. Clin Cancer Res. 2003;9:5607-5615. [PubMed] |
| 11. | Wu X, Zeng H, Zhang X, Zhao Y, Sha H, Ge X, Zhang M, Gao X, Xu Q. Phosphatase of regenerating liver-3 promotes motility and metastasis of mouse melanoma cells. Am J Pathol. 2004;164:2039-2054. [PubMed] [DOI] |
| 12. | Polato F, Codegoni A, Fruscio R, Perego P, Mangioni C, Saha S, Bardelli A, Broggini M. PRL-3 phosphatase is implicated in ovarian cancer growth. Clin Cancer Res. 2005;11:6835-6839. [PubMed] [DOI] |
| 13. | Peng L, Ning J, Meng L, Shou C. The association of the expression level of protein tyrosine phosphatase PRL-3 protein with liver metastasis and prognosis of patients with colorectal cancer. J Cancer Res Clin Oncol. 2004;130:521-526. [PubMed] [DOI] |
| 14. | Stephens BJ, Han H, Gokhale V, Von Hoff DD. PRL phosphatases as potential molecular targets in cancer. Mol Cancer Ther. 2005;4:1653-1661. [PubMed] [DOI] |
| 15. | Miskad UA, Semba S, Kato H, Yokozaki H. Expression of PRL-3 phosphatase in human gastric carcinomas: close correlation with invasion and metastasis. Pathobiology. 2004;71:176-184. [PubMed] [DOI] |