修回日期: 2008-01-15
接受日期: 2008-01-23
在线出版日期: 2008-02-28
目的: 研究小鼠胰腺肿瘤细胞系MPC-83细胞中功能性G蛋白偶联受体(G protein-coupled receptor, GPCR).
方法: 培养小鼠胰腺肿瘤细胞系MPC-83细胞, 检测其刺激前后胞质游离钙离子浓度的变化.
结果: ACh 25 nmol/L刺激新鲜分离的正常小鼠胰腺腺泡细胞, 胞质钙离子浓度发生规则、振荡样升高; CCK 5 pmol/L具有类似作用. GPCR激动剂CCK 1 μmol/L、VP 1 μmol/L、P 物质5 μmol/L、组织氨10 μmol/L、PE 10 μmol/L和ACh 100 μmol/L分别刺激MPC-83细胞, 胞质钙离子没有发生任何增加. 地塞米松100 nmol/L与MPC-83细胞共孵育72 h, MPC-83细胞增殖速度明显降低, 但GPCR配体CCK、VP、P物质仍然不引起胞质钙离子浓度的增加.
结论: 从昆明小鼠胰腺外分泌部肿瘤分离出来的胰腺腺泡细胞系MPC-83, 正常的G蛋白偶联受体完全缺失, 处于极度去分化状态.
引文著录: 程海立, 王琳, 崔宗杰. 小鼠胰腺腺泡细胞系MPC-83中功能性G蛋白偶联受体的缺失. 世界华人消化杂志 2008; 16(6): 590-595
Revised: January 15, 2008
Accepted: January 23, 2008
Published online: February 28, 2008
AIM: To study G-protein-coupled receptor (GPCR) in mouse exocrine pancreatic acinar cell line MPC-83.
METHODS: Cytoplasmic calcium concentration in mouse exocrine pancreatic acinar cell line MPC-83 was measured both before and after stimulation with GPCR agonists.
RESULTS: Acetylcholine (ACh, 25 nmol/L) and cholecystokinin (CCK, 5 pmol/L) induced regular calcium oscillations in freshly isolated normal mouse pancreatic acinar cells. When GPCR agonists CCK (1 μmol/L), vasopressin (VP, 1 μmol/L), substance P (5 μmol/L), histamine (10 μmol/L), phenylephrine (PE, 10 μmol/L) and ACh 100 μmol/L were added to MPC-83 cells, no change of intracellular calcium concentration was detected. After 100 nmol/L dexamethasone pre-treatment of MPC-83 cells for 72 h, MPC-83 cell proliferation was reduced, but still no calcium increases were detected after stimulation with GPCR agonists 1 μmol/L CCK, 1 μmol/L VP and 5 μmol/L substance P.
CONCLUSION: The pancreatic acinar tumor cell line MPC-83 from Kunming mice have completely lost their functional GPCR which are normally present in pancreatic acinar cells, and these cells are in extreme de-differentiation state.
- Citation: Cheng HL, Wang L, Cui ZJ. Complete loss of functional G protein-coupled receptors in mouse pancreatic acinar cell MPC-83. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 590-595
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/590.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.590
胰腺腺泡细胞合成、分泌多种消化酶如淀粉酶、胰蛋白酶、糜蛋白酶、脂酶、核酸酶[1]. 消化酶/酶原的合成和分泌受到胰腺腺泡细胞表面多种G蛋白偶联受体(GPCR)的调控, 如CCK1受体、M3受体、P物质受体[2]. 刺激新鲜分离的胰腺腺泡细胞表面的GPCR, 可以得到接近在体状态的消化酶分泌水平[3]. 但在实际工作中, 往往也需要可传代的、近似生理状态的胰腺腺泡细胞系.
目前ATCC收录的胰腺外分泌细胞系有6种, 分别是PANC-1、SW1990、ARIP、DSL-6A/C1、DSL-6B/C2和AR4-2J[4]. PANC-1、SW 1990来自人[5-6], 其余4种来自大鼠[7-8]; 没有来自小鼠的胰腺外分泌细胞系. 6种胰腺外分泌细胞系中, SW1990是由脾转移的肿瘤细胞, PANC-1、DSL-6A/C1、DSL-6B/C2是胰腺导管细胞[5-7]. ARIP和AR4-2J是大鼠胰腺腺泡肿瘤细胞系; AR4-2J既有致瘤性, 也能分泌淀粉酶和其他胰腺消化酶[8]. 近年也有人认为ARIP具有导管细胞的特性[9].
AR4-2J是Longnecker et al[10]建立的重氮丝氨酸诱导的大鼠胰腺腺泡肿瘤细胞系. AR4-2J同时具有外分泌和神经内分泌细胞的特性[11], 也可被诱导向胰岛细胞表型分化[12]. 地塞米松(dexamethasone, Dex)处理后, AR4-2J的外分泌表型加强, 胰岛内分泌表型减弱[13]. Dex处理6 h后, 淀粉酶分泌开始上升, 细胞生长变缓[12-14].
AR4-2J细胞典型地含有电压依赖性钙离子通道L、P、N[15]. Ghrelin刺激AR4-2J细胞导致其胞内钙离子浓度的双相增加, L型钙离子通道在第二相中具有关键作用[16]. CCK刺激AR4-2J, 诱发钙振荡的出现[17]和淀粉酶的分泌[18]. 植物血凝素抑制CCK-8与AR4-2J细胞CCK受体的结合[19].
我国科学家建立的小鼠胰腺腺泡肿瘤细胞系MPC-83, 来自1983年发现的1例♂昆明种小鼠胰腺自发瘤[20-22]. MPC-83细胞可在小鼠皮下连续传代220代[21]. MPC-83细胞, 在胞质含酶原颗粒和丰富的脂酶颗粒[21]. MPC-83皮下移植传代后仍然具有胰腺腺泡细胞消化酶活性[22]. 研究发现, MPC-83可作为生物反应调节剂(BRM)抗肿瘤实验研究的细胞模型[23].
AR4-2J建系后到目前为止, 以AR4-2J为研究对象的论文超过1000篇. 但是对MPC-83细胞基本特性的研究, 尚鲜见报道. 因而本工作的目的是研究MPC-83细胞是否存在相关的功能性GPCR.
正常胰腺腺泡细胞表面最主要分泌刺激物(secretagogue)受体是CCK1受体和M3受体. 两种都通过Gq/11与PLCβ信号系统偶联[2], 低浓度ACh、CCK刺激引发胞内游离钙离子浓度的振荡性升高[3,24-26]. 随着ACh和CCK刺激浓度的增加, 钙离子浓度的振荡性升高逐渐转换为高台样升高[3,26-27]. 这种浓度依赖性变化在其他细胞也普遍存在, 如淋巴细胞、肝细胞、成纤维细胞和胰岛β细胞[28]. 所以本文通过检测胞质钙离子浓度的升高, 来判断MPC-83细胞是否具有相关的功能性GPCR.
胆囊收缩素八肽(CCK-8)、血管加压素(VP)、苯肾上腺素(PE)、乙酰胆碱(ACh)、P物质(substance P)、组织胺(histamine)、胰蛋白酶(trypsin)均为美国Sigma-Aldrich公司产品. Fura-2 AM为美国Molecular Probes(Eugene, OR)公司或AnaSpec(San Diego, CA, USA)产品. 4-(2-Hydroxyethyl)-1-piperazineethane-sulfonic acid(HEPES)为德国Boehringer Mannheim公司产品.
小鼠胰腺腺泡肿瘤细胞系MPC-83购自协和医科大学肿瘤研究所细胞室, 用含100 mL/L胎牛血清(FBS, Hyclone)的RPMI 1640培养液, 在50 mL/L CO2培养箱中37 ℃培养. MPC-83细胞传代开始时1 d换培养液1次, 长至50%以上闭合度后, 至少每12 h换液一次. 培养所用RPMI 1640培养基(Invitrogen), 配制时加入HEPES 10 mmol/L, 青霉素和各链霉素100 U/L, NaHCO3 2 g/L, pH值7.2. 细胞传代时用0.25%胰酶/EDTA 0.53 mmol/L消化. 细胞冻存时成份为60% RPMI 1640, 30% FBS, 10% DMSO.
正常胰腺腺泡的分离见文献报道[3,26]. 分离腺泡细胞用胶原水解酶P(Roche)和机械吹打, 分离后用150线的尼龙网或不锈钢网过滤. 消化后残留的胶原水解酶, 通过在含有4%牛血清白蛋白(BSA)的缓冲液中离心而去除.
1.2.1 细胞胞质钙离子浓度的测量: 细胞用Fura-2 AM(终浓度5 µmol/L)加载1 h, 在单细胞钙离子测量系统(DelatRam V, Photon Technology Incorporation, New Jersey, USA)的倒置荧光显微镜(Olympus IX70)下, 检测细胞胞质钙浓度的变化. 单色仪交替以340 nm/380 nm波长激发Fura-2, 采集荧光发射波长>510 nm, 钙离子浓度以荧光强度比F340/F380表示. 实验过程中用缓冲液灌流细胞15-20 min, 记录静息状态下的钙离子浓度的基础值, 之后灌流含不同浓度刺激物的缓冲液, 刺激细胞. 灌流细胞用缓冲液成份如下(mmol/L): NaCl 118, KCl 4.7, CaCl2 2.5, MgCl2 1.13, NaH2PO4 1.0, D-葡萄糖5.5, HEPES 10, pH7.4, 充氧30 min后使用. 试验过程中通过Felix32软件(Photon Technology Incorporation, New Jersey, USA)自动得到以荧光强度比值F340/F380为纵坐标, 时间为横坐标的钙离子浓度随时间动态变化图. 数据后期处理使用SigmaPlot软件重新做图和标注.
1.2.2 Dex处理: 对于形态学实验, 首先用Dex 100 nmol/L处理3 d, 之后将对照和Dex 100 nmol/L处理过的MPC-83细胞在盖玻片爬片, 12 h后细胞贴壁, 加载MitoTracker(100 nmol/L)1 h. 加载MitoTracker的细胞在FV300(Olympus, Japan)激光共聚焦显微镜(IX70, Olympus, Japan)成像. 对于细胞增殖实验, 将细胞在24孔培养板接种, 在平行孔中分别接种细胞后, 对照细胞加正常培养基, 实验组加含Dex 100 nmol/L的培养基. 在不同时间将细胞用胰酶消化后记数. 每组实验都进行平行3组实验.
统计学处理 细胞记数后用SigmaPlot做图, 绘制细胞生长曲线, 细胞数以mean±SE表示. 细胞生长曲线中细胞数目的差异用Student's t检验进行统计学分析, P<0.05时为差异显著.
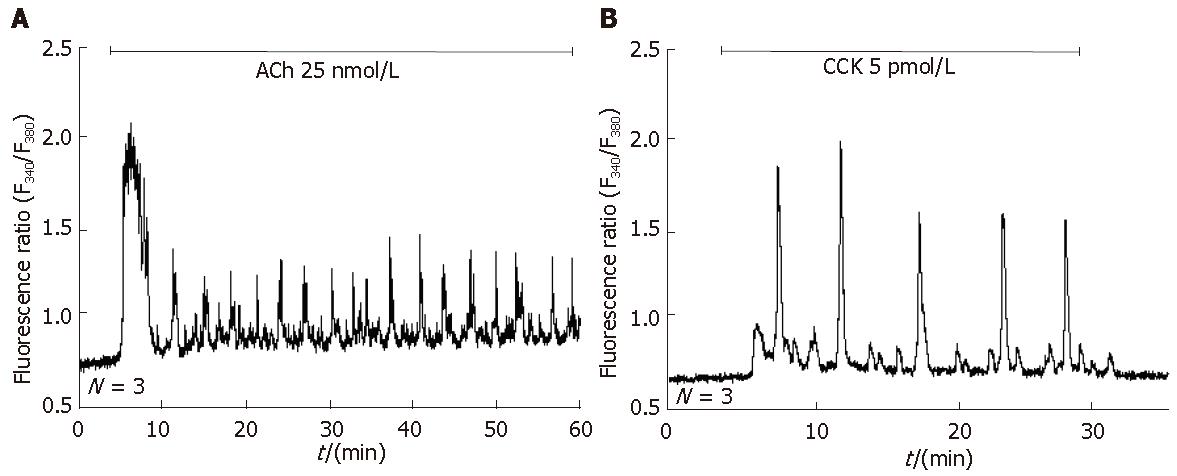
新鲜分离的正常小鼠胰腺腺泡细胞, 经ACh 25 nmol/L刺激后, 出现规则的钙离子浓度的振荡样增加; CCK 5 pmol/L刺激也出现规则钙振荡(图1). 这些结果说明, 在正常的新鲜分离的小鼠胰腺腺泡细胞, 分泌刺激物(secretagogue) ACh、CCK都引发规则钙振荡; 显示在正常细胞, 存在功能性的胆碱能和CCK受体(图1).
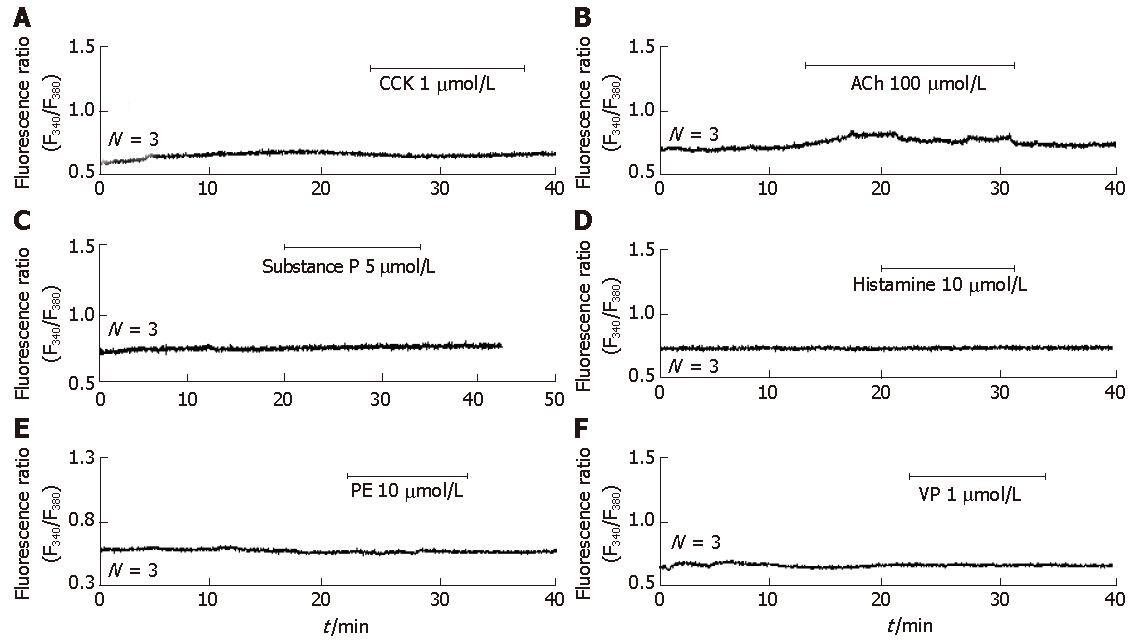
为了验证在培养的MPC-83细胞, 是否存在胆碱能和CCK受体, 首先用CCK、ACh刺激MPC-83细胞. 低浓度ACh 25 nmol/L、CCK 5 pmol/L没有任何作用(结果未显示); 当浓度分别增加到ACh 100 μmol/L、CCK 1 μmol/L, 也没有发现胞质钙离子浓度的明显增加(图2A-B). 其他GPCR受体激动剂P物质5 μmol/L、组织胺10 μmol/L、phenylephrine(PE) 10 μmol/L、vasopressin(VP) 1 μmol/L高浓度刺激, 钙离子浓度也都没有发生明显变化(图2C-F). 其中在一个细胞, ACh刺激后有轻微增加(图2B); 但是在后续的两次试验中, 这一增加也没有重复出现.
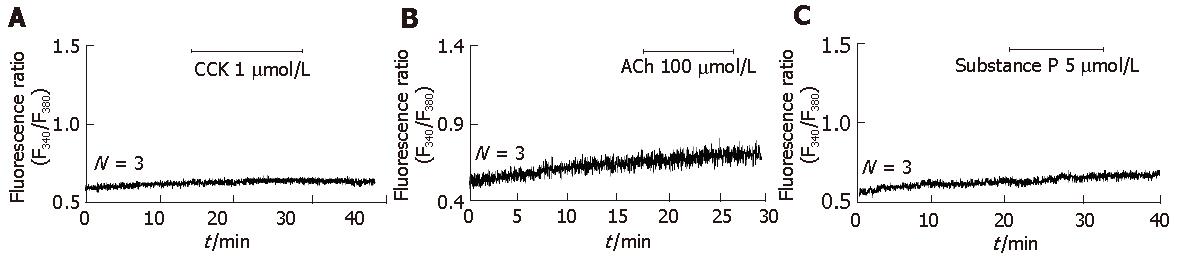
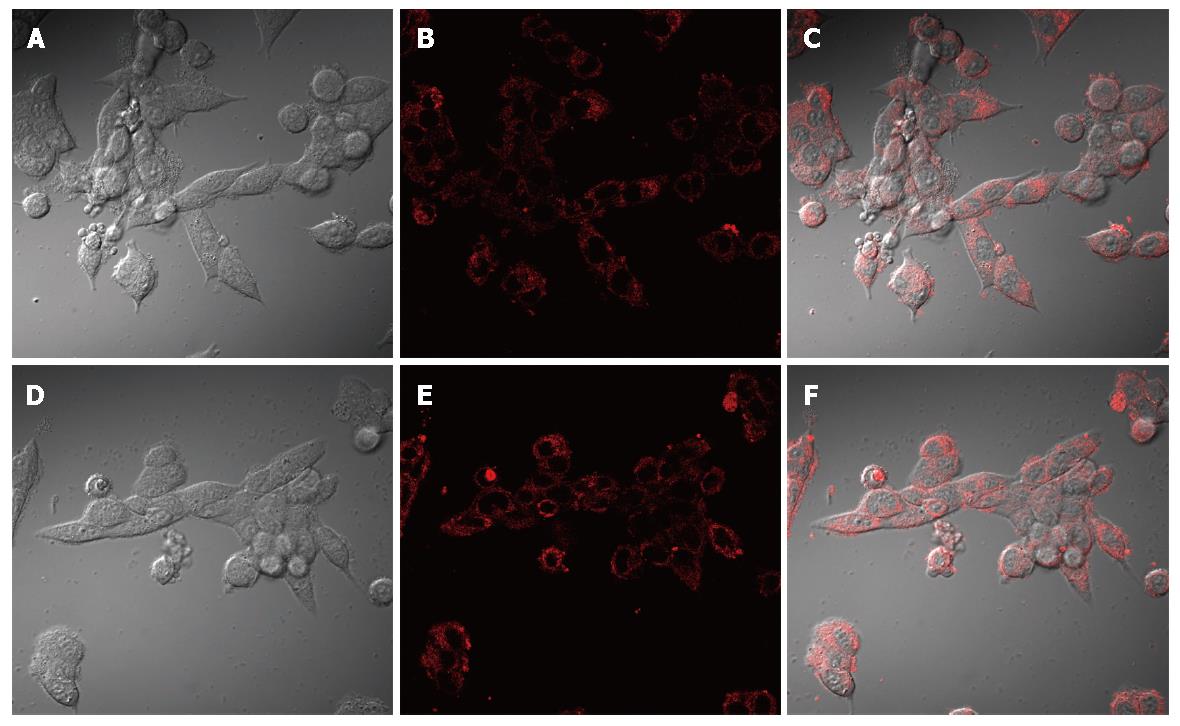
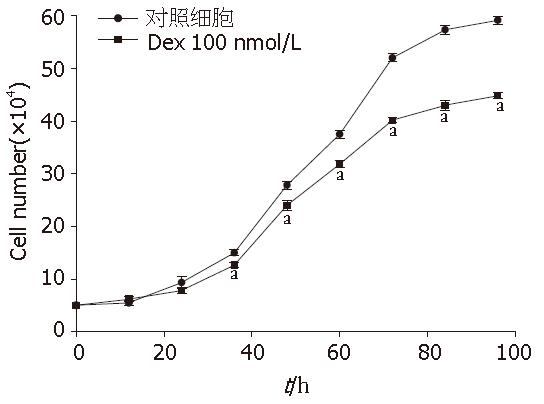
已知在大鼠胰腺腺泡细胞系AR4-2J, 糖皮质激素Dex处理后, 细胞趋于进一步分化的状态; 细胞酶原颗粒增加[14,29]. 因而在本试验中, MPC-83细胞也用Dex进行了处理. 用含有Dex 100 nmol/L的RPMI 1640培养基, 培养MPC-83细胞72 h后, 发现MPC-83细胞对CCK 1 μmol/L、ACh 100 μmol/L和P物质 5 μmol/L仍然没有任何反应(图3A-C). 这些结果揭示, 糖皮质激素Dex在MPC-83细胞, 不能有效诱导CCK、ACh和P物质受体的表达. 从形态学上来看, Dex处理后, 细胞没有发生明显变化. MitoTracker荧光成像发现, MPC-83细胞胞质充满线粒体; Dex处理后, 线粒体有增多的趋势(图4). MPC-83细胞的生长曲线呈典型的S型曲线; Dex处理后, 生长曲线明显变缓, 细胞生长速度从第48小时开始有显著差异(图5).
本项工作研究昆明小鼠胰腺腺泡细胞肿瘤来源的细胞系MPC-83, 可能存在的G蛋白偶联受体. 研究发现: (1)MPC-83细胞用ACh、CCK、P物质、组织胺、VP、PE刺激都没有引发胞质钙离子浓度的变化; (2)Dex 100 nmol/L处理72 h, ACh、CCK、P物质仍然没有反应; (3)Dex处理后, MPC-83细胞整体形态没有明显变化, 但是线粒体密度有增加的趋势; (4)Dex处理后, MPC-83细胞生长速度明显变缓; (5)作为对照, 低浓度的ACh和CCK在新鲜分离的正常小鼠胰腺腺泡细胞, 可以诱发出规则钙振荡.
已知CCK在生理浓度(5-50 pmol/L)可引发新鲜分离的啮齿类胰腺腺泡细胞产生规则钙振荡, >50 pmol/L引发[Ca2+]i的高台样升高[3,26-27]. ACh 也具有类似的浓度依赖关系, 纳摩尔水平(如25 nmol/L)的ACh, 就可以有效诱导啮齿类胰腺腺泡细胞中钙振荡的出现; 更高浓度导致钙离子的高台样升高[3,26-27]. ACh和CCK分别通过M3型胆碱能受体和CCK1型CCK受体, 发挥作用[25]. 在本试验中, 刺激MPC-83细胞的ACh、CCK浓度分别增加到100 μmol/L和1 μmol/L后, MPC-83细胞仍然没有钙离子浓度的明显升高. 这说明在MPC-83细胞, 不存在功能性ACh和CCK受体. 同样, 高浓度的G蛋白偶联受体激动剂VP、P物质、组织胺和PE, 也不刺激MPC-83细胞胞质钙离子浓度的明显增加. 在所有实验结束后蒸馏水灌流, 都导致胞质钙离子的大幅增加(没有显示), 说明MPC-83细胞存在水通道. 综合考虑以上实验结果, 昆明小鼠胰腺腺泡细胞系MPC-83, 不含功能性G蛋白偶联受体, 细胞处于高度去分化状态.
肿瘤细胞增殖迅速, 使细胞的原有功能受到抑制. 肿瘤细胞增殖越快, 其分化程度越低. MPC-83细胞生长旺盛, 用含胎牛血清100 mL/L的RMPI 1640培养基培养, 细胞需12 h换液一次, 两天可传代一次. 检测MPC-83细胞静息状态下胞质钙离子浓度的试验证实, 对细胞进行灌流, 胞质钙离子浓度保持不变. 但是在1次试验中(共6次), 记录到细胞的自发钙振荡(结果没有显示).
在重氮丝氨酸诱导的大鼠胰腺腺泡肿瘤细胞AR4-2J, Dex处理抑制AR4-2J细胞的增殖, 但是细胞的淀粉酶含量增加, Dex有效促进AR4-2J向外分泌表型分化[29-30]. 在本实验中, 用Dex 100 nmol/L处理MPC-83细胞, 处理过的细胞对CCK、ACh、P物质的刺激仍然没有任何反应.
Dex处理MPC-83细胞72 h后, 处理细胞与正常细胞比较, 线粒体密度有明显增加. 生长曲线比较显示, Dex处理过的MPC-83细胞, 其增殖速度明显变缓. 说明和AR4-2J一样, Dex能够抑制MPC-83细胞的增殖, 并促进其分化.
至于MPC-83细胞为何不含功能性的G蛋白偶联受体, 将来需要进行更加深入的研究. 有几个可能: G蛋白偶联受体得到表达, 但是所偶联的G蛋白、或磷脂水解酶C缺失, 或者GPCR-G-PLC都存在, 但是钙离子信号系统的相关蛋白如IP3R、SERCA/PMCA缺失. 尽管如此, MPC-83细胞可能具有AR4-2J细胞所不具备的优点. MPC-83细胞没有内源性的胰腺腺泡细胞促分泌(secretagogue)受体, 因而这一细胞系可以用来表达外源性的G蛋白偶联受体, 并研究这些外源表达的受体, 如何随着表达程度的变化调控细胞消化酶的分泌. 也可用MPC-83细胞来重构胰腺腺泡细胞的钙离子振荡系统, 分析钙振荡发生的分子基础.
胰腺腺泡细胞合成、分泌消化酶, 为动物对食物进行消化所必须. 胰腺腺泡细胞表面G蛋白偶联受体(GPCR)调控消化酶的分泌. 胰腺腺泡细胞系是开展这方面研究的重要工具. 目前应用最广泛的是Longnecker et al通过重氮丝氨酸诱导而于1979年建立的大鼠胰腺腺泡肿瘤细胞系AR4-2J.
施瑞华, 教授, 南京医科大学第一附属医院消化科.
G蛋白偶联受体(GPCR)种类繁多, 其基因占人类基因组的5%, 临床用药的1/3作用于约60种常见的 GPCR. 正常胰腺腺泡细胞表面最主要分泌刺激物(secretagogue)受体CCK1受体和M3受体等都通过Gq/11与PLCβ信号系统偶联, 受到低浓度激动剂刺激后引发胞质游离钙离子浓度的振荡性升高. 因而可以通过检测钙振荡的变化, 来判断MPC-83细胞是否具有相关的功能性GPCR. 这对于正常、肿瘤胰腺腺泡细胞差异性研究具有重要意义, 是当前肿瘤生物学研究的热点之一.
我国科学家胡美英et al于1983年发现1例雄性昆明种小鼠胰腺自发瘤MPC-83, 并可连续传代. 但是对于MPC-83的细胞生理学, 所知甚少.
钙振荡: 体内细胞受到生理性刺激后, 所产生的最早的反应之一是胞质中钙离子浓度的升高. 钙离子浓度的升高在单个细胞水平多以振荡的形式出现, 即钙离子浓度随着时间的变化出现很规则的钙峰. 钙振荡的出现使得胞质钙离子浓度可以进行多种方式的调制, 如振幅调制(AM)、频率调制(FM). 因而通过振荡的方式胞质钙离子浓度变化可以编码成复杂多样的信号, 使得钙离子可以特异性调控细胞的多种功能.
本研究紧密围绕临床实践, 具有一定的临床指导意义.
编辑: 李军亮 电编: 吴鹏朕
| 1. | Petersen OH, Burdakov D, Tepikin AV. Polarity in intracellular calcium signaling. Bioessays. 1999;21:851-860. [PubMed] [DOI] |
| 2. | Iacovelli L, Sallese M, Mariggiò S, de Blasi A. Regulation of G-protein-coupled receptor kinase subtypes by calcium sensor proteins. FASEB J. 1999;13:1-8. [PubMed] |
| 3. | An YP, Xiao R, Cui H, Cui ZJ. Selective activation by photodynamic action of cholecystokinin receptor in the freshly isolated rat pancreatic acini. Br J Pharmacol. 2003;139:872-880. [PubMed] [DOI] |
| 4. | Silver K, Yao F. ARIP cells as a model for pancreatic beta cell growth and development. Pancreas. 2001;22:141-147. [PubMed] [DOI] |
| 5. | Lieber M, Mazzetta J, Nelson-Rees W, Kaplan M, Todaro G. Establishment of a continuous tumor-cell line (panc-1) from a human carcinoma of the exocrine pancreas. Int J Cancer. 1975;15:741-747. [PubMed] [DOI] |
| 6. | Kyriazis AP, McCombs WB, Sandberg AA, Kyriazis AA, Sloane NH, Lepera R. Establishment and characterization of human pancreatic adenocarcinoma cell line SW-1990 in tissue culture and the nude mouse. Cancer Res. 1983;43:4393-4401. [PubMed] |
| 7. | Pettengill OS, Faris RA, Bell RH, Kuhlmann ET, Longnecker DS. Derivation of ductlike cell lines from a transplantable acinar cell carcinoma of the rat pancreas. Am J Pathol. 1993;143:292-303. [PubMed] |
| 8. | Jessop NW, Hay RJ. Characteristics of two rat pancreatic exocrine cell lines derived from transplantable tumors. In Vitro. 1980;16:212. |
| 9. | Anastasi E, Santangelo C, Bulotta A, Dotta F, Argenti B, Mincione C, Gulino A, Maroder M, Perfetti R, Di Mario U. The acquisition of an insulin-secreting phenotype by HGF-treated rat pancreatic ductal cells (ARIP) is associated with the development of susceptibility to cytokine-induced apoptosis. J Mol Endocrinol. 2005;34:367-376. [PubMed] [DOI] |
| 10. | Longnecker DS, Lilja HS, French J, Kuhlmann E, Noll W. Transplantation of azaserine-induced carcinomas of pancreas in rats. Cancer Lett. 1979;7:197-202. [PubMed] [DOI] |
| 11. | Christophe J. Pancreatic tumoral cell line AR42J: an amphicrine model. Am J Physiol. 1994;266:G963-G971. [PubMed] |
| 12. | Qiu X, Valentijn JA, Jamieson JD. Carboxyl-methylation of Rab3D in the rat pancreatic acinar tumor cell line AR42J. Biochem Biophys Res Commun. 2001;285:708-714. [PubMed] [DOI] |
| 13. | Zhu M, Breslin MB, Lan MS. Expression of a novel zinc-finger cDNA, IA-1, is associated with rat AR42J cells differentiation into insulin-positive cells. Pancreas. 2002;24:139-145. [PubMed] [DOI] |
| 14. | Eum WS, Li MZ, Sin GS, Choi SY, Park JB, Lee JY, Kwon HY. Dexamethasone-induced differentiation of pancreatic AR42J cell involves p21(waf1/cip1) and MAP kinase pathway. Exp Mol Med. 2003;35:379-384. [PubMed] [DOI] |
| 15. | Cui ZJ. Types of voltage-dependent calcium channels involved in high potassium depolarization-induced amylase secretion in the exocrine pancreatic tumour cell line AR4-2J. Cell Res. 1998;8:23-31. [PubMed] [DOI] |
| 16. | Lai JK, Cheng CH, Ko WH, Leung PS. Ghrelin system in pancreatic AR42J cells: its ligand stimulation evokes calcium signalling through ghrelin receptors. Int J Biochem Cell Biol. 2005;37:887-900. [PubMed] [DOI] |
| 17. | Yu JH, Lim JW, Kim KH, Morio T, Kim H. NADPH oxidase and apoptosis in cerulein-stimulated pancreatic acinar AR42J cells. Free Radic Biol Med. 2005;39:590-602. [PubMed] [DOI] |
| 18. | Ikeda Y, Fukuoka S. Phosphatidic acid production, required for cholecystokinin octapeptide-stimulated amylase secretion from pancreatic acinar AR42J cells, is regulated by a Wort-sensitive process. Biochem Biophys Res Commun. 2003;306:943-947. [DOI] |
| 19. | Damm I, Mikkat U, Kirchhoff F, Böckmann S, Jonas L. Inhibitory effect of the lectin wheat germ agglutinin on the binding of 125I-CCK-8s to the CCK-A and -B receptors of AR42J cells. Pancreas. 2004;28:31-37. [PubMed] [DOI] |
| 23. | Liu ZY, Wang ZG, Zhang W, Tian HM, Li H, Na DY, Cao DY, Liu Y and Li M. Antitumor effect of BRM. Chin J Cancer Res. 2002;14:195-201. [DOI] |
| 24. | Thorn P, Lawrie AM, Smith PM, Gallacher DV, Petersen OH. Local and global cytosolic Ca2+ oscillations in exocrine cells evoked by agonists and inositol trisphosphate. Cell. 1993;74:661-668. [PubMed] [DOI] |
| 25. | Williams JA, Sans MD, Tashiro M, Schäfer C, Bragado MJ, Dabrowski A. Cholecystokinin activates a variety of intracellular signal transduction mechanisms in rodent pancreatic acinar cells. Pharmacol Toxicol. 2002;91:297-303. [PubMed] [DOI] |
| 26. | Xiao R, Cui ZJ. Mutual dependence of VIP/PACAP and CCK receptor signaling for a physiological role in duck exocrine pancreatic secretion. Am J Physiol Regul Integr Comp Physiol. 2004;286:R189-R198. [PubMed] [DOI] |
| 27. | Habara Y, Kanno T. Stimulus-secretion coupling and Ca2+ dynamics in pancreatic acinar cells. Gen Pharmacol. 1994;25:843-850. [PubMed] [DOI] |
| 28. | Herbst M, Sasse P, Greger R, Yu H, Hescheler J, Ullrich S. Membrane potential dependent modulations of calcium oscillations in insulin-secreting INS-1 cells. Cell Calcium. 2002;31:115-126. [PubMed] [DOI] |
| 29. | Swarovsky B, Steinhilber W, Scheele GA, Kern HF. Coupled induction of exocrine proteins and intracellular compartments involved in the secretory pathway in AR4-2J cells by glucocorticoids. Eur J Cell Biol. 1988;47:101-111. [PubMed] |