修回日期: 2008-01-16
接受日期: 2008-01-23
在线出版日期: 2008-02-28
目的: 探讨PI3K/Akt(PKB)/p27kip1通道对胃癌细胞BGC-823化疗的效果和作用机制.
方法: 将培养的胃癌细胞BGC-823分为对照组, PI3K/Akt/p27kip1通道抑制剂Wort组(Wort组), 足叶乙甙组(Eto组), 阿霉素组(Dox组), Eto+Wort组和Dox+Wort组; MTT法检测细胞生存率, 流式细胞仪检测细胞周期和凋亡, Western印迹法检测p27Kip1蛋白表达水平, RT-PCR检测p27基因mRNA表达水平.
结果: 与对照组相比, Wort组, Eto+Wort组和Dox+Wort组24 h细胞生存率降低(57.8%、46.5%、44.3% vs 46.5%、44.3%, P<0.01), G0-G1期的比例增多(85.0±3.54, 91.5±3.63, 92.4±3.64 vs 71.5±3.25, P<0.01), 12 h和24 h蛋白表达升高; Eto组和Dox组细胞生成率较对照组升高, 但G0-G1期的比例无明显变化; 各组p27基因mRNA表达水平一致.
结论: PI3K/Akt/p27通道激活能介导肿瘤细胞化疗耐药.
引文著录: 张利, 于红刚, 于皆平, 罗和生. PI3K/Akt/p27kip1通道介导胃癌细胞对阿霉素、足叶乙甙化疗的耐药性及其机制. 世界华人消化杂志 2008; 16(6): 575-581
Revised: January 16, 2008
Accepted: January 23, 2008
Published online: February 28, 2008
AIM: To investigate the effect of chemo-resistance to Etoposide and Doxorubicin mediated by the PI3K/Akt/p27 pathway on human gastric carcinoma cell line BGC-823 and its mechanism.
METHODS: Cultured BGC-823 gastric cancer cells were divided into control group, PI3K/Akt/p27 Kip1 channel inhibitor Wort (Wort) group, Etoposide (Eto) group, Doxorubicin (Dox) group, Eto + Wort group and Dox + Wort group. Cell survival was assessed with MTT method. Cell cycle and apoptosis were detected using a flow cytometer (FCM). Expression level of p27 Kip1 and p27 gene mRNA was determined by Western blotting analysis and reverse transcription-polymerase chain reaction, respectively.
RESULTS: The cell survival rate at 24 h was lower in Wort group, Eto +Wort group and Dox +Wort group than in control group (57.8%, 46.5%, 44.3% vs 46.5%, 44.3%, P < 0.01). The cell ratio in G0-G1 phase was higher in Wort group, Eto +Wort group and Dox + Wort group than in control group (85.0 ± 3.54, 91.5 ± 3.63, 92.4 ± 3.64 vs 71.5 ± 3.25, P < 0.01) and the protein expression was increased at 12 h and 24 h. The cell survival rate in Eto and Dox groups was higher than that in control group, but no obvious change was found in G0 - G1 phase. The p27 mRNA expression was similar in different groups.
CONCLUSION: Activation of PI3K/Akt/p27 channel can mediate chemo-resistance to tumor cells.
- Citation: Zhang L, Yu HG, Yu JP, Luo HS. PI3K/Akt/p27kip1 pathway mediates chemoresistance to Etoposide and Doxorubicin in gastric carcinoma cell line BGC-823 and its mechanism. Shijie Huaren Xiaohua Zazhi 2008; 16(6): 575-581
- URL: https://www.wjgnet.com/1009-3079/full/v16/i6/575.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i6.575
胃癌是消化道最常见的恶性肿瘤, 其发病率和死亡率居我国恶性肿瘤之首, 寻找一种辅助疗法以提高手术疗效和延长失去手术机会患者的生存期已成为令人瞩目的课题. 目前胃癌化学治疗(简称化疗)已引起越来越多医学工作者的重视.
最新研究显示, 一些肿瘤细胞可以通过对负责细胞生长和凋亡的细胞信息传导通路进行调控而获得对化疗药物的耐药性[1], 磷脂酰肌醇3-激酶(phosphatidylinositol 3-kinase, 以下简称PI3K)信息传导通路的激活被认为是肿瘤细胞抗凋亡的主要机制之一[2-3], 该通路不但与肿瘤的发生有关, 还与肿瘤的进一步浸润和转移有关[4], 可能该通道抑制剂有较强的癌细胞杀伤和抑制作用[5-8]. 足叶乙甙(Etoposide)和阿霉素(Doxorubicin)为应用较为普遍的抗癌药, 这两种药物主要通过干扰拓扑异构酶Ⅱα诱导双链DNA断裂[9]. 因拓扑异构酶Ⅱα的表达与细胞周期循环紧密联系, 故足叶乙甙和阿霉素主要影响快速增殖细胞. 本研究通过PI3K/Akt/p27 kip1通道抑制剂Wortmannin, 阿霉素及足叶乙甙对低分化胃癌细胞BGC-823生长增殖的影响, 以探求其作用机制, 为克服肿瘤细胞化疗耐药提供指导.
噻唑蓝(MTT)、二甲亚砜(DMSO)、胎牛血清、RPMI-1640、碘化丙啶(PI)、Annexin V/PI双染试剂盒、细胞计数板、96孔培养板、Western blot试剂盒、P27兔抗人一抗、羊抗兔二抗、5×上样缓冲液(以上试剂均购于武汉林海生物); 流式细胞仪(武汉大学医学院), 酶联检测仪、CO2孵箱、电泳和电转槽、底片、显影液和定影液、Vilber Lourmat凝胶成像系统(以上于武汉大学人民医院消化实验室); Ecl试剂盒(Santa公司); 细胞裂解液, TRIzol, RNA初提试剂盒, cDNA合成试剂盒及PCR试剂盒(以上购于晶美生物); 引物合成和设计由英骏公司提供帮助, 100 bp DNA ladder(Genscript Corporation); 人胃癌细胞株BGC-823购用中国科学院上海细胞生物研究所细胞库.
1.2.1 细胞培养: 将胃癌细胞接种于含100 mL/L胎牛血清(56 ℃灭活30 min), 100 000 IU/L青霉素及100 000 IU/L链霉素的RPMI1640培养液中, 在37 ℃, 50 mL/L CO2培养箱中进行单层传代培养2 d更换培养基1次, 1:4常规传代培养, 取对数生长期细胞进行实验.
1.2.2 MTT法检测细胞生存率: 细胞以每孔3×108个/L的浓度接种于96孔培养板, 于含100 mL/L胎牛血清RPMI-1640培养液中培养36 h, 细胞贴壁后, 先均用无血清培养液培养24 h后, 实验组: Ⅱ: 单加Wortmannin组(Wort, 终浓度40 nmol/L), Ⅲ: 单加足叶乙甙组(Eto, 20 µmol/L), Ⅳ: 加Eto+Wort组, Ⅴ: 单加阿霉素(Dox, 0.3 µmol/L)组, Ⅵ: 加Dox+Wort组及他们的混合液, 对照组加等量相同不含药物培养液. 药物作用24 h后, 于每孔中加入配制的0.5% MTT 20 µL继续培养4 h, 弃上清, 加入150 µL DMSO, 在混合振荡仪上振摇约15 min, 使结晶物充分溶解后, 于酶联检测仪上570 nm波长测定各孔吸光光度值. 计算细胞毒性值(CT%), CT% = (1-A处理/A对照)×100%. 分别做5次, 结果以mean±SD表示.
1.2.3 药物作用时间曲线: 细胞以每孔3×108个/L的浓度接种于96孔培养板, 共接种4个96孔板, 实验组单独加入阿霉素(0.3 µmol/L)、足叶乙甙(20 µmol/L)、单独Wort组(40 nmol/L)及他们的混合培养液, 对照组加入等量相同培养液. 分别于加药后12、24、36、48 h取出一培养板测定药物组的A值, 并根据存活率绘制药物作用下的细胞生长曲线, 存活率= A处理/A对照×100%.
1.2.4 流式细胞仪: (1)PI单染色检测Etoposide, Doxorubicin, Wort及他们的混合液对BGC-823细胞周期和凋亡的影响: 药物干预分组同1.2.2, 于药物作用24 h后, 分别收集处理组及对照组培养瓶细胞, 用PBS洗涤2次后, 用700 mL/L乙醇固定待检. 上机前再经PBS洗涤2次, RNA酶消化, PI染色. 用流式细胞仪测定, 每次计数细胞10 000个, 用多参数细胞分析软件处理测定结果, 对各样本进行细胞周期分析, 并计算凋亡率. (2)Annexin V/PI双染: 将各分组干预的细胞, 用冰冷PBS洗涤2次后, 离心, 加入结合缓冲液(1:4去离子水稀释)250 µL重新悬浮细胞, 取100 µL放入待测管, 按说明加以上两种染色试剂置暗处孵育15 min上机, 检测早期细胞凋亡.
1.2.5 Western blot检测p27蛋白表达: 取对数生长期肿瘤细胞先加无血清培养液24 h后, 再分别在六组中加抗癌药, Ⅰ: 对照组(无血清培养液), Ⅱ: 单加Wort组, Ⅲ: 单加足叶乙甙组(Eto), Ⅳ: 加Eto+Wort组, Ⅴ: 单加阿霉素(Dox)组, Ⅵ: 加Dox+Wort组. 作用12、24 h后分别收集细胞(死亡细胞多漂起, 通过收集培养液离心而收集死亡细胞), 加裂解液提取总蛋白, 取400 µL裂解上清液, Bradford法测定蛋白浓度: 每种样品以20 µg总蛋白上样, 进行12.5% PAGE凝胶电泳, 100 V, 40 min. 电泳结束后, 取下凝胶25 V电转2 h, 使蛋白转移至硝酸纤维素膜(NC)膜上, 将NC膜用封闭液封闭非特异性抗体2 h, 加入一抗(兔抗人p27抗体1:1000), 4 ℃摇床孵育过夜加入二抗(羊抗兔1:2000)室温孵育1 h, 将NC膜置于ECL(增强化学发光试剂)中反应1-3 min, 暗室中使X线片曝光, 常规方法显影定影, X线片上的条带用图像分析系统进行分析, 测定积分灰度值, 将p27/β-actin的比值作为蛋白表达的相对量.
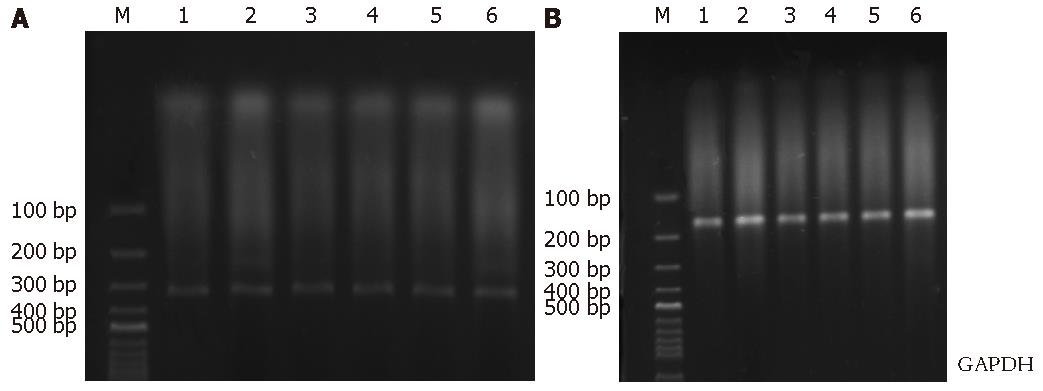
1.2.6 RT-PCR检测p27基因的表达: (1)细胞总RNA的提取: 细胞处理过程及分组同1.2.5, 将分组干预的细胞, 经PBS洗涤后, 每瓶加入1 mL TRIzol, 使细胞充分裂解, 按操作手册抽提取总RNA, 紫外分光光度计检测RNA的纯度和含量, RNA电泳检测其完整性. (2)两步法实时定量RT-PCR: 按cDNA合成说明书逆转录为cDNA, 合成的引物序列见表1, 常规PCR扩增, 循环参数如下: 94 ℃预变性5 min, 94 ℃变性30 s, 最佳退火温度55 ℃ 30 s, 72 ℃延伸30 s, 35个循环后, 72 ℃延伸10 min, GAPDH为内参照, PCR反应产物15 g/L琼脂糖凝胶电泳, 两者同时进行(两引物退火温度相同). 采用法国Vilber Lourmat凝胶成像系统观测实验5次, 测定积分灰度值以p27/GAPDH的比值作为基因表达的相对量(表1).
| Primer | Seq(5' to 3') | TM值 | 产物长度 |
| p27 | |||
| Left | TCATGCCCTCTCTTCGTTTCC | 59.89 | 353 bp |
| Right | CGTTCGGATATAAACTGGCC | 59.57 | 353 bp |
| GAPDH | |||
| Left | ACCACAGTCCATGCCATCAT | 60.36 | 182 bp |
| Right | TCTACCACCCTGTTGCTGTA | 60.64 | 182 bp |
统计学处理 数据以mean±SD表示, 采用SPSS13.0软件, 单纯比较处理组与对照组之间的差别用t检验. 随机区组间三者或以上计量资料的两两比较, 用LSD检验.
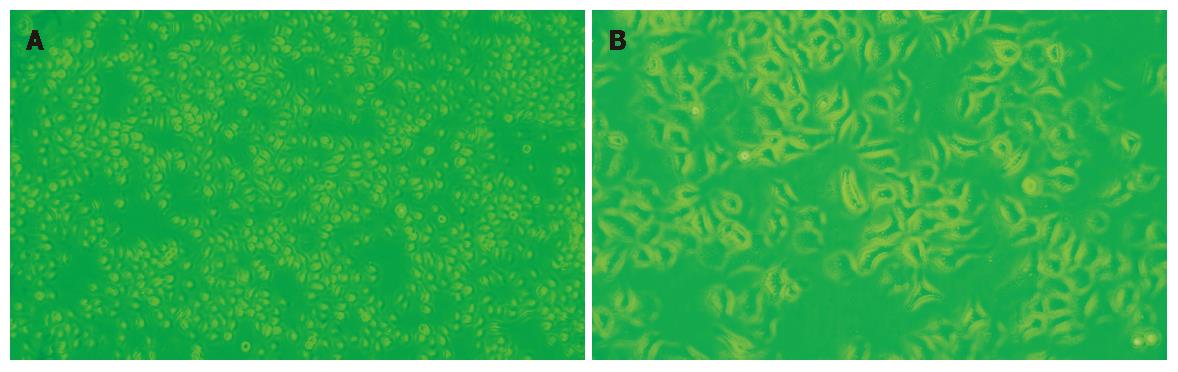
药物作用24 h后, 阿霉素、足叶乙甙、Wort组均有肿瘤细胞抑制作用(以阿霉素为例, 细胞生长状态前后对比见图1), 以Wort较为明显, 且联合作用抑制作用最为显著(表2).
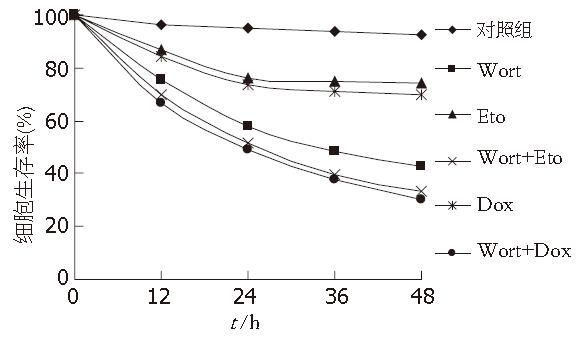
各实验组和对照组药物作用胃癌细胞, 分别于12、24、36、48 h行细胞毒性检测, 单用足叶乙甙、阿霉素两组细胞生存率有明显下降, 但于24 h后出现细胞耐药, 下降幅度明显减弱; Wort组也有较强的细胞毒性, 且联合作用不但细胞毒性加强, 又能克服单用足叶乙甙、阿霉素出现的化疗耐药, 药物作用24 h后细胞生存率下降幅度仍明显(图2).
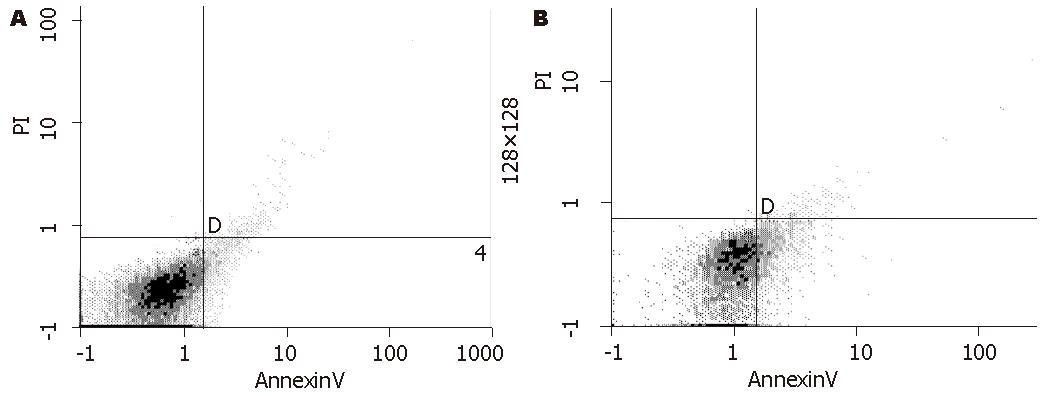
Wort、Etoposide, Doxorubicin及联合应用组分别作用细胞24 h后, Wortmannin参与三组与对照组在各期、增殖指数和早期凋亡率上的比较, 均有显著差异, 而足叶乙甙、阿霉素单用组与对照组比较, 各期细胞比例、PI和早期凋亡率的比较无统计学意义(阿霉素和联合Wortmannin作用细胞早期凋亡分布见图3). 显示Wortmannin及其联合应用组药物作用肿瘤细胞后, 与对照组比较细胞处于G0-G1期的比例增多, 说明药物作用后细胞G1期延长和不增殖细胞群即G1期细胞增多, G1期延长意味着细胞增殖周期延长, 增殖缓慢, 而相对增殖期细胞减少, 以联合组最显著; 并分析含Wort三组的S期细胞比例可见, 该期细胞明显减少, 在联合组中更为突出(表3).
| 分组 | G0-G1期 | S期 | G2-M期 | PI | 凋亡率 |
| 对照组 | 71.5±3.25 | 18.9±1.36 | 6.3±1.68 | 25.0±2.35 | 7.2±2.15 |
| Wort组 | 85.0±3.54b | 8.7±1.46b | 5.1±0.84 | 13.6±1.87b | 42.4±3.57b |
| Eto组 | 75.1±3.18 | 16.3±1.25 | 8.2±1.56 | 24.4±2.14 | 9.2±2.16 |
| Wort+Eto组 | 91.5±3.63bd | 2.5±0.78bd | 5.7±1.16 | 7.9±1.16bd | 53.4±3.82b |
| Dox组 | 76.4±3.36 | 15.8±1.17 | 7.8±1.45 | 23.6±2.05 | 11.4±2.21a |
| Wort+Dox组 | 92.4±3.64bd | 2.3±0.65bd | 5.4±1.02 | 7.4±1.08bd | 54.8±3.06b |
对照组及处理组Wort、Eto、Wort+Eto、Dox、Wort+Dox 5个组药物干预肿瘤细胞12 h、24 h后, 裂解细胞行免疫印迹p27蛋白表达检测, 各灰带值分别与β-actin进行校正(图4). 两时间段含Wort组与对照组比较, p27蛋白表达强, 统计分析有差异(P<0.05), 以24 h更为明显, 干预24 h时联合组有显著差异(P<0.01); 单用Eto、Dox干预12 h时两组则较对照组表达强弱无差异, 干预24 h时则出现有显著差异(P<0.01). 灰度值进行统计学分析结果见(表4).
PI3K是一种胞内磷脂酰肌醇激酶, 可以特异性使肌醇环上的3位羟基磷酸化, 使PIP2转变为第二信使PIP3. PI3K主要是通过其3位羟基磷酸化产物PIP3转移Akt到细胞膜上, 并改变Akt的构象使之能被3-磷脂酰肌醇依赖蛋白激酶所磷酸化和激活, 从而传递抗凋亡信号到PI3K/Akt下游通道的效应因子, 本研究证实Akt/p27途径起一定作用.
p27kip1是1994年由Polyak et al首先发现的一种广谱周期蛋白依赖性激酶抑制剂, 具有抑制细胞周期蛋白依赖性激酶(CDK)和抑制细胞从G1期到S期的转化功能, p27蛋白的下调和高表达, 直接影响肿瘤细胞周期和肿瘤细胞的凋亡, 现纳入候选的抑癌基因[10-11], 从p27基因的复制, 转录, 翻译到p27蛋白的降解, p27蛋白水平的调节, 主要是转录后水平, 转录后水平的调节途径包括对p27蛋白的水解、对p27在细胞中的定位以及对p27被扣留的调控, p27kip1基因改变少见[12], 最新研究显示, 在乳腺癌[13]及结肠癌[14]患者中, p27蛋白表达高的患者其预后明显好于p27蛋白低表达者; p27蛋白低表达与肿瘤向血管、淋巴管侵润有明显关系[15]; p27蛋白免疫反映性与肿瘤分期有关[16]; 在卵巢上皮细胞癌患者中, p27蛋白低表达预示临床预后差[17]; 食管癌患者中, p27蛋白表达水平能反映食管癌细胞的增殖状态[18], 均提示p27表达的高低将直接反映患者的预后, 也可间接反映化疗预后.
PI3K/Akt(PKB)通道激活对p27的作用是多方面的, 在不同的细胞类型中其效应也有不同: (1)PKB能磷酸化p27核定位信号区的T157[19]; (2)PI3K调节p27的稳定性; (3)在PTEN缺失的细胞中, PKB介导的磷酸化可抑制p27的核转位; (4)PI3K途径的激活会导致p27在特定细胞中的表达下调; (5)PI3K的激活促进p27蛋白水解; (6)磷酸化p27KIP1使他们在胞内堆积; (7)forkhead家族蛋白, 是一类转录因子, 入核后促进p27蛋白的表达, 而PI3K通道的激活可以对其磷酸化起负性调节[20-21]. PI3K/Akt途径对p27稳定性的调控在活体内可能更复杂一些. 综上所述, PI3K/Akt(PKB)通道激活或失活将直接影响p27的表达水平.
通过实验, 我们得出: (1)p27蛋白水平的调节, 在转录后, 故RT-PCR检测的结果p27基因各组的表达水平趋于一致, 各药物组对p27 mRNA无影响. (2)含PI3K/Akt(PKB)通道抑制剂Wort的3组p27蛋白表达均较对照组表达强, 联合应用表达升高更加显著, 而单用足叶乙甙和阿霉素组p27表达较对照组降低, 可知足叶乙甙和阿霉素能异常激活PI3K/Akt通道, 磷酸化的PKB通过上文所述的诸多作用机制, 导致p27表达下调, 且随时间的延长而下调明显, 与PI3K/Akt通道抑制剂Wort联合应用, 既能提高Wort对该通道的抑制能力, 直接上调p27蛋白表达水平, 又加强肿瘤细胞毒性和杀伤力, 细胞生存率明显降低; (3)足叶乙甙、阿霉素和Wort均有较强的胃癌细胞BGC-823抑制和杀伤作用, 以Wort作用更为突出, 单用足叶乙甙、阿霉素于24 h后出现明显细胞耐药, 联合Wort处理后未见肿瘤细胞耐药; 且在含PI3K通道抑制剂Wort组, 细胞生存率均较对照组低(57.8%), 细胞停止生长在G1期(85%), 联合阿霉素和足叶乙甙生存率更低(44.3%、46.5%), 停止在G1期的肿瘤细胞为(92.2%、91.5%), 结合各实验结果综合分析, 提示PI3K/Akt通道抑制剂Wort能通过上调p27蛋白表达对肿瘤细胞周期进行负性调节, 并使肿瘤细胞停止生长在G1期、明显降低增殖期细胞比例, p27蛋白还可以诱导肿瘤细胞凋亡, 且与阿霉素、足叶乙甙联合应用既加强了自身对PI3K/Akt通道的抑制作用, 又能提高足叶乙甙和阿霉素细胞毒性和杀伤力; 而单用阿霉素和足叶乙甙, 则异常激活PI3K/Akt通道, 直接下调p27表达水平, 失去了对肿瘤细胞周期的负性调节和诱导凋亡的能力, 胃癌细胞对化疗药物产生耐药. 以上提示PI3K/Akt/p27通道激活能介导肿瘤细胞化疗耐药.
进展期肿瘤的治疗问题, 主要是手术切除和解决肿瘤细胞的无限增殖, 而对细胞调控点的抑制作用是解决细胞增殖的关键, 细胞周期的调控点有三个: G1期控制点, S期及M期控制点. p27蛋白主要是通过结合和抑制cyclin E/CDK2复合物(一种能调节细胞进入S期所必须的催化酶)来抑制细胞从G1向S期转变, 同样, 还能广泛的调节其他的周期蛋白cyclin, 因而被称广谱细胞周期蛋白依赖性激酶CDK抑制剂(CDKI)[22]: 一方面, p27kip1能够与CDK亚单位结合, 抑制CAK(CDK2 activating kinase)对CDK的激活过程; 另一方面, p27kip1直接抑制细胞中已激活的cyclin 2/CDK激酶活性[23], 由于p27kip1的作用, cyclin D2/CDK4/6、cyclin E2/CDK2不能有效地磷酸化Rb蛋白, E2F转录因子不能被释放, 细胞周期的进程被阻断; p27蛋白的下调, 其直接结果导致TNF-α的下调, 肿瘤细胞抗凋亡, 以上为p27蛋白作用G1期控制点抑制肿瘤细胞增殖和诱导凋亡的机制.
总之, 足叶乙甙、阿霉素诱导PI3K/Akt/p27通路的异常激活能下调p27蛋白, 从而对细胞周期负性调节和诱导肿瘤细胞凋亡的能力下降, 该通道的激活参与胃癌细胞对化疗药物耐药性的产生. 应用PI3K/Akt通路抑制剂将增加胃癌细胞对化疗药物的敏感性.
近年来, PI3K/Akt通道与肿瘤的关系已日益受到重视. Akt又名PKB, 是丝氨酸/苏氨酸蛋白激酶, Akt是磷脂酰肌醇3-激酶的直接下游靶蛋白, Akt成为信号传导深入研究的焦点. 通过抑制Akt的活性, 从而提高胃癌细胞中的广谱周期蛋白依赖性激酶抑制剂p27蛋白的表达, 进而对肿瘤细胞周期行负性调节和诱导凋亡.
王小众, 教授, 福建医科大学附属协和医院消化内科.
肿瘤细胞信号转导特别是各种传导通路是该领域研究热点, PI3K/Akt通道以及下游Akt/p27途径参与了调控胃癌细胞生长传导的机制.
本文通过体外细胞培养, 测定不同化疗药物干预后的生存率和增殖抑制指标, 并裂解细胞检测p27蛋白、mRNA的表达, 为常规化疗药物作用PI3K/Akt/p27通道, 调控胃癌细胞增殖的信号传导机制提供了更有力的支持. 为临床联合化疗药物以提高疗效性提供了理论依据和指导作用.
Wort: 一种常见phosphatidylinositol 3kinase(PI3K)抑制剂. Wort可以通过细胞和PI3K的110 kDa催化亚基相结合, 特异性抑制PI3K, 抑制PI3K/Akt信号通路, 包括常见的Akt磷酸化等.
本文内容较新, 层次分明, 具有临床指导价值.
编辑: 程剑侠 电编: 吴鹏朕
| 1. | Poh TW, Pervaiz S. LY294002 and LY303511 sensitize tumor cells to drug-induced apoptosis via intracellular hydrogen peroxide production independent of the phosphoinositide 3-kinase-Akt pathway. Cancer Res. 2005;65:6264-6274. [PubMed] [DOI] |
| 3. | Nicholson KM, Anderson NG. The protein kinase B/Akt signalling pathway in human malignancy. Cell Signal. 2002;14:381-395. [PubMed] [DOI] |
| 4. | Qian Y, Zhong X, Flynn DC, Zheng JZ, Qiao M, Wu C, Dedhar S, Shi X, Jiang BH. ILK mediates actin filament rearrangements and cell migration and invasion through PI3K/Akt/Rac1 signaling. Oncogene. 2005;24:3154-3165. [PubMed] [DOI] |
| 5. | Kraus AC, Ferber I, Bachmann SO, Specht H, Wimmel A, Gross MW, Schlegel J, Suske G, Schuermann M. In vitro chemo- and radio-resistance in small cell lung cancer correlates with cell adhesion and constitutive activation of AKT and MAP kinase pathways. Oncogene. 2002;21:8683-8695. [PubMed] [DOI] |
| 6. | Krystal GW, Sulanke G, Litz J. Inhibition of phosphatidylinositol 3-kinase-Akt signaling blocks growth, promotes apoptosis, and enhances sensitivity of small cell lung cancer cells to chemotherapy. Mol Cancer Ther. 2002;1:913-922. [PubMed] |
| 7. | Clark AS, West K, Streicher S, Dennis PA. Constitutive and inducible Akt activity promotes resistance to chemotherapy, trastuzumab, or tamoxifen in breast cancer cells. Mol Cancer Ther. 2002;1:707-717. [PubMed] |
| 8. | Wu K, Wang C, D'Amico M, Lee RJ, Albanese C, Pestell RG, Mani S. Flavopiridol and trastuzumab synergistically inhibit proliferation of breast cancer cells: association with selective cooperative inhibition of cyclin D1-dependent kinase and Akt signaling pathways. Mol Cancer Ther. 2002;1:695-706. [PubMed] |
| 9. | Kingma PS, Osheroff N. The response of eukaryotic topoisomerases to DNA damage. Biochim Biophys Acta. 1998;1400:223-232. [PubMed] [DOI] |
| 10. | Takeno S, Noguchi T, Kikuchi R, Uchida Y, Yokoyama S, Müller W. Prognostic value of cyclin B1 in patients with esophageal squamous cell carcinoma. Cancer. 2002;94:2874-2881. [PubMed] [DOI] |
| 11. | Radosevic N, Delmer A, Tang R, Marie JP, Ajchenbaum-Cymbalista F. Cell cycle regulatory protein expression in fresh acute myeloid leukemia cells and after drug exposure. Leukemia. 2001;15:559-566. [PubMed] [DOI] |
| 12. | Chen TC, Ng KF, Lien JM, Jeng LB, Chen MF, Hsieh LL. Mutational analysis of the p27(kip1) gene in hepatocellular carcinoma. Cancer Lett. 2000;153:169-173. [PubMed] [DOI] |
| 13. | Zheng WQ, Zheng JM, Ma R, Meng FF, Ni CR. Relationship between levels of Skp2 and P27 in breast carcinomas and possible role of Skp2 as targeted therapy. Steroids. 2005;70:770-774. [PubMed] [DOI] |
| 14. | Hershko DD, Shapira M. Prognostic role of p27Kip1 deregulation in colorectal cancer. Cancer. 2006;107:668-675. [PubMed] [DOI] |
| 15. | Goto A, Niki T, Moriyama S, Funata N, Moriyama H, Nishimura Y, Tsuchida R, Kato JY, Fukayama M. Immunohistochemical study of Skp2 and Jab1, two key molecules in the degradation of P27, in lung adenocarcinoma. Pathol Int. 2004;54:675-681. [PubMed] [DOI] |
| 16. | Langner C, von Wasielewski R, Ratschek M, Rehak P, Zigeuner R. Expression of p27 and its ubiquitin ligase subunit Skp2 in upper urinary tract transitional cell carcinoma. Urology. 2004;64:611-616. [PubMed] [DOI] |
| 17. | Bali A, O'Brien PM, Edwards LS, Sutherland RL, Hacker NF, Henshall SM. Cyclin D1, p53, and p21Waf1/Cip1 expression is predictive of poor clinical outcome in serous epithelial ovarian cancer. Clin Cancer Res. 2004;10:5168-5177. [PubMed] [DOI] |
| 18. | Huang JX, Song ZX, Qian RY, Xu GW. [Expression of cell cycle-regulatory proteins in squamous cell carcinoma of the esophagus]. Ai Zheng. 2003;22:277-281. [PubMed] |
| 19. | Shin I, Yakes FM, Rojo F, Shin NY, Bakin AV, Baselga J, Arteaga CL. PKB/Akt mediates cell-cycle progression by phosphorylation of p27(Kip1) at threonine 157 and modulation of its cellular localization. Nat Med. 2002;8:1145-1152. [PubMed] [DOI] |
| 20. | Medema RH, Kops GJ, Bos JL, Burgering BM. AFX-like Forkhead transcription factors mediate cell-cycle regulation by Ras and PKB through p27kip1. Nature. 2000;404:782-787. [PubMed] [DOI] |
| 21. | Brownawell AM, Kops GJ, Macara IG, Burgering BM. Inhibition of nuclear import by protein kinase B (Akt) regulates the subcellular distribution and activity of the forkhead transcription factor AFX. Mol Cell Biol. 2001;21:3534-3546. [PubMed] [DOI] |
| 22. | Timmerbeul I, Garrett-Engele CM, Kossatz U, Chen X, Firpo E, Grünwald V, Kamino K, Wilkens L, Lehmann U, Buer J. Testing the importance of p27 degradation by the SCFskp2 pathway in murine models of lung and colon cancer. Proc Natl Acad Sci USA. 2006;103:14009-14014. [PubMed] [DOI] |
| 23. | Xu X, Nakano T, Wick S, Dubay M, Brizuela L. Mechanism of Cdk2/Cyclin E inhibition by p27 and p27 phosphorylation. Biochemistry. 1999;38:8713-8722. [PubMed] [DOI] |