修回日期: 2008-01-10
接受日期: 2008-01-15
在线出版日期: 2008-02-08
目的: 探讨激活素受体相互作用蛋白2(ARIP2)在肝细胞内的表达形式及其介导的生物学
作用.
方法: 采用免疫组织化学及细胞化学染色、Western blot检测ARIP2蛋白在小鼠肝组织及肝癌细胞系Hepa1-6细胞内的表达; 采用激活素特异应答的CAGA-lux报告基因质粒分析ARIP2对激活素诱导的特异基因转录的影响; MTT法检测ARIP2过表达对Hepa1-6细胞增殖的影响.
结果: ARIP2蛋白可在小鼠肝组织及Hepa1-6细胞表达. 激活素A刺激Hepa1-6细胞ARIP2蛋白表达呈时间依赖性升高, 于24 h达到高峰; 12 h、24 h测定值与对照组相比有显著性意义(1.01±0.16, 1.62±0.26 vs 0.82±0.11, P<0.05). pcDNA3-ARIP2转染Hepa1-6细胞, 可以明显抑制激活素诱导的特异基因转录; MTT检测显示激活素A(5 μg/L、10 μg/L)可以明显抑制Hepa1-6细胞增殖, 其570 nm吸光度值与对照组相比有显著差异(1.59±0.03、1.49±0.04 vs 1.79±0.07, P<0.05, P<0.01). 在Hepa1-6细胞内过表达ARIP2可以阻断激活素A对Hepa1-6细胞的增殖抑制作用.
结论: ARIP2有望成为治疗激活素诱导的肝脏损伤性疾病的基因调控靶点.
引文著录: 张红军, 柳忠辉, 陈芳芳, 马迪, 周静, 台桂香. ARIP2蛋白在小鼠肝细胞中的表达及其生物学作用. 世界华人消化杂志 2008; 16(4): 350-355
Revised: January 10, 2008
Accepted: January 15, 2008
Published online: February 8, 2008
AIM: To investigate the activin receptor-interacting protein 2 (ARIP2) expression and its biological function in hepatocytes.
METHODS: Expression of ARIP2 in mouse liver tissue and hepatoma cell line Hepal-6 cells was detected by Western blot, immunohistochemistry and cytochemical staining. Effect of ARIP2 on activin-induced gene transcription was analyzed using CAGA-lux plasmid. Effect of over-expression of ARIP2 on the proliferation of Hepal-6 cells was assayed with MTT method.
RESULTS: ARIP2 was expressed in mouse liver tissue and Hepal-6 cells. The expression of ARIP2 in activin A-stimulated Hepal-6 cells was increased in a time-dependent manner, and peaked at 24 h. There was a significant difference in the expression level of ARIP2 on Hepal-6 cells at 12 and 24 h in contrast with the control group (1.01 ± 0.16, 1.62 ± 0.26 vs 0.82 ± 0.11, P < 0.05, P < 0.01). pcDNA3-ARIP2-transfected Hepal-6 cells obviously suppressed the gene transcription induced by activin A. MTT assay displayed that activin A (5 μg/L and 10 μg/L) remarkably inhibited the proliferation of Hepal-6 cells, the A570 nm value was 1.59 ± 0.03 and 1.49 ± 0.04 vs 1.79±0.07, respectively (P < 0.05, P < 0.01). ARIP2 over-expression in Hepal-6 cells significantly blocked the inhibitory effects of activin A (5 μg/L and 10 μg/L) on the proliferation of Hepal-6 cells.
CONCLUSION: ARIP2 can be expected to become a regulation target of genes in treatment of liver injury induced by activin.
- Citation: Zhang HJ, Liu ZH, Chen FF, Ma D, Zhou J, Tai GX. Activin receptor-interacting protein 2 expression and its biological function in mouse hepatocytes. Shijie Huaren Xiaohua Zazhi 2008; 16(4): 350-355
- URL: https://www.wjgnet.com/1009-3079/full/v16/i4/350.htm
- DOI: https://dx.doi.org/10.11569/wcjd.v16.i4.350
激活素(Activin)属于转化生长因子-β(trans-forming growth factor, TGF-β)超家族的多功能生长、分化因子[1-4]. 近年研究发现激活素与肝脏疾病关系密切, Activin A不仅以自分泌/旁分泌形式作用于肝实质细胞, 抑制肝细胞的增殖、影响肝组织再生, 还可以通过活化肝星形细胞(HSC), 促进肝细胞外基质(extracellular matrix, ECM)异常分泌, 参与肝纤维化的形成和发展[5-7].
激活素受体属于丝/苏氨酸激酶型受体[8-9], 激活素首先与靶细胞表面的Ⅱ型受体(ActRⅡ)结合, ActRⅡ再活化Ⅰ型受体(ActRⅠ), 进而激活细胞内下游信号传导蛋白Smads, 发挥生物学作用. 激活素受体相互作用蛋白(ARIP)是最近发现的一组信号传导调控蛋白[10-13], 作为Smad上游信号调控蛋白可特异结合激活素Ⅱ型受体, 影响激活素诱导的细胞内信号传导. 研究发现ARIP2具有抑制激活素信号传导的作用, Northern blot检测显示ARIP2 mRNA在肝组织内高表达[10], 我们的研究还显示肝癌细胞系Hepa1-6高表达ARIP2 mRNA[10]. 因此推测, ARIP2表达与激活素调控肝细胞活性有关, 但是ARIP2在肝细胞中介导激活素信号传导及其对激活素诱导的肝细胞增殖抑制的影响作用仍不清楚. 本研究采用Hepa1-6细胞[14], 进一步探讨了ARIP2蛋白的表达规律及其参与激活素信号传导和细胞增殖的作用, 为进一步寻找治疗肝脏疾病的基因作用靶点奠定研究基础.
Activin A、MTT购自Sigma公司, Dulbecco's modified Eagle's medium(DMEM)高糖培养基是GIBCO产品, Lipofectamine 2000由Invitrogen公司提供, Glutathione-Sepharose 4B以及Protein A-Sepharose 4B为Amersham Biosciences产品. 免疫组织化学染色用Ultrasensitive SP试剂盒购置福建迈新公司. Hepa1-6细胞株来源于小鼠肝癌细胞系, 由中科院上海细胞库提供, 采用100 mL/L牛血清(FCS)-DMEM培养.
1.2.1 质粒构建: 根据编码ARIP2全氨基酸cDNA序列(1-153氨基酸残基), 分别设计并引入EcoRⅠ酶切位点的上游引物: 5'-ggaattcatgattttctcagggctggg-3'和引入XhoⅠ酶切位点及终止密码子的下游引物5'-gctcgagctattcacaagaacagtgtaaa-3'. 经一步法RT-PCR扩增目的基因片段, TA克隆入pMD18-T质粒, 再亚克隆入真核表达载体pcDNA3, 构建pcDNA3-ARIP2. 同时构建原核表达质粒pGEX-4T-1-ARIP2(编码ARIP2 COOH端的98-153氨基酸残基).
1.2.2 兔抗ARIP2抗体制备: 构建的pGEX-4T-1-ARIP2表达质粒转染大肠杆菌BL21, 采用Glutathione-Sepharose 4B亲和层析柱纯化表达的GST-ARIP2融合蛋白(按产品说明书操作). 取GST-ARIP2融合蛋白500 µg与完全弗氏佐剂混匀, 多点接种免疫家兔, 加强免疫两次后, 静脉采血、分离血清. 经Protein A亲和层析纯化抗GST-ARIP2融合蛋白抗体, 再经GST-Sepharose 4B亲和层析除去抗GST抗体[13]. 获得纯化的抗ARIP2特异性IgG型抗体, 用于免疫组织及细胞化学染色.
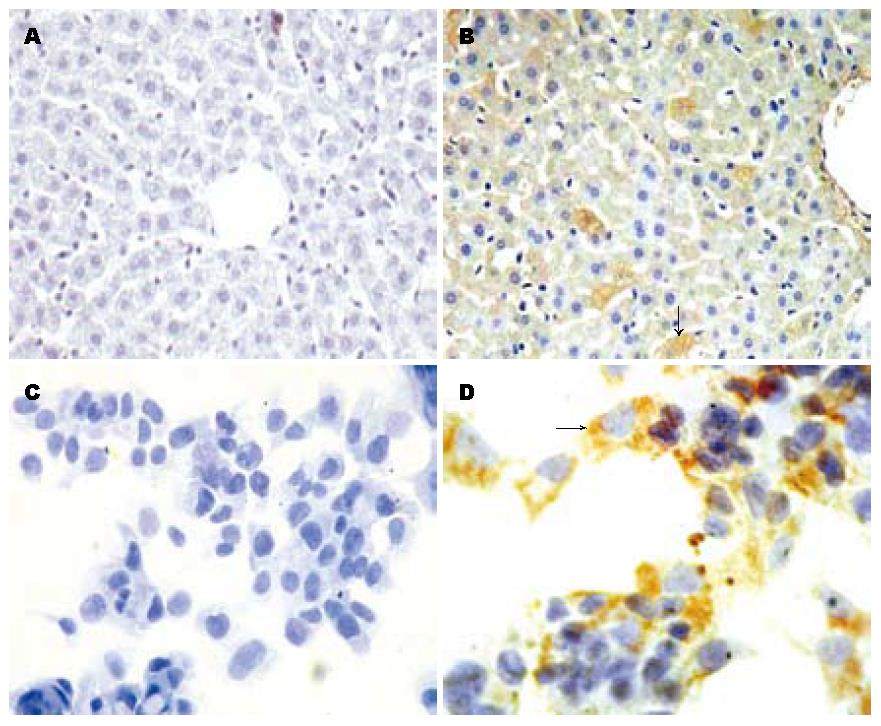
1.2.3 免疫组织化学及细胞化学染色检测ARIP2蛋白表达: 取C57BL/6小鼠肝脏经40 g/L多聚甲醛固定, 常规石蜡切片, 再经二甲苯脱蜡、梯度酒精水化; 同时将处于对数生长期的Hepa1-6细胞接种在放有盖玻片的12孔培养板内, 继续培养过夜, 贴有Hepa1-6细胞的盖玻片经40 g/L多聚甲醛固定. 上述标本经3 mL/L H2O2孵育1 h除去内源性过氧化物酶后, 用20 mL/L BSA-PBS室温封闭1 h, 滴加兔抗ARIP2抗体(1:200稀释), 4 ℃过夜. PBS洗3次, 采用Ultrasensitive SP试剂盒, 按照说明书操作进行显色; 苏木精复染, 水冲洗返蓝, 常规梯度酒精脱水干燥, 二甲苯透明, 树胶封片, 光学显微镜观察. 实验同时以未免疫健康兔IgG做阴性对照, 操作过程同抗体组.
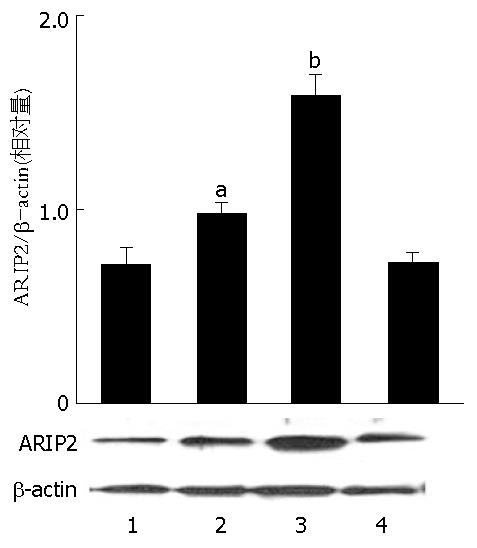
1.2.4 Western blot检测ARIP2蛋白的动态表达: 将对数生长期的Hepa1-6细胞接种于12孔细胞培养板, 细胞数2×105/孔, 37 ℃培养过夜后, 更换培养液为20 mL/L FCS-DMEM培养基, 各孔加入刺激物Activin A(5 mg/L), 同时设培养液单纯培养细胞做对照孔, 继续培养8 h、12 h、24 h, 收集细胞, 每孔细胞加入50 µL组织裂解缓冲液(1 mL/L Triton X-100; pH7.5 50 mmol/L Tris-HCl; 150 mmol/L NaCl; 2 mmol/L EDTA; 2 mmol/L PMSF; 1 mmol/L NaF; 4 ng/L leupeptin; 1 ng/L aprotitin), 4 ℃, 制备细胞匀浆, 以2000 r/min, 4 ℃离心10 min, 取上清液再以12000 r/min, 4 ℃离心30 min, 回收上清液, 加入2×SDS-PAGE上样缓冲液25 μL, 100 ℃变性样本5 min, SDS-PAGE凝胶电泳分离样本, 电转印至PVDF膜, 用抗ARIP2抗体做探针进行Western杂交, 采用ECL化学发光检测试剂盒检测杂交结果, 以β-actin为参照, 将条带进行灰度扫描.
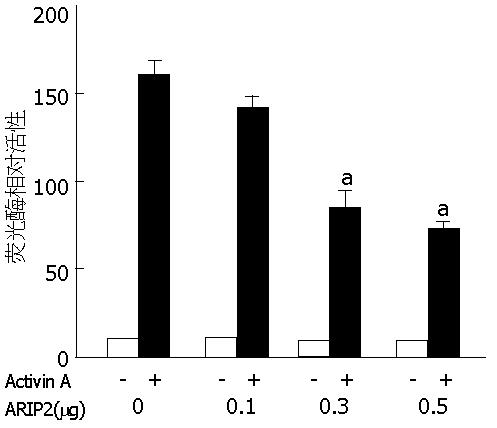
1.2.5 激活素诱导的特异应答基因转录分析: 为了研究ARIP2介导的激活素信号传导作用, 实验选择对激活素特异应答的CAGA-lux质粒提供荧光素酶报告基因. 采用Lipofectamine 2000将CAGA-lux、CMV-gal(用于荧光素酶活性标准化计算)及pcDNA3-ARIP2质粒共转染体外培养的Hepa1-6细胞, 采用5 μg/L Activin A刺激, 检测细胞内报告基因转录荧光素酶的活性[10,13].
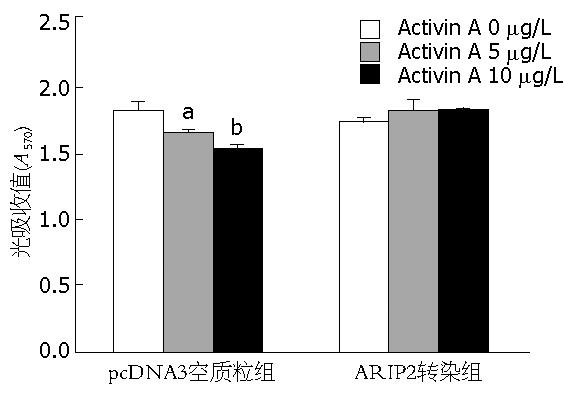
1.2.6 MTT法检测Hepa1-6细胞增殖: 取对数生长期的Hepa1-6细胞接种于96孔细胞培养板, 2×104/孔. 根据ARIP2抑制激活素信号传导情况选择0.03 μg pcDNA3-ARIP2及0.03 μg pcDNA3空质粒, 采用Lipofectamine 2000分别将pcDNA3-ARIP2及pcDNA3转染培养的Hepa1-6细胞, 设单纯培养液对照及5 μg/L Activin A和10 μg/L Activin A刺激组, 每组设3复孔, 培养24 h后, 常规MTT法检测细胞增殖, 全自动酶标仪读取波长570 nm的光吸收值(A570nm), 以A570nm值表示细胞生长情况[15].
统计学处理 实验数据以mean±SD表示, 采用统计学处理软件SPSS9.0进行统计学分析, 组间比较采用t检验, 各实验组与对照组差异的显著性以P<0.05或P<0.01表示.
在肝实质细胞及Hepa1-6细胞均有明显的抗ARIP2抗体染色(图1), 提示ARIP2蛋白在小鼠肝脏及肝癌细胞系Hepa1-6细胞内均存在. 因此实验选择Hepa1-6细胞进一步研究ARIP2在肝细胞内的生物学活性.
Activin A作用8 h后, ARIP2蛋白表达开始出现时间依赖性增加, 12, 24 h蛋白的表达与对照组比较差异显著(1.01±0.16, 1.62±0.26 vs 0.82±0.11, P<0.05, P<0.01, 图2), 尤以24 h蛋白表达增加最为明显.
ARIP2呈剂量依赖性的抑制激活素诱导的特异基因转录活性(图3). 上述结果提示在激活素A刺激Hepa1-6细胞后, 升高的ARIP2可能参与激活素信号传导的负反馈调节, 对终止激活素的病理损伤作用具有重要意义.
Activin A能明显抑制Hepa1-6细胞的增殖, 并具有一定的剂量依赖关系, 5 μg/L和10 μg/L Activin A组570 nm吸光度值与0 μg/L Activin A组相比有显著差异(1.59±0.03, 1.49±0.04 vs 1.79±0.07, P<0.05, P<0.01). 而ARIP2过表达后可以明显阻断Activin A对Hepa1-6细胞的生长抑制作用(图4), 5 μg/L和10 μg/L Activin A组570 nm吸光度值与0 μg/L Activin A组相比无差异(1.69±0.09, 1.7±0.08 vs 1.65±0.06, P>0.05). 上述资料提示ARIP2在Hepa1-6细胞内表达可能是通过阻断激活素特异信号传导途径, 进而翻转激活素A对Hepa1-6细胞的增殖抑制作用.
肝纤维化是慢性肝病重要的病理特征, 是慢性肝损伤引起肝脏代谢和细胞间相互作用紊乱的结果[17-18]. 大量研究表明Activin A在调节肝细胞生长[19-20], 促进肝纤维化发生发展过程中发挥重要作用[5,21-27]. TGF-β是重要的致肝纤维化因子, Wada et al[3]的新近研究发现TGF-β在作用于肝星形细胞(HSC)诱导胶原产生的过程中, 主要依赖于其对内源性Activin A自分泌的诱导. 该研究证实在肝纤维化发病机制中, TGF-β与Activin A二者不仅仅是功能相似, 而且存在协同和依赖的关系, TGF-β诱导肝纤维化的功能部分依赖于Activin A的自分泌, 因此如果能够阻断肝细胞自分泌激活素, 或抑制其受体后特异信号传导, 都可能减轻或抑制激活素介导的肝损伤进程, 发挥治疗肝脏疾病的作用.
激活素受体相互作用蛋白(ARIP)具有明显的组织学特异性, 在不同的组织中不仅表达、分布不同, 其生物学活性也存在很大差异, 是决定激活素组织学作用特异性的关键分子. 研究发现ARIPs均能特异结合激活素II型受体, 调控激活素诱导的细胞内信号传导[11-13]. 其中ARIP1与Smad3蛋白结合, 抑制Smad蛋白向细胞内传递信号[11]; ARIP2/2a通过Ral/RalBP1依赖的途径, 促进ActRII内吞, 降低细胞膜上的ActRⅡ受体表达, 具有抑制激活素诱导的信号传导作用[8,28]; ARIP2b、2c可以上调ActRⅡ受体表达, 具有促进激活素诱导的信号传导作用[13]. 我们的研究发现ARIP2 mRNA在肝脏细胞及Hepa1-6细胞中表达[16], 提示ARIP2与激活素作用肝细胞的信号传导调控有关.
为了探讨ARIP2蛋白在肝细胞中的表达形式及其生物学作用, 本研究采用免疫组织化学以及细胞化学染色, 确定在小鼠肝脏组织细胞以及Hepa1-6细胞均有成熟的ARIP2蛋白表达. 研究通过Western blot进一步分析了ARIP2蛋白的动态表达情况, 结果显示在Activin A刺激的晚期12、24 h ARIP2的表达显著增加, 这一结果与我们前期研究发现的ARIP2 mRNA动态转录水平一致[16], 进一步提示ARIP2可能参与激活素作用后期信号传导调节过程. 为明确ARIP2对激活素的信号传导调控作用, 实验分析了ARIP2对激活素诱导的特异基因转录的影响, 结果显示ARIP2在肝细胞中能够明显抑制激活素诱导的信号传导. 由此可见ARIP2可能作为激活素信号传导负调控蛋白, 参与激活素作用晚期的信号传导的负反馈调节过程.
为了进一步阐述ARIP2作为激活素信号传导的负调控分子在肝细胞中的生物学作用, 本研究采用来源于肝实质细胞的肝癌细胞系Hepa1-6细胞作为研究对象, 研究发现Activin A对Hepa1-6细胞增殖具有明显的抑制作用, Activin A 10 μg/L刺激24 h生长抑制率达27%, 具有剂量依赖关系. Activin A对Hepa1-6细胞增殖抑制与有关报道的Activin A抑制小鼠肝实质细胞增殖的结果一致[4-5,17-18]. 实验进一步将pcDNA3-ARIP2转染至小鼠肝癌细胞系Hepa1-6细胞, 观察ARIP2表达对激活素诱导的肝细胞增殖抑制的影响, 结果显示ARIP2过表达可以明显减弱或消除Activin A对Hepa1-6细胞的增殖抑制作用, 表明ARIP2可能通过抑制激活素信号传导, 对激活素的生物学作用具有明显的阻断作用.
上述资料显示ARIP2是一种可在肝细胞内表达, 具有抑制激活素信号传导作用的负调控蛋白, 在肝细胞内上调ARIP2的表达, 可以反转激活素在肝脏介导的生物学作用. 因此在肝细胞内上调ARIP2的表达对预防和减轻激活素在肝脏的致病作用, 具有重要意义, ARIP2有望成为治疗肝病的有效靶点.
激活素以自分泌/旁分泌形式作用于肝实质细胞, 抑制肝细胞的增殖, 还可以通过活化肝星形细胞, 促进肝细胞外基质异常分泌, 参与肝纤维化的形成和发展.
李涛, 主治医师, 北京大学人民医院肝胆外科
激活素受体相互作用蛋白2(ARIP2)是新发现的激活素信号传导的负向调控蛋白, 有关其组织学分布、生物学作用等仍不清楚.
前期研究主要集中在ARIP2在细胞内介导激活素信号传导作用及其方式, 但有关其在肝细胞的生物学作用研究仅有本实验室的一篇报道.
本研究通过蛋白水平首次证实在肝癌细胞系Hepa1-6细胞中ARIP2参与激活素A作用的晚期信号传导调控, 并具有阻断激活素A抑制Hepa1-6细胞增殖的作用.
ARIP2作为激活素信号传导抑制蛋白, 可以反转激活素对Hepa1-6细胞的增殖抑制作用, 因此, ARIP2有望成为治疗激活素诱导的肝损伤性疾病的基因调控靶点.
ARIP2: 激活素受体相互作用蛋白2, 具有特异结合激活素Ⅱ型受体, 并抑制激活素信号传导作用的蛋白.
本文探讨ARIP2蛋白在在小鼠肝组织和肝癌细胞系Hepa1-6中的表达, 并对Hepa1-6细胞中ARIP2蛋白对Activin信号通路的作用进行了研究, 作者所在单位在这方面有一定的研究基础, 该研究有一定的科学意义和创新性.
编辑: 程剑侠 电编: 郭海丽
| 1. | Werner S, Alzheimer C. Roles of activin in tissue repair, fibrosis, and inflammatory disease. Cytokine Growth Factor Rev. 2006;17:157-171. [PubMed] [DOI] |
| 2. | Zhang XJ, Li Y, Tai GX, Xu GY, Zhang PY, Yang Y, Lao FX, Liu ZH. Effects of activin A on the activities of the mouse peritoneal macrophages. Cell Mol Immunol. 2005;2:63-67. [PubMed] |
| 3. | Wada W, Kuwano H, Hasegawa Y, Kojima I. The dependence of transforming growth factor-beta-induced collagen production on autocrine factor activin A in hepatic stellate cells. Endocrinology. 2004;145:2753-2759. [PubMed] [DOI] |
| 4. | Takamura K, Tsuchida K, Miyake H, Tashiro S, Sugino H. Activin and activin receptor expression changes in liver regeneration in rat. J Surg Res. 2005;126:3-11. [PubMed] [DOI] |
| 5. | Sugiyama M, Ichida T, Sato T, Ishikawa T, Matsuda Y, Asakura H. Expression of activin A is increased in cirrhotic and fibrotic rat livers. Gastroenterology. 1998;114:550-558. [PubMed] [DOI] |
| 6. | Smith C, Yndestad A, Halvorsen B, Ueland T, Waehre T, Otterdal K, Scholz H, Endresen K, Gullestad L, Frøland SS. Potential anti-inflammatory role of activin A in acute coronary syndromes. J Am Coll Cardiol. 2004;44:369-375. [PubMed] [DOI] |
| 7. | De Bleser PJ, Niki T, Xu G, Rogiers V, Geerts A. Localization and cellular sources of activins in normal and fibrotic rat liver. Hepatology. 1997;26:905-912. [PubMed] [DOI] |
| 8. | Mathews LS, Vale WW. Expression cloning of an activin receptor, a predicted transmembrane serine kinase. Cell. 1991;65:973-982. [PubMed] [DOI] |
| 9. | Attisano L, Wrana JL, Montalvo E, Massagué J. Activation of signalling by the activin receptor complex. Mol Cell Biol. 1996;16:1066-1073. [PubMed] [DOI] |
| 10. | Matsuzaki T, Hanai S, Kishi H, Liu Z, Bao Y, Kikuchi A, Tsuchida K, Sugino H. Regulation of endocytosis of activin type II receptors by a novel PDZ protein through Ral/Ral-binding protein 1-dependent pathway. J Biol Chem. 2002;277:19008-19018. [PubMed] [DOI] |
| 11. | Shoji H, Tsuchida K, Kishi H, Yamakawa N, Matsuzaki T, Liu Z, Nakamura T, Sugino H. Identification and characterization of a PDZ protein that interacts with activin type II receptors. J Biol Chem. 2000;275:5485-5492. [PubMed] [DOI] |
| 12. | Tsuchida K, Nakatani M, Matsuzaki T, Yamakawa N, Liu Z, Bao Y, Arai KY, Murakami T, Takehara Y, Kurisaki A. Novel factors in regulation of activin signaling. Mol Cell Endocrinol. 2004;225:1-8. [PubMed] [DOI] |
| 13. | Liu ZH, Tsuchida K, Matsuzaki T, Bao YL, Kurisaki A, Sugino H. Characterization of isoforms of activin receptor-interacting protein 2 that augment activin signaling. J Endocrinol. 2006;189:409-421. [PubMed] [DOI] |
| 14. | Darlington GJ. Liver cell lines. Methods Enzymol. 1987;151:19-38. [PubMed] [DOI] |
| 15. | Miljkovic D, Cvetkovic I, Momcilovic M, Maksimovic-Ivanic D, Stosic-Grujicic S, Trajkovic V. Interleukin-17 stimulates inducible nitric oxide synthase-dependent toxicity in mouse beta cells. Cell Mol Life Sci. 2005;62:2658-2668. [PubMed] [DOI] |
| 16. | Zhang HJ, Tai GX, Zhou J, Ma D, Liu ZH. Regulation of activin receptor-interacting protein 2 expression in mouse hepatoma Hepa1-6 cells and its relationship with collagen type IV. World J Gastroenterol. 2007;13:5501-5505. [PubMed] [DOI] |
| 17. | Friedman SL. Molecular regulation of hepatic fibrosis, an integrated cellular response to tissue injury. J Biol Chem. 2000;275:2247-2250. [PubMed] [DOI] |
| 18. | Hoek JB, Pastorino JG. Ethanol, oxidative stress, and cytokine-induced liver cell injury. Alcohol. 2002;27:63-68. [PubMed] [DOI] |
| 19. | Endo D, Maku-Uchi M, Kojima I. Activin or follistatin: which is more beneficial to support liver regeneration after massive hepatectomy? Endocr J. 2006;53:73-78. [PubMed] [DOI] |
| 20. | Date M, Matsuzaki K, Matsushita M, Tahashi Y, Sakitani K, Inoue K. Differential regulation of activin A for hepatocyte growth and fibronectin synthesis in rat liver injury. J Hepatol. 2000;32:251-260. [PubMed] [DOI] |
| 21. | Patella S, Phillips DJ, de Kretser DM, Evans LW, Groome NP, Sievert W. Characterization of serum activin-A and follistatin and their relation to virological and histological determinants in chronic viral hepatitis. J Hepatol. 2001;34:576-583. [PubMed] [DOI] |
| 22. | Pirisi M, Fabris C, Luisi S, Santuz M, Toniutto P, Vitulli D, Federico E, Del Forno M, Mattiuzzo M, Branca B. Evaluation of circulating activin-A as a serum marker of hepatocellular carcinoma. Cancer Detect Prev. 2000;24:150-155. [PubMed] |
| 23. | Huang X, Li DG, Wang ZR, Wei HS, Cheng JL, Zhan YT, Zhou X, Xu QF, Li X, Lu HM. Expression changes of activin A in the development of hepatic fibrosis. World J Gastroenterol. 2001;7:37-41. [PubMed] [DOI] |
| 24. | Gold EJ, Francis RJ, Zimmermann A, Mellor SL, Cranfield M, Risbridger GP, Groome NP, Wheatley AM, Fleming JS. Changes in activin and activin receptor subunit expression in rat liver during the development of CCl4-induced cirrhosis. Mol Cell Endocrinol. 2003;201:143-153. [PubMed] [DOI] |
| 25. | Gold EJ, Zhang X, Wheatley AM, Mellor SL, Cranfield M, Risbridger GP, Groome NP, Fleming JS. betaA- and betaC-activin, follistatin, activin receptor mRNA and betaC-activin peptide expression during rat liver regeneration. J Mol Endocrinol. 2005;34:505-515. [PubMed] [DOI] |
| 26. | Yuen MF, Norris S, Evans LW, Langley PG, Hughes RD. Transforming growth factor-beta 1, activin and follistatin in patients with hepatocellular carcinoma and patients with alcoholic cirrhosis. Scand J Gastroenterol. 2002;37:233-238. [PubMed] [DOI] |
| 27. | Hughes RD, Evans LW. Activin A and follistatin in acute liver failure. Eur J Gastroenterol Hepatol. 2003;15:127-131. [PubMed] [DOI] |
| 28. | Cui XL, Tai GX, Zhang HJ, Fang L, Liu ZH. Cloning of the full-length gene of activin receptor-interacting protein2a and characterization of its interaction with ActR ⅡA. Progress in Natural Science. 2007;17:172-176. [DOI] |